银叶树果壳木质素提取及抗氧化性
2016-07-25庞庭才熊拯胡上英廖燕青
庞庭才++熊拯++胡上英+廖燕青

摘要:采用碱液提取法对银叶树果壳木质素进行提取分离,以单因素试验和正交试验法研究提取温度、KOH浓度、料液比、提取时间对银叶树果壳木质素提取效果的影响,并对所提取木质素进行紫外光谱分析和抗氧化性研究。结果发现,银叶树果壳木质素最佳提取工艺参数为:提取温度60 ℃、KOH浓度0.5 mol/L、料液比1 g ∶ 55 mL、提取时间2 h,在此条件下木质素得率达到10.78%。银叶树果壳木质素浓度对羟基自由基、超氧阴离子自由基和对DPPH自由基均有明显的清除作用,且清除率随木质素浓度增加而增大。
关键词:银叶树果壳;木质素;抗氧化性
中图分类号: R284.2文献标志码: A文章编号:1002-1302(2016)06-0385-04
收稿日期:2015-05-10
基金项目:广西高校科学技术研究(编号:2013YB260;2013LX161);钦州学院校级科研项目(编号:2014XJKY-58C);大学生创新创业训练计划(编号:201411607064)。
作者简介:庞庭才(1985—),男,硕士,实验师,研究方向为植物有效成分提取与分析。E-mail:pangtingcai@126.com。银叶树(Heritiera littoralis)属梧桐科植物,是热带、亚热带海岸红树林中的乔木树种,主要分布于我国广东、广西和台湾等地区,是比较典型的水陆两栖红树植物种类[1]。银叶树的根为板状根,茎高而大,叶背银白色,果实形状奇特,为近心形或近椭圆形或扁圆形,果皮木质化,外果皮坚硬[2]。有关银叶树的研究主要集中在地理分布与形态特征[3-4]、生物化学与遗传多样性[5-6]、抗性生理[7-8]、育苗造林技术[9-10]、资源利用[11-12]等方面,而对于银叶树果壳的研究还比较少。目前银叶树果壳常常在果实被采摘之后当作垃圾遗弃,这不仅造成资源的浪费,还对环境造成了一定的危害。因此,为了高效利用银叶树资源,有必要开展银叶树果壳木质素的研究。木质素是一种在酸作用下难以水解、具有复杂空间网状结构的聚芳基化合物,主要存在于木质化植物的细胞中,是工业上唯一能从可再生资源中获取的芳香族化合物[13],具有较高地利用价值。但是由于木质素自身理化性质不均一、结构复杂、分离提取困难等因素,使得木质素至今没有被很好的利用。近年来,随着研究的深入,从花生壳、核桃壳、造纸废液中提取木质素的研究开始增多[14-16],但从银叶树果壳中提取木质素的研究国内外尚未见报道。本研究采用一般碱法提取银叶树果壳中的木质素,并对所提取木质素进行紫外光谱分析和抗氧化性研究。通过对银叶树果壳木质素的研究,为提高银叶树的综合利用价值,进一步开发和利用红树资源提供一定的理论基础。
1材料与方法
1.1材料与仪器
银叶树果实外种壳,产自广西防城港北仑河口红树林保护区。
试验用氢氧化钾、盐酸、乙醇等试剂均为AR,1,1-二苯基-2苦肼基为BR。主要仪器有紫外可见分光光度计(UV-3200),上海美谱达仪器有限公司;电子天平(EL204)梅特勒-托利多(上海)有限公司;高速离心机(H1850),湖南湘仪实验仪器开发有限公司;旋转蒸发器(RE-3000),上海亚荣生化仪器厂;循环水式真空泵[SHZ-D(Ⅲ)],巩义市予华仪器有限责任公司。
1.2方法
1.2.1样品预处理银叶树果壳在60 ℃下干燥至恒质量,粉碎,过80目筛。用甲苯与乙醇混合溶液(体积比为2 ∶ 1)浸提10 h后过滤,回收甲苯-乙醇溶剂,滤渣40 ℃烘干至恒质量,得样品备用。
1.2.2银叶树果壳中木质素的提取称取预处理后的银叶树果壳粉末1.0 g,按一定的料液比加入一定浓度的KOH溶液,在设定的水浴温度条件下浸提一定时间,抽滤取滤液,用6 mol/L乙酸将滤液pH值调至5.5,减压蒸馏得样品浓缩液,加入浓缩液3倍体积的95%乙醇,混匀后静置,待沉淀完全后,抽滤。滤液通过减压蒸馏除去乙醇,用6 mol/L HCl 将样液pH值调至1.5,静置后过滤,所得滤渣用pH值为2的HCl溶液洗涤,低温干燥,即得到碱木质素[17]。
木质素得率=木质素产量原料质量×100%。
(1)
1.2.3单因素试验提取温度对木质素得率的影响在提取时间1.5 h、料液比1 g ∶ 55 mL、KOH浓度0.5 mol/L条件下,研究不同温度(40、50、60、70、80 ℃)对木质素得率的影响。
1.2.3.1KOH浓度对木质素得率影响在提取温度60 ℃、提取时间1.5 h、料液比 1 g ∶ 55 mL条件下,研究不同KOH溶液浓度(0.1、0.3、0.5、0.7、0.9 mol/L)对木质素得率的影响。
1.2.3.2料液比对木质素得率的影响在提取温度60 ℃、提取时间1.5 h、KOH浓度0.5 mol/L条件下,研究不同料液比(1 ∶ 25、1 ∶ 35、1 ∶ 45、1 ∶ 55、1 ∶ 65,g/mL)对木质素得率的影响。
1.2.3.3提取时间对木质素提取得率的影响在提取温度60 ℃、料液比1 g ∶ 55 mL、KOH浓度0.5 mol/L条件下,研究不同提取时间(0.5、1.0、1.5、2.0、2.5 h)对木质素得率的影响。
1.2.4正交试验设计以银叶树果壳木质素得率为指标,在单因素试验的基础上进行L9(34)正交试验(表1),以确定最佳的银叶树果壳木质素提取工艺参数。
1.2.5紫外光谱的测定取一定量提取所得木质素样品,溶于适量乙醇溶液中,以乙醇溶液为空白,用紫外可见分光光度计测其在200~400 nm范围内的吸收光谱。
1.2.6木质素抗氧化性研究
1.2.6.1DPPH自由基的清除[18]称取0.003 8 g的DPPH用无水乙醇溶解,定容至50 mL,摇匀得到浓度为0.2 mmol/L的DPPH溶液,放于冰箱内备用。在具塞试管中分别加入 2 mL 浓度分别为0.05、0.10、0.15、0.20、0.25 mg/mL 的木质素样品溶液,再加入2 mL的DPPH溶液作为试验组,避光反应30 min后在波长517 nm处测定其吸光度。以2 mL样品溶液加入2 mL的无水乙醇作对照组,以2 mL的DPPH溶液加入2 mL蒸馏水中作为空白,计算对DPPH自由基的清除率。
清除率=D0-(Di-Di0)D0×100%。
式中:Di为试验组吸光度;Di0对照组吸光度;D0为空白吸光度;以无水乙醇作为参比。
1.2.6.2羟基自由基(·OH)的清除[19]称取0.083 4 g FeSO4·7H2O溶于少量蒸馏水中,定容至50 mL,得到 6 mmol/L FeSO4 溶液;称取0.041 4 g水杨酸溶于少量无水乙醇中,用无水乙醇准确定容至50 mL,得到6 mmol/L的水杨酸-乙醇体系;用微量移液器量取166.7 μL 30%的H2O2用蒸馏水定容至50 mL容量瓶中,得到0.1%的H2O2。在 15 mL 的具塞试管中分别加入2 mL 6 mmol/L FeSO4溶液,2 mL 6 mmol/L的水杨酸-乙醇溶液,再分别加入2 mL浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL样品溶液,最后加入 2 mL H2O2启动反应,37 ℃水浴反应30 min后,以 4 000 r/min 速度离心 5 min,取上清液在510 nm处测定吸光度,以此作为试验组。以蒸馏水代替H2O2作为对照组,以蒸馏水代替样品作为空白。
清除率=D0-(Di-Di0)D0×100%。
式中:Di为样品组;Di0为对照组;D0为以蒸馏代替样品的空白。
1.2.6.3超氧阴离子自由基( O-2 · )的清除[20]在25 ℃的恒温水浴锅中,将pH值 8.2的Tris-HCl缓冲液和45 mmol/L邻苯三酚保温20 min后,取4.5 mL pH值8.2的Tris-HCl 缓冲液,加 0.3 mL 45 mmol/L邻苯三酚,振荡器混匀,在 25 ℃ 水浴中反应4 min,加入8 mol/L HCl终止反应,在 325 nm 测吸光度,计算出邻苯三酚的自氧化率V0。取 4.5 mL Tris-HCl缓冲液,加入不同浓度(0.1、0.3、0.5、0.7、0.9 mg/mL)的银叶树果壳木质素溶液2 mL在25 ℃恒温水浴中放置20 min后,加入 0.3 mL 的25 ℃预热的邻苯三酚溶液,振荡混匀,在25 ℃水浴中反应4 min,加入6 mol/L HCl终止反应,在 325 nm 测吸光度,计算出加入样品后邻苯三酚的自氧化率V1。
清除率=[(V0-V1)/V0]×100%。
式中:V0为对照组;V1为样品组。
2结果与讨论
2.1单因素试验结果
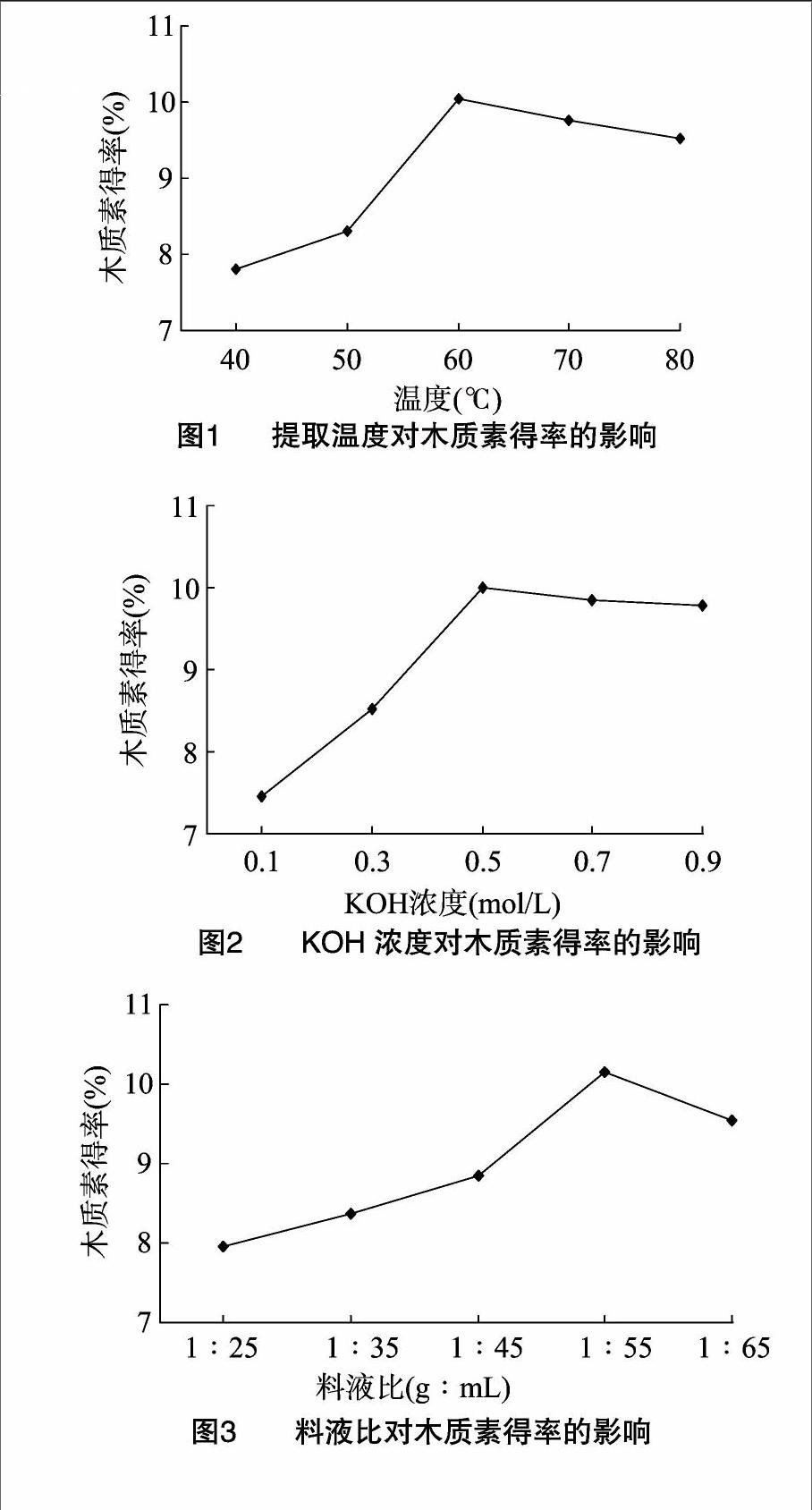
2.1.1提取温度对木质素得率的影响在40~60 ℃范围内,随着温度的升高,木质素的得率呈明显上升趋势,在 60 ℃ 时达到最大值;当温度继续升高时,得率反而有所下降(图1)。其原因可能是当温度较低时,由于纤维素上木质素结构结合紧密,结构破坏力大,使木质素分离不彻底,部分木质素还残留在果壳纤维中[21],所以木质素的得率略低;当提取温度超过60 ℃时,会导致部分木质素分解,从而影响了木质素得率。因此,最佳提取温度为60 ℃。
2.1.2KOH浓度对木质素得率的影响随着碱液浓度的增大,木质素得率呈上升趋势,碱液浓度为0.5 mol/L时木质素
得率达到最大值,之后得率趋于平稳(图2)。结果表明,适宜的碱浓度可断裂木质素与糖聚物之间的酯键和醚键,而碱浓度较高时,木质素可能发生氧化和自身缩合反应造成损失。因此,最佳KOH浓度为0.5 mol/L。
2.1.3料液比对木质素得率的影响料液比在1 g ∶ (25~55) mL之间,木质素得率逐渐升高,料液比1 g ∶ 55 mL时得率达到最大值,之后随着料液比的继续增大,木质素得率反而有所降低(图3)。其原因可能是当料液比较小时,随着提取溶液的增加有利于木质素的溶出;但当料液比超过 1 g ∶ 55 mL 时,木质素得率趋于平稳,基本不再提高。因此,最佳料液比为 1 g ∶ 55 mL。
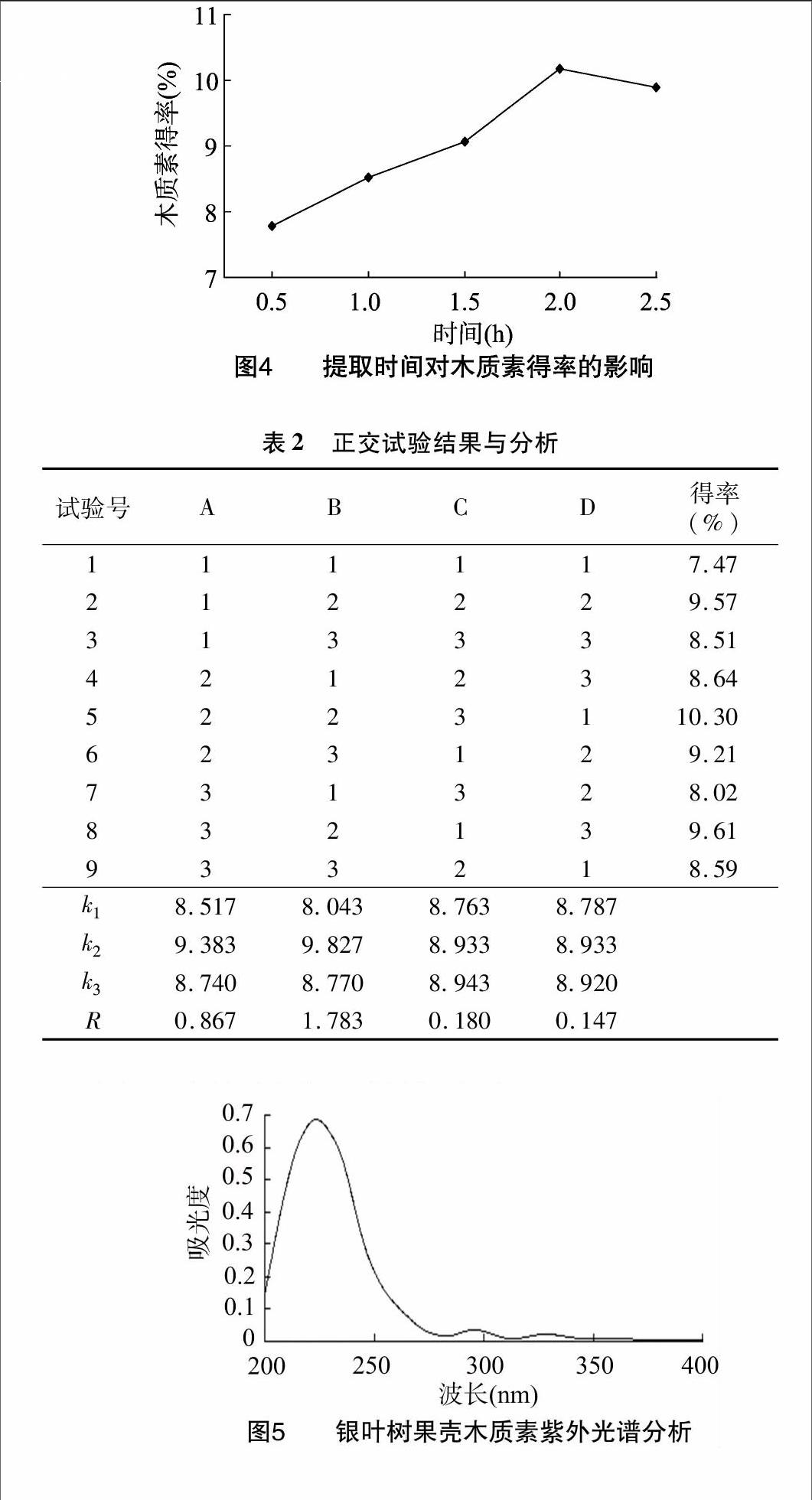
2.1.4提取时间对木质素得率的影响随着提取时间的增加,木质素得率呈上升趋势,当提取时间为2 h时,木质素得率达到最大值,之后随着提取时间继续增加,得率反而有所降低(图4)。其原因可能是在一定的时间范围内,随着提取时间的延长,木质素与纤维素分离程度逐渐提高,使得木质素得率也随之增大;而当提取时间达到2.0 h后,样品中木质素基本已经全部溶出,之后随着提取时间的继续延长,木质素得率也趋于平稳。因此,最佳提取时间为2.0 h。
2.2正交试验结果与方差分析
影响银叶树果壳木质素得率的因素主次为:KOH浓度
(B)>提取温度(A)>料液比(C)>提取时间(D)。提取木质素的最佳工艺参数为:A2B2C3D2,即提取温度为60 ℃、KOH浓度为0.5 mol/L、料液比为1 g ∶ 65 mL、提取时间为 2.0 h。在此条件下对最佳提取工艺进行验证试验,验证试验得到的木质素平均得率分别是10.68%、10.79%、10.80%、10.90%、10.74%(表2)。因此,银叶树果壳木质素得率为10.78%,说明该木质素提取工艺稳定可行。
2.3紫外吸收波谱分析
在200~400 nm范围内扫描,测得本试验所提取的木质素的紫外吸收光谱(图5)。在216 nm处产生最大吸收峰,这些是苯环物质典型的特征吸收峰,说明所提取得到的木质素为芳香族化合物。由紫外光谱分析表明,所提取的木质素含有苯环结构,具有较好的化学活性。
2.4抗氧化性研究结果
2.4.1对DPPH自由基的清除效果银叶树果壳木质素对 DPPH 自由基具有明显的清除作用,DPPH的清除率随着木质素浓度的提高而升高,当银叶树果壳木质素浓度达到 0.25 mg/mL 时,对DPPH自由基的清除率可达到80.6%(图6),说明银叶树果壳木质素具有较强的DPPH自由基清除能力。
2.4.2对羟基自由基(·OH)的清除效果银叶树果壳木质素对羟基自由基(·OH)具有明显的清除作用,羟基自由基(·OH)的清除率随着木质素浓度的提高而升高,当银叶树果壳木质素浓度为0.5 mg/mL时,对羟基自由基(·OH)的清除率为26.8%,当浓度达到2.5 mg/mL时,清除率可达到 83.7%(图7),说明银叶树果壳木质素具有较强的羟基自由基(·OH)清除能力。
2.4.3对超氧阴离子( O-2 · )的清除效果银叶树果壳木质素对超氧阴离子自由基( O-2 · )具有明显的清除作用,超氧阴离子自由基( O-2 · )的清除率随着木质素浓度的提高而升高,当银叶树果壳木质素浓度为0.1 mg/mL时,对超氧阴离子自由基( O-2 · )的清除率为45.1%,当浓度达到 0.9 mg/mL 时,清除率可达到89.8%(图8),说明银叶树果壳木质素具有较强的超氧阴离子自由基( O-2 · )清除能力。
3结论
(1)经正交试验分析,得到最佳提取工艺条件:提取温度为60 ℃、KOH浓度为0.5 mol/L、料液比1 g ∶ 65 mL、提取时间为2 h,在此条件下木质素得率达到10.78%。各因素对木质素得率的影响顺序为:KOH浓度>提取温度>料液比>提取时间。
(2)紫外光谱分析表明,在216 nm附近有较强的吸收带,所提取的木质素含有苯环结构,具有较好的化学活性。
(3)抗氧化性研究表明,对DPPH自由基、羟基自由基(·OH)、对超氧阴离子自由基( O-2 · )的清除率随着银叶树果壳木质素的浓度提高而提高,清除率最高分别为80.6%、83.7%、89.8%。
参考文献:
[1]韩维栋,王秀丽. 银叶树研究进展[J]. 广东林业科技,2013,29(6):80-84.
[2]曾聪,范航清. 红树植物银叶树果实和种子的形态结构研究[J]. 广西科学,2006,13(2):147-150.
[3]冯国楣. 中国植物志[M]. 北京:科学出版社,1996:140-143.
[4]简曙光,韦强,唐恬,等. 深圳盐灶银叶树种群的生物学特性研究[J]. 华南农业大学学报,2005,26(4):84-87,91.
[5]牟美蓉,蒋巧兰,王文卿. 真红树和半红树植物叶片氯含量及叶性状的比较[J]. 植物生态学报,2007,31(3):497-504.
[6]Tian Y,Wu J,Zhang S. Flavonoids from leaves of Heritiera littoralis[J]. Journal of Chinese Pharmaceutical Sciences,2004,13(3):214-216.
[7]栾建国,杜灿坤,何德善. 深圳地区红树植物淡水种植试验[J]. 水生态学杂志,2011,32(2):63-68.
[8]杨盛昌,林鹏,中须贺常雄. 5 ℃夜间低温对红树幼苗光合速率和蒸腾速率的影响[J]. 植物研究,2001,21(4):587-591.
[9]韩静. 几种半红树植物的育苗技术研究[D]. 长沙:中南林业科技大学,2010.
[10]高秀梅,韩维栋. 银叶树育苗试验研究[J]. 福建林业科技,2006,33(3):140-143,174.
[11]邱凤英. 几种半红树植物生物学特性、耐盐、耐水淹及造林试验研究[D]. 长沙:中南林业科技大学,2009.
[12]张艳军,彭重威,钟秋平,等. 广西红树植物银叶树不同部位提取物体外抗氧化性分析[J]. 南方农业学报,2013,44(12):2066-2070.
[13]蒋挺大. 木质素[M]. 北京:化学工业出版社,2001.
[14]唐婷范,刘雄民,郭占京,等. 蒜头果木质素提取及成分分析[J]. 精细化工,2013,30(5):591-594.
[15]张莹,雷中方. 造纸黑液提取木质素的抗氧化性研究[J]. 复旦学报:自然科学版,2010,49(1):60-65.
[16]潘英明,梁英,王恒山,等. 超声波法从罗汉果渣中提取碱木质素的研究[J]. 林产化学与工业,2004,24(4):73-76.
[17]崔晓芳,李伟阳,魏婷婷,等. 微波辅助提取油茶果壳木质素工艺优化[J]. 食品科学,2011,32(8):98-102.
[18]张海德,黄玉林,范燕忠. 槟榔提取物对DPPH自由基的清除作用研究[J]. 食品科学,2008,29(8):74-77.
[19]赵璐. 山竹果壳中抗氧化活性物质的研究[D]. 天津:天津科技大学,2009.
[20]吴伟杰. 文冠果果壳总皂苷分离工艺及其抗氧化活性的研究[D]. 北京:北京林业大学,2010.
[21]田维亮,葛振红,孙辉. 棉籽壳木质素提取工艺的初步研究[J]. 作物杂志,2013(2):130-133.黄娇,姜登军. 多指标综合评价重庆不同产区桔梗药材的质量[J]. 江苏农业科学,2016,44(6):389-393.
