基于SSR的铁皮石斛实生群体遗传多样性研究
2016-07-25韩晓霞章静钢张鹏博宗宇陈
韩晓霞++章静钢++张鹏博++宗宇++陈文荣++郭卫东


摘要:铁皮石斛属于传统名贵中药,由于人们的过度采挖,其野生资源日益减少,遗传多样性遭到严重破坏,人工栽培是对石斛资源进行保护的有效措施之一。本研究采用15对SSR引物对5个实生群体的100株铁皮石斛进行了遗传多样性分析,以期检测群体之间和群体内部的遗传分化,确定纯化株系,为后期优良品种选育提供理论参考。结果表明,15个位点共检测到185个等位基因,群体B6的等位基因数目最大,为7.14个;群体B11等位基因数最少,为 5.42个;观察杂合度(Ho)最大的种群为B6(0.376),群体B10最小(0.286)。近交系数(Fis)最大值出现在群体B10中,为0.241;群体B6近交指数最小,仅为0.091。STRUCTURE遗传结构分析发现5个石斛实生群体可能来自2个同源基因库。实生群体B10遗传背景单一,可以用于后续的铁皮石斛纯化育种,群体B6具有较高的杂合度,可以用作种间杂交的良好材料,有利于种间差异性状的整合。
关键词:铁皮石斛;SSR;实生群体;遗传多样性
中图分类号: S567.23+9.03文献标志码: A文章编号:1002-1302(2016)06-0090-04
收稿日期:2015-05-02
基金项目:浙江省金华市科学技术局农业类重点项目(编号:2012-2-018)。
作者简介:韩晓霞(1993—),女,山西朔州人,硕士研究生,主要从事特色经济植物研究。E-mail:15268636679@163.com。
通信作者:宗宇,博士,讲师,研究方向为植物种质资源与遗传。E-mail:yzong@zjnu.cn。铁皮石斛(Dendrobium officinale Kimura et Migo)是兰科(Orchidaceae)石斛属植物,属于传统名贵中药,由于人们的过度采挖,铁皮石斛野生资源日益减少,已近枯竭,遗传多样性遭到严重破坏。1987年铁皮石斛因数量锐减,被列入《国家重点保护野生药材物种名录》[1-2]。铁皮石斛的人工栽培是对石斛资源进行保护的有效措施之一,虽然近几年人工栽培铁皮石斛取得了较大的进展,但由于种质混杂、盲目引种等原因,致使铁皮石斛质量和产量差异较大,扰乱了消费市场,阻碍铁皮石斛产业的正常、有序发展[3-8]。因此,开展铁皮石斛种质资源和遗传多样性研究,对铁皮石斛优良品种的选育具有重要意义。
遗传多样性是生物多样性的基本组成元素,丰富的遗传多样性可以维持种群动态平衡,为物种的进化提供基本保障;评价一个物种的遗传多样性也是制定该物种科学保护策略的重要前提。前人在铁皮石斛遗传多样性研究方面取得了一定进展,沈洁等利用RAMP标记对9个野生居群的112株铁皮石斛进行了检测,结果表明,不同居群间存在丰富的遗传多样性,而且居群之间存在一定地域相关性[9]。丁鸽等采用RAPD技术对8个铁皮石斛野生居群的遗传多样性和亲缘关系进行研究,发现引物S412可以有效鉴别8个野生居群;同样发现居群的地理分布与居群间的遗传关系呈现良好的正相关性[10]。Li等利用AFLP标记对12个铁皮石斛居群的遗传多样性进行研究,发现居群间分化系数变幅为0.047~0.578,居群间的遗传变异平均值为26.97%[11],研究结果支持将这12个铁皮石斛居群分为3大类群。Ding等利用SRAP标记对铁皮石斛的9个野生种的84个植株进行研究,发现在物种水平上遗传多样性较高,而在居群水平上差异性较低[12]。Shen等利用ISSR标记技术将 8个野生铁皮石斛居群区分开来,发现了16个具有特异性标记的DNA片段[13]。谢明璐等利用开发的SSR标记成功对铁皮石斛种质进行了纯度鉴定[14]。但是基于SSR的铁皮石斛遗传多样性研究仍鲜有报道,更缺乏对人工栽培铁皮石斛实生群体的遗传多样性分析,相关研究缺失不利于铁皮石斛优良品种的选育,会造成杂交亲本的盲目选择。
核基因SSR标记在真核生物基因组中分布非常普遍,由于其丰富的多态性和共显性遗传等特征,被广泛应用于种内和种群间遗传变异的分析。本研究利用15对SSR引物对铁皮石斛不同实生群体的遗传多样性进行了分析,主要目的在于:(1)评估石斛实生群体的近交系数,确定纯化株系;(2)检测石斛实生群体之间和群体内部的遗传分化;(3)为后期人工杂交育种提供理论参考。
1材料与方法
在铁皮石斛实生苗群体中选取表观性状优良的5个群体,分别标记为B4、B6、B10、B11、B12,每个群体随机选择长势较为一致的铁皮石斛20株,单株编号分别为1~20,共100株用于遗传多样性分析。分别从100个单株上取健康幼嫩的叶片,带回实验室,置于-80 ℃的超低温冰箱中备用。
1.1DNA提取
利用优化后的CTAB法[15]进行DNA提取。从叶片中提取基因组总DNA(图1),每份样品使用1 g叶片。DNA提取后使用TE缓冲液溶解,置于-20 ℃的冰箱中备用。
1.2PCR扩增及测序
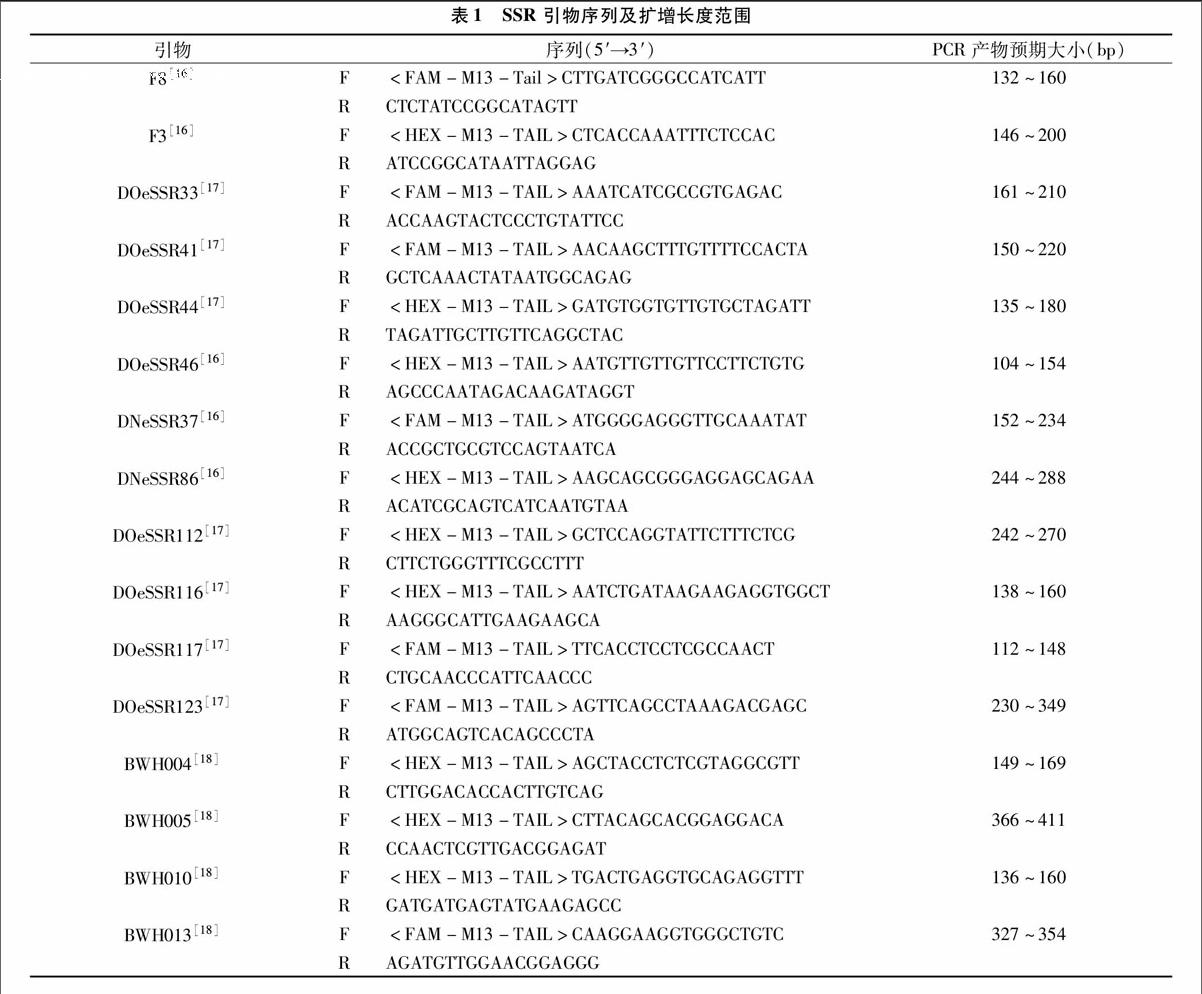
使用15对前人报道的、在石斛中扩增稳定、多态性好的SSR引物进行PCR反应(表1)。引物由Invitrogen(上海)公司合成,并合成5′端经过荧光修饰(FAM和HEX 2种荧光)的M13-Tail通用引物(序列为:TGTAAAACGACGGCCAGT)[19]。PCR体系为20 μL,各组分体积见表2。
PCR反应步骤及条件:94 ℃预变性5 min;随后是94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环后反应条件设置为94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,12个循环;最终72 ℃延伸6 min。
PCR反应结束后,取4 μL扩增产物用1.5%的琼脂糖凝胶进行电泳检测(图2),确认得到单一且长度正确的片段后,将PCR产物送至生工(上海)生物工程有限公司进行基因分型(图3)。
1.3数据处理
为尽可能避免基因分型过程中的偏差,确定等位基因大小后进行了2次人工校对。对于每个种群和SSR位点,使用GenAlEx 6.501[20]计算等位基因个数(Na)、有效等位基因个数(Ne)、观察杂合度(Ho)、期望杂合度(He)和近交系数(Fis)。利用FSTAT 2.9.3[21]计算经过香农多样性指数(I)。
利用STRUCTURE 2.3.4软件[22]计算同源基因库的数
目,该方法利用贝叶斯概率统计将铁皮石斛个体或预定义的群体划分到K个支系中来解释其遗传结构。本研究中,STRUCTURE 2.3.4的运行选择混合模型和关联等位基因频率等参数配置,将同源基因库个数的赋值为1~8(N+3),每个K值进行10次重复计算来推测最佳的K值。每一次运行使用200 000个循环的马尔科夫链-蒙特卡洛模拟(MCMC),初始收敛周期为100 000;其他参数设为默认值。运行后结果上传到STRUCTURE HARVESTER(http://taylor0.biology.ucla.edu/structureHarvester/)确定最佳K值,运行结束后利用CLUMPP软件处理对10次独立运行得到的分配系数进行均一化处理,然后使用DISTRUCT软件绘制计算结果。
2结果与分析
2.1SSR引物多样性
15对SSR引物共检测到185个等位基因,每个位点的等位基因数目从2.3个(DNeSSR86)到22.6个(DOeSSR41)不等,平均每个位点有12.3个等位基因。有效等位基因数从1.3个(DNeSSR86)到9.2个(DOeSSR41),平均值为5.5个。香农多样性指数最大值是2.61(DOeSSR41),最小值是0.31(DNeSSR86),平均值为1.82。观察杂合度最大值是0.756(DOeSSR44),最小值是0114(DNeSSR86),平均值为0.604。期望杂合度最大值为0.786(DNeSSR37),最小值为0.169(DNeSSR86),平均值为0.654。表明本研究中使用的SSR引物大部分多态性良好,可用于后续的群体遗传信息分析;其中引物DOeSSR33、DNeSSR86、DOeSSR117多态性显著低于其他引物(表3)。
2.2铁皮石斛群体的遗传多样性
对5个石斛实生群体进行遗传多样性分析,发现群体B6的等位基因数目最多,为7.14个,其次是群体B12,为6.50个;群体B4和B10等位基因数均为5.64个;群体B11等位基因数最少,为5.42个;5个实生群体的有效等位基因数存在一定的差异,以群体B6的有效等位基因数目最大,为6.57
个,最小值虽然出现在群体B11中,但是与群体B4几乎没有差异(表4)。观察杂合度最大的种群是B6,为0.376,群体B12略低于B6,为 0.361;群体B4、B11没有显著差别,观察杂合度分别为 0.309、0.329;群体B10最小,仅为0.286。期望杂合度表现出的趋势与观察杂合度相似,最大值和最小值分别出现在群体B6和群体B11,群体B6为0.654,群体B11为0.514。分别对5个石斛种群的近交系数进行了计算。近交系数最大值出现在群体B10中,为0.241;其次为群体B4,为0.168;群体B6近交指数最小,仅为0.091。
2.3铁皮石斛群体的遗传结构
为了进一步检验群体的遗传多样性信息,基于贝叶斯统计法对5个铁皮石斛实生群体进行了遗传结构分析。STRUCTURE结果显示,对5个群体的K值范围设为1~8,运行10次重复后,将STRUCTURE的运行结果上传到STRUCTURE HARVESTER并通过前人描述的方法确定最佳的K值,在K=2处观察到ΔK的最大值(图4),结果表明,5个石斛实生群体可能来自2个同源基因库(图5)。
从STRUCTURE结果中我们发现,除群体B6中的一些个体表现出较为明显的多源遗传背景外,其他4个群体种质纯度较高,以群体B10遗传背景最为单一,与之前的杂合度、近交系数等遗传多样性参数保持一致。
3结论与讨论
本研究采用15对微卫星引物对5个石斛实生群体共100个个体进行了PCR扩增,15个位点共检测到185个等位基因,群体B6的等位基因数目最多,群体B11等位基因数最少,5个石斛实生群体可能来自2个同源基因库。杂合度水平可以在很大程度上反映植物的遗传多样性[23-24]。杂合度较低与石斛的繁育系统有关,铁皮石斛自交和杂交均可育,试验使用的实生种群来自于自交群体,但人工授粉失败或隔离措施不完善可能造成一些个体是开放式授粉形成的实生苗,这可能是导致B6群体杂合度高于其他群体的原因。
近交系数的取值为[-1,1],负值表示群体种杂合个体较多,群体的形成可能受到了外源基因流的影响,并非自交育种过程中成功构建的群体。正值表明群体间的近交繁殖有所增加,对于自然群体来讲可能是因为群体大小的减小或人为的干预[20]。本研究石斛实生群体为近亲或自交形成的种系,有较高的近交系数是正常现象,而且群体B10近交系数最大,表明其遗传背景较为单一,种质比其他实生群体更加纯化,这一点也能通过B10具有最小的观察杂合度得到佐证。
基于种质杂合背景,因遗传背景单一,实生群体B10可以用于后续的纯化选择,但是否属于石斛特征性状(石斛多糖、石斛碱含量等)还需进一步研究。与其他实生群体相比,群体B6具有较高的杂合度,可以用作石斛种间杂交的良好材料,有利于种间差异性状的整合。
参考文献:
[1]姚领爱,胡之璧,郑志仁,等. 铁皮石斛种质资源研究中的DNA条形码初探[J]. 上海农业学报,2012,28(1):49-54.
[2]张志勇,齐泽民,黄作喜. 铁皮石斛生物技术研究进展[J]. 核农学报,2014,28(4):605-610.
[3]斯金平,诸燕,朱玉球. 铁皮石斛人工栽培技术研究与应用进展[J]. 浙江林业科技,2009,29(6):66-70.
[4]郑希龙,蔡时可,邱道寿,等. 铁皮石斛种质资源研究进展[J]. 广东农业科学,2011(增刊1):110-114.
[5]包英华. 铁皮石斛种质资源的鉴定与评价研究[D]. 广州:广州中医药大学,2014.
[6]包英华,潘超美,白音,等. 铁皮石斛种质资源遗传多样性的SRAP分析[J]. 北京中医药大学学报,2014,37(5):349-353.
[7]武荣花. 我国石斛属植物种质资源及其亲缘关系研究[D]. 北京:中国林业科学研究院,2007.
[8]张启香,方炎明. 铁皮石斛组织培养及试管苗营养器官和原球茎的结构观察[J]. 西北植物学报,2005,25(9):1761-1765.
[9]沈洁,徐慧君,袁英惠,等. 铁皮石斛野生居群基于RAMP标记的遗传多样性评价[J]. 药学学报,2011,46(9):1156-1160.
[10]丁鸽,丁小余,沈洁,等. 铁皮石斛野生居群遗传多样性的RAPD分析与鉴别[J]. 药学学报,2005,40(11):1028-1032.
[11]Li X E,Ding X Y,Chu B H,et al. Genetic diversity analysis and conservation of the endangered Chinese endemic herb Dendrobium officinale Kimura et Migo (Orchidaceae) based on AFLP[J]. Genetica,2008,133(2):159-166.
[12]Ding G,Zhang D Z,Ding X Y,et al. Genetic variation and conservation of the endangered Chinese endemic herb Dendrobium officinale based on SRAP analysis[J]. Plant Systematics and Evolution,2008,276(3/4):149-156.
[13]Shen J,Ding X Y,Liu D Y,et al. Intersimple equence repeats(ISSR)molecular fingerprinting markers for authenticating populations of Dendrobium officinale Kimura et Migo[J]. Biological & Pharmaceutical Bulletin,2006,29(3):420-422.
[14]谢明璐,侯北伟,韩丽,等. 珍稀铁皮石斛SSR标记的开发及种质纯度鉴定[J]. 药学学报,2010,45(5):667-672.
[15]Doyle J J. A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J]. Phytochem Bull,1987,19:11-15.
[16]Lu J J,Kan J Y,Ye S R,et al. Isolation and characterization of novel EST-SSRs in the showy dendrobium,Dendrobium nobile(Orchidaceae) [J]. Genet Mol Res,2014,13:986-991.
[17]Lu J J,Suo N N,Hu X,et al. Development and characterization of 110 novel EST-SSR markers for Dendrobium officinale(Orchidaceae)[J]. American Journal of Botany,2012:e415-e420.
[18]Hou B W,Tian M,Luo J,et al. Genetic diversity assessment and ex situ conservation strategy of the endangered Dendrobium officinale (Orchidaceae) using new trinucleotide microsatellite markers[J]. Plant Systematics and Evolution,2012,298(8):1483-1491.
[19]Schuelke M. An economic method for the fluorescent labeling of PCR fragments[J]. Nature Biotechnology,2000,18(2):233-234.
[20]Peakall R,Smouse P E. GENALEX 6:genetic analysis in Excel. Population genetic software for teaching and research[J]. Molecular Ecology Notes,2006,6:288-295.
[21]Goudet J F. A computer program to calculate F-statistics(version 2.9.3)[J]. Journal of Heredity,1995,86:485-486.
[22]Pritchard J K,Stephens M,Donnelly P. Inference of population structure using multilocus genotype data[J]. Genetics,2000,155(2):945-959.
[23]Gregorius H,Roberds J H. Measurement of genetical differentiation among subpopulations[J]. Theoretical and Applied Genetics,1986,71:826-834.
[24]Miller J C,Tanksley S D. RFLP analysis of phylogenetic relationships and genetic variation in the genus Lycopersicon[J]. Theoretical and Applied Genetics,1990,80:437-448.
