利用CAPS初步定位甜瓜MR—1白粉病抗性基因
2016-07-25艾子凌高鹏杜黎黎栾非时
艾子凌++高鹏++杜黎黎++栾非时


摘要:从国际生理小种鉴别寄主中选取甜瓜抗病自交系MR-1为母本,感病自交系Topmark为父本,构建F2代群体。对354株F2代群体进行田间甜瓜白粉病抗病性调查并分析其遗传规律,发现甜瓜白粉病的抗性基因为单显性基因;根据两亲本基因组重测序数据,自行开发设计CAPS分子标记,将具有多态性的标记应用于F2代基因分型以构建遗传连锁图谱。图谱内含142个CAPS标记,分布于12个连锁群上。图谱总长度2 065.47 cM,平均距离14.55 cM;标记最多的为第四连锁群,分布22个标记,标记间平均距离为11.61 cM;最长的为第五连锁群,总长277.98 cM;最短的为第三连锁群,总长65.6 cM。得到1个甜瓜白粉病抗性相关基因位点,该位点在第七连锁群上,位于CAPS标记7-4E和7-1H之间。
关键词:甜瓜;白粉病;生理小种;CAPS;遗传图谱
中图分类号: S436.5文献标志码: A文章编号:1002-1302(2016)06-0066-05
收稿日期:2015-03-11
基金项目:国家自然科学基金(编号:31301791);农业部“948”项目(编号:2014-S15)。
作者简介:艾子凌(1988—),女,黑龙江齐齐哈尔人,硕士研究生,主要从事甜瓜分子育种。 E-mail:linglingfighting@126.com。
通信作者:栾非时,教授,博士生导师,主要从事西甜瓜分子遗传育种。 E-mail:luanfeishi@sina.com。甜瓜白粉病别称白毛病、粉霉病,常在坐果期发生,是一种世界性病害,严重威胁葫芦科作物生长[1]。病菌侵染到叶片表面,起初叶片上只是有水滴大小的白色圆形粉状霉点,在高温潮湿的环境里迅速布满叶片,蔓延至叶柄、茎蔓,浓厚的白粉菌不仅降低感病植株的光合效能,还能增加植株的蒸腾效能,长时间呼吸作用强于光合作用导致植株萎黄干枯,提早衰亡,严重影响甜瓜产量和品质[2]。甜瓜白粉病致病菌有3个属,6个种,瓜单囊壳白粉菌分化出生理小种0、1、2(2U.S、2France)、3、4、5[3]、6、7、N3和N4[4];二孢白粉菌衍生出生理小种0和生理小种1[5]。诸多病原菌仅仅依靠化学制剂已不能根除白粉病,且随着时间增长病原菌已产生耐药性,即使加大用药剂量也难以获得好的效果,这对甜瓜白粉病防治工作造成了极大的困难[6]。面对白粉病对甜瓜造成的重大危害,外界施药又困难重重,培育抗病新品种成为杜绝白粉病的不二方法。然而传统的育种方法极易受环境因素、基因表达、基因显隐性、目标基因与不利基因的连锁等影响,使得育种周期长,选择目标性状困难,很难培育出优良品种[7-8]。分子标记辅助育种可以有针对性的培育出所含目标性状的新品种,首先要明确致病菌类型研究抗病规律进而获得抗病基因 [9]。本试验以甜瓜高抗白粉病品系MR-1(P1)和甜瓜高感白粉病品系Topmark(P2)为亲本配制杂交组合,探索抗源MR-1对瓜单囊壳白粉菌生理小种1的抗性遗传规律。以F2群体为作图群体,利用CAPS技术,定位抗性基因,为甜瓜抗白粉病基因的精细定位和分子克隆奠定基础。
1材料与方法
1.1试验材料
1.1.1供试甜瓜品种试验所用母本为抗性材料MR-1,对白粉病菌不同的生理小种普遍具有抗性,父本Topmark为感病材料,不含抗病基因。采用国际通用13个生理小种的鉴别寄主,分别是PMR45、Topmark、PI124111、IranH、PI24112、MR-1、Nantais Oblong、Edisto47、PI414723、WMR29、PMR5、PMR6、Vedrantais。
1.1.2供试菌株2013年7月采集于东北农业大学实验基地感白粉病严重的葫芦科病叶,隔离保存菌株并对病原菌进行显微镜镜检,确定病原菌类型。将菌株接种到感病植株上进行纯化后接种到13个鉴别寄主上鉴定生理小种。
1.2田间试验
1.2.1田间试验设计2013年3月将6世代群体浸种,催芽,单粒播种于钵中。5月将20株长势良好的MR-1(P1)、Topmark(P2)、F1,100株BC1P1(F1与P1回交),100株BC1P2(F1与P2回交)及354株F2代定植于东北农业大学香坊农场5号温室中,株行距50 cm×80 cm,待植株长到3叶1心时去掉生长点,采取双蔓绑枝法将植株吊起,施肥、杀虫、灌溉等进行日常田间管理。2013年夏季将鉴别寄主播种在 8 cm×8 cm 的营养钵中,采用对角线种植。收集充分发病的葫芦科蔬菜病叶,轻轻抖下白粉病菌进行纯化配制菌液,喷雾接种到13个鉴别寄主上,设 3次重复,1次重复10株。
1.2.2田间接种试验采用风媒接种法,即模仿田间自然发病条件,在高温高湿下白粉病病原菌最易侵染甜瓜,将其他温室成株期充分发病的甜瓜品种移植到试验温室中,白粉病菌的分生孢子随着空气从发病植株落到需要进行抗病调查6世代群体上,达到接种目的。为确保高温高湿条件,白天在温室地面上多次浇水,适时封闭温室[10]。
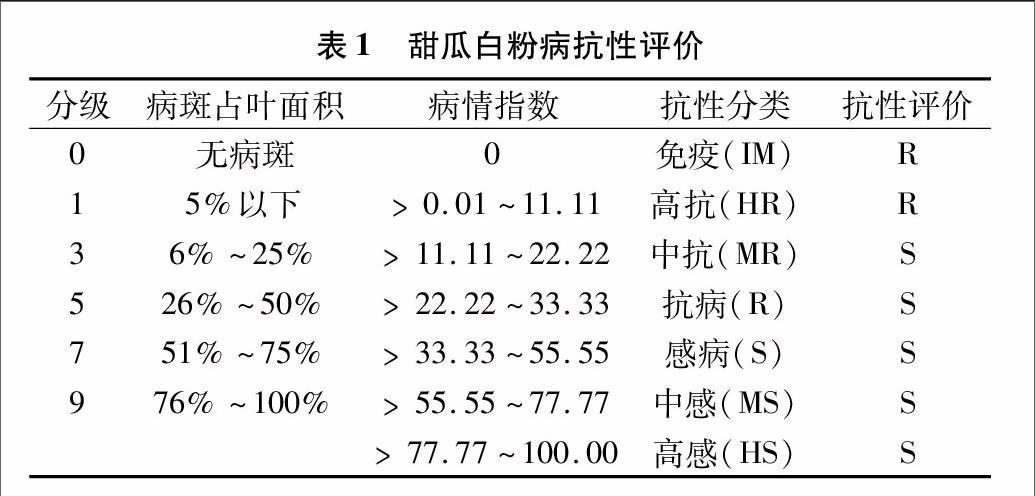
1.2.3田间调查试验白粉病调查方法依照《中国蔬菜病虫预测预报》,根据感染程度即叶面菌落多少进行分级,共分6级。6世代群体每株由下而上调查10张叶片记录病级。按病情指数(DI)=∑ [(病级的代表值该病发病叶片数)/(调查单株总叶片数×最高病级的代表值)]×100计算病情指数。根据病指(DI)确定父本、母本、F1、F2、BC1P1、BC1P2的抗感表现型。将病情指数小于等于11.11定义为抗病,病情指数大于11.11定义为感病(表1)。
参照上述方法记录鉴别寄主5张叶片的病级,计算病情指数,对照表2的抗感反应,确定试验地的优势生理小种。
1.3CAPS分子标记
1.3.1CAPS引物开发CAPS标记的开发以2个亲本材料的基因组重测序数据为依据,以已经发布的甜瓜基因组数据为参考,自编perl语言脚本提取位于SNP 位点前后约500 bp的片段序列作为候选SNP位点序列。通过SNP2CAPS软件分析酶切位点信息,在候选SNP序列中筛选存在CAPS突变的位点,用4种不同的限制性内切酶(EcoRⅠ、HindⅢ、 PstⅠ和BamHⅠ)设计引物进行酶切验证。在甜瓜基因组的每条染色体上平均选取30~40个存在CAPS 位点的序列,用Primer 5软件设计引物[11],控制退火温度55~58 ℃,G+C比例在40%~60%,得到长度为19~25 bp的引物。(M/A)酶切位点所在连锁群号+引物编号+酶简写进行引物命名。
1.3.2CAPS引物筛选CAPS标记 PCR反应体系(20μL):2.0 μL模版DNA,2.0 μL引物,0.3 μL dNTPs,0.2 μL Taq酶,13.5 μL ddH2O,2.0 μL 10×Buffer。
采用梯度PCR反应程序,即94 ℃预变性7 min;94 ℃变性 20 s,60 ℃退火 20 s,72 ℃延伸 30 s;30 个循环,每个循环降 0.5 ℃;94 ℃变性 20 s,45 ℃退火20 s,72 ℃延伸 30 s,10个循环;72 ℃延伸 7 min,4 ℃保存[12]。酶切体系是1 μL 限制性内切酶缓冲液,0.5 μL 限制性内切酶(10 U/μL,THERMO),9 μL 超纯水,PCR 扩增产物5 μL,37 ℃水浴 2 h。酶切产物用1%琼脂糖凝胶在250 V高压下电泳,25~35 min后紫外照射凝胶拍照。
1.3.3F2群体分子数据记录分析F2群体扩增的CAPS 条带和白粉病抗性基因之间的遗传关系,同P1带型一致的标记记为2,同P2的带型一致的标记记为0,同F1带型一致的则记为1,缺失或者模糊不清楚的带型记作-1,将所有条带类型记录在Microsoft Excel 2003。
1.3.4遗传图谱构建利用QTL IciMapping 4.0对具有多态性且应用到F2代基因分型的分子标记进行遗传图谱构建并分析,用“map”命令打开记录F2代条带类型的表格,设定LOD值为3.0,使用完备区间作图(ICIM)构建遗传连锁图谱。利用MapChart 2.2 绘制遗传连锁图谱,根据CAPS标记在染色体上的位置,依次将连锁群命名为LG1~LG12。
2结果与分析
2.1白粉病抗性调查
显微镜观察白粉病病原菌无性世代,均观察到有纤维状体,证实致病白粉病菌是P. xanthii。对13个鉴别寄主的抗病调查发现,8种鉴别寄主在不同程度上表现为抗病,分别是PMR45、PMR5、WMR29、Edisto47、PI124111、PI124112、PMR6和MR-1。其余5个鉴别寄主均表现为感病,说明试验地的优势小种是生理小种1。
F1代植株表现出与母本性状相似的抗性性状,对354株F2代进行田间抗病性调查,发现其中30株F2免疫、212株高抗、62株中抗、14株抗病、13株感病、5株中感和2株高感。计算统计得到抗病植株为268株、感病86株,抗病 ∶ 感病=3.12,符合3 ∶ 1的分离比例,F1全部抗病,BC1P1抗病,BC1P2感病 ∶ 抗病=1 ∶ 1。通过F2代群体中白粉病病情指数在群体中的频次分布图可以发现,F2代群体的354个单株中,表现出明显的偏分离,大部分单株偏向于低值病情指数,病情指数11.11时可以将F2代群体明显地分为抗病和感病2类。病情指数为31.057~40.613时,存在小峰分布,证明还存在一些微效基因与抗白粉病基因连锁。证明甜瓜抗白粉病基因由显性单基因控制并同时受到微效基因调控。调查分级结果为质量性状(图1)。用Excel绘制的病情指数频次分布图见图2。
2.2CAPS标记多态性
用Primer5设计并选用316对CAPS引物,对两亲本进行扩增筛选,共筛选出在亲本间有多态性的CAPS引物157对,多态率为49.80%。其中带型清晰用于构建图谱的标记有142个,分布在1号连锁群上的标记14个,2号连锁群13个,3号连锁群8个,4号连锁群22个,5号连锁群15个,6号连锁群14个,7号连锁群10个,8号连锁群9个,9号连锁群8个,10号连锁群9个,11号连锁群10个,12号连锁群10个。部分筛选引物见图3。具有多态性引物对F2群体基因型检测见图4。
2.3连锁图谱构建与基因定位
运用QTL IciMapping软件在LOD值≥3的条件下对 142个多态性标记进行连锁分析,获得一张包含有142个CAPS标记、覆盖12个连锁群的遗传连锁图谱(图5)。图谱总长度2 065.47 cM,图谱标记平均距离14.55 cM。含标记最多的为第四连锁群,分布22个标记,标记间平均距离为 11.61 cM。最长的为第五连锁群,总长277.98 cM,最短的为第三连锁群,总长65.6 cM。甜瓜CAPS引物在连锁群上呈均匀分布。结合田间数据分析发现,在第七连锁群与抗白粉病紧密相关的位点,距离上端7-4E标记17.00 cM,距离下端 7-1H标记12.35 cM。
3结论与讨论
3.1接种方法
试验群体采用风媒接种法模仿自然发病,不仅大大降低了工作量,而且能真实反映植株对白粉病的抗性程度,对鉴别寄主接种采用孢子悬浮液喷雾法是为了使鉴别寄主快速感染白粉病进行鉴别,避免因枯萎病等其他病菌侵染植株成为主要病菌而不感染白粉病的发生。
3.2生理小种的鉴定
甜瓜是否感染白粉病很大程度上受环境影响,地点不同、种植季节不同都会影响植株是否感病及感病程度,盛夏及秋季种植的甜瓜感病概率及程度远远高于春季栽培的甜瓜;覆盖物过厚潜在地加大甜瓜周围环境湿度,使甜瓜更易感病;菌液不纯含有其他病菌使供试植株不感白粉病而感染其他病。试验严格执行采集、纯化及接种步骤,依照病级分类标准对试验中侵染的生理小种进行鉴别,结果准确可靠。在鉴定生理小种时,为防止空间差异影响植株感病试验采用对角线位置种植,设置重复使调查结果准确。
3.3CAPS标记
目前,SRAP、AFLP、SSR作为甜瓜抗病育种常用的标记方法。CAPS为酶切扩增多态性序列技术,即在已知 DNA序列两端设计引物进行PCR扩增,用限制性内切酶切割特异序列,得到大小不一的DNA片段,用琼脂糖电泳分析产物片段,即可区分基因型。CAPS相对RFLP操作简便、酶切多态性高;相对RAPD稳定性、可靠性、重复性强;相对AFLP工作量小,统计条带容易;相对SSRs引物设计容易。CAPS对DNA浓度及纯度要求不高,大大减少了对F2代DNA的提取。试验对重测序的两亲本开发CAPS标记使得引物更有针对性,设计的CAPS引物具有在基因组上的座位号,便于在基因组层面上对各个标记进行定位,遗传图谱中的连锁群代号就是染色体顺序。
3.4连锁图谱与基因定位
本试验用CAPS分子标记构建甜瓜抗白粉病基因遗传连锁图谱在世界范围内都很罕见。在全基因组测序的基础上,有针对性地自行开发设计引物,结合田间调查结果发现MR-1 对瓜单囊壳白粉菌生理小种1的抗性基因是单显性基因,与Jagger等的研究结论[13-15]一致。试验群体数量足够大,但标记数量还有待增多。Wang等对Ano2 × Hami413 和Ano2 × Queen 2组杂交组合得到的F2代,构建出2张遗传连锁图谱,包括SSR标记、GRA标记和AFLP标记,结合分离群体分组分析法(BSA)和比较基因组学(RGA),在抗病材料Ano2中定位出抗病基因Pm-AN,该基因在RPW 和 MRGH63B 2个标记中间 [16]。王建设以1A151(抗)×恒进红瓤酥(感)构建6世代群体,运用RAPD分子标记结合抗性遗传分析找到1个由1对不完全显性抗病基因控制的抗病位点RAPD-S329,其遗传距离为(6.81±l.67) cM[17]。Yuste-Lisbona等利用AFLP对抗病材料TGR-1551和感病材料 Bola de Oro配制杂交组合构建分子标记体系,构建出1张包含14个连锁群的遗传图谱,发现主效QTL位点Pm-R在第五连锁群上[18]。Teixeira等使用AFLP法找到与抗病基因Pm-1距离为4.9 cM的分子标记M75/H35_155,所用抗病材料为 AF426-R [19]。Fukino等为比较甜瓜生长在子叶和第一片真叶期,pxA、pxB 2种白粉病菌株对其是否发病产生不同影响,利用高抗AR5和高感Harukei配制重组自交系,用157个SSR标记和7 个SCARs/CAPSs标记构建遗传图谱,检测QTL位点[20]。Liu等在抗性材料PI 134198中发现了1个单显性抗性基因,并且在距离该基因3.9 cM处获得了1个SRAP标记[21]。Ning等用抗病材料Edisto47和感病材料Queen构建BC1群体,发现抗病基因Pm-Edisto47-1在SSR标记CMGA36 和 SSR252089之间,与两标记距离均为 2.1 cM[22]。由此可见使用抗病材料不同也会导致抗病位点不同。
研究发现试验材料MR-1所含有的甜瓜白粉病基因为单显性基因。通过对MR-1×Topmark所构建的F2代群体进行分析,共检测到1个与白粉病抗性有关的位点,位于7号染色体上,距离上端7-4E标记17.00 cM,距离下端7-1H标记12.35 cM,为今后甜瓜白粉病抗性基因的精细定位及克隆奠定了基础。
参考文献:
[1]Kuzuya M,Hosoya K,Yashiro K,et al.Powdery mildew (Sphaerotheca fuliginea) resistance in melon is selectable at the haploid level[J]. Journal of Experimental Botany,2003,54(384):1069-1074.
[2]Sitterly W R.Powdery mildew of cucurbits[M]//Spencer D M. The powdery mildews.New York:Academic Press,1978:359-379.
[3]Hosoya K,Narisawa K,Pitrat M,et al.Race identification in powdery mildew(Sphaerotheca fuliginea)on melon (Cucumis melo)in Japan[J]. Plant Breeding,1999,118(3):259-262.
[4]Hosoya K,Kuzuya M,Murakami T,et al.Impact of resistant melon cultivars on Sphaerotheca fuliginea[J]. Plant Breeding,2000,119(3):286-288.
[5]Bardin M,Dogimont C,Nicot P,et al.Genetic analysis of resistance of melon line PI 124112 to Sphaerotheca fuliginea and Erysiphe cichoracearum studied in recombinant inbred lines[J]. Acta Hort,1999,492:163-168.
[6]Hollomon D,Wheeler I.The powdery mildew:a comprehensive treatise [M]. St Paul:The American Phytopathological Society,2002:249-255.
[7]邹明学,许勇,张海英,等. 葫芦科瓜类作物分子标记辅助育种研究进展[J]. 生物技术通报,2007(4):72-78.
[8]徐小万,雷建军,罗少波,等. 作物基因聚合分子育种[J]. 植物遗传资源学报,2010,11(3):364-368.
[9]张海英,苏芳,郭绍贵,等. 甜瓜白粉病抗性基因Pm-2F的遗传特性及与其紧密连锁的特异片段[J]. 园艺学报,2008,35(12):1773-1780.
[10]王建设,唐晓伟,孟淑春,等. 甜瓜白粉病抗源鉴定与抗性遗传分析[J]. 华北农学报,2002,17(3):124-128.
[11]刘传奇,高鹏,栾非时. 西瓜遗传图谱构建及果实相关性QTL分析[J]. 中国农业科学,2014,47(14):2814-2829.
[12]束永俊,李勇,柏锡,等. 基于基因重测序信息的大豆基因靶向CAPS标记开发[J]. 作物学报,2009,35(11):2015-2021.
[13]Jagger I,Whitaker T,Porter D.A new biologic form of powdery mildew on muskmelons in the Imperial Valley of California[J]. Plant Dis Rep,1938,22:275-276.
[14]Bohn G,Whitaker T.Genetics of resistance to powdery mildew race 2 in muskmelon[J]. Phytopathology,1964,54(5):587-590.
[15]Harwood R R,Markarian D. A genetic survey of resistance to powdery mildew in muskmelon[J]. Journal of Heredity,1968,59(3):213-217.
[16]Wang X,Li G,Gao X,et al. Powdery mildew resistance gene (Pm-AN) located in a segregation distortion region of melon LGV [J]. Euphytica,2011,180(3):421-428.
[17]王建设,宋曙阵,唐晓伟,等. 甜瓜白粉病抗性基因的遗传与分子标记[J]. 华北农学报,2005,20(1):89-92.
[18]Yuste-Lisbona F J,Capel C,Sarria E,et al. Genetic linkage map of melon (Cucumis melo L.)and localization of a major QTL for powdery mildew resistance[J]. Molecular Breeding 2011,27(2):181-192.
[19]Teixeira A P M,Barreto F,Camarg L E A.An AFLP marker linked to the Pm-1 gene that confers resistance to Podosphaera xanthii race 1 in Cucumis melo[J]. Genet and Mol Biol,2008,31(2):547-550.
[20]Fukino N,Ohara T,Monforte A J,et al. Identification of QTLs for resistance to powdery mildew and SSR markers diagnostic for powdery mildew resistance genes in melon(Cucumis melo L.)[J]. Theoretical & Applied Genetics,2008,118(1):165-175.
[21]Liu L,Chen Y,Su Z,et al.A sequence-amplified characterized region marker for a single,dominant gene in melon PI 134198 that confers resistance to a unique race of Podosphaera xanthii in China[J]. Hortscience,2010,45(9):1407-1410.
[22]Ning X,Wang X,Gao X,et al. Inheritances and location of powdery mildew resistance gene in melon Edisto47[J].
