褪黑激素对雌性动物生殖系统调节作用的研究进展
2016-07-25王淑娟刘文举王立克庞训胜
王淑娟++刘文举++王立克++庞训胜++车传燕

摘要:褪黑激素的分泌具有日节律和季节性节律,对季节性繁殖动物的生殖功能具有重要的调节作用。大量研究表明,褪黑激素对生殖系统的影响因动物种类、生理状况的不同而表现出多重性,具有促进、抑制作用或无作用。褪黑激素对于牛、鼠类、禽类、人等均具有抑制生殖作用,对于绵羊、鹿等动物均具有促进生殖作用,而对光不敏感的动物无作用。光照对生殖机能的调节依靠褪黑激素介导传递到下丘脑-垂体-性腺(HPG)轴。褪黑激素调节下丘脑分泌促性腺激素释放激素(GnRH),而GnRH调控LH和FSH的分泌,进而调节性腺水平的生殖功能。近年来的研究表明,褪黑激素也可直接作用于卵巢,调控雌性动物的生殖系统及功能。
关键词:褪黑素;雌性动物;卵巢;颗粒细胞;胚胎
中图分类号: Q492.5文献标志码: A
文章编号:1002-1302(2016)06-0015-05
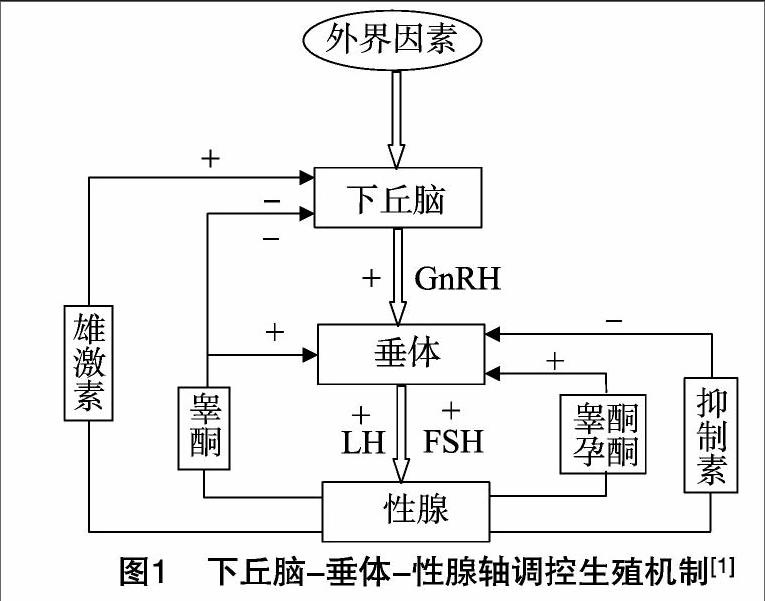
1褪黑激素对下丘脑-垂体-性腺轴的调节作用
动物生殖系统的发育和功能维持是机体内外各种调控因素综合作用的结果,而HPG轴则起主要调控作用。下丘脑、垂体、性腺在中枢神经的调控下形成一个自动反馈系统(图1),三者相互协调、相互制约,使动物的生殖内分泌系统保持相对稳定。来自外部的各种刺激(视觉、听觉、嗅觉等刺激)以及机体内部的刺激经过中枢神经系统的分析与整合,传至或刺激下丘脑特殊部位,从而间歇性脉冲式分泌GnRH。GnRH 通过垂体门脉系统或神经细胞的轴突末梢刺激垂体前叶分泌促性腺激素、卵泡刺激素(FSH)、促黄体素(LH)。垂体分泌的FSH和LH通过外周血液循环作用于性腺,使其分泌睾酮或雌二醇,促进睾丸或卵巢的发育,从而控制动物的个体发育和生殖过程。GnRH的分泌是脉冲式的,脉冲式分泌可诱导LH峰的出现,外周血LH与GnRH水平呈伴随性变化。然而,GnRH对FSH的影响不如对LH的影响明显,可能是由于FSH的分泌更大程度上受到卵泡内分泌物的反馈调节。下丘脑不仅分泌GnRH,还分泌促性腺释放抑制素(GnRI),可抑制GnRH的合成与释放[1]。
HPG的调控不是单向的,而是双向的,反馈调节在生殖过程中也具有重要作用。垂体促性腺激素和性腺激素也可反馈调节GnRH的释放。一般认为,FSH和LH分泌水平的升高常引起GnRH脉冲释放的减弱,反之亦然。
褪黑激素分泌受光照的影响,其通过下丘脑-垂体-性腺轴(HPG)的信号传导调节季节性繁殖动物的生殖功能,且在下丘脑GnRH释放神经元、垂体前叶结节部、远端促性腺细胞[CM(25]和泌乳细胞、睾丸、卵巢等部位的褪黑激素受体作用下完成[2-5]。褪黑激素对HPG主要表现为抑制作用,在培育24 h后的GnRH释放细胞中,褪黑激素减少GnRH mRNA的表达[4]。可断定,褪黑激素可直接调节下丘脑神经元的GnRH分泌,进而调节GnRH控制的促性腺激素、促黄体素(LH)、促卵泡素(FSH)的分泌,从而调节生殖功能。在新生小鼠垂体部位表达的褪黑激素受体通过百日咳毒素敏感性G蛋白偶联受体激活,可抑制GnRH诱导的LH的释放、cAMP与cGMP的积累、细胞内Ca2+的增加[6-8]。
2褪黑激素对卵巢功能的直接调控作用
已有研究表明,褪黑激素可调节HPG的作用以及动物的生殖系统,褪黑激素对卵巢功能的直接调节作用对动物的生殖生理也颇为重要。卵巢卵泡液中褪黑激素的存在可表明褪黑激素对卵巢功能具有直接作用。MT1、MT2在卵巢组织及颗粒细胞中的表达,可进一步证明褪黑激素在卵巢中通过褪黑激素受体直接调节卵巢功能。
卵泡液中的褪黑激素可能是在颗粒细胞中合成的,但此外还有来自血液中的褪黑激素。褪黑激素可调节颗粒细胞和卵泡内膜细胞中甾体生成酶的活性及其基因表达,从而调节性激素的生成。褪黑激素也可调节LH mRNA表达、Bcl-2和Casp3(与细胞凋亡相关的一种蛋白酶)生成、胰岛素生长因子(IGF)和转化生长因子-β(TGF-β)活性,并诱导成熟激素(MIH)基因表达和活性。巨噬细胞[JP2]和颗粒细胞中生成的ROS和褪黑激素可调节颗粒细胞中SOD、谷胱甘肽过氧化酶(GPx)、过氧化氢酶(CAT)基因表达。过多ROS诱导凋亡而导致卵泡闭锁,然而卵泡液中高水平的褪黑激素可发挥其直接和间接抗氧化作用以清除ROS,从而防止卵泡闭锁[9]。由高水平褪黑激素保护的卵泡可继续生长,成为优势卵泡(图2)。
2.1褪黑激素对卵泡的生长调控研究进展
近年来,体外受精、胚胎移植、动物克隆等技术发展迅速,并在家畜优良品种推广、濒危动物繁殖、资源保护上得到广泛应用,因此对高质量成熟卵母细胞的需求迅速增加。常规的超排技术难以满足需要,卵母细胞的成熟机制及体外培养技术已成为当前的研究热点。卵泡的生长和卵母细胞的成熟是一个非常复杂的过程,包括内分泌、旁分泌、自分泌机制。卵泡的生长开始于卵泡池的确立。[JP2]原始卵泡生长经过初期、窦前期、窦期才能达到排卵前期,然后释放卵母细胞以受精。在生长过程中,窦前期后期、窦期早期的生长依靠FSH水平维持。卵巢内每个生殖周期中的大部分卵泡为备用卵泡,只有小部分(<0.1%)能发育到成熟阶段并排出卵子。囊状卵泡是一个充满液体的小个体,终结于成熟卵泡。卵泡内充满水、电解质、血清蛋白及由颗粒细胞分泌的高浓度类固醇激素[10]。[JP]
人的排卵期卵泡中存在季节性变化的高水平褪黑激素,其浓度是血清中的3倍[11]。在接受体外受精胚胎移植的患者体内发现,大卵泡中褪黑激素浓度高于小卵泡。褪黑激素及其母体、5-羟色胺、N-乙酰-5-羟色胺存在于人的卵巢提取物中,且褪黑激素合成酶NAT、HIOMT也存在于人的卵巢匀浆液中[12],表明卵巢可能合成褪黑激素释放进卵泡内。备用卵泡具有诱导一系列mRNA表达的特征,这些mRNA主要编码类固醇合成酶、促性腺激素受体、局部调节因子。卵泡发育成熟过程中,对激素的依赖也发生了变化,从FSH依赖转为LH依赖,该机制也许是成熟卵泡选择机制。卵泡选择机制与颗粒细胞中编码LH受体的mRNA的表达时间有关[13]。在人的颗粒细胞中,褪黑激素(10 pmol/L~100 nmol/L)可增加LHR mRNA、GnRH、GnRHR mRNA的表达[14]。
性激素对卵巢细胞的生长和分化具有重要作用。雌激素与促性腺激素协同作用于颗粒细胞的生长和分化[15]。孕激素对卵泡生长和发育的作用是有限的,但可调节颗粒细胞的功能和排卵过程中卵泡的破裂[16]。雄激素可促进卵泡的早期生长[17],但也通过刺激闭锁和凋亡而阻碍了卵泡的发育[18]。在卵泡成熟的各个阶段,褪黑激素均调节性激素的分泌。Adriaens等证实,采用褪黑激素(100 μmol/L)孵育小鼠窦前期卵泡,可增加孕激素(P)、雄烯二酮(A)的生成[19]。在猪囊状卵泡中,褪黑激素也刺激P和A的合成,但不影响雌二醇(E2)的合成。Soares等证实,松果体切除后卵巢中的闭锁卵泡数增加,E2水平显著增加,而P减少[20]。在人的排卵前卵泡中,P与褪黑激素的浓度成正比[21]。相反,采用hCG孵育24 h后的仓鼠排卵前卵泡中,褪黑激素减少P、E2、cAMP的合成。当卵泡膜细胞与颗粒细胞分离时,褪黑激素减少膜细胞合成的P,而对颗粒细胞无影响。在cAMP调节的类固醇合成途径的早期阶段,褪黑激素可直接抑制卵泡类固醇生成。该结果与另一报道相一致,即褪黑激素阻止类固醇合成急性调节蛋白的[JP2]表达[22]。类固醇合成急性调节蛋白决定了胆固醇穿过膜间隙进入内膜,在那里细胞色素裂解酶(P450 SCC)可裂解胆固醇为孕烯醇酮。在小鼠的莱迪希肿瘤细胞中,褪黑激素减少由hCG刺激的类固醇合成急性调节蛋白的表达。然而,褪黑激素直接作用于卵泡类固醇合成是复杂的,要依赖于细胞类型(膜细胞或颗粒细胞)、持续时间(短暂或长期作用)、试验模型(细胞培养或卵泡培养)、物种、计量。[JP]
卵巢外信号和卵泡内因子共同决定卵泡是否继续发育或转向闭锁途径。褪黑激素可清理生长卵泡内的RNS和ROS,[JP3]刺激抗氧化酶活性,也可调节抗氧化酶、抗凋亡或促凋亡蛋白基因的表达。生长卵泡中褪黑激素浓度的增加是卵泡避免闭锁的重要因素,卵泡可继续发育成熟,并释放卵母细胞以供受精。[JP]
2.2褪黑激素改善卵母细胞质量
劣质卵母细胞对于女性的不孕不育是一个重要问题。卵泡在排卵过程中产生大量ROS,这些氧化应激作用可能是导致卵母细胞劣质的原因之一。·OH、O2-·、H2O2在卵母细胞中均已被发现,它们导致细胞膜脂质体劣化、破坏DNA、加速凋亡、诱导二细胞阻滞和凋亡、抑制受精。与未分散胚胎和未受精卵母细胞相比,分散胚胎内的H2O2水平显著较高。ROS的产生与抗氧化剂清除能力之间的平衡,是卵母细胞成熟和受精的重要因素之一。
利用药物保护卵母细胞和滋养层细胞免受损害是非常重要的。卵泡中存在高水平的褪黑激素,颗粒细胞中存在褪黑激素受体,均表明吲哚胺有益于卵泡。劣质卵母细胞的妇女卵泡内8-羟基-2′-脱氧鸟苷(8-OHdG,一种损害DNA产物的生物标记)浓度显著高于正常卵母细胞的妇女。褪黑激素可显著降低卵泡内8-OHdG的浓度[22],也可影响抗氧化酶活性及其基因表达。褪黑激素增强了SOD活性[23],在其生理浓度下,诱导3种抗氧化酶(Cu,Zn-SOD、Mn-SOD and GPx)的基因表达。对于因卵母细胞劣质而无法生育的妇女,褪黑激素可作为改善妇女卵母细胞质量的良好药物[24]。
褪黑激素也可调节卵母细胞成熟[19]。17α,20β-dihydroxy-4-pregnen-3-one(17α,20β-DP)是一种孕激素类固醇,是一种成熟诱导激素[25],作用于卵母细胞膜上的受体,诱导卵母细胞质内成熟促进因子的活性[26]。近期研究表明,褪黑激素影响鲤鱼卵母细胞成熟过程中成熟诱导激素的活性。褪黑激素加速了成熟诱导激素对成熟促进因子激活、卵母细胞胚泡破裂的作用[27]。在培养液中添加褪黑激素,不仅可促进小鼠受精,也可促进胚胎组织的早期发育[28]。Rodriguez 等报道,褪黑激素可使猪胚胎的卵裂率升高,且囊胚细胞数增加[29]。另外,褪黑激素可提高冻融囊胚的孵化率,并促进其发育[30]。毒性试验表明,褪黑激素对胚胎发育并无副作用[31]。
褪黑激素是一种抗氧化剂和自由基清理剂,对卵母细胞的质量和成熟、胚胎的发育具有重要作用。在体内,羊皮下埋植的外源褪黑激素增加动物体内卵巢卵泡的更新,与对照组相比,试验组的卵母细胞总数没有显著变化,但卵母细胞的发育活力增加,表现为体外受精和培养后卵母细胞的卵裂率增加,促进胚胎发育,提高囊胚率[32]。体外试验表明,在24、48 h 内,褪黑激素可增加羊的玻璃化冷冻囊胚成活率[33]。在小鼠和牛体外受精后的体外胚胎培养液中添加褪黑激素,可促进胚胎发育[28,34]。在猪的卵母细胞体外成熟中,外源褪黑激素对细胞核、细胞质的成熟起到有利作用[35]。Takada等证实,褪黑激素对牛卵丘细胞的扩散、卵母细胞的细胞核成熟没有显著作用,高浓度褪黑激素增加减数分裂中期阶段的卵母细胞成熟[36]。El-Raey等研究表明,牛卵丘卵母细胞复合体中存在褪黑激素受体MT1和MT2的表达,卵母细胞中只有MT2的表达[37]。体外成熟培养液中的褪黑激素可促进卵母细胞核的成熟、卵丘细胞的扩散,并改变线粒体的分布模式,但对卵母细胞线粒体的活性、卵丘卵母细胞复合体中甾体的合成没有影响,褪黑激素可降低卵母细胞内ROS的水平。在体内和体外毒性试验中,并未发现褪黑激素在小鼠胚胎发育过程中的副作用。
2.3褪黑激素对颗粒细胞功能的影响
哺乳动物卵泡发育是一个极其复杂的过程。卵泡主要由1个卵母细胞、外周颗粒细胞、卵泡膜细胞等组成,颗粒细胞增殖、分化、凋亡对卵泡发育具有重要作用。颗粒细胞分泌的一些激素和调控因子对卵母细胞生长成熟具有重要作用。卵巢卵泡内存在较高浓度的褪黑激素,对卵泡发育具有重要的调控作用。研究表明,褪黑激素对颗粒细胞的发育及功能也具有重要作用。
早在20世纪80年代就已证实,褪黑激素对颗粒细胞具有调节作用。Fiske等证实,褪黑激素刺激体外培养小鼠卵巢颗粒细胞中孕酮的分泌,但不能调节雌激素的分泌;然而,当在与人绒毛膜促性腺激素的伴同下,褪黑激素可显著增加孕激素的分泌;褪黑激素抑制睾丸雄激素的合成[38]。Webley等研究表明,褪黑激素可直接刺激体外培养的人和牛颗粒细胞中孕酮的分泌[39]。褪黑激素对颗粒细胞的调节作用逐渐引起人们的重视,Yie等利用放射性褪黑激素类似物 2-[125I]-iodomelatonin 检测到,人的颗粒细胞膜部位存在褪黑激素结合位点[40]。体外培养细胞7 d,褪黑激素受体浓度增加,但亲和力并无增加。在小鼠、大鼠、人等卵巢中已检测到褪黑激素受体MT1和MT2的表达,MT1和MT2 mRNA存在于人、猪的颗粒细胞中。这一发现进一步表明,卵泡中的褪黑激素在卵巢颗粒细胞中具有重要的生理作用。Woo等利用RT-PCR方法,在人的卵巢颗粒细胞中检测到褪黑激素受体MT1和MT2 mRNA的表达,且褪黑激素可调节LH、FSH、GnRH 受体及GnRH的表达[14]。在羊、小鼠、猪的颗粒细胞中,褪黑激素有着相似的作用。Baratta等研究表明,褪黑激素刺激羊颗粒细胞中孕酮和雌二醇-17β的分泌,但对2种激素的影响是不同的,褪黑激素可单独作用于颗粒细胞增加孕酮的分泌,但对雌二醇17β没有作用[41]。褪黑激素对猪颗粒细胞的影响不同于牛和羊,可抑制孕酮的生成而增加雌激素的生成[42]。可见,褪黑激素对动物生殖功能的调节随物种的不同而有所不同,且根据细胞类型、培养时间、试验模型、培养液的不同,其作用也不同。褪黑激素对细胞的增殖和凋亡也有一定作用,不同细胞类型在不同浓度和处理时间下,其结果不同。通常褪黑激素对正常的细胞具有抗凋亡作用,并抑制癌细胞的生长,诱导肿瘤细胞的凋亡。Jou等研究证明,褪黑激素通过线粒体途径减少了氧化诱导的凋亡[43]。褪黑激素与环磷酰胺共同作用于尿道上皮细胞,显著增加细胞的增殖,减少了凋亡。Wang等研究表明,褪黑激素对牛的颗粒细胞具有抗凋亡作用[44]。激素调节卵巢的功能不仅依靠激素的水平,其激素受体的表达也必不可少。
3褪黑激素对胚胎发育的影响
在哺乳动物体内,卵巢排卵后,卵泡液带着卵子缓慢流出,至腹腔内输卵管壶腹末端,在此与精子结合而受精,胚胎在输卵管中就开始发育。可以推测,卵泡液中高浓度的褪黑激素可能发挥其生理功能,调节受精和早期的胚胎发育。另外,胚胎发育过程中的氧化应激作用阻滞胚胎发育,而褪黑激素作为抗氧化剂和自由基清除剂,也可保护胚胎免受氧化压力。褪黑激素对体内和体外胚胎发育具有重要保护作用。
外源褪黑激素的植入可改善体内胚胎的活力。Forcada等在高龄、高繁殖力的Rasa Aragonesa母羊超排后植入外源褪黑激素,以证明乏情期褪黑激素对胚胎产生的作用。连续2年季节性乏情期间,完成113只超排处理。试验设为2组,植入褪黑激素的为试验组,没有植入褪黑激素的为对照组。在排出和产生功能性黄体的88只羊(78%)中,褪黑激素通过增加每个超排处理的囊胚数、存活率、受精率以改善胚胎的活力,且褪黑激素显著减少了退化胚胎数目和概率[45]。Vázquez等研究了在成年Rasa Aragonesa羊的乏情期和繁殖期,褪黑激素和营养不良对胚胎活力的影响。采用随机分配的模式,设计了2个试验4个处理组,即2×2×2。皮下植入褪黑激素、不植入褪黑激素的个体每天分别饲喂0.5、1.5次,持续20 d。结果表明,在繁殖季节和乏情季节,营养和褪黑激素补充并没有改善排卵率和卵子数;低营养的褪黑激素处理组中,每只羊的活性胚胎数显著低于对照组、对照的褪黑激素处理组。在繁殖季节,营养不良影响羊胚胎的活力,但是褪黑激素处理营养不良羊改善了其胚胎的活力[46],这些结果足以证明褪黑激素和营养的互作可以改善胚胎发育。Vázquez等再次验证,外源褪黑激素对间情期断奶后营养不良的羊体内胚胎活力、卵母细胞质量具有一定作用[47]。结果表明,褪黑激素显著提高了受精胚胎数、活力胚胎数、存活率、妊娠率;对于营养不良的母羊,褪黑激素改善了胚胎的活性。
受光照周期、高浓度氧、培养基、代谢产物的影响,体外胚胎发育过程中产生大量的ROS,会对细胞膜和DNA造成严重损害;因此,在培养液中添加合适的抗氧化剂,是保护体外胚胎发育过程中免受氧化应激损伤的有效措施。褪黑激素已被公认为一种良好的自由基清除剂和抗氧化剂,在很多方面发挥该作用,近年来也被广泛应用于体外胚胎发育体系。
超氧阴离子( O-2[KG-*2]· [KG-*3])和过氧化氢(H2O2)是小鼠体外胚胎发育2-细胞期阻滞的重要原因,褪黑激素作为一种自由基清除剂和抗氧化剂,可有效保护小鼠体外胚胎发育。Ishizuka等证实,褪黑激素有助于体外受精和受精后的早期胚胎发育,10-6、10-4 mol/L浓度的褪黑激素可提高小鼠体外受精率,当培养液中添加10-8、10-6 mol/L浓度的褪黑激素时,4-细胞胚、8-细胞胚、囊胚率均增加[28]。Tian等研究证明了褪黑激素对小鼠2-细胞胚胎体外发育的作用[48]。褪黑激素以剂量依赖性模式对小鼠2-细胞胚胎体外发育产生有利作用。褪黑激素对囊胚形成率、孵化囊胚、囊胚细胞数的作用是双向的,10-13~10-5 mol/L的褪黑激素发挥正向作用,而10-3 mol/L 的褪黑激素则发挥负向作用。褪黑激素对小鼠2-细胞胚胎体外发育的最佳浓度为10-9 mol/L。褪黑激素对猪的体外胚胎发育也有影响,Jang等将猪体外成熟或体外受精后的胚胎培养在添加了不同浓度(1、5、10 nmol/L)褪黑激素的培养液中。结果表明,与对照组相比,1 nmol/L褪黑激素处理组的桑葚胚率显著增加;与 10 nmol/L 褪黑激素处理组相比,对照组及1、5 nmol/L褪黑激素处理组的胚胎内细胞团和滋生层细胞数据均显著增加。胚胎内抗氧化酶基因表达也受褪黑激素处理的影响,0、1、5 nmol/L的褪黑激素减少了Catalase mRNA水平,10 nmol/L的褪黑激素减少了bax和caspase-3 mRNA的表达[49]。Rodriguez等验证了褪黑激素可促进猪体外胚胎发育,结果表明,10-9 mol/L的褪黑激素可显著提高卵裂率,并能提高囊胚中的细胞数;此外,进一步研究了褪黑激素对抗应激的作用,在体外胚胎培养中H2O2(0.01 mmol/L)和高温40 ℃的情况下,褪黑激素可抵抗高压而增加卵裂率,但对H2O2作用下的胚胎没有正面影响,推测其原因可能是褪黑激素不能消除药理学浓度H2O2的作用[29]。Choi等在猪的孤雌胚胎发育中证实,褪黑激素提高卵裂率和囊胚率的同时,可显著降低ROS水平[50]。褪黑激素对牛、羊等哺乳动物的体外胚胎发育也有类似作用。
褪黑激素对胚胎发育的影响已被广泛研究,但褪黑激素受体在早期胚胎发育中的表达仍研究较少。在斑马鱼中,褪黑激素受体在发育中的胚胎、新生儿中的表达高于成年斑马鱼[51]。褪黑激素受体mRNA首次于受精后18 h被检测到,随后广泛快速表达,该现象表明很多胚胎组织是褪黑激素的靶位点。截至24 h,褪黑激素受体在脑中的表达信号非常强,而背部主动脉的表达变弱,且尾部和躯干的表达减少[JP2]。研究发现,在褪黑激素受体开始表达前,褪黑激素不能影响胚胎内细胞的增殖;而当褪黑激素受体开始表达时,褪黑激素显著增强了胚胎细胞增殖。在大龄胚胎(38 h)中褪黑激素受体的作用减弱,此时胚胎内褪黑激素受体的表达也在减少。由上述数据可推断,褪黑激素对胚胎的作用与褪黑激素受体在胚胎中的表达是同步的,且褪黑激素受体参与调节褪黑激素的作用。[JP]
4总结与展望
褪黑激素是具有多种功能的光信号激素,通过改变其分泌水平,将光照信息传递给体内相关组织和器官,使其功能活动适应外界环境的变化。大量研究表明,雌性动物卵巢中存在褪黑激素及其受体;褪黑激素可直接调节人、羊、小鼠、猪等动物的卵巢功能,如刺激性激素分泌、促进卵母细胞成熟、诱导胚胎着床等,进而调节动物的生殖活动,对季节性繁殖的动物影响更为显著。除了对雌性动物生殖活动的调节外,褪黑激素还具有调节免疫系统、抗氧化、抗衰老等其他功能;近年来的研究表明,褪黑激素及其受体对癌细胞的抑制具有重要作用。褪黑激素的生物作用如此广泛,对褪黑激素及其受体的研究越来越受到人们重视,特别是其对动物生殖系统的调节作用。褪黑激素对动物生殖系统的调控机制及其调控通路有待进一步研究。褪黑激素在人类保健品中已被广泛应用,如何将褪黑激素在生殖系统中的功能利用于畜牧生产依然是值得关注的热点。利用动物模型研究褪黑激素对卵母细胞、胚胎成熟及发育的作用,可为人类辅佐生殖技术提供有利参考。[JP]
[HS2][HT8.5H]参考文献:[HT8.SS]
[1][ZK(#]苏娟. Orexin在体内外对母猪下丘脑-垂体-性腺轴作用机理的研究[D]. 南京:南京农业大学,2008.
[2]Vanecek J. Cellular mechanisms of melatonin action[J]. Physiological Reviews,1998,78(3):687-721.[HJ1.3mm]
[3]Soares J M J,Masana M I,Ersahin C O,et al. Functional melatonin receptors in rat ovaries at various stages of the estrous cycle[J].Exp Ther,2003,306:694-702.
[4]Roy D,Angelini N L,Fujieda H,et al. Cyclical regulation of GnRH gene expression in GT1-7 GnRH-secreting neurons by melatonin[J]. Endocrinology,2001,142(11):4711-4720.
[5]Frungieri M B,Mayerhofer A,Zitta K,et al. Direct effect of melatonin on Syrian hamster testes:melatonin subtype la receptors,inhibition of androgen production,and interaction with the local corticotropin-releasing hormone system[J]. Endocrinology,2005,146:1541-1552.
[6]Vanecek J,Vollrath L. Developmental changes and daily rhythm in melatonin-induced inhibition of 3′,5′-cyclic AMP accumulation in the rat pituitary[J]. Endocrinology,1990,126:1509-1513.
[7]Vanecek J,Klein D C. Melatonin inhibition of GnRH-induced LH release from neonatal rat gonadotroph:involvement of Ca2+ not cAMP[J]. Am J Physiol.1995,269:85-90.
[8]Dubocovich M L,Markowska M. Functional MT1 and MT2 melatonin receptors in mammals[J]. Endocrine,2005,27(2):101-110.
[9]Tamura H,Nakamura Y,Korkmaz A,et al. Melatonin and the ovary:physiological and pathophysiological implications[J].Fertil Steril,2009,92:328-343.[ZK)]
[10][ZK(#]Hirshfield A N. Development of follicles in the mammalian ovary[J]. International Review of Cytology,1991,124:43-101.
[11]Rnnberg L,Kauppila A,Leppluoto J,et al. Circadian and seasonal variation in human preovulatory follicular fluid melatonin concentration[J]. J Clin Endocrinol Metab.1990,71:492-496.
[12]Itoh M T,Ishizuka B,Kuribayashi Y,et al. Melatonin,its precursors,and synthesizing enzyme activities in the human ovary[J].Mol Hum Reprod.1999,5:402-408.
[13]Webb R,Nicholas B,Gong J G,et al. Mechanisms regulating follicular development and selection of the dominant follicle[J]. Reproduction Supplement,2003,61:71-90.
[14]Woo M M,Tai C J,Kang S K,et al. Direct action of melatonin in human granulosa-luteal cells[J]. The Journal of Clinical Endocrinology and Metabolism,2001,86(10):4789-4797.
[15]Drummond A E. The role of steroids in follicular growth[J]. Reproductive Biology and Endocrinology,2006,4(1):1435-1441.[JP]
[16]Graham J D,Clarke C L. Physiological action of progesterone in target tissues[J]. Endocrine Reviews,1997,18(4):502-519.
[17]Murray A A,Gosden R G,Allison V,et al. Effect of androgens on the development of mouse follicles growing in vitro[J]. Journal of Reproduction and Fertility,1998,113(1):27-33.
[18]Billig H,Furuta I,Hsueh A J. Estrogens inhibit and androgens enhance ovarian granulosa cell apoptosis[J]. Endocrinology,1993,133(5):2204-2212.
[19]Adriaens I,Jacquet P,Cortvrindt R,et al. Melatonin has dose-dependent effects on folliculogenesis,oocyte maturation capacity and steroidogenesis[J]. Toxicology,2006,228(2/3):333-343.
[20]Soares J M,Simes M J,Oshima C T,et al. Pinealectomy changes rat ovarian interstitial cell morphology and decreases progesterone receptor expression[J]. Gynecological Endocrinology,2003,17(2):115-123.
[21]Tamura H,Takasaki A,Miwa I,et al. Oxidative stress impairs oocyte quality and melatonin protects oocytes from free radical damage and improves fertilization rate[J]. Journal of Pineal Research,2008,44(3):280-287.
[22]Wu C S,Chuang J,Leu S F,et al. Melatonin inhibits the expression of steroidogenic acute regulatory protein and steroidogenesis in MA-10 cells[J]. Biology of Reproduction,1999,60(1):112.
[23]Liu F,Ng T B. Effect of pineal indoles on activities of the antioxidant defense enzymes superoxide dismutase,catalase,and glutathione reductase,and levels of reduced and oxidized glutathione in [JP3]rat tissues[J]. Biochemistry and Cell Biology,2000,78(4):447-453.[JP]
[24][JP3]Takazuki A,Nakamura A,Tamura A,et al. Melatonin as a new drug for improving oocyte quality[J]. Reprod Medic Biol,2003,2:139-144.[JP]
[25]Sen U,Mukherjee D,Bhattacharyya S P,et al. Seasonal changes in plasma steroid levels in Indian major carp Labeo rohita:influence of homologous pituitary extract on steroid production and development of oocyte maturational competence[J]. General and Comparative Endocrinology,2002,128(2):123-134.
[26]Nagahama Y. 17 α,20 β-dihydroxy-4-pregnen-3-one,a maturation-inducing hormone in fish oocytes:mechanisms of synthesis and action[J]. Steroids,1997,62(1):190-196.
[27]Chattoraj A,Bhattacharyya S,Basu D,et al. Melatonin accelerates maturation inducing hormone(MIH):induced oocyte maturation in carps[J]. General and Comparative Endocrinology,2005,140(3):145-155.
[28]Ishizuka B,Kuribayashi Y,Murai K,et al. The effect of melatonin on in vitro fertilization and embryo development in mice[J]. Journal of Pineal Research,2000,28(1):48-51.
[29]Rodriguez O N,Kim I J,Wang H,et al. Melatonin increases cleavage rate of porcine preimplantation embryos in vitro[J]. J Pineal Res,2007,43:283-288.
[30]Mcelhinny A S,Davis F C,Warner C M. The effect of melatonin on [JP2]cleavage rate of C57BL/6 and CBA/Ca preimplantation embryos cultured in vitro[J]. Journal of Pineal Research,1996,21(1):44-48.[JP]
[31]Jahnke G,Marr M,Myers C,et al. Maternal and developmental toxicity evaluation of melatonin administered orally to pregnant Sprague-Dawley rats[J]. Toxicol Sci,1999,50:271-279.
[32]Berlinguer F,Leoni G G,Succu S A,et al. Exogenous melatonin positively influences follicular dynamics,oocyte developmental competence and blastocyst output in a goat model[J]. Journal of Pineal Research,2009,46(4):383-391.
[33]Abecia J A,Forcada F,Zúniga O. The effect of melatonin on the secretion of progesterone in sheep and on the development of ovine embryos in vitro[J]. Veterinary Research Communications,2002,26(2):151-158.
[34]Papis K,Poleszczuk O,Wenta-Muchalska E,et al. Melatonin effect on bovine embryo development in vitro in relation to oxygen concentration[J]. Journal of Pineal Research,2007,43(4):321-326.
[35]Kang J T,Koo O J,Kwon D K,et al. Effects of melatonin on in vitro maturation of porcine oocyte and expression of melatonin receptor RNA in cumulus and granulosa cells[J]. Journal of Pineal Research,2009,46(1):22-28.
[36]Takada L,Junior A M,Mingoti G Z,et al. Effect of melatonin on DNA damage of bovine cumulus cells during in vitro maturation(IVM)and on in vitro embryo development[J]. Research in Veterinary Science,2012,92(1):124-127.
[37]El-Raey M,Geshi M,Somfai T,et al. Evidence of melatonin synthesis in the cumulus oocyte complexes and its role in enhancing oocyte maturation in vitro in cattle[J]. Molecular Reproduction and Development,2011,78(4):250-262.
[38]Fiske V M,Parker K L,Ulmer R A,et al. Effect of melatonin alone or in combination with human chorionic gonadotropin or ovine luteinizing hormone on the in vitro secretion of estrogens or progesterone by granulosa cells of rats[J]. Endocrinology,1984,114:407-410.
[39]Webley G E,Luck M R. Melatonin directly stimulates the secretion of progesterone by human and bovine granulosa cells in vitro[J]. J Reprod Fertil,1986,78:711-717.
[40][ZK(#]Yie S M,Brown G M,Liu G Y,et al. Melatonin and steroids in human pre-ovulatory follicular fluid:seasonal variations and granulosa cell steroid production[J]. Hum Reprod,1995,10:50-55.
[41]Baratta M,Tamanini C. Effect of melatonin on the in vitro secretion of progesterone and estradiol 17 beta by ovine granulosa cells[J]. Acta Endocrinologica,1992,127(4):366-370.
[42]Sirotkin A V. Direct influence of melatonin on steroid,nonapeptide hormones,and cyclic nucleotide secretion by granulosa cells isolated from porcine ovaries[J].J Pineal Res,1994,17:112-117.
[43]Jou M J,Peng T,Reiter R J,et al. Visualization of the antioxidative effects of melatonin at the mitochondrial level during oxidative stress-induced apoptosis of rat brain astrocytes[J]. Journal of Pineal Research,2004,37(1):55-70.
[44]Wang S J,Liu W J,Wu C J,et al. Melatonin suppresses cell apoptosis and stimulates progesterone production of bovine granulosa cells via melatonin receptors(MT1 and MT2)[J]. Theriogenology,2012,78(7):1517-1526.
[45]Forcada F,Abecia J A,Cebrián-Pérez J A,et al. The effect of melatonin implants during the seasonal anestrus on embryo production after superovulation in aged high-prolificacy Rasa Aragonesa ewes[J]. Theriogenology,2006,65(2):356-365.[HJ1.4mm]
[46]Vazquez M I,Forcada F,Casao A,et al. Effects of melatonin and undernutrition on the viability of ovine embryos during anestrus and the breeding season[J]. Animal Reproduction Science,2009,112(1/2):83-94.
[47]Vazquez M I,Abecia J A,Forcada F,et al. Effects of exogenous melatonin on in vivo embryo viability and oocyte competence of undernourished ewes after weaning during the seasonal anestrus[J]. Theriogenology,2010,74(4):618-626.
[48]Tian X Z,Wen Q,Shi J M,et al. Effects of melatonin on in vitro development of mouse two-cell embryos cultured in HTF medium[J]. Endocrine Research,2010,35(1):17-23.
[49]Jang H Y,Kong H S,Choi K D,et al. Effects of melatonin on gene expression of IVM/IVF porcine embryos[J]. Asian-Australasian Journal of Animal Sciences,2005,18(1):17-21.
[50]Choi J,Park S M,Lee E,et al. Anti-apoptotic effect of melatonin on preimplantation development of porcine parthenogenetic embryos[J]. Mol Reprod Dev,2008,75(7):1127-1135.
[51]Danilova N,Krupnik V E,Sugden D,et al. Melatonin stimulates cell proliferation in zebrafish embryo and accelerates its development[J]. FASEB Journal,2004,18(2):751.
