pH值调节方式对LAB辅助合成纳米Cu2O微球的影响与组装机理
2016-07-22殷广明张转芳辛建娇齐齐哈尔大学化学与化学工程学院齐齐哈尔161006
殷广明 张转芳 宋 坤 辛建娇 孙 立(齐齐哈尔大学化学与化学工程学院,齐齐哈尔 161006)
pH值调节方式对LAB辅助合成纳米Cu2O微球的影响与组装机理
殷广明*张转芳宋坤辛建娇孙立
(齐齐哈尔大学化学与化学工程学院,齐齐哈尔161006)
摘要:以Cu(Ac)2为原料,两性表面活性剂月桂酰胺丙基甜菜碱(LAB)为模板,采用两种不同的调节pH值方式制备了Cu2O纳米材料。表征结果表明两种调节pH值方式均可获得Cu2O纳米微球,并都呈立方晶相,而且样品的红外吸收峰、固体紫外吸收峰都不同程度的发生了蓝移;第一种Cu2O纳米微球由针状纳米粒子积聚而成,针状纳米粒子间空隙孔径主要分布在25~50 nm之间,比表面积为22 m2·g-1,禁带宽度为2.15 eV;第二种Cu2O纳米微球由小的纳米球状体堆积而成,球状体间孔道直径集中在25~50 nm和50~125 nm两个区域,比表面积为9 m2·g-1,禁带宽度为2.46 eV。两种不同的调节pH值方式获得的Cu2O纳米微球,其反应历程和自组装机理存在不同。
关键词:LAB两性表面活性剂;Cu2O纳米微球;pH值调节;组装机理
氧化亚铜(Cu2O)属于p型金属氧化物半导体材料,禁带宽度为1.9~2.6 eV[1],自1998年Ikdea等[2]首次提出纳米Cu2O在阳光下可以分解水以来,纳米尺寸Cu2O半导体的制备、性质和潜在应用的探究一直是物理化学、材料科学、生物制药以及电子元器件等各个交叉领域的研究热点之一。
黑龙江省自然科学基金(No.B201312)和国家自然科学基金青年项目(No.201501104)资助项目。
*通信联系人。E-mail:qdyingm@163.com
制备纳米Cu2O有许多种方法,包括水热法、化学还原法和电解法等[1,3-6]。在水热法和化学还原法中为了获得特定形貌的纳米Cu2O材料,常常使用表面活性剂为软模板来控制,使用的表面活性剂有十二烷基硫酸钠 (SDS)、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(PVP)等等[7-9],获得的纳米Cu2O呈线状、球状和多面体状。目前使用的表面活性剂虽然很多,也仅仅局限于阴离子表面活性剂和非离子表面活性剂,并未涉及使用双亲性表面活性剂,使用双亲性表面活性剂制备Cu2O的例子还未见报道。
甜菜碱型双性表面活性剂是双性表面活性剂的一个重要组成部分,且性质温和,正电荷中心多数负载在季铵N原子上,而负电荷中心负载在酸性集团上,根据其酸性基团的类型可分为羧酸型、磺酸型和磷酸型等等。本课题组选择了含有内铵阳离子和羧基(-(H3C)2N+CH2COO-)的月桂酰胺丙基甜菜碱(LAB)两性表面活性剂为辅助合成剂,以Cu(Ac)2为原料,采用两种不同的调节pH值途径,制备了具有介孔的Cu2O纳米微球,通过扫描电镜(SEM)、透射电镜(TEM)、傅立叶红外光谱(FT-IR)、固体紫外漫反射光谱(UV-Vis DRS)、光电子能谱(XPS)和N2吸附-脱吸附实验对不同pH值调节方式获得的产物进行了表征比较分析,并探讨了在LAB存在下两种不同的pH值调节方式自组装Cu2O纳米微球的机理。
1 实验方法
1.1实验试剂与测试仪器
月桂酰胺丙基甜菜碱(LAB,质量分数35%),购自林沂市兰山区绿森化工有限公司;其他所用试剂均为分析纯,购自天津市科密欧化学试剂有限公司;实验用水为二次去离子水。
X射线衍射仪(XRD,D8-FOCUS,Cu靶,λ= 0.154 18 nm,V=40 kV,I=40 mA,德国布鲁克公司);扫描电子显微镜(SEM,H-7650,加速电压20.0 kV,日本日立公司);透射电子显微镜(TEM,S-4300,日本日立公司);X射线光电子能谱仪(XPS,ESCALAB 250X,美国Thermo公司);红外光谱(FT-IR,Nicolet 380,美国Thermo公司);紫外-可见漫反射吸收光谱仪(UV-Vis DRS,Lambda750,美国P.E.公司);比表面积及孔径分析仪(NOVA-2000e,美国康塔公司)。
1.2样品制备
方法1:将0.22 mL月桂酰胺丙基甜菜碱加入盛有100 mL去离子水的烧杯中,慢速搅拌30 min后滴加入3 mL醋酸铜(0.1 mol·L-1)溶液,继续搅拌30 min;用0.5 mol·L-1NaOH溶液调节至pH=10.0并保持不变,滴加0.2 mol·L-1抗坏血酸溶液3 mL,电磁搅拌反应40 min。所获悬浊液经8 000 r·min-1离心分离,沉淀物用无水乙醇洗涤多次后置于真空干燥箱80℃干燥24 h。所得样品标记为A。
方法2:将0.22 mL月桂酰胺丙基甜菜碱加入盛有100 mL去离子水的烧杯中,用0.5 mol·L-1NaOH溶液调节至pH=10.0并保持不变,滴加入0.1 mol·L-1醋酸铜溶液3 mL,慢速搅拌30 min,再滴加0.2 mol·L-1抗坏血酸溶液3 mL,电磁搅拌反应40 min。余下步骤同方法1。所获样品标记为B。
2 结果与讨论
2.1样品的结构分析
样品A和B的XRD图见图1,样品A和B的XRD图与国际标准卡片JCPDS 65-3228相一致。样品A衍射峰峰位的 2θ值分别为:36.19°、42.19°、61.27°、73.96°,样品B衍射峰峰位的2θ值分别为35.96°、42.11°、61.35°、73.03°,分别对应于立方晶型Cu2O的(111)、(200)、(220)和(311)晶面。样品A和B的衍射峰较为宽化,说明Cu2O的晶粒尺寸较小,并且代表(111)晶面的衍射峰为主峰,表明样品表面晶粒表面主要由(111)晶面占据。采用Schemer公式计算(111)晶面衍射峰位可得产物A的晶粒尺寸约为9.6 nm,产物B的晶粒尺寸约为7.0 nm。

图1 样品A和样品B的XRD图Fig.1 XRD patterns for sample A and B
图2为样品A和B经选用C1s(285.0 eV)作为参比,进行元素结合能校正后的Cu2p精细结构图。经高斯拟合后发现样品A和B的Cu2p3/2的吸收峰均由2个峰组成,样品A的2个Cu2p3/2电子结合能吸收峰分别位于931.97和933.01 eV,样品B的2 个Cu2p3/2电子结合能吸收峰分别位于931.97和933.06 eV,位于931.0 eV属于Cu2O的Cu+电子结合能吸收峰,位于933.0 eV属于CuO的Cu2+电子结合能吸收峰[10]。样品A和B的XRD的检测中并没有发现CuO的衍射峰,CuO来自于表面氧化[11],从Cu2O 和CuO的电子结合能峰面积可以看出样品B中CuO的含量较高,说明样品B表面氧化程度较高。
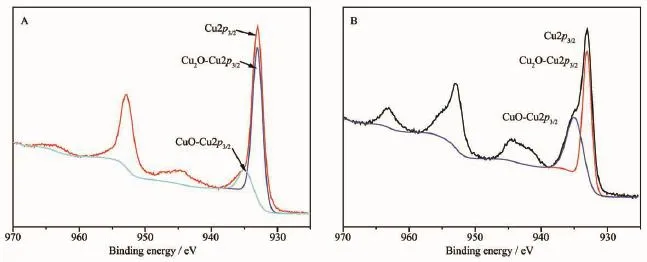
图2 样品A和B的Cu2p X射线光电子能谱图Fig.2 XPS spectra of Cu2p region of sample A and B

图3 样品A和B的O1s X射线光电子能谱图Fig.3 XPS spectra of O1s region of sample A and B
图3为样品A和B的O1s的吸收峰,A和B的O1s的吸收峰都比较宽化,经高斯拟合后,A和B的O1s的吸收峰都由3个吸收峰组成,分属于纳米微球表面吸附水分子、Cu2O和表面CuO中O2-的结合能[12],样品A相对应的O1s结合能分别为:533.09、530.93和529.55 eV;样品B相对应的O1s结合能分别为:533、530.94和529.53 eV。
2.2样品的形貌分析
图4为样品A和B的SEM、TEM图像。从样品A和B的SEM图像可以看出2种pH值调节方式均可获得球形形貌的纳米Cu2O。2种微球结构球径尺寸存在差异,样品A的纳米微球球径分布较宽粒径尺寸处于130~210 nm之间;样品B的纳米微球球径分布较窄,粒径尺寸处于120~140 nm之间观察SEM的放大图片,发现样品A的纳米微球较为致密,表面存在小的突起;样品B纳米微球由径向尺寸在20~30 nm范围内的小的球状纳米颗粒体构成,并且纳米颗粒体结构间存在明显的孔隙。2种产物的TEM图像进一步证明微球2种调节pH值方式对Cu2O纳米微球的构成单元结构产生了影响,即组成Cu2O纳米微球的纳米颗粒形貌存在差异。样品A由针状的纳米颗粒体构成,针状的纳米颗粒体间存在细小的孔道;样品B微球属于中空结构,这种中空结构是由小的球状纳米颗粒堆积形成的,由于小的球状纳米颗粒径向尺寸差异,孔道大小不均匀。

图4 样品A和B的SEM、TEM图像Fig.4 SEM and TEM images of sample A and B

图5 样品A和B的N2-吸附与脱吸附曲线图Fig.5 N2adsorption-desorption isotherms of sample A and B
2.3N2吸附-脱吸附等温线及孔径分析
样品A和B的N2吸附-脱吸附等温曲线见图5。从图中可以看出,2个样品的N2吸附-脱吸附等温线属于IUPAC分类中的Ⅴ型,在低压段吸附量平缓增加,在相对压力p/p0=0.4~1.0范围内有明显的毛细凝聚现象,等温线都表现为一个突跃,样品A属于介孔材料的H3型迟滞环,样品B属于介孔材料的H4型迟滞环,2种类型迟滞环都属于由颗粒堆积形成的狭缝状孔道[13]。BJH孔径分布图(图6)表明样品A中孔径分布主要在25~50 nm之间,而样品B中孔径分布集中于2个区域:25~50 nm和50~120 nm之间,分布较宽,孔道的分布不均匀性是由于构成纳米微球的纳米颗粒尺寸分布不均匀性形成的。N2吸附-脱吸附等温曲线及孔径分析进一步证明了SEM和TEM的分析。经过计算样品A的比表面积为22 m2·g-1,样品 B的比表面积为9 m2·g-1。
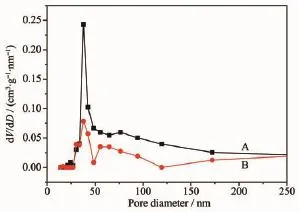
图6 样品A和B孔径分布图Fig.6 Pore size distributions of sample A and B
2.4样品的光谱性质
纳米金属氧化物红外吸收峰峰位与氧化物的晶型结构和粒径有密切关系,峰位变化实质原因是化学键力常数的变化,也就是量子尺寸效应、表面效应产生的悬空键和晶格畸变3种因素共同作用的结果,量子尺寸效应、表面效应产生的悬空键促进红外吸收峰峰位蓝移,晶格畸变通常促进红外吸收峰峰位红移[14]。样品A和B的红外吸收光谱如图7所示。Cu2O块体的红外吸收光谱最强的特征吸收峰位于609 cm-1[15],相较于Cu2O块体材料,样品A 和B的Cu-O伸缩振动吸收峰分别蓝移了14和12 cm-1,这是由于组成样品A和B的纳米粒子尺寸小于10 nm,费米能级附近的能级间隙变宽,产生了量子尺寸效应,另外,Cu2O纳米粒子表面原子配位不饱和,存在大量的悬空键,产生的离域电子在表面和体相间重新分配,使键强增强,化学键常数增大,也促进了红外光谱的蓝移,并且2种效应产生的蓝移作用大于晶格畸变引起的红移作用的结果。观察样品B的红外光谱图,在468 cm-1也出现了代表CuO纳米材料的红外吸收峰,进一步印证了XPS的测试结果。

图7 样品A、B的红外光谱图Fig.7 FT-IR spectra of sample A and B
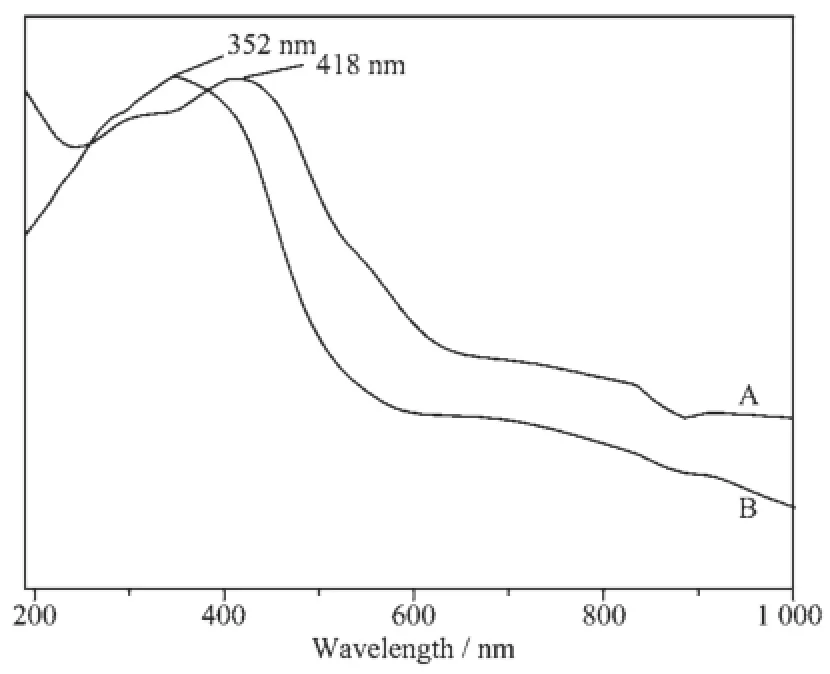
图8 样品A和样品B的紫外-可见漫反射吸收图谱Fig.8 UV-Vis DRS spectra of sample A and B

图9 样品A和B的(αEp)n~Ep关系曲线Fig.9 (αEp)nvs Epcurves of sample A and B
图8是两种方法制备的Cu2O的UV-Vis DRS谱,样品A和B的最大吸收波长分别为418、352 nm,相对于Cu2O在可见光区570 nm范围内有特征吸收峰[16],发生了明显的蓝移,吸收带蓝移现象的产生是由于量子尺寸效应使纳米Cu2O的导带和价带能级变成分立能级,能隙变宽所致[17]。紫外-可见漫反射光谱的吸收主要是电子从基态到激发态的跃迁导致的,和所测量的样品的能带结构有直接联系,可根据公式(αEp)n=C(Ep-Eg)通过画图得出样品的禁带宽度[18]。在公式(αEp)n=C(Ep-Eg)中C是常数,E为半导体样品的禁带宽度,Ep为光子的能量,α为半导体材料的吸收系数。n与半导体电子的跃迁方式有关,当半导体的电子跃迁是间接禁带跃迁的时候n=1,当半导体的电子跃迁是直接禁带跃迁的时候n=2。Cu2O属于直接禁带跃迁的半导体材料,式中的n=2。通过作(αEp)2~Ep线性图(图9),其直线部分与Ep轴的交点即为该半导体材料的禁带宽度样品A的禁带宽度为2.15 eV,样品B的禁带宽度为2.46 eV。
2.5Cu2O纳米微球形成机理
甜菜碱型两性表面活性剂在酸性介质中,当等电点的pH值更小时,表现为溶于水的阳离子表面活性剂;在中性或碱性介质中,即与等电点pH值相同或更大时,它均表现为能溶于水的两性表面活性剂,而不会表现为阴离子表面活性剂。LAB的结构简式为C12H25CONH(CH2)3N+(CH3)2CH2COO-,其临界胶束浓度为0.36 mmol·L-1,中性或碱性条件下,在水溶液中形成的球状胶束表面带有正、负 电荷。
在方法1中加入Cu2+时,-COO-吸附铜离子,形成表面吸附铜离子的球状体,随着NaOH溶液的逐渐加入至pH=10.0时,铜离子全部转化成[Cu(OH)4]2-离子。[Cu(OH)4]2-离子与LAB的含正电部位依靠静电作用形成表面吸附[Cu(OH)4]2-离子的球状体。逐渐加入抗坏血酸还原剂后,初形核的Cu2O带正电,吸附在[Cu(OH)4]2-表面,为了最大的降低体系的表面能,Cu2O以[Cu(OH)4]2-离子为模板形成原子簇,发展成纳米晶,纳米晶以层状方式优先沿Cu2O的(111)晶面生长[19-20],逐渐形成 Cu2O针状的纳米粒子。而且由于存在LAB含正电部位的空间限域作用,形成的粒子尺寸较小,XRD计算结果仅为9.6 nm。针状的Cu2O纳米粒子以放射状堆积,形成Cu2O纳米微球。该化学反应历程如下:

方法2中,随着NaOH溶液的逐渐加入,LAB含正电部位被OH-离子中和,加入Cu2+,Cu2+与OH-存在Cu2++OH-⇌[Cu(OH)]++OH-⇌Cu(OH)2可逆平衡,由于[Cu(OH)]+和Cu2+与-COO-基团静电吸附力大小不同,-COO-基团主要与Cu2+静电吸附在LAB剂胶束表面,再逐滴加入抗坏血酸还原剂,Cu2+被逐渐还原成为Cu+,Cu+与OH-生成Cu(OH),Cu(OH)分解生成Cu2O[21],带正电的初形核的Cu2O吸附在-COO-基团附近,聚集成纳米颗粒。同时,抗坏血酸的滴加速度和可逆反应Cu2++OH-⇌[Cu(OH)]++OH-⇌Cu(OH)2存在,控制着Cu2O晶体的生成速度。在吸附点生成的Cu2O纳米小颗粒较多,由于小颗粒运动快,在做布朗运动时彼此发生碰撞和相互吸引,彼此连接在一起,形成二次颗粒,二次颗粒虽运动速度较慢,仍会与其他颗粒发生碰撞,形成更大的Cu2O纳米团聚体。另外OH-离子中和了LAB胶束含正电部位,-COO-基团间距离增大,有足够的空间使Cu2O纳米团聚体聚集成小的球体结构,这些小的球体结构最后堆积成具有孔道的Cu2O纳米微球结构。该化学反应历程如下:

3 结论
在LAB存在下,不同的pH值调节方式都能够制备出带有介孔的、径向尺寸大约在200 nm附近的呈立方晶相的Cu2O纳米微球,并且样品的红外光谱中Cu-O伸缩振动吸收峰蓝移了十几个波数,固体紫外吸收峰也都发生了不同程度的蓝移。添加Cu源后再进行pH值调节获得的Cu2O纳米微球由针状纳米粒子积聚而成,针状纳米粒子的形成是由于LAB球状胶束表面的-(H3C)2N+与[Cu(OH)4]2-相互静电吸引、空间限域和还原剂共同作用下形成的,N2吸附-脱吸附等温线属于IUPAC分类Ⅴ中的H3型迟滞环,Cu2O纳米微球孔径主要分布在25~50 nm之间,比表面积为22 m2·g-1,禁带宽度为2.15 eV;先进行pH值调节再添加Cu源获得的Cu2O纳米微球由球状纳米颗粒堆积而成,球状纳米颗粒的形成是由于LAB球状胶束表面的-COO-与Cu2+相互静电吸引和还原剂共同作用下形成的,N2吸附-脱吸附等温线同属于IUPAC分类Ⅴ,但迟滞环类型为H3型,纳米微球孔道直径集中在25~50 nm和50~125 nm两个范围,比表面积为9 m2·g-1,禁带宽度为2.46 eV。
参考文献:
[1]YAN Li-Li(闫丽丽),WANG Yan(王艳),XIONG Liang-Bin(熊良斌),et al.Chinese J.Inorg.Chem.(无机化学学报),2009,25(11):1960-1964
[2]McShane C,Choi K.J.Am.Chem.Soc.,2009,131:2561-2569
[3]WANG Yue-Jun(王跃俊),ZHOU Kang-Gen(周康根),JIANG Zhi-Gang(蒋志刚).Chinese J.Inorg.Chem.(无机化学学报),2011,27(12):2405-2412
[4]Suzi Deng,Verawati Tjoa,Hai Ming Fan,et al.J.Am.Chem. Soc.,2012,134:4905-4917
[5]LI Ru(李如),YU Ling-Min(于良民),JIA Lan-Ni(贾兰妮),et al.Chinese J.Inorg.Chem.(无机化学学报),2013,29(2): 265-270
[6]Huang W C,Liu L M,Yang Y C,et al.J.Am.Chem.Soc., 2012,134:1261-1267
[7]SUN Du(孙都),YIN Peng-Gang(孙鹏刚),GUO Lin(郭林)Acta Phys.-Chim.Sin.(物理化学学报),2011,27(6):1543 1550
[8]Zhang H G,Zhu Q S,Zhang Y,et al.Adv.Funct.Mater. 2007,17(15):2766-2771
[9]Xu H,Wa W Z.Angew.Chem Int.Ed.,2007,46(9):1489 1492
[10]Morales J,Espinos J P,Caballero A,et al.J.Phys.Chem B,2005,109(16):7758-7765
[11]Deng X Y,Tirma Herranz,Christoph Weis,et al.J.Phys Chem.C,2008,112(26):9668-9672
[12]Xu R,Zeng H C.Langmuir,2004,20:9780-9790
[13]XU Ru-Ren(徐如人),PANG Wen-Qin(庞文琴),YU Ji-Hon(于吉红),et al.Chemistry-Zeolites and Porous Materials(分子筛与多孔材料化学).Beijing:Science Press,2004.
[14]ZHANG Li-De(张立德).Science of Nano Materials(纳米材料科学).Shenyang:Liaoning Science and Technology Press 1994.
[15]O′Keeffe M.J.Chem.Phys.,1963,39:1789-1793
[16]Yin M,Wu C K,Lou Y B,et al.J.Am.Chem.Soc.,2005 127:9506-9511
[17]Gao J N,Li Q S,Zhao H B,et al.Chem.Mater.,2008,20 6263-6269
[18]Tsunekawa S,Fukuda T,Kasuya A.J.Appl.Phys.,2000,87 1318-1321
[19]Zhang Z L,Che H W,Wang Y L,et al.Ind.Eng.Chem Res.,2012,51:1264-1274
[20]Zhang Y,Wang Z,Li D,et al.Eur.J.Inorg.Chem.,2008,8 2733-2739
[21]Hai Z B,Zhu C H,Huang J L,et al.Inorg.Chem.,2010,49 7212-7219
中图分类号:O614.41+1文献识别码:A
文章编号:1001-4861(2016)05-0799-07
DOI:10.11862/CJIC.2016.102
收稿日期:2016-01-06。收修改稿日期:2016-02-16。
Influence of pH Adjustment Modes on LAB Assisted-Synthesis of Cu2O Nanospheres and Self-assembly Mechanism
YIN Guang-Ming*ZHANG Zhuan-FangSONG KunXIN Jian-JiaoSUN Li
(Chemistry and Chemical Engineering Institute of Qiqihar University,Qiqihar,Heilongjiang 161006,China)
Abstract:By two different ways of adjusting the pH value,Cu2O nanomaterials was prepared with Cu(Ac)as raw material and the ampholytic surfactant N-(3-Cocoamidopropyl)-N,N-dimethyl-N-carboxymethyl ammonium betaine(LAB)as the template.The characterization results show that Cu2O nanometer materials obtained by two kinds of adjusting pH value belong to cubic phase,and morphology is nanospheres.In the IR and UV-Vis DRS spectra,there are different degree of blue shift of the infrared and ultraviolet absorption peak of Cu2O nanospher separately.The first kind of Cu2O nanosphere is composed of acicular nanoparticles,and the size of Nanomete pore between nanoparticles is mainly distributed in 25~50 nm;the specific surface area is 22 m2·g-1;the band gap is 2.15 eV.The second kind of Cu2O nanospheres assembles from smaller nano-structrue globules;the size o nanometer channel among smaller nano-structrue globules are 25~50 nm and 50~125 nm;the specific surface area is 9 m2·g-1;the band gap is 2.46 eV.There are different reaction mechanism and the self-assembly mechanism of Cu2O nanospheres obtained by two different ways of adjusting pH value.
Keywords:LAB ampholytic surfactant;Cu2O nanometer microsphere;pH value adjustment;assembly mechanism
