血管内皮生长因子抑制剂治疗晚期胃癌的Meta分析
2016-07-22蔡其明
蔡其明
上海市奉贤区中心医院药剂科,上海 201400
血管内皮生长因子抑制剂治疗晚期胃癌的Meta分析
蔡其明
上海市奉贤区中心医院药剂科,上海201400
目的研究血管内皮生长因子(VEGF)抑制剂治疗晚期胃癌的效果与安全性。 方法通过检索1990年1月~2015年8月PubMed、EMBASE、Cochrane Centra1 Register of Contro11ed Tria1s、MEDLINE和中国知网等电子数据库,并用Stata 12.0软件对其进行VEGF抑制剂治疗晚期胃癌的随机对照试验研究的Meta分析。结果纳入7个试验包括2340例患者。与无VEGF抑制剂治疗比较,VEGF抑制剂治疗可以显著改善总生存期(HR=0.71,95%CI:0.54~0.88,P=0.003)、无进展生存期(HR=0.57,95%CI:0.38~0.77,P<0.001)、总缓解率(RR=1.29,95%CI:1.11~1.47,P<0.001);VEGF抑制剂治疗可能发生更多3级以上不良反应。结论VEGF抑制剂治疗可显著改善晚期胃癌患者的总体生存,尤其是较早接受治疗的患者。
晚期胃癌曰血管内皮生长因子抑制剂曰Meta分析
[Abstract]Objective To study the effectiveness and security of vascu1ar endothe1ia1 growth factor(VEGF)inhibitors in the treatment of advanced gastric cancer.Methods The databases of PubMed,EMBASE,Cochrane Centra1 Register of Contro11ed Tria1s,MEDLINE and CNKI from January 1990 to August 2015 were searched.A Meta-ana1ysis of randomized contro11ed tria1s(RCTs)was performed to assess the efficacy and safety of VEGF inhibitors in the treatment of advanced gastric cancer by using Stata 12.0.Results Seven RCTs which invo1ved 2340 patients were u1timate1y enro11ed. Compared with the treatment without VEGF inhibitors,the VEGF inhibitors therapy cou1d significant1y improve overa11 surviva1(HR=0.71,95%CI∶0.54-0.88,P=0.003),progression free surviva1(HR=0.57,95%CI∶0.38-0.77,P<0.001)and ORR(RR=1.29,95%CI∶1.11-1.47,P<0.001).Additiona11y,more incidences of grade 3 or 4 of adverse reactions were observed in VEGF inhibitors therapy.Conclusion The VEGF inhibitors therapy can significant1y improve the overa11 surviva1 of patients with advanced gastric cancer,especia11y for the patients receiving treatment ear1y.
[Key words]Advanced gastric cancer;Vascu1ar endothe1ia1 growth factor inhibitors;Meta-ana1ysis
胃癌是一种常见且预后性极差的肿瘤,其全球发病率位于所有肿瘤的第4位,病死率位于所有肿瘤的第2位[1]。目前,手术切除是早期胃癌的首选治疗方案,但大部分患者在确诊时已属晚期,难以接受手术治疗,化疗则成为其主要的治疗方案。常见的化疗方案通常由氟尿嘧啶、铂类药物、表柔比星和多西他赛等联合序贯治疗,患者易出现耐受,且其中位生存期较短,仅为7~11个月[2-3],新型治疗方案对此类患者有重要的意义。血管内皮生长因子 (vascu1ar epithe1ia1 growth factor,VEGF)在血管生成中具有重要作用。目前,使用VEGF抑制剂抑制血管生成被认为是治疗实体瘤和抑制肿瘤转移的一种潜在有效的治疗手段[4]。大量随机对照试验显示VEGF抑制剂对晚期胃癌具有一定的疗效,但其疗效和安全性并未得到完全证实[5-8]。因此,本研究严格纳入随机对照临床试验并进行Meta分析,以探讨VEGF抑制剂治疗晚期胃癌的疗效与安全性。
1 资料与方法
1.1资料检索
电子检索以下数据库:PubMed、EMBASE、Cochrane Centra1 Register of Contro11ed Tria1s、MEDLINE和中国知网;检索时间:1990年1月~2015年8月;检索词:“bevacizumab”“avastin”“af1ibercept”“VEGFR-TKIs”“sorafenib”“nexavar”“sunitinib”“sutent”“SU1248”“vandetanib”“capre1sa”“ZD6474”“axitinib”“pazopanib”“votrient”“GW786034”“regorafenib”“apatinib”“ramu-cirumab”“angiogenesis inhibitors”“randomized”“gastric cancer”;限定字段:人类、随机对照试验、临床试验。检索不纳入以下研究类型:信件、摘要、会议概要。
1.2文献纳入标准
纳入的文献必须符合以下4点:①必须是关于VEGF抑制剂与无VEGF抑制剂比较治疗抗晚期胃癌的随机对照试验;②受试者必须确诊为晚期胃癌;③各项研究的主要结局指标是总生存期、无进展生存期与总缓解率;④次要结局指标为3级以上不良反应,主要为贫血、中性粒细胞减少、恶心、呕吐、静脉血栓栓塞、动脉血栓栓塞、大出血和胃肠穿孔。
1.3文献评价方法
所有文献的纳入由2名研究者独立进行,存在意见分歧时由3名研究者讨论决定纳入与否,对纳入文献的质量行Jadad评分[5],评分标准基于以下3点:①研究的随机方法是否正确;②是否采用盲法;③有无失访或者退出,数据是否完整。
1.4数据提取
从纳入文献中提取以下数据:第一作者、发表年份、临床试验类型、参与试验人数及分组情况、治疗方案、平均年龄、总生存期中位数、无进展生存期中位数、平均总缓解率与3级以上不良反应情况等。
1.5统计学方法
用Stata 12.0软件进行数据分析。总生存期和无进展生存期率采用风险比(Harzard,HR),总缓解率与3级以上不良反应采用相对风险比(re1ative risk ratio,RR)及其95%CI为统计量,P<0.05为差异有统计学意义。对纳入研究结果间的统计学异质性采用X2检验,检验水平为α=0.05,同时采用I2对异质性进行定量分析,当P≥0.05和I2≤50%,认为研究结果间无统计学异质性,采用固定效应模型;当P<0.05 和I2>50%时,认为研究结果间统计学异质性较大,进一步分析产生异质性的原因,若无明显临床异质性,可采用随机效应模型;反之,只进行描述性分析。为评价结果的稳定性,剔除任一项研究进行敏感性分析。利用Begg test和Egger test验证发表偏倚。
2 结果
2.1检索结果
依据纳入标准,最终纳入7项随机对照试验[6-12]包括2340例患者,详细检索过程见图1。7项随机对照试验中有4项试验[6-9]的Jadad评分为5分,3项试验[10-12]为3分,各纳入试验的基本特征见表1。

图1 随机对照试验检索流程图
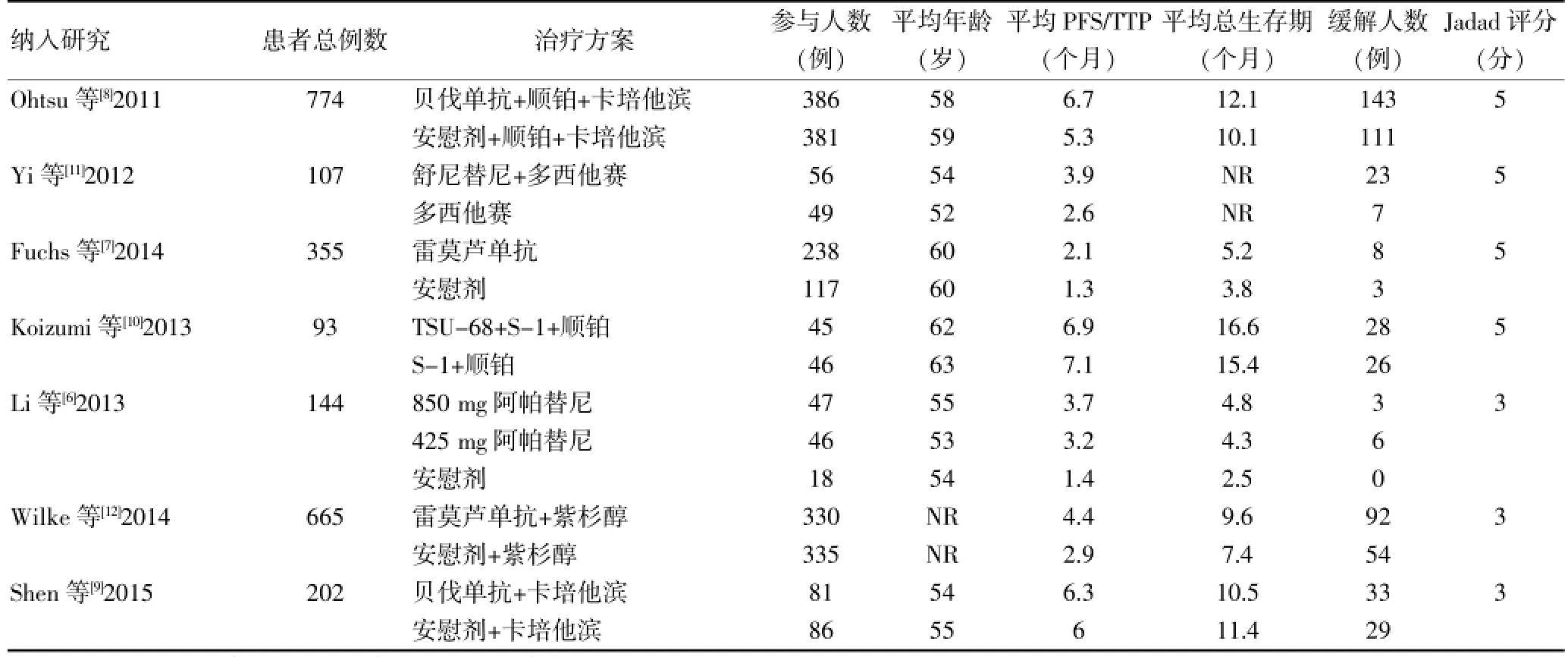
表1 纳入文献基本特征(n=2340)
2.2总生存期的Meta分析
6项随机对照试验报道了VEGF抑制剂对总生存期的影响。与非VEGF抑制剂治疗比较,VEGF抑制剂可获得更好的总生存期 (HR=0.71,95%CI:0.54~0.88,P=0.003)。见图2。
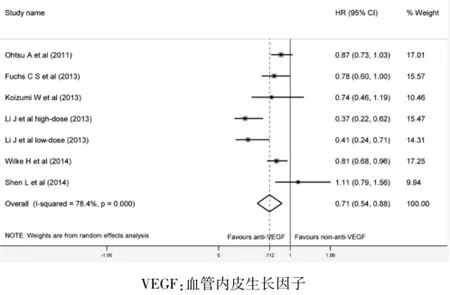
图2 VEGF抑制剂治疗与非VEGF抑制剂治疗对总生存期风险比较的Meta分析
2.3无进展生存期的Meta分析
7项随机对照试验报道了VEGF抑制剂对无进展生存期的影响。与非VEGF抑制剂治疗比较,VEGF抑制剂可获得更好的无进展生存期(HR=0.57,95%CI:0.38~0.77,P<0.001)。见图3。
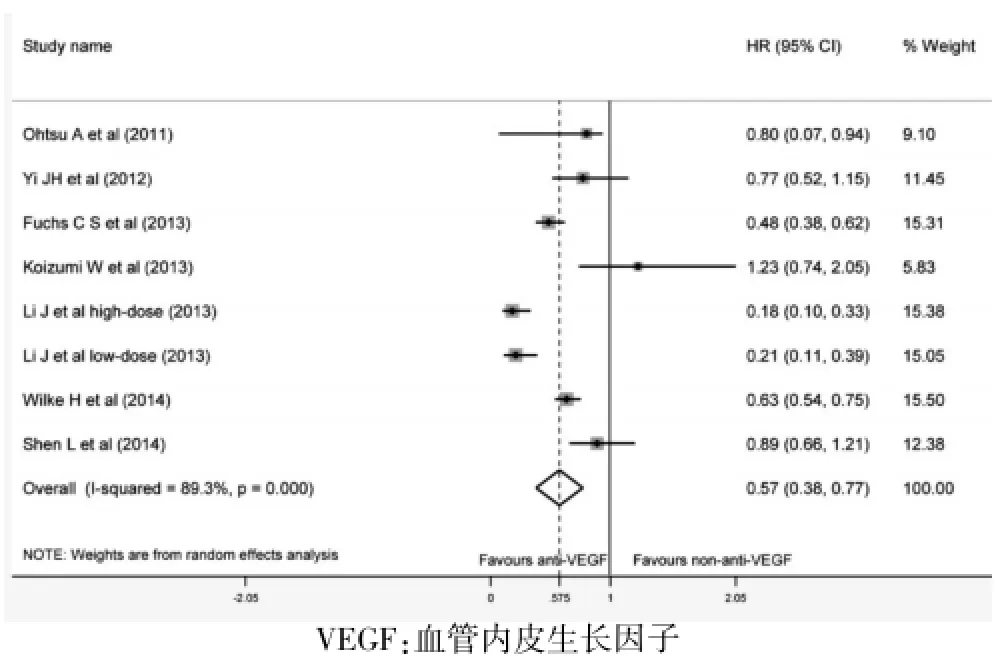
图3 VEGF抑制剂治疗与非VEGF抑制剂治疗对无进展生存期风险比较的Meta分析
2.4总缓解率的Meta分析
7项随机对照试验报道了VEGF抑制剂对总缓解率的影响。与非VEGF抑制剂治疗比较,VEGF抑制剂可获得更好的总缓解率 (RR=1.29,95%CI:1.11~1.47,P<0.001)。见图4。
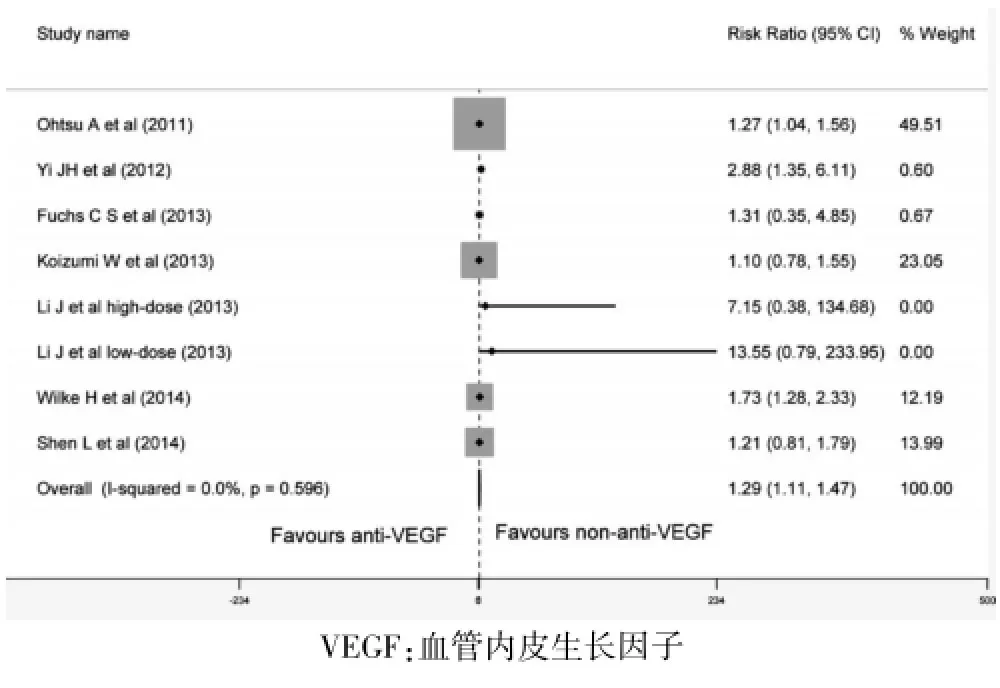
图4 VEGF抑制剂治疗与非VEGF抑制剂治疗对总缓解率风险比较的Meta分析
2.53级以上不良反应
在VEGF抑制剂组患者中,以下几种3级以上不良反应发生率更高:血小板减少症(RR=2.06,95%CI:1.01~4.22,P=0.04)、腹泻(RR=1.98,95%CI:1.22~3.22,P=0.01)和高血压 (RR=5.45,95%CI:3.16~ 9.40,P<0.01)。然而,两组患者贫血、中性粒细胞减少、恶心、呕吐、静脉血栓栓塞、动脉血栓栓塞、大出血和胃肠穿孔等3级以上不良反应发生率比较差异无统计学意义(P>0.05)。见表2。
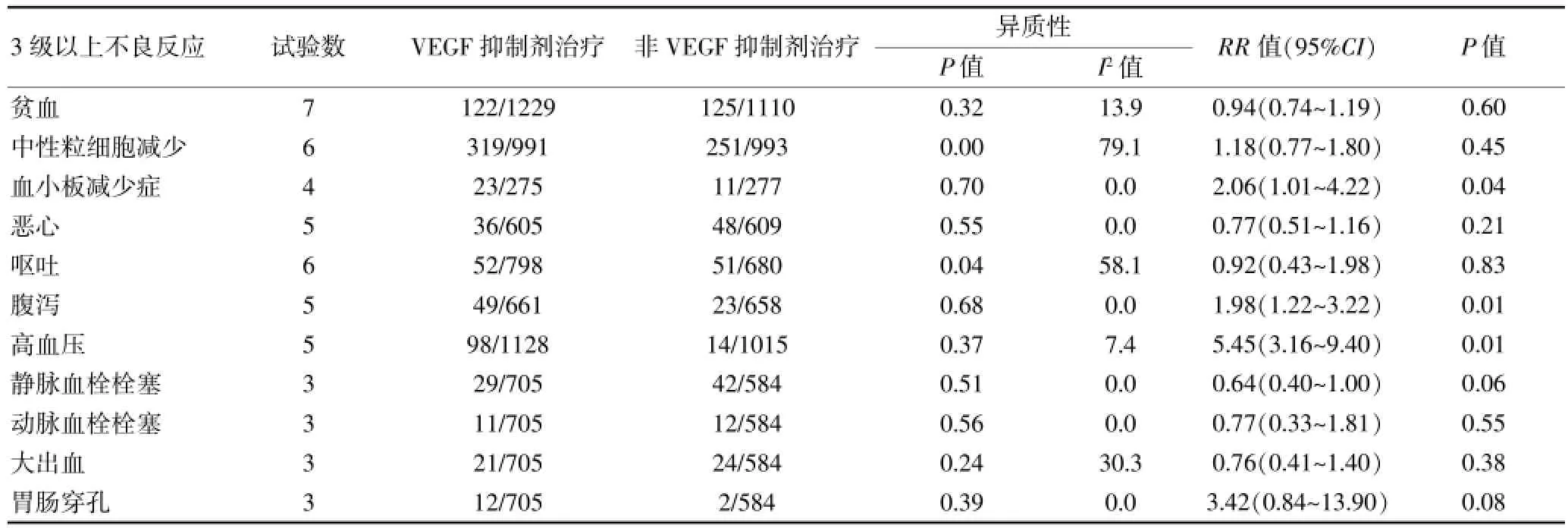
表2 VEGF抑制剂治疗与非VEGF抑制剂治疗的3级以上不良反应比较Meta分析
2.6敏感性分析
本研究采取逐步剔除单项试验的方法进行敏感性分析,发现剔除任一单项试验均不影响合并后的HRs和RRs。见图5。
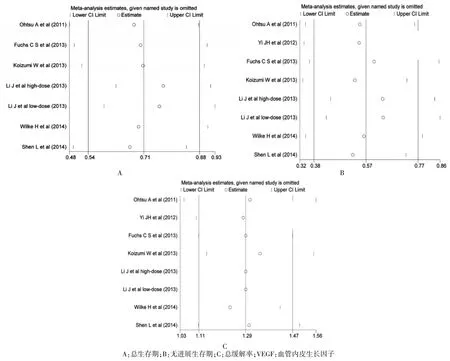
图5 VEGF抑制剂治疗与非VEGF抑制剂治疗的敏感性分析结果
2.7发表偏倚
Begg倒漏斗图结果并未显示任何不对称[P总生存期= 0.072,P无进展生存期=0.711,P总缓解率=0.386],见图6;Egger test仍未发现任何发表偏倚[P总生存期=0.146,P无进展生存期=0.614,P总缓解率=0.115],见图7。
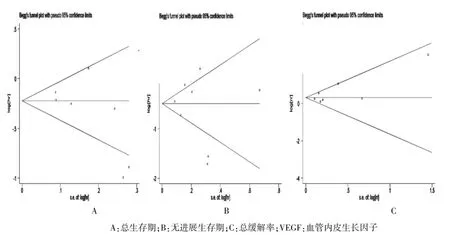
图6VEGF抑制剂治疗与非VEGF抑制剂治疗的Begg test结果

图7 VEGF抑制剂治疗与非VEGF抑制剂治疗的Egger test结果
3 讨论
血管生成在胃癌的生长、发展和远端转移等中占据重要地位,因而,各种阻断血管生成逐步成为一种有前途的治疗手段[13]。目前,VEGF抑制剂已经在很多肿瘤的治疗中取得较好的疗效[14-16]。然而,VEGF抑制剂对晚期胃癌的疗效和安全性尚无统一结论。因此,本研究探讨了VEGF抑制剂治疗晚期胃癌的效果与安全性。
本研究结果显示,VEGF抑制剂治疗可以显著改善总生存期(HR=0.71,95%CI:0.54~0.88,P=0.003)、无进展生存期(HR=0.57,95%CI:0.38~0.77,P<0.001)和总缓解率(RR=1.29,95%CI:1.11~1.47,P=0.002)。同时,VEGF抑制剂患者发生贫血、中性粒细胞减少、恶心、呕吐、静脉血栓栓塞、动脉血栓栓塞、大出血和胃肠穿孔等3级以上不良反应率与非VEGF抑制剂治疗无差别;但VEGF抑制剂患者更易发生血小板减少症、腹泻和高血压等不良反应。
本研究主要存在以下一些局限性:①此Meta分析主要依赖于疗效评估过高的发表数据,可能存在一定的发表偏倚;②不同种类的VEGF抑制剂、不同剂量、不同给药方案、随访周期以及不同研究者都有可能增加被纳入试验间的异质性;③纳入的试验都排除了肝肾功能低下的患者,意味着VEGF抑制剂可能不适用于肝肾功能不全的胃癌患者;④Ⅱ期临床试验和Ⅲ期临床试验均被纳入,然而总生存期并非Ⅱ期临床试验的主要结局指标,导致随访时间可能少于总生存期,使总生存期数据可信度降低;⑤阳性结果更易发表和阴性结果更难发表可能导致发表偏倚,本研究通过Begg倒漏斗图和Egger test均未发现发表偏倚。
本研究对VEGF抑制剂治疗晚期胃癌的效果与安全性进行了Meta分析,发现VEGF抑制剂治疗可以显著改善晚期胃癌患者的总生存期、无进展生存期和总缓解率;但患者可能更容易出现血小板减少症、腹泻和高血压等不良反应。为了取得更好疗效,可识别个体患者的特异性VEGF抑制剂需要大力研发。
[1]Lambert R,Gui11oux A,Oshima A,et a1.Incidence and morta1ity from stomach cancer in Japan,S1ovenia and the USA[J].Int J Cancer,2002,97(6):811-818.
[2]Cunningham D,Okines AF,Ash1ey S.Capecitabine and oxa1ip1atin for advanced esophagogastric cancer[J].N Eng1 J Med,2010,362(9):858-859.
[3]Van Cutsem E,Moiseyenko VM,Tju1andin S,et a1.Phase Ⅲstudy of docetaxe1 and cisp1atin p1us f1uorouraci1 compared with cisp1atin and f1uorouraci1 as first-1ine therapy for advanced gastric cancer:a report of the V325 Study Group[J].J C1in Onco1,2006,24(31):4991-4997.
[4]Fo1kman J.Tumor angiogenesis:therapeutic imp1ications[J]. N Eng1 J Med,1971,285(21):1182-1186.
[5]Moher D,Pham B,Jadad AR,et a1.Does qua1ity of reports of randomised tria1s affect estimates of intervention efficacy reported in meta-ana1yses?[J].Lancet,1998,352(9128):609-613.
[6]Li J,Qin S,Xu J,et a1.Apatinib for chemotherapy-refractory advanced metastatic gastric cancer:resu1ts from a randomized,p1acebo-contro11ed,para11e1-arm,phaseⅡtria1[J].J C1in Onco1,2013,31(26):3219-3225.
[7]FuchsCS,TomasekJ,YongCJ,eta1.Ramucirumab monotherapy for previous1y treated advanced gastric or gastrooesophagea1 junction adenocarcinoma(REGARD):an internationa1,randomised,mu1ticentre,p1acebo-contro11ed,phase 3 tria1[J].Lancet,2014,383(9911):31-39.
[8]Ohtsu A,Shah MA,Van Cutsem E,et a1.Bevacizumab in combination with chemotherapy as first-1ine therapy in advanced gastric cancer:a randomized,doub1e-b1ind,p1acebo-contro11ed phaseⅢstudy[J].J C1in Onco1,2011,29(30):3968-3976.
[9]Shen L,Li J,Xu J,et a1.Bevacizumab p1us capecitabine and cisp1atin in Chinese patients with inoperab1e 1oca11y advanced or metastatic gastric or gastroesophagea1 junction cancer:randomized,doub1e-b1ind,phaseⅢ study(AVATAR study)[J].Gastric Cancer,2015,18(1):168-176.
[10]Koizumi W,Yamaguchi K,Hosaka H,et a1.Randomised phaseⅡstudy of S-1/cisp1atin p1us TSU-68 vs S-1/cisp1atin in patients with advanced gastric cancer[J].Br J Cancer,2013,109(8):2079-2086.
[11]Yi JH,Lee J,Park SH,et a1.Randomized phaseⅡtria1 of docetaxe1 and sunitinib in patients with metastatic gastric cancer who were previous1y treated with f1uoropyrimidine and p1atinum[J].Br J Cancer,2012,106(9):1469-1474.
[12]Wi1ke H,Van Cutsem E,Rougie P,et a1.RAINBOW:a g1oba1,phaseⅢ,randomized,doub1e-b1indstudy oframucirumab p1us pac1itaxe1 versus p1acebo p1us pac1itaxe1 in the treatment of metastatic gastroesophagea1 junction(GEJ)and gastric adenocarcinoma fo11owing disease progression on first-1ine p1atinum-and f1uoropyrimidine-containing combination therapy rainbow IMCL CP12-0922(I4T-IEJVBE)[J].J C1in Onco1,2014,32(28):2231-2239.
[13]Ferrara N,Hi11an KJ,Gerber HP,et a1.Discovery and deve1opmentofbevacizumab,ananti-VEGFantibodyfortreating cancer[J].Nat Rev Drug Discov,2004,3(5):391-400.
[14]Grothey A,Van Cutsem E,Sobrero A,et a1.Regorafenib monotherapy for previous1y treated metastatic co1orecta1 cancer(correct):an internationa1,mu1ticentre,randomised,p1acebo-contro11ed,phase 3 tria1[J].Lancet,2013,381 (9863):303-312.
[15]Sand1er A,Gray R,Perry MC,et a1.Pac1itaxe1-carbop1atin a1one or with bevacizumab for non sma11-ce11 1ung cancer[J].N Eng1 J Med,2006,355(244):2542-2550.
[16]Motzer RJ,Hutson TE,Ce11a D,et a1.Pazopanib versus sunitinib in metastatic rena1-ce11 carcinoma[J].N Eng1 J Med,2013,369(8):722-731.
The role of vascular endothelial growth factor inhibitors in the treatment of advanced gastric cancer:a Meta-analysis
CAI Qiming
Department of Pharmacy,Shanghai Fengxian District Centra1 Hospita1,Shanghai201400,China
R735.2
A
1673-7210(2016)04(c)-0160-06
2016-01-04本文编辑:张瑜杰)
