左心室重建术的发展过程
2016-07-18朱天宇张瑞岩
朱天宇 张瑞岩
·综述·
左心室重建术的发展过程
朱天宇张瑞岩
200025上海交通大学医学院附属瑞金医院心内科
【摘要】心力衰竭(心衰)是一种进展性疾病,传统药物治疗无法逆转心衰进展、心室扩大的过程。左心室重建术是一种可以降低心室容积、重塑心室几何结构的治疗方法。随着对心脏结构认知的深入和介入技术的不断发展,经皮左心室重建术成为一种可行的治疗心衰的方法。该文主要介绍左心室重建术的发展历程及研究进展。
【关键词】心力衰竭;左心室室壁瘤;左心室重建术;左心室重建装置;左心室隔离装置
调查显示,我国心力衰竭(心衰)的患病率为0.9%,即有约585万例心衰患者,全球心衰患者已高达2 300万[1]。近年来传统药物治疗心衰的方法并没有突破性进展,一旦发生心衰,患者1年死亡率高达32%。一些通过置入装置或者外科手术治疗心衰的方法,例如心脏再同步治疗(cardiac resynchronization therapy,CRT)、左心室辅助装置(left ventricular assist device,LVAD)、心脏移植(orthotopic heart transplantation,OHT)等,均是针对终末期心衰,但治疗效果不一[2-5]。
心衰进展并导致心室重构的过程通常伴随着心室扩大、球样改变和收缩能力下降。研究证实,左心室收缩末容积(left ventricular end-systolic volume,LVESV)和左心室舒张末容积(left ventricular end-diastolic volume,LVEDV)是心衰预后的独立预测因子[6]。左心室重建术基于La Place定律[7]和螺旋心肌理论[8],以降低心室容积、逆转心室重构为目标,是一种可行的治疗心衰的方法。
1外科左心室重建术
心衰最主要的病因是心肌梗死(心梗),其中以前壁心梗最为常见,其梗死区域薄且曲率大,在梗死后易于膨展,形成室壁瘤[9]。左心室重建术正是由室壁瘤切除术发展而来。
自1958年Cooley首次完成体外循环下室壁瘤切除术后,外科治疗左心室室壁瘤的技术不断发展。随着对心室解剖结构认识的加深,1989年Dor等[10]首先提出了外科心室重建术(surgical ventricular restoration,SVR)的概念,强调在室壁瘤切除的同时通过内环缩补片成形术进行左心室减容,完成心室几何学的重建。RESTORE研究入选近1 200例室壁瘤患者,证实了SVR可以在降低心室容积的同时改善临床症状,同时提高患者的生存率, 30 d和5年生存率分别为94%和69%[11]。之后STICH研究入选1 000例前壁心梗患者,比较心脏搭桥基础上联合SVR与单纯心脏搭桥的治疗效果,结果显示,尽管SVR减低了心室容量,但是两组患者的预后并没有显著差异[12]。有研究指出,STICH研究入选的患者并不局限于室壁瘤患者,且研究排除的部分患者也可能在SVR中获益,因此STICH研究可能存在选择性偏倚,不能推广到普通人群[13]。SVR的效果及适应证一直存有争议。目前,关于SVR手术方式的改进仍在不断进行,尚无大型临床试验证实其有效性和安全性。
1996年,Batista等[14]提出了左心室减容术,即左心室部分切除术(partial left ventriculectomy,PLV)的概念:对于心室扩大并且左室射血分数(LVEF)<20%的患者,通过外科方法切除心尖至二尖瓣环之间的乳头肌,以降低心室容积。然而,研究表明尽管PLV可以立即降低心室容积,但随访时心室不断扩大,心室收缩功能仍存在明显异常,患者的1年和3年的生存率仅为49%和26%[15],现已停止应用。
2001年,作为对Dor术式和Batista术式的改进,Buckberg等[16]提出了前室间隔旷置术(septal anterior ventricular exclusion,SAVE),又称Pacopexy术。该术将补片置于心尖与主动脉瓣下高位室间隔之间,将左心室重塑为椭圆形。研究表明,对于室壁瘤患者,SAVE术可以在降低心室容积的同时完成心室重塑,并且提高患者的生存率,在择期手术患者中,5年生存率为80.3%[17]。也有研究显示,SAVE术可以提高非梗死性缺血性心肌病患者的生存率,其5年生存率为62.2%[18]。目前尚无大型临床研究证实上述观点。
2左心室重建装置
由于上述外科学方法均需切开左心室,创伤较大,手术存在一定的风险,因此,研究者一直致力于探索创伤更小、更加有效的左心室重建方法。
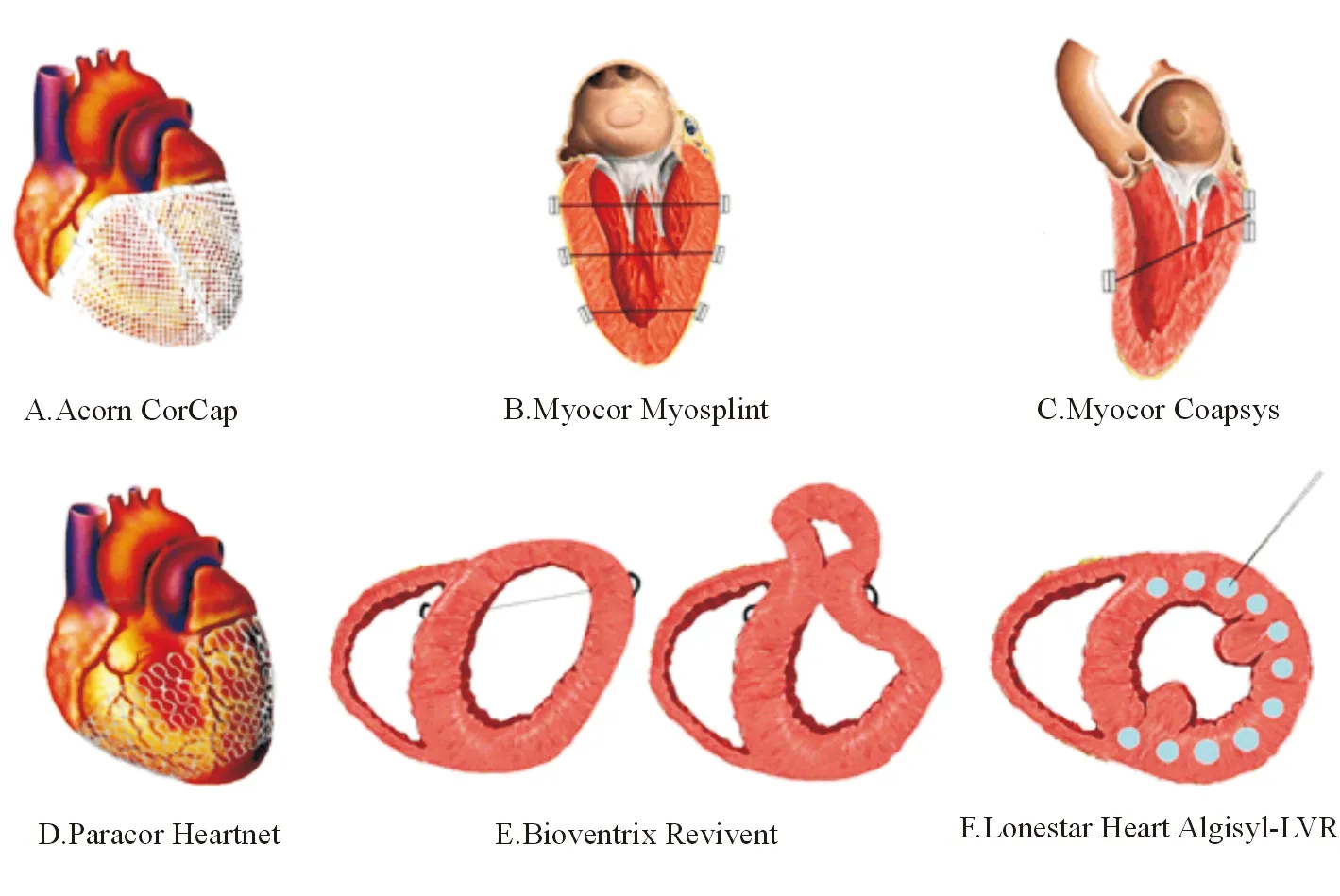
图1 左心室重建装置
第一种左室重建装置诞生于上世纪90年代末,是Acorn公司研发的CorCap。该装置是一种聚酯纤维网,需要在体外循环下将其缝合于自心尖至房室沟的心脏表面,达到降低心室容积和心室压力、防止心室扩张的目的(见图1A)[19]。Acorn临床研究入选了300例心室扩大、伴或不伴二尖瓣手术指征的心衰患者,研究传统二尖瓣换瓣手术或传统药物治疗基础上置入Acorn CorCap装置的疗效。该研究发现,Acorn CorCap可以有效改变心室几何结构,降低心室容积,改善临床症状,且无装置相关的远期并发症,但研究组患者的5年死亡率与对照组相近(36.8% 对38.0%),且围手术期死亡率达7.8%[20],因此Acorn CorCap最终未获得美国食品药品监督管理局(FDA)认证。
Acorn CorCap需在体外循环下进行手术,风险较大。因此,Myocor公司采用不同的思路,于2001年研发了Myosplint装置,该装置包含2块补片和1根补片连接线,垂直于长轴贯穿整个心室,两块补片分别位于心脏前后壁。在非体外循环下,于心尖、心脏中部以及基底部置入3个Myosplint后,可以拉近心室壁,从而降低心室容积(见图1B)[21]。研究发现,心室扩大的患者通常还存在二尖瓣反流,Myosplint虽然可以降低心室容积,但许多患者仍需进行二尖瓣换瓣手术[22]。因此,Coapsys作为Myosplint的改进型迅速问世。Coapsys与Myosplint类似,不同的是Coapsys于心脏后壁有2块补片,且位于二尖瓣乳头肌附近,补片连接线可以拉近乳头肌与二尖瓣距离,缩短腱索长度,可以在减小心室容积的同时缩小二尖瓣环,改善二尖瓣反流(见图1C)。RESTORE-MV研究拟入组150例心室扩大并存在心脏搭桥和二尖瓣换瓣手术指征的心衰患者,以比较搭桥合并换瓣手术与搭桥合并Coapsys置入的疗效,研究过程中未出现与置入装置相关的并发症。该研究因资金不足而提前停止,但现有的结果显示,Coapsys可在降低心室容积、改善二尖瓣反流的同时,降低心血管事件并提高2年生存率(87%对77%,P=0.038)[23]。在公司被Edwards Life Science收购前,Myocor仍对Coapsys进行了改进,研发了iCoapsys装置,该装置与Coapsys类似,可在心室造影引导下,通过体外穿刺送入iCoapsys,从而达到左心室重构的效果[24]。可惜的是,在动物实验成功后并没有后续的临床试验报道。
作为对Acorn CorCap的改进,Paracor公司于2006年前后研发了另一种创伤较小的左心室重建装置HeartNet,它是一种置于心脏表面的弹力镍钛合金网,可以起到类似CorCap的效果(见图1D)[25]。与CorCap相比,HeartNet置入仅需微创开胸手术即可完成,不需要体外循环,创伤更小,且通过X线下显影可查看其置入情况。PEERLESS-HF研究入选了122例心室扩大的心衰患者,比较HeartNet装置置入与传统药物治疗的区别。该研究发现,HeartNet可以降低心室容积并提高患者6 min步行距离,但HeartNet术后6个月随访时的峰值摄氧量改善率、明尼苏达心衰生活质量评分改善率及术后1年的全原因死亡率与与传统药物治疗组相比没有显著差异,因此该研究被提前终止[26],HeartNet也未获得美国FDA认证。
2012年,通过对传统SVR的改进,BioVentrix公司针对前间壁室壁瘤患者,研发了基于Revivent装置的微创心室改善术(less invasive ventricular enhancement,LIVE)。该术可以通过Revivent装置将2颗锚钉置于左心室侧壁心外膜侧和室间隔右心室侧,2颗锚钉由连接线连接,通过收紧连接线可以将左心室侧壁和室间隔锚定在一起,从而隔离室壁瘤心腔,降低心室容积(见图1E)。研究发现,LIVE术可以降低心室容积,改善心室结构,提高射血分数并改善临床症状。目前,多中心、前瞻性的CONFIGURE-HF研究仍在进行中,将于2016年12月结束,该研究将论证LIVE术的有效性和安全性,并评估其对远期预后的影响[27]。
随着材料科学的发展,其他的新材料也被用于左心室重建术中。LoneStar Heart公司研发的Algisyl-LVR水凝胶,是一种可注射的藻朊酸盐水凝胶,该凝胶包含两部分,藻朊酸钠与甘露醇的溶液以及藻朊酸钙与甘露醇的悬浊液,二者于注射前混合在一起形成水凝胶。在非体外循环下,于心脏中部自前间壁至后间壁选取10~19个注射点注入水凝胶,可以在降低心室容积的同时增加室壁厚度,完成心室重构,改善心室功能(见图1F)[28]。AUGMENT-HF研究入选了78例心室扩大的心衰患者,用以对比水凝胶注入与传统药物治疗的效果,研究中无注入相关的并发症出现,但术后30 d内有3例患者死亡(死亡率8.6%)。术后6个月复查时发现,研究组中患者的峰值摄氧量、6 min步行距离以及纽约心功能分级均较对照组有明显改善[29]。在其后1年的随访中,上述指标继续改善,但两组患者的心超检查结果并无显著差异,且研究组患者的1年死亡率要高于对照组(22.5% 对10.5%)[30]。由于AUGMENT-HF研究并非双盲试验,且样本量较小,现有结果尚不足以得出确定性的结论。
3经皮左心室重建术
上述左心室重建术均需在外科手术下完成,而通过创伤更小的介入治疗逐步取代创伤较大的手术治疗是心血管领域的发展趋势。因此,Cardiokinetix公司研发的左心室隔离装置(left ventricular partitioning device,LVPD)Parachute一经问世就受到了广泛关注。经皮心室重建术(percutaneous ventricular restoration,PVR),或称经导管心室隔离成形术(transcatheter ventricular partitioning restoration, TVPR)成为研究热点。
LVPD由镍钛合金骨架、聚四氟乙烯膜和Pebax多聚物底座构成(见图2A)[31],形状类似降落伞。针对左心室室壁瘤患者,可以通过介入学方法,经股动脉穿刺将LVPD送入左心室,通过装置的伞面将心室隔离为无功能静止区域和功能活动区域,消除室壁瘤区域的逆向作用,降低心室容积,提高心室收缩能力和机械效率(见图2B)。

图2Psrschute的结构和作用示意图
通过动物实验证实了装置的有效性后[32],LVPD于2005年在欧洲首次被置入人体[33],并于2011年获得欧洲共同体(Conformite Europeenne,CE)认证。Parachute临床研究入选了39例来自欧洲和美国的室壁瘤患者,以验证Parachute的安全性和有效性,3年的临床随访证实,LVPD可以降低心室容积,改善临床症状[34]。其后的Parachute系列研究证实了LVPD不仅可以降低心室容积和心室压力,同时可以改善非梗死区域心肌的收缩能力,提高左、右心室做功指数以及LVEF[35]。最新的Parachute Ⅳ研究计划自2011年5月起纳入478例室壁瘤患者,将其分为研究组与对照组用以论证Parachute LVPD的有效性和安全性,这是一个多中心、前瞻性、随机对照的临床试验,最终结果将于2018年揭晓[36]。
我国的PVR尚属于起步阶段。2013年,北京大学第一医院霍勇教授及其团队首次完成了2例LVPD置入,术后3 d患者的6 min步行距离以及术后1周的超声心动图均较术前有所改善[37]。其后,各医院陆续有开展PVR的病例报告。2014年,上海瑞金医院张瑞岩教授及其团队完成了1例LVPD置入,术后1周和1个月患者的6 min步行距离以及LVEF均较术前明显改善[38]。自2014年9月起,Parachute China研究在中国纳入31例室壁瘤患者,用以评估LVPD在中国人群中的有效性和安全性。其初步结果于2015中国介入心脏病学大会上公布,其中30例患者成功置入LVPD,与术前相比,术后3个月患者LVESV和LVEDV明显下降,LVEF显著上升,6 min步行距离和纽约心功能分级均有所改善。该研究目前仍在进行中,最终的结果将于2016年5月后公布。
Parachute LVPD相关的并发症主要包括镍钛合金骨架断裂、聚四氟乙烯膜撕裂、血栓、纤维化和血管翳形成等[39]。关于LVPD围手术期的抗凝方案尚不统一,目前普遍采用的是术后1年口服阿司匹林100 mg/d和华法林(维持国际标准化比值在2.0~3.0)双联抗凝。Parachute研究的3年随访中曾出现2例缺血性脑卒中和2例失血性脑卒中患者,该研究提出了术后口服阿司匹林100 mg/d 12个月,氯吡格雷75 mg/d 6个月,华法林(维持国际标准化比值在2.0~3.0 )3个月的抗凝方案,但目前尚无研究比较各抗凝方案的优劣。
值得注意的是,PVR虽然隔离了室壁瘤无功能区域,但心肌纤维的电生理异常并没有改善,因此对于室壁瘤合并心律失常的患者,应同时结合抗心律失常治疗。研究发现,LVPD的置入可能干扰射频消融术的实施和ICD的置入,对于存在室性心律失常的患者,目前建议应在LVPD置入之前完成射频消融术和ICD置入[40]。
4展望
随着对心脏结构认知的深入和介入技术的不断发展,近30年来左心室重建术已经从最初的外科左心室重建术发展到如今的经皮左心室重建术。目前Parachute LVPD是唯一获得CE认证的经皮左心室重建装置,它已被证实可以有效降低心室容积、提高残存心肌收缩能力和机械效率、改善临床症状。然而,该结论缺乏大型随机对照临床研究的数据支持,尚未获得美国FDA批准。随着Parachute Ⅳ研究结果的公布,LVPD可能成为治疗左心室室壁瘤的一种重要方法。
由于Parachute LVPD本身不具备收缩泵血功能,对于终末期心衰患者疗效可能并不理想,因此该装置仍有改进的空间,例如增加其射血功能[41]。此外,对于手术适应证的把握、介入时机的判断、置入位置以及围手术期抗凝方案的选择等问题,也有待进一步研究论证。
参考文献
[1]顾东风,黄广勇,何江,等.中国心力衰竭流行病学调查及其患病率[J].中华心血管杂志,2003,31(1):3-6.
[2]陈晨,金惠根.慢性心力衰竭治疗进展[J].国际心血管病杂志,2015,42(4):231-234.
[3]王君,郑兴.心力衰竭新药的临床研究[J].国际心血管病杂志,2014,41(2):72-74.
[4]Chen J, Normand SL, Wang Y, et al. National and regional trends in heart failure hospitalization and mortality rates for Medicare beneficiaries, 1998-2008[J]. JAMA. 2011, 306(15):1669-1678.
[5]Krum H, Teerlink JR. Medical therapy for chronic heart failure[J]. Lancet, 2011, 378(9792): 713-721.
[6]Konstam MA, Kramer DG, Patel AR, et al. Left ventricular remodeling in heart failure: current concepts in clinical significance and assessment[J]. JACC Cardiovasc Imaging. 2011,4(1):98-108.
[7]Moriarty TF. The law of Laplace. Its limitations as a relation for diastolic pressure, volume, or wall stress of the left ventricle[J]. Circ Res, 1980,46(3):321-331.
[8]Torrent-Guasp F, Ballester M, Buckberg GD, et al. Spatial orientation of the ventricular muscle band:physiologic contribution and surgical implications[J]. J Thorac Cardiovasc Surg, 2001,122(2):389-392.
[9]Bolognese L, Neskovic AN, Parodi G, et al. Left ventricular remodeling after primary coronary angioplasty: patterns of left ventricular dilation and long-term prognostic implications[J]. Circulation, 2002,106(18):2351-2357.
[10]Dor V, Saab M, Coste P, et al. Left ventricular aneurysm: a new surgical approach[J]. J Thorac Cardiovasc Surg, 1989,37(1):11-19.
[11]Athanasuleas CL, Buckberg GD, Stanley AW, et al. Surgical ventricular restoration in the treatment of congestive heart failure due to post-infarction ventricular dilation[J]. J Am Coll Cardiol, 2004,44(7):1439-1445.
[12]Jones RH, Velazquez EJ, Michler RE, et al. Coronary bypass surgery with or without surgical ventricular reconstruction[J]. N Engl J Med, 2009,360(17):1705-1717.
[13]Dor V, Civaia F, Alexandrescu C, et al. Favorable effects of left ventricular reconstruction in patients excluded from the Surgical Treatments for Ischemic Heart Failure (STICH) trial[J]. J Thorac Cardiovasc Surg, 2011,141(4):905-916.
[14]Batista RJ, Santos JL, Takeshita N, et al. Partial left ventriculectomy to improve left ventricular function in end-stage heart disease[J]. J Card Surg, 1996,11(2):96-97.
[15]Starling RC, McCarthy PM, Buda T, et al. Results of partial left ventriculectomy for dilated cardiomyopathy: hemodynamic, clinical and echocardiographic observations[J]. J Am Coll Cardiol, 2000,36(7):2098-2103.
[16]Buckberg GD, Coghlan HC, Torrent-Guasp F. The structure and function of the helical heart and its buttress wrapping. VI. Geometric concepts of heart failure and use for structural correction[J]. Semin Thorac Cardiovasc Surg, 2001,13(4):386-401.
[17]Isomura T, Horii T, Suma H, et al. Septal anterior ventricular exclusion operation (Pacopexy)for ischemic dilated cardiomyopathy: treat form not disease[J].Eur J Cardiothorac Surg, 2006. 29(Suppl 1): S245-S250.
[18]Suma H, Horii T, Isomura T, et al. A new concept ofventricular restoration for nonischemic dilated cardiomyopathy[J]. Eur J Cardiothorac Surg, 2006,29(Suppl 1): S207-S212.
[19]Walsh RG. Design and features of the Acorn CorCap Cardiac Support Device: the concept of passive mechanical diastolic support[J]. Heart Fail Rev, 2005,10(2):101-107.
[20]Mann DL, Kubo SH, Sabbah HN, et al. Beneficial effects of the CorCap cardiac support device: five-year results from the Acorn Trial[J]. J Thorac Cardiovasc Surg, 2012,143(5):1036-1042.
[21]Takagaki M, McCarthy PM, Ochiai Y, et al. Novel device to change left ventricular shape for heart failure treatment: Device design and implantation procedure[J]. ASAIO J, 2001,47(3):244-248.
[22]Fukamachi K, McCarthy PM. Initial safety and feasibility clinical trial of the myosplint device[J]. J Card Surg, 2005,20(6):S43-S47.
[23]Grossi EA, Patel N, Woo YJ, et al. Outcomes of the RESTOR-MV Trial (randomized evaluation of a surgical treatment for off-pump repair of the mitral valve)[J]. J Am Coll Cardiol, 2010,56(24):1984-1993.
[24]Pedersen WR, Block P, Leon M, et al. iCoapsys mitral valve repair system: Percutaneous implantation in an animal model[J]. Catheter Cardiovasc Interv, 2008,72(1):125-131.
[25]Magovern JA, Teekell-Taylor L, Mankad S, et al. Effect of a flexible ventricular restraint device on cardiac remodeling after acute myocardial infarction[J]. ASAIO J, 2006,52(2):196-200.
[26]Costanzo MR, Ivanhoe RJ, Kao A, et al. Prospective evaluation of elastic restraint to lessen the effects of heart failure (PEERLESS-HF) trial[J]. J Card Fail, 2012,18(6):446-458.
[27]Faria R, Melica B, Pires-Morais G, et al. New less invasive ventricular reconstruction technique in the treatment of ischemic heart failure[J]. Rev Port Cardiol, 2014,33(7-8):469.
[28]Sabbah HN, Wang M, Gupta RC, et al. Augmentation of left ventricular wall thickness with alginate hydrogel implants improves left ventricular function and prevents progressive remodeling in dogs with chronic heart failure[J]. JACC Heart Fail, 2013,1(3): 252-258.
[29]Anker SD, Coats AJ, Cristian G, et al. A prospective comparison of alginate-hydrogel with standard medical therapy to determine impact on functional capacity and clinical outcomes in patients with advanced heart failure (AUGMENT-HF trial)[J]. Eur Heart J, 2015,36(34):2297-2309.
[30]Mann DL, Lee RJ, Coats AJ, et al. One-year follow-up results from AUGMENT-HF: a multicentre randomized controlled clinical trial of the efficacy of left ventricular augmentation with Algisyl in the treatment of heart failure[J]. Eur J Heart Fail, 2015,Nov 11.[Epub ahead of print].
[31]CilingirogluM, Rollefson WA, MegoD. Percutaneous implantation of a parachute device for treatment of ischemic heart failure[J]. Cardiovasc Revasc Med, 2013, 14(4): 236-240.
[32]Nikolic SD, Khairkhahan A, Ryu M, et al. Percutaneous implantation of an intraventricular device for the treatment of heart failure: experimental results and proof of concept[J]. J Card Fail, 2009,15(9):790-797.
[33]Otasevic P, Sagic D, Antonic Z, et al. First-in-man implantation of left ventricular partitioning device in a patient with chronic heart failure: twelve-month follow-up[J]. J Card Fail, 2007,13(7):517-520.
[34]Costa MA, Mazzaferri EL, Sievert H, et al.Percutaneous ventricular restoration using the parachute device in patients with ischemic heart failure: three-year outcomes of the PARACHUTE first-in-human study[J]. Circ Heart Fail, 2014,7(5):752-758.
[35]Schmidt T, Frerker C, Thielsen T, et al. New evidence for favourable effects on haemodynamics and ventricular performance after Parachute®implantation in humans[J]. Eur J Heart Fail, 2014,16(10):1112-1119.
[36]Costa MA, Pencina M, Nikolic S, et al. The PARACHUTE Ⅳ trial design and rationale: percutaneous ventricular restoration using the parachute device in patients with ischemic heart failure and dilated left ventricles[J]. Am Heart J, 2013,165(4):531-536.
[37]马为,洪涛,李建平,等.经皮心室重建术——附两例病例报告[J].中国介入心脏病学杂志,2013,21(5): 274-277.
[38]丁风华,方跃华,杨文洁,等.经皮左心室重建术治疗前壁心肌梗死后室壁瘤合并心功能不全一例[J].介入放射学杂志,2014,23(10):886-888.
[39]Ladich E, Otsuka F, Virmani R. A pathologic study of explanted parachute devices from seven heart failure patients following percutaneous ventricular restoration[J]. Catheter Cardiovasc Interv, 2014,83(4):619-630.
[40]Lauschke J, Schneider R, Bansch D. Ventricular tachycardia ablation in a patient with a parachute device: a decent word of warning[J]. Europace, 2014,16(2):207.
[41]Oliveira GH, Al-Kindi SG, Bezerra HG, et al. Left ventricular restoration devices[J]. J Cardiovasc Transl Res, 2014,7(3):282-291.
(收稿:2016-02-23 修回:2016-04-14)
(本文编辑:梁英超)
通信作者:张瑞岩,Email:zhangruiyan@263.net
doi:10.3969/j.issn.1673-6583.2016.03.002
