HPLC测定人工蛹虫草中6种核苷类成分的含量
2016-07-18牛聪聪王身艳刘畅潘苏华
牛聪聪,王身艳,刘畅,潘苏华
(南京中医药大学 药学院,南京 江苏 210023)
HPLC测定人工蛹虫草中6种核苷类成分的含量
牛聪聪,王身艳,刘畅,潘苏华Δ
(南京中医药大学 药学院,南京 江苏 210023)
目的 建立人工蛹虫草中核苷类成分的HPLC测定方法,为产品质量标准提供参考。方法 用高效液相色谱法测定人工蛹虫草中的有效成分,选用Waters XBridgeTMC18柱色谱柱(250×4.6 nm,5 μm);流动相为甲醇-0.2%磷酸二氢钾溶液梯度洗脱,流速为1.0 mL/min,检测波长为260 nm,柱温为30 ℃。结果 虫草素、腺苷、鸟苷、尿苷、胸苷、胞苷分别在0.025~0.5 mg/mL,0.01~0.2 mg/mL,0.01~0.2 mg/mL,0.01~0.2 mg/mL,0.01~0.2 mg/mL,线性关系良好,平均回收率虫草素为99.34%,胞苷为99.04%,尿苷为99.09%,鸟苷为98.75%,胸苷为102.38%,腺苷为99.27%。结论 该测定方法简便易行、准确性好、灵敏度高、重复性好,可用于人工蛹虫草中核苷类成分的质量控制。
人工蛹虫草;核苷类成分;HPLC;含量测定
蛹虫草(cordyceps militaris)又名北冬虫夏草,是冬虫夏草的替代品。研究资料表明人工蛹虫草子中含有虫草素、核苷类、甾醇类、虫草酸、虫草多糖、超氧化物歧化酶等[1-3],其中虫草素等核苷类化合物,为蛹虫草的主要活性成分之一。蛹虫草是具有良好药用价值的真菌,其有效成分众多,有抗疲劳[4]、抗菌[5]、降血糖[6]、抗肿瘤[7]、增强免疫力[8]等药理作用。随着蛹虫草的生产工艺的日益成熟,它的食用开发价值也有很多研究者正在研究, 现已广泛应用于药品和保健品中。蛹虫草作为食用方面的安全问题也需思考。本文拟采用高效液相色谱方法检测人工蛹虫草中核苷类成分含量,旨在为蛹虫草的质量评价提供科学依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂:虫草素标准品(SIGMA,批号:Lot#06M4030V);腺苷标准品(成都瑞芬思生物科技有限公司,批号:Y-022-140108);鸟苷标准品(成都瑞芬思生物科技有限公司,批号:N-021-130821);尿苷标准品(成都瑞芬思生物科技有限公司,批号:N-025-131128);胸苷标准品(南京泰普瑞仪器设备有限公司,批号:27189);胞苷标准品(南京泽郎医药科技有限公司);甲醇为色谱纯;重蒸水(娃哈哈饮用纯净水);磷酸二氢钾(AR南京化学试剂有限公司,批号:080760460)。
人工蛹虫草样品批号(蛹虫草子实体,批号分别为20140412A(东台),20140412B(岗州春),20140412C(新会海山堂),20140412D(沈阳),20140111A、20140214A、20140214B、20140218A、20140218B(无锡山禾)。
1.1.2 仪器:Waters e2695高效液相色谱仪,(二元泵,柱温箱, Photodiode Array Detector:Waters 2998;美国Waters公司);AG285 电子天平(0.01 mg,METTLER,SWITERLAND);KQ-250DB 型数显超声波清洗器( 昆山市超声仪器有限公司) ; 电热恒温水浴锅( 上海浦东荣丰科学仪器有限公司) ;AIIEGRAX-30R高速冷冻离心机(美国Beckman 公司)。
1.2 方法
1.2.1 色谱条件:色谱柱:Waters XBridgeTMC18(4.6×250 mm,5 μm,Waters);流动相:A:甲醇B:0.2%KH2PO4缓冲液,梯度洗脱:0 min~10 min(1%~ 1% A)、10 min~30 min (1%~5%A)、30 min~50 min(5% ~40% A),流速为1 mL/min;检测波长为260 nm;柱温为30 ℃;进样量为10 μL。
1.2.2 对照品溶液的制备:精密称取对照品虫草素5 mg,腺苷,鸟苷,尿苷,胸苷,胞苷各2 mg置10 mL的容量瓶中,加入20%甲醇溶解并定容至刻度,摇匀,得虫草素0.5 mg/mL,腺苷、鸟苷、尿苷、胞苷、胸苷质量浓度均为0.2 mg/mL,作为标准储备液。
1.2.3 供试品溶液的制备:取人工蛹虫草药材粗粉约1 g,精密称定,置已干燥至恒重的具塞锥形瓶中,加入20%的甲醇30 mL超声提取20 min,取出,用20%甲醇补足减失重量,摇匀,滤过冷却至室温,离心,取上清液0.45 μm微孔滤膜滤过,弃去初滤液,取续滤液,即得。
精密吸取“1.2”项下供试品溶液、对照品溶液各10 μL,按“1.2.1”项下的色谱条件进行测定。
1.2.4 线性关系考察:分别精密吸取1.2.2项下的虫草素,胞苷,尿苷,鸟苷,胸苷,腺苷标准储备液0.25、0.5、1、2.5、5.0 mL于10 mL量瓶中,加20%甲醇稀释至刻度,摇匀,各对照品溶液分别进样10 μL,记录峰面积。以峰面积为纵坐标,质量浓度为横坐标,进线性回归。
1.2.5 精密度试验:取1.2.2项下的标准储备液,按1.2.1的色谱条件连续进样6次,测定虫草素、胞苷、尿苷、鸟苷、胸苷、腺苷苷峰面积,并计算各色谱峰的相对标准偏差(RSD)。
1.2.6 稳定性试验:取同一批次人工蛹虫草粉末(批号:20140218),分别于制备后的0、2、4、8、12、24 h时进样,测定虫草素、胞苷、尿苷、鸟苷、胸苷、腺苷苷峰面积的峰面积,计算RSD。
1.2.7 重复性试验:取同一批次人工蛹虫草粉末(批号:20140218),精密称取1 g,平行5份,按1.2.3方法分别制备供试品溶液依法制备,测定虫草素、胞苷、尿苷、鸟苷、胸苷、腺苷峰面积的质量分数,计算RSD。
1.2.8 加样回收试验:精密称取蛹虫草粉末(批号:20140218)内容物精密称取1 g,共6份,加入胞苷对照品0.3995 mg、尿苷对照品2.0118 mg、鸟苷对照品0.2860 mg、胸苷对照品0.0344 mg、腺苷对照品1.1512 mg、虫草素对照品4.7656 mg,按1.2.3项下方法制备供试品溶液,按1.2.1色谱条件测定峰面积,计算回收率
1.2.9 样品测定:对所收集到的不同批号供试品,按1.2.3 方法分别制备成相应的供试品溶液,精密吸取上述供试品溶液和对照品溶液各10 μL 分别注入高效液相色谱仪,依法测定,计算各批号供试品中虫草素、胞苷、尿苷、鸟苷、胸苷、腺苷等成分的含量。
2 结果
2.1 系统性适应性试验 供试品色谱中,在与胞苷、尿苷、鸟苷、胸苷、腺苷、虫草素对照品色谱峰相同的位置上,显示相同保留时间的色谱峰,供试品色谱中目标色谱峰的分离度均不低于1.5,说明方法的系统适应性良好。见图1。

图1 各溶液HPLC图谱1:胞苷;2:尿苷;3:鸟苷;4:胸苷;5:腺苷;6:虫草素 A:混合对照品溶液;B:人工蛹虫草供试品Fig.1 HPLC Chromatograms ofeach solution 1:cytidine; 2: uridine; 3: vernine; 4: thymidine; 5: adenosine; 6: cordycepinA: The reference solution; B: Thecultured cordycepsmilitaris
2.2 线性关系考察 胞苷,尿苷,鸟苷,胸苷,腺苷、虫草素的回归方程分别为Y=1.74×107X+13400,r=0.9999;Y=2.44×107X+13800,r=0.9999;:Y=2.45×107X+32200,r=0.999885;Y=2.0×107X+27100,r=0.9997;Y=3.65×107X+14400,r=0.9999;Y=2.06×107X-42700,r=0.9999。结果表明虫草素在0.025~0.5 mg/mL,胞苷在0.01~0.2 mg/mL,尿苷在0.01~0.2 mg/mL,鸟苷在0.01~0.2 mg/mL,胸苷在0.01~0.2 mg/mL,腺苷0.01~0.2 mg/mL,与峰面积线性关系良好。
2.2 精密度试验测定 虫草素、腺苷、鸟苷、尿苷、胸苷、胞苷峰面积的RSD 分别为1.26%、1.3%、0.53%、0.56%、1.39%、0.54%,表明仪器的精密度良好。
2.3 稳定性试验 供试品溶液中胞苷、尿苷、鸟苷、胸苷、腺苷、虫草素色谱峰面积RSD分别为3.46%、0.99%、0.37%、3.49%、2.13%、1.68%,证明供试品溶液中的核苷类成分在制备后24h内稳定。
2.4 重复性试验 测定人工蛹虫草粉末中虫草素、腺苷、鸟苷、尿苷、胸苷、胞苷的平均含量分别为4.68 mg/g、1.50 mg/g、0.83 mg/g、2.08 mg/g、0.23 mg/g、0.35 mg/g,RSD分别为1.57%、1.07%、1.69%、1.64%、1.53%、1.75%,表明该方法重复性良好。
2.5 加样回收试验 其中,胞苷的平均回收率为99.04%,RSD值为2.88%;尿苷的平均回收率为99.09%,RSD值为2.40%;鸟苷的平均回收率为98.75%,RSD值为1.49%;胸苷的平均回收率为102.38%,RSD值为3.26%;腺苷的平均回收率为99.27%,RSD值为1.16%;虫草素的平均回收率为99.34%,RSD值为1.03%,表明该方法的准确度良好。加样回收率数据见表1~6。

表1 胞苷回收率考察

表2 尿苷回收率考察
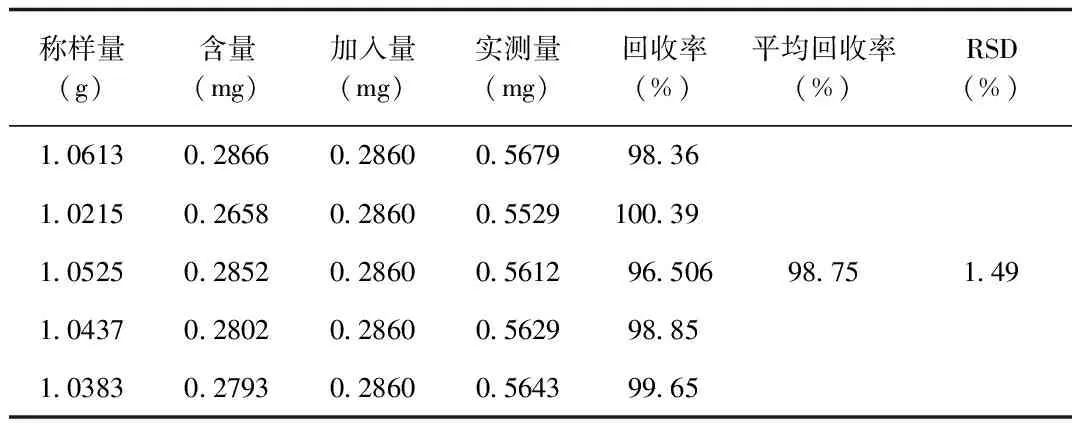
表3 鸟苷回收率考察

表4 胸苷回收率考察

表5 腺苷回收率考察
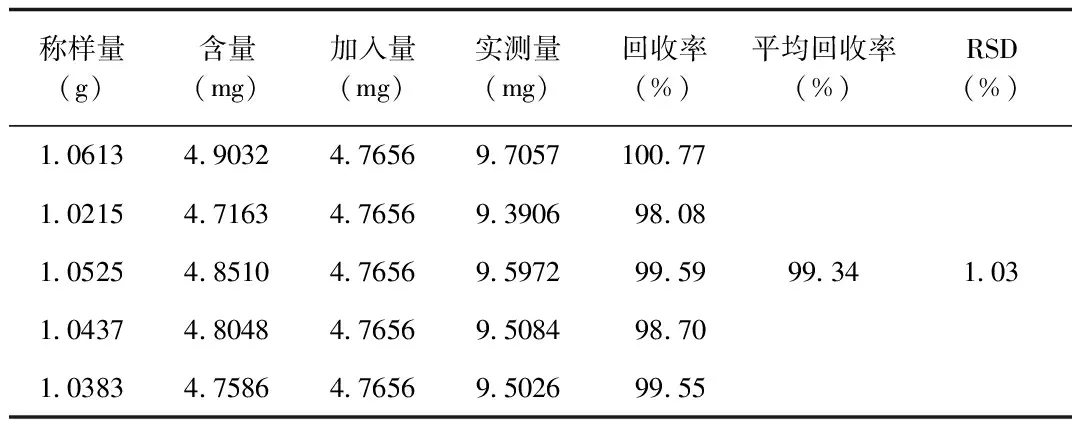
表6 虫草素回收率考察
2.7 样品测定取 8批蛹虫草粉末(批号分别为20140412A,20140412B,20140412C,20140412D,20140111A,20140214A,20140214B,20140218A,20140218B)中胞苷、尿苷、鸟苷、胸苷、腺苷、虫草素的含量。见表7。
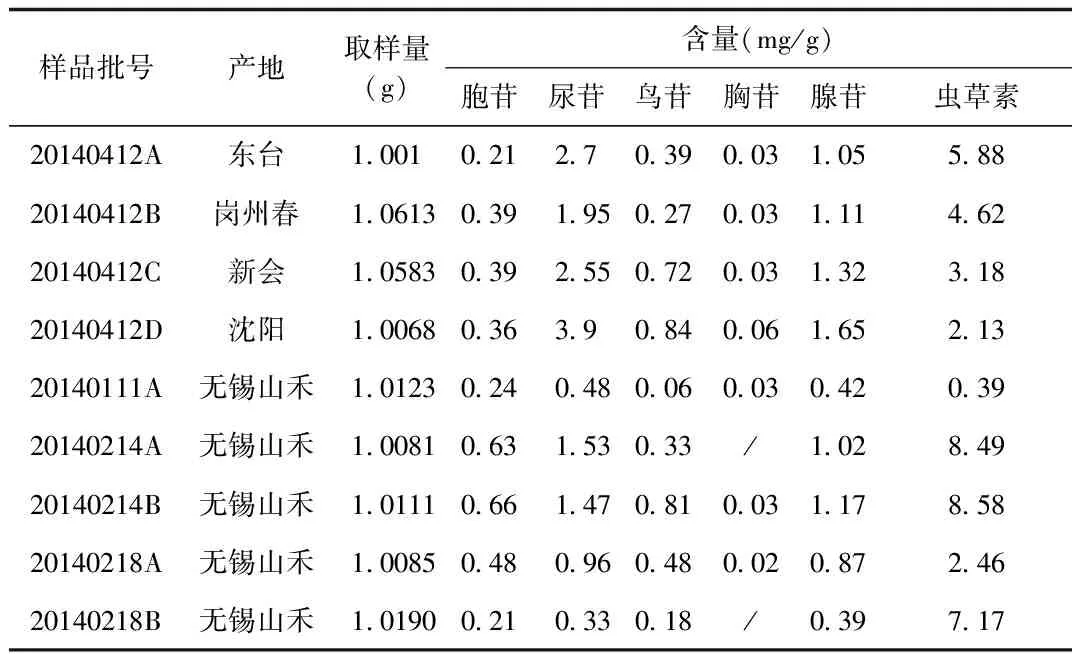
表7 不同批次蛹虫草中核苷类成分的含量测定结果
3 讨论
制备样品供试液过程中,由于蛹虫草中的核苷类成分,极性很大,本研究参考了文献[9-11],对提取溶剂和超声时间进行了考察,发现20%甲醇、50%甲醇、80%甲醇提取的核苷类成分得率差别不大,采用20%甲醇提取效率稍高于其他比例的甲醇;20%甲醇提取的色谱峰较多,峰形较好,且分离度较好,超声20 min和40 min所得的核苷类成分的得率没有差别,所以采用超声20min提取。流动相经多次摸索,为甲醇~0.2%磷酸二氢钾溶液梯度洗脱,此时核苷类成分与杂质峰已能完全分离。
从表7中,可以看出人工蛹虫草产地不同,所含的核苷类成分含量不同,分析其原因可能是不同厂家所选用的菌种不同和蛹虫草培育工艺不同造成核苷类成分含量差异。目前市场上蛹虫草的需求日益增加,因此急需制定统一可靠的评价标准,从宏观上控制蛹虫草的质量和规范化生产。
本研究建立了HPLC测定人工蛹虫草中6种核苷酸成分含量,并且针对所测样品中含有的6种成分进行了定量分析,并做了方法学考察。结果表明,该测定方法简便易行、准确性好、灵敏度高、重复性好、操作可行,可被用于测定蛹虫草中核苷类物质的质量控制方法。
[1] 樊慧婷,林洪生.蛹虫草化学成分及药理作用研究进展[J].中国中药杂志,2013,38(15):2549-2551.
[2]曾宏彬,宋斌,李泰辉. 蛹虫草研究进展及其产业化前景[J].食用菌学报,2011,18(2):70-74.
[3]王奇.蛹虫草功效成分研究进展[J].辽宁师专学报,2011,13(3):102-106.
[4]江海涛,任源浩,吴雨龙,等.蛹虫草多糖对小鼠抗疲劳作用的研究[J].食用菌学报,2014,21(3):55-59.
[5]高燕燕, 周礼红, 潘肇仪,等.蛹虫草抗菌活性物质的初步研究[J].广东农业科学,2013(11):183-185.
[6]徐雷雷, 王静凤, 唐筱,等.蛹虫草降血糖作用及其机制研究[J].中国药理学通报,2011,27(9):1331-1332.
[7]尹导群,陈丽,张松.蛹虫草抗肿瘤活性物质研究[J].中药材,2010,33(7):1189-1191.
[8]谈唯,宋捷,张润桐.复方蛹虫草制剂对大鼠运动性疲劳和免疫力的影响[J].中国民族民间医药,2011(20):24-27.
[9]苏颖,李竞. 人工蛹虫草指纹图谱的建立[J].亚太传统医药,2012,8(3):10-11.
[10]杨昕,王瑞华,涂秩平,等. 高效液相色谱法同时测定人工蛹虫草子实体中核苷类成分的含量[J].中国医院药学杂志,2007,27(8):1097-1099.
[11]裴轶琨. 超声波提取HPLC-UV法测定人工蛹虫草中8种核苷类物质[J].中国酿造,2012,31(11):163-166.
(编校:谭玲)
Determination of the nucleosides in cultured Cordyceps militarisby HPLC
NIU Cong-cong, WANG Shen-yan, LIU Chang, PAN Su-huaΔ
(College of Pharmacy, Nanjing University of Traditional Chinese Medicine, Jiangsu 210023, China)
ObjectiveTo determine the content of nucleoside in cultured Cordyceps militaris.MethodsThe HPLC method was established for the determination of the content of nucleosides in cultured Cordyceps militaris, The HPLC was performed on WatersXBridgeTMC18(250 mm×4.6 mm,5 μm) column, mobile phaseconsisted methanol-0.2% monopotassium phosphate gradient elute. column temperature 30 ℃,and flow rate was 1.0 mL/min. The detection wavelength was 260 nm.ResultsA good linearity was obtained in the range of 0.025-0.5 mg/mL of cordycepin,0.01-0.2 mg/mL of cytidine, 0.01-0.2 mg/mL of uridine, 0.01-0.2 mg/mL of vernine, 0.01-0.2 mg/mL of thymidine and 0.01-0.2 mg/mL of adenosine.The average recovery rates of cordycepin, cytidine, uridine, vernine, thymidine ,and adenosine were 99.34%, 99.04%, 99.09%, 98.75%, 102.38% and 99.27%,respectively.ConclusionThe established method is simple,accurate and sensitive,and suitable for quality control of cultured Cordyceps militaris.
cultured Cordyceps militaris; nucleosides; HPLC; determination
江苏高校优势学科建设工程资助项目(PAPD)
牛聪聪,女,硕士,研究方向: 消化药理,E-mail:niuconga@162.com; 潘苏华,通信作者,女,博士,教授,研究方向:消化道药理, E-mail: 13851664089@163.com。
S567.35
A
10.3969/j.issn.1005-1678.2016.03.56
