Cd(Ⅱ)、Cu(Ⅱ)胁迫对双齿围沙蚕热休克蛋白70(HSP70)基因表达的影响
2016-07-15李婉娟杨大佐周一兵
赵 欢,李婉娟,万 良,杨大佐,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
Cd(Ⅱ)、Cu(Ⅱ)胁迫对双齿围沙蚕热休克蛋白70(HSP70)基因表达的影响
赵欢,李婉娟,万良,杨大佐,周一兵
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
摘要:为研究重金属浓度的变化对双齿围沙蚕Perinereisaibuhitensis热休克蛋白70(heat shock proteins 70,HSP70)基因的表达变化,采用实时荧光定量PCR方法,分析了重金属Cu(Ⅱ)、Cd(Ⅱ)单一诱导及联合作用下双齿围沙蚕HSP70基因的表达规律。结果表明:Cu(Ⅱ)单独作用时,沙蚕HSP70 mRNA表达量随时间的增加而增大,在诱导的第3天时不同浓度组沙蚕HSP70 mRNA表达量依次为22.86μg/L浓度组>44.50μg/L浓度组>4.45μg/L浓度组,而在诱导的第7天和第14天时HSP70 mRNA表达量与Cu(Ⅱ)浓度呈正相关;Cd(Ⅱ)单独作用时,沙蚕HSP70 mRNA表达量则随Cd(Ⅱ)浓度和诱导时间的增加而增大,但较Cu(Ⅱ)单独作用下变化趋势平缓;Cu(Ⅱ)和Cd(Ⅱ)联合作用下,沙蚕HSP70 mRNA表达量亦与暴露浓度和时间呈正相关,在诱导的第3天和第7天时45.70μg/L Cu(Ⅱ)+10μg/L Cd(Ⅱ)浓度组HSP70 mRNA表达量高于Cu(Ⅱ)和Cd(Ⅱ)单一作用,表明Cu(Ⅱ)和Cd(Ⅱ)存在一定的协同作用。
关键词:双齿围沙蚕;热休克蛋白70(HSP70);铜离子;镉离子;联合毒性
热休克蛋白70(HSP70)是热休克蛋白 (heat shock proteins,HSPs)家族中最保守、最受关注的一类,HSP70蛋白具有保护细胞的作用,在高温、缺氧、DNA损伤、环境毒物作用等应激条件下,可以维持细胞蛋白质空间构象的稳定,抵抗由环境胁迫引起的损伤,提高细胞对外界刺激的耐受性。当重金属污染胁迫发生时,机体内HSP70基因的变化可以快速地被检测出来,同时,此变化在重金属浓度接近于环境背景值甚至更低的水平下均能发生,使得HSP70基因成为很有潜力的环境污染监测指标。大量研究表明,生物体内HSP70基因的变化可以用于标记生物细胞受胁迫的情况。Rajeshkumar等[1]研究发现,重金属污染下遮目鱼Chanos chanos的鳃和肝脏中HSP70基因均会有显著表达。沈骅等[2-3]研究发现,重金属 Pb、Cd、Zn污染可以显著诱导鲫Carassius auratus应激蛋白HSP70基因的表达。Mic'ovic'等[4]检测到Cd在24 h内可以显著诱导紫贻贝Mytilusedulis消化腺中HSP基因表达,且与 Cd浓度呈线性关系。Radlowska等[5]认为,低浓度重金属污染可诱导贻贝体内HSP70基因的轻微变化,而高浓度重金属污染可导致HSP70基因高水平表达,且重金属联合作用时对HSP70基因的诱导表达更为显著。
多毛类沙蚕作为海洋底栖动物的优势种类,具有特殊的生态和生物属性:一方面,沙蚕为重要的饵料生物,处于海洋生态系统能量流动与物质循环中的关键环节[6-7];另一方面,沙蚕对重金属、合成有机物、石油烃等持久性污染物具有较强的耐受和超富集作用[8-14]。富集在沙蚕体内的污染物不一定会对沙蚕造成严重伤害,但却可能通过食物链对海洋顶级消费者产生重要影响,因此,沙蚕既可以作为海洋沉积质环境污染早期生态风险预测和评价的指示物,又可以成为近岸污染沉积质生境修复的关键种类。本试验中,以在中国广泛分布的双齿围沙蚕Perinereisaibuhitensis为研究对象,研究了在重金属Cu(Ⅱ)、Cd(Ⅱ)单一及联合作用下双齿围沙蚕HSP70 mRNA基因的表达变化规律,旨在揭示重金属浓度的变化与双齿围沙蚕HSP70基因表达量之间的相关性,旨在为利用双齿围沙蚕HSP70基因作为环境监测指标提供数据参考。
1 材料与方法
1.1 材料
试验用双齿围沙蚕采自辽宁省盘锦双台子河口潮滩沉积质,挑选体质量为1.5~2.0 g的个体,采集后将双齿围沙蚕置于加冰泡沫保温箱中,运回至辽宁省海洋生物资源恢复与生境修复重点实验室,于18℃海水中暂养一周,每24 h更换一次海水。
1.2 方法
1.2.1 毒性诱导试验 参考预试验中获得的Cu(Ⅱ)对双齿围沙蚕96 h LC50半致死浓度以及国家水质标准 (GB30971997)Ⅲ类水质Cd(Ⅱ)的浓度,依据周永欣等[15]的方法,选取0.01、0.05、0.10三个系数,设置Cu(Ⅱ)、Cd(Ⅱ)单一作用浓度,联合诱导试验组浓度根据毒性相加原则设置,即Cu(Ⅱ)浓度设为4.57、22.86、45.70μg/L,Cd(Ⅱ)浓度设为 1、5、10μg/L,Cu(Ⅱ)+ Cd(Ⅱ)浓度设为45.70μg/L Cu(Ⅱ)+1μg/L Cd(Ⅱ)、22.86μg/L Cu(Ⅱ)+5μg/L Cd(Ⅱ)、45.70μg/L Cu(Ⅱ)+10μg/L Cd(Ⅱ),每种毒物试验均设一个空白对照组,每组设置3个重复。试验在2 L塑料烧杯中进行,试验开始时,先加入不同重金属浓度的溶液,然后在每个烧杯中放入5尾完整、健康、活性良好的沙蚕个体。试验期间不投饵,每24 h更换一次溶液,试验海水温度控制在(18±0.5)℃。分别于第3、7和14天[16]时,从各浓度组中随机选取3尾沙蚕放入超低温冰箱 (-80℃)中,用于后续基因表达检测。
1.2.2 总RNA提取、反转录和引物设计 取双齿围沙蚕体壁肌肉0.1 g,液氮下研磨至粉末状,按照Trizol说明书 (购自 Invitrogen公司)提取总RNA,使用 Recombinant DNaseⅠ试剂盒 (购自TaKaRa公司)对总RNA进行纯化,将纯化后的RNA稀释至500 ng/μL,按照SYBR©PrimeScript©RT-PCR KitⅡ说明书 (购自TaKaRa公司)进行cDNA第一条链的合成。反应完成后将得到的cDNA于冰箱 (-20℃)中保存备用。
将空白对照组与各处理组总RNA浓度进行标准化,再对β-actin基因运用RT-PCR方法检测,结果表明,处理组β-actin mRNA表达未受影响,故本研究中可采用β-actin作为内参基因。根据本实验室已获得的双齿围沙蚕HSP70 cDNA序列[17](GenBank登录号:HQ449186)及β-actin内参[16]基因序列设计引物,引物序列详见表1。
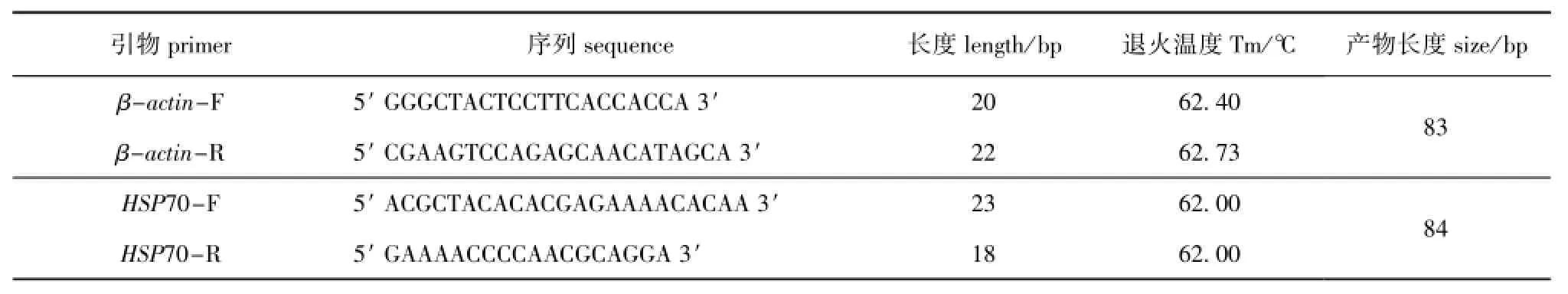
表1 试验所用引物序列Tab.1 Primers used in this experim ent
1.2.3 实时荧光定量 PCR 以对照组总 RNA (500 ng)反转录获得的cDNA作为标准品,按5倍梯度稀释 (50、10、2、0.4、0.08 ng)作为模板,分别进行内参基因β-actin和目的基因HSP70标准曲线的绘制,在确定目的基因与内参基因扩增效率相同的情况下进行 Real-Time PCR。采用SYBR©PrimeScript©RT-PCR KitⅡ在ABIStepOne荧光定量PCR仪上进行扩增。Real-Time PCR反应体系 (共20μL):SYBR©Premix Ex TaqTMⅡ 10 μL,PCR Forward Primer 0.8μL,PCR Reverse Primer 0.8μL,ROX Reference Dye 0.4μL,cDNA 2μL,ddH2O 6μL。Real-Time PCR反应条件:95℃下预变性5min;95℃下变性30 s,95℃下退火5 s,60℃下延伸30 s,共进行40个循环。每个样品进行3次重复,扩增结束后进行熔解曲线分析,取部分扩增产物进行琼脂糖凝胶电泳、测序以进行验证。
1.3 数据处理
使用2-△△CT法进行重金属胁迫下双齿围沙蚕HSP70基因相对表达量的分析。应用SPSS 13.0软件对各样品HSP70基因相对表达量进行分析,采用多重比较法进行各组间的差异显著性检验,显著性水平设为0.05,极显著性水平设为0.01。
2 结果与分析
2.1 内参基因和目的基因标准曲线的建立
对β-actin和HSP70基因的熔解曲线进行分析发现,两者熔解曲线均呈现单一峰。取部分扩增产物进行琼脂糖凝胶电泳、测序发现,无引物二聚体及非特异性扩增出现,证明两个基因扩增的特异性和准确性良好。通过反应液内模板数与每个反应管内荧光信号达到设定域值时所经历的循环数 (CT)分别建立β-actin和HSP70的标准曲线。可以得出β-actin的曲线方程为Y=21.173-3.3 lg X,相关系数R=0.997,HSP70的曲线方程为 Y=23.154-3.223 lg X,相关系数R=1.000,这表明两个标准曲线均显示出良好的线性关系,可以在宽广的范围内进行准确定量。
2.2 不同浓度Cu(Ⅱ)胁迫下沙蚕HSP70基因表达随时间的变化
如图1所示,不同浓度Cu(Ⅱ)浓度组均能显著诱导双齿围沙蚕HSP70基因的表达,并且随着诱导时间的延长,各浓度组沙蚕HSP70基因表达量也不断升高。暴露第3天时,各浓度组HSP70 mRNA表达量分别为对照组的3.69、5.37和3.72倍,其中仅22.86μg/L Cu(Ⅱ)浓度组沙蚕HSP70 mRNA表达量显著高于对照组 (P<0.05);暴露第7天时,各浓度组沙蚕HSP70 mRNA表达量较第3天均有所升高,而对照组基本无变化,各浓度组HSP70 mRNA表达量均显著高于对照组 (P<0.05),分别为对照组的4.38、6.80和6.56倍;暴露第14天时,各浓度组HSP70 mRNA表达量均达到最高值,均显著高于对照组 (P<0.05),分别为对照组的5.41、7.40和8.13倍,HSP70 mRNA表达量呈现随Cu(Ⅱ)浓度升高而增加的趋势。

注:标有不同小写字母者表示组间有显著性差异 (P<0.05),标有相同小写字母者表示组间无显著性差异 (P>0.05),下同Note:Themeans with different letters are significant differences at the 0.05 probability level,and the means with the same letters are not significant differences,et sequentia图1 不同浓度Cu(Ⅱ)胁迫下双齿围沙蚕HSP70基因表达变化特征Fig.1 The HSP70 m RNA exp ression pattern of lugw orm Perinereis aibuhitensis under different concentrations of Cu(Ⅱ)
2.3 不同浓度Cd(Ⅱ)胁迫下双齿围沙蚕HSP70基因表达随时间的变化
如图 2所示,Cd(Ⅱ)暴露下双齿围沙蚕HSP70基因表达变化趋势与Cu(Ⅱ)暴露下相似,表现出明显的剂量-时间-效应关系,但是相比Cu(Ⅱ),沙蚕HSP70基因表达在Cd(Ⅱ)诱导下增加趋势较缓。暴露第3天时,各浓度组 HSP70 mRNA表达量均高于对照组,分别为对照组的1.70、1.98和4.52倍;暴露第7天时,各浓度组沙蚕HSP70 mRNA表达量与第3天时相比略有升高,分别为对照组的2.06、3.45和4.81倍;暴露第14天时,各浓度组HSP70 mRNA表达量均达到最高值,分别为对照组的3.54、4.08和4.93倍;不同时间点,仅10μg/L浓度组HSP70 mRNA表达量显著高于对照组 (P<0.05),其余组间均无显著性差异 (P>0.05)。

图2 不同浓度Cd(Ⅱ)胁迫下双齿围沙蚕HSP70基因表达变化特征Fig.2 The HSP70 m RNA exp ression pattern of lugw orm Perinereis aibuhitensis under different concentrations of Cd(Ⅱ)
2.4 不同浓度Cu(Ⅱ)与Cd(Ⅱ)联合胁迫下双齿围沙蚕HSP70基因表达随时间的变化
如图3所示,在Cu(Ⅱ)与Cd(Ⅱ)联合作用下,沙蚕HSP70基因表达呈现与Cu(Ⅱ)与Cd(Ⅱ)单独作用下相同的变化趋势,沙蚕HSP70基因表达量随暴露浓度的上升而增加,表达量亦与暴露时间呈正相关,基因表达量变化趋势与Cu(Ⅱ)单独作用时较为相似。暴露第3天时,各浓度组HSP70 mRNA表达量分别为对照组的2.69、5.78和6.89倍,其在高浓度组的联合暴露下呈现比两种重金属单独作用时更明显的上升趋势,其中两个高浓度组[22.86μg/L Cu(Ⅱ)+5μg/L Cd(Ⅱ)、45.70 μg/L Cu(Ⅱ)+10μg/L Cd(Ⅱ)]HSP70 mRNA表达量显著高于对照组 (P<0.05);暴露第7天时,各浓度组HSP70 mRNA表达量分别为对照组的4.12、6.94、8.14倍,3个浓度组均显著高于对照组 (P<0.05);暴露第14天时,各浓度组HSP70 mRNA表达量分别为对照组的4.04、6.48和8.13倍,其中两个高浓度组显著高于对照组 (P<0.05)。

图3 不同浓度Cd(Ⅱ)和Cu(Ⅱ)联合胁迫下双齿围沙蚕HSP70基因表达变化特征Fig.3 The HSP70 m RNA exp ression pattern of lugw orm Perinereis aibuhitensis induced by d ifferent combined concentrations of Cu(Ⅱ)and Cd(Ⅱ)
3 讨论
HSP70作为应激保护蛋白,任何应激条件均可诱导机体的热休克蛋白合成增加,它能使动物迅速适应环境的变化,保护机体不受或少受损害[18]。很多研究表明,热休克蛋白在机体对抗重金属离子引起的损伤中起着重要作用,现已证实,在重金属浓度接近于环境背景值甚至更低的水平时均能诱导该蛋白的转录和表达,因此,开展低剂量重金属胁迫下生物体HSP70基因表达变化规律的研究,可以为环境污染预警提供重要的理论依据。中国国家海水水质标准中对第Ⅰ、Ⅱ、Ⅲ类水质中Cu浓度设置的界限值分别为5、10、50μg/L,Cd浓度的界限值分别为1、5、10μg/L,本试验中,Cu(Ⅱ)和Cd(Ⅱ)单独作用时分别设置了4.57、22.86、45.70μg/L和1、5、10μg/L 3个浓度,试验浓度的设计接近实际环境中两种重金属可能存在的浓度,结果表明,沙蚕HSP70基因在该浓度范围内出现表达量的变化,证实了沙蚕HSP70基因对环境胁迫亦具有敏感性,这与前人所得到的结论相一致,为利用沙蚕HSP70基因作为分子标记进行环境污染预警提供了重要的理论依据和技术支持。
3.1 单一重金属污染对HSP70基因表达的影响
当生物受到重金属胁迫时,体内热休克蛋白为抵御外界危害会进行相应的调控,含量会出现明显变化。Kim等[19]研究表明,Cu、Zn、Ag、Cd等多种重金属能诱导桡足类Tigriopus japonicus HSP10、HSP20、HSP60、HSP70等多个热休克蛋白家族基因表达上调。沈骅等[20]研究了Cu(Ⅱ)对鲫脑组织HSP70基因表达的影响,结果表明,Cu(Ⅱ)浓度组鲫脑组织应激蛋白基因HSP70均有显著的诱导表达 (P<0.05),在0.25、0.05、0.01 mg/L高浓度试验组中HSP70基因表达量上调尤为明显。刘婧婧等[21]研究发现,Cd(Ⅱ)胁迫下涡虫DjHSP70基因表达随Cd(Ⅱ)浓度的增加呈现递增的趋势,DjHSP70基因表达量在诱导第9天时达到最大值,第15天时表达量下降,但仍显著高于对照组。本试验中,Cu(Ⅱ)单独暴露条件下,中浓度组沙蚕在第3、7天时HSP70基因表达量略高于高浓度组,在第14天时沙蚕 HSP70基因表达量均随Cu(Ⅱ)浓度的增加而增加;Cd(Ⅱ)单独暴露下,沙蚕HSP70基因表达与Cd(Ⅱ)浓度间亦存在同样的剂量-效应关系,这与对其他物种的报道结果相一致。Kim等[19]比较了Cu、Zn、Ag、Cd等多种重金属诱导下桡足类Tigriopus japonicus热休克蛋白基因的表达量变化,发现不同重金属胁迫下基因表达量趋势为Cu>Zn>Ag>Cd。对比Cu(Ⅱ)和Cd(Ⅱ)单独诱导下沙蚕 HSP70表达量的变化趋势,由4.57μg/L Cu(Ⅱ)和5μg/L Cd(Ⅱ)浓度组沙蚕HSP70基因表达量情况可以看出,Cd(Ⅱ)诱导下双齿围沙蚕HSP70基因表达量的增加趋势小于Cu(Ⅱ),这与Kim等[19]得到的结论相同,推测出现这种现象的原因可能与重金属的种类及对沙蚕的毒性差异有关。王晶等[22]研究了双齿围沙蚕暴露于不同浓度的Cu(Ⅱ)和Cd(Ⅱ)的毒性效应,结果发现,Cu(Ⅱ)对沙蚕的毒性效应要大于Cd(Ⅱ),这可能是由于与Cu(Ⅱ)相比,Cd(Ⅱ)进入生物体后更易与含巯基 (-SH)的金属硫蛋白结合,减少了Cd(Ⅱ)与细胞的非特异性结合,从而降低了Cd(Ⅱ)对沙蚕机体的损伤。对于这一推测,需要进行金属硫结合蛋白表达的研究,探讨不同重金属污染胁迫下金属硫蛋白和热休克蛋白表达之间的相关性以进一步地验证。
3.2 复合重金属污染对HSP70基因表达的影响
在实际污染水环境中,单一重金属污染较少,大部分情况都是重金属的联合污染。联合毒性机制较为复杂,由于不同金属离子的分子形态差异,导致不同组合联合毒性效应迥然,差异甚大。重金属对生物的联合毒性效应通常表现为相加、拮抗或协同作用[23]。近年来,国内外很多学者研究了Cu和Cd联合作用对多种生物的毒性效应,普遍认为两者共存时表现为协同作用[23-24],Cu和Cd对水螅Hydra[25]和孔雀鱼Poecilia reticulata[26]的联合急性作用均表现为协同作用,但对泥螺Bullacta exarata[27]的联合急性作用表现为拮抗作用。朱旭等[28]研究表明,Cu(Ⅱ)和Zn(Ⅱ)对泥鳅的联合毒性48 h为协同,72 h为拮抗。本试验结果表明,不同浓度的Cu(Ⅱ)和Cd(Ⅱ)联合作用下,双齿围沙蚕HSP70基因表达较Cd(Ⅱ)单一作用时要明显增加,但与Cu(Ⅱ)单独作用时的表达量却较为相近,只在诱导第3天和第7天时,高浓度组 (45.70μg/L Cu(Ⅱ)+10μg/L Cd(Ⅱ))沙蚕HSP70表达量高于Cu(Ⅱ)和Cd(Ⅱ)单独暴露时的表达量,这表明两种重金属联合作用存在一定程度的协同作用,导致毒性增加,使得机体需要产生更多的热休克蛋白来抵御外界损伤。
已有研究表明,生物体内不同组织对重金属胁迫产生的反应存在差异,本试验中尚未对不同组织间HSP70基因表达进行比较和分析,因此,后续需要开展不同组织器官间基因表达量差异分析。同时在本试验周期内沙蚕HSP70基因表达量在重金属诱导下持续增加,尚未出现下降趋势,在后续试验中有必要延长试验时间来进一步全面研究HSP70基因表达量的变化规律。本试验结果表明,当重金属含量接近环境浓度值时,沙蚕体内HSP70基因的表达也有明显变化,沙蚕HSP70基因表达量对环境变化的敏感性,为利用这一生理生化指标的变化进行实际环境污染检测提供了可能。生物细胞内的HSP70基因表达量对温度、pH、盐度和溶解氧的变化均会产生响应,对紫贻贝的研究表明,适宜温度的海水不会影响到重金属对双壳类HSP70基因的诱导效果。当环境温度比生物适宜生长温度提高或降低5~10℃以上时,则可明显诱导双壳类HSP70基因的合成[29-31]。在实际海域调查时,上述环境因子不可能像室内试验一样严格控制,因此,为了增加该分子标记利用时的准确性,有必要探讨各种环境因子对沙蚕HSP70基因表达影响的大小,以便减少干扰较大的环境因子对结果准确性的影响。
参考文献:
[1] Rajeshkumar S,Mini J,Munuswamy N.Effects of heavymetals on antioxidants and expression of HSP70 in different tissues of milk fish(Chanos chanos)of Kaattuppalli Island,Chennai,India[J]. Ecotoxicology and Environmental Safety,2013,98:8-18.
[2] 沈骅,王晓蓉,张景飞.应用应激蛋白HSP70作为生物标志物研究锌、铜及其联合毒性对鲫鱼肝脏的影响[J].环境科学学报,2004,24(5):895-899.
[3] 沈骅,王晓蓉,张景飞,等.低浓度Zn对幼龄鲫鱼肝脏组织应激蛋白HSP70诱导的影响[J].农业环境科学学报,2004,23 (3):441-443.
[4] Mic'ovic'V,Bulog A,Kucˇic' N,et al.Metallothioneins and heat shock proteins 70 in marine mussels as sensors of environmental pollution in Northern Adriatic Sea[J].Environmental Toxicology and Pharmacology,2009,28(3):439-447.
[5] Radlowska M,Pempkowiak J.Stress-70 as indicator ofheavymetals accumulation in blue mussel Mytilus edulis[J].Environment International,2002,27(8):605-608.
[6] Gillet P,Mouloud M,Durou C,et al.Response of Nereisdiversicolor population(Polychaeta,Nereididae)to the pollution impact—Authie and Seine estuaries(France)[J].Estuarine,Coastal and Shelf Science,2008,76(2):201-210.
[7] Liu Fei,Shi Hongzhuan,Guo Qiaosheng,et al.Analysis of the genetic diversity and population structure of Perinereisaibuhitensis in China using TRAPand AFLPmarkers[J].Biochemical Systematics and Ecology,2015,59:194-203.
[8] Amiard JC,Geffard A,Amiard-Triquet C,et al.Relationship between the lability of sediment-bound metals(Cd,Cu,Zn)and their bioaccumulation in benthic invertebrates[J].Estuarine,Coastal and Shelf Science,2007,72(3):511-521.
[9] Tian Yulu,Liu Hongjun,Wang Qixiang,et al.Acute and chronic toxic effects of Pb2+on polychaete Perinereis aibuhitensis:morphological changes and responses of the antioxidant system[J].Journal of Environmental Sciences,2014,26(8):1681-1688.
[10] Berthet B,Mouneyrac C,Amiard JC,etal.Accumulation and soluble binding of cadmium,copper,and zinc in the polychaete Hediste diversicolor from coastal sites with different trace metal bioavailabilities[J].Archives of Environmental Contamination and Toxicology,2003,45(4):468-478.
[11] Wang Jing,Zhou Qixing,Zhang Qianru,et al.Single and joint effects of petroleum hydrocarbons and cadmium on the polychaete Perinereisaibuhitensis Grube[J].Journal of Environmental Sciences,2008,20(1):68-74.
[12] Zhang Qianru,Zhou Qixing,Wang Jing,et al.Influences of Cu or Cd on the neurotoxicity induced by petroleum hydrocarbons in ragworm Perinereis aibuhitensis[J].Journal of Environmental Sci-ences,2008,20(3):364-371.
[13] Sun Fuhong,Zhou Qixing.Oxidative stress biomarkers of the polychaete Nereis diversicolor exposed to cadmium and petroleum hydrocarbons[J].Ecotoxicology and Environmental Safety,2008,70 (1):106-114.
[14] 牛俊翔,蒋玫,李磊,等.滩涂贝类养殖区底质硫化物的去除及修复[J].农业环境科学学报,2013,32(7):1467-1472.
[15] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社,1989.
[16] 赵欢,赵新达,岳宗豪,等.苯并(a)芘对双齿围沙蚕抗氧化酶活性和细胞色素P450基因表达的影响[J].大连海洋大学学报,2014,29(4):342-346.
[17] 李颖,周一兵,万良,等.双齿围沙蚕HSP70 cDNA基因的克隆及序列分析[J].大连海洋大学学报,2012,27(6):502-507.
[18] 战玉杰.渤海重金属污染状况及对典型浮游植物生长影响初步分析[D].青岛:中国海洋大学,2005.
[19] Kim B,Rhee J,Jeong C,et al.Heavy metals induce oxidative stress and trigger oxidative stress-mediated heat shock protein (hsp)modulation in the intertidal copepod Tigriopus japonicus [J].Comparative Biochemistry and Physiology Part C:Toxicology &Pharmacology,2014,166:65-74.
[20] 沈骅,王晓蓉,张景飞,等.Cu2+和Cu-EDTA对鲫鱼脑组织应激蛋白HSP70诱导的影响[J].环境科学,2004,25(3):94-97.
[21] 刘婧婧,吴素格,张秀芳.镉胁迫对涡虫DjHSP70、DjP53基因表达量的影响[J].基因组学与应用生物学,2015,34(1):96-99.
[22] 王晶,周启星,张倩茹,等.沙蚕暴露于石油烃、Cu2+和Cd2+毒性效应及乙酰胆碱酯酶活性的响应[J].环境科学,2007,28 (8):1796-1801.
[23] 沈鹏,席贻龙,张烨,等.铜和镉对多刺裸腹溞的联合毒性效应[J].应用生态学报,2012,23(10):2855-2862.
[24] 杨再福,陈立侨,陈华友.重金属铜、镉对蝌蚪毒性的研究[J].中国生态农业学报,2003,11(1):102-103.
[25] Ou X B,Li H Y,Chen Y H,et al.Toxicity and toxic effects of heavy metals cadmium and copper on Hydra sp.[J].Environmental Pollution and Control,2006,28(8):584-588.
[26] 赵岩,孔强,付荣恕.Cu2+、Cd2+和Cr6+对孔雀鱼的单一与联合毒性效应[J].供水技术,2009,3(6):10-12.
[27] 包坚敏,王志铮,陈启恒,等.4种重金属对泥螺的急性毒性和联合毒性研究[J].浙江海洋学院学报:自然科学版,2007,26 (3):252-256.
[28] 朱旭,陈雷,陈玉明,等.Cu2+、Al3+和Zn2+对泥鳅的急性毒性和联合毒性研究[J].环境科学与技术,2014,37(10):26-30.
[29] Ivanina A V,Taylor C,Sokolova IM.Effects of elevated temperature and cadmium exposure on stress protein response in eastern oysters Crassostrea virginica(Gmelin)[J].Aquatic Toxicology,2009,91(3):245-254.
[30] Brun N T,Bricelj VM,MacRae TH,et al.Heatshock protein responses in thermally stressed bay scallops,Argopecten irradians,and sea scallops,Placopecten magellanicus[J].Journal of Experimental Marine Biology and Ecology,2008,358(2):151-162.
[31] 赵顺顺,孟范平,王震宇,等.监测水体重金属污染的分子生物标志物研究进展[J].生态环境学报,2010,19(2):453-458.
Single and synergetic effects of heavy m etal Cd(Ⅱ)and Cu(Ⅱ)stress on heat shock protein 70(HSP70)gene expression in lugworm Perinereis aibuhitensis
ZHAO Huan,LIWan-juan,WAN Liang,YANG Da-zuo,ZHOU Yi-bing
(Key Laboratory of Marine Bio-resources Restoration and Habitat Reparation in Liaoning Province,Dalian Ocean University,Dalian 116023,China)
Abstract:Single and synergetic effects of heavy metal Cd(Ⅱ)and Cu(Ⅱ)stresson heat shock protein 70 (HSP70)gene expression were studied in lugworm Perinereis aibuhitensis by real-time PCR method to investigate the relationship between heavymetals concentration and HSP70 gene expression in lugworm.The results showed that HSP70 gene expression levels were induced with the elapse of Cu(Ⅱ)exposure at various concentrations of Cu(Ⅱ),with the descendant order of HSP70 gene expression as:22.86μg/L group>44.50μg/L>4.45μg/L in 3 days and with positive relationship between the HSP70 gene expression level and concentration of Cu(Ⅱ)in 7 days and 14 days.HSP70 gene expressionswere shown to be increased with increasing Cd(Ⅱ)concentration and the elapse of single Cd(Ⅱ)exposure,withmore stable fluctuation under Cd(Ⅱ)exposure than under Cu(II)exposure.Under synergetic effects of both Cu(Ⅱ)and Cd(Ⅱ),HSP70 gene expression levels were also increased with the increasing exposure concentration and time,the maximal expression of HSP70 in group 45.70μg/L Cu(Ⅱ)+10μg/LCd(Ⅱ)in 7 days and 14 days,andmuch higher than that in the single Cu(Ⅱ)or Cd(Ⅱ)exposure,indicating that Cu(Ⅱ)combined with Cd(Ⅱ)had synergy effect in a certain extent.
Key words:Perinereis aibuhitensis;heat shock protein 70(HSP70);Cu(Ⅱ);Cd(Ⅱ);joint toxicity
中图分类号:X174
文献标志码:A
DOI:10.16535/j.cnki.dlhyxb.2016.02.007
文章编号:2095-1388(2016)02-0156-06
收稿日期:2015-05-11
基金项目:国家自然科学基金资助项目 (41306138);海洋公益性行业科研专项 (201305002,201305043);蓬莱19-3油田溢油事故海洋生态修复技术研究项目 (201005018)
作者简介:赵欢 (1983—),女,博士,助理研究员。E-mail:zhaohuan@dlou.edu.cn
通信作者:周一兵 (1957—),男,教授。E-mail:ybzhou@dlou.edu.cn
