新疆地产葡萄酒优良酿酒酵母菌的筛选
2016-07-14魏玉洁张亚南王德良新疆农业大学新疆乌鲁木齐83005中国食品发酵工业研究院北京0005
魏玉洁,邹 弯,王 威,张亚南,王德良,武 运,薛 洁(.新疆农业大学,新疆乌鲁木齐83005;.中国食品发酵工业研究院,北京0005)
新疆地产葡萄酒优良酿酒酵母菌的筛选
魏玉洁1,邹弯1,王威1,张亚南1,王德良2,武运1,薛洁2
(1.新疆农业大学,新疆乌鲁木齐830052;2.中国食品发酵工业研究院,北京100015)
摘要:对新疆昌吉、玛纳斯和阜康3个主要酿酒地区的酵母菌进行研究,以成熟期的赤霞珠、葡萄园中的土壤为原料,通过涂布、划线的分离方法共分离纯化出39株酵母菌,采用传统形态学观察、生理生化实验和分子生物学鉴定,确定39株酵母菌分别为Saccharomyces cerevisiae、Wickerhamomyces anomalus、Rhodotorula glutinis和Cyberlindnera fabianii。本研究对葡萄酒产区酵母种质资源的探明具有重要意义。
关键词:微生物;酿酒酵母;分离纯化;鉴定
优先数字出版时间:2016-02-25;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20160225.1730.004.html。
自2013年以来,由于国内葡萄酒企业间激烈的竞争以及国外进口葡萄酒的冲击,对我国葡萄酒行业造成了严重的影响。进口葡萄酒品种多样,口味独特且风格各异,而我国葡萄酒风味则大同小异,这使得国产葡萄酒在消费者日渐追求高质量产品的情况下处于被动的局面[1-2]。
影响葡萄酒风味的原因主要有3个,即酿酒原料(酿酒葡萄)、酿造工艺以及发酵过程中微生物的代谢,其中以微生物的代谢影响最为重要,菌种的差异决定了风味物质的含量与种类。由于酿酒葡萄的种植期一般为3~7年,从原料上改变同质化现象需耗费大量时间且成本较大;而采用具有典型性、个性化的酿酒微生物对葡萄酒的风味进行改善确是一种快速且有效的方法[3],所以,选育有地方特色的葡萄酒优良酿酒微生物对我国葡萄酒产业的发展具有十分深远的意义。新疆自古以来就是中国主要的酿酒葡萄及葡萄酒产地,具有得天独厚的气候、地理条件及资源优势。鉴于新疆地区的丰富资源,本研究采用传统形态学、生理生化特性及分子学鉴定法对新疆3个主要葡萄酒产地的酵母菌进行鉴定,以期筛选出新疆地区葡萄酒中特有的优良酿酒酵母菌,为新疆葡萄酒酵母菌的利用奠定基础。
1材料与方法
1.1材料
样品:实验所需的成熟期葡萄和土壤采集于新疆玛纳斯县中信国安、阜康天山冰湖葡萄酒庄和昌吉遗韵酒庄,均位于新疆葡萄酒主要产区。
仪器:全温振荡器,生化培养箱,立式电热压力蒸汽灭菌锅,pH计,荧光显微镜,生物安全操作台,离心机,痕量分析型纯水机,温度梯度PCR仪,电泳仪,凝胶成像仪。
培养基:酵母菌分离纯化培养基(麦芽汁培养基),酵母菌保藏培养基(YPD培养基),WL培养基[4],糖发酵培养基,液体无碳基础培养基,液体无氮基础培养基,尿素培养基,明胶液化培养基,淀粉水解培养基,类淀粉化合物产生液体培养基。
1.2实验方法
1.2.1酵母菌的分离纯化
将葡萄从葡萄串上摘下来(葡萄上不带果梗),约50粒放到含有2%的无菌葡萄糖水溶液中,在恒温振荡培养箱中以180 r/min在30℃下富集培养24 h。富集培养液按10倍梯度稀释至10-7,取10-5、10-6、10-73个梯度的菌悬液各0.1 mL在麦芽汁培养基上涂布,28℃倒置培养48 h,选择具有典型酵母菌菌落形态的单菌落进行划线纯化,直至获得纯种菌株,最后将各菌株编号,并接种生长于PDA培养基后在4℃冰箱中保藏备用[5-6]。
1.2.2酵母菌的鉴定
酵母菌的分类依据主要包括形态特征与生理学特征两个方面,根据巴尼特鉴定手册[7],本研究关于酵母菌主要通过形态学观察并结合一些生理生化实验来进行鉴定,最后采用分子生物学技术确定酵母菌的种类。
1.2.2.1形态学鉴定
(1)菌落形态
将待检酵母菌接种到PDA培养基上,28℃培养24 h,选取单菌落观察其颜色、大小、形状、光滑度、湿润度、透明度和边缘是否整齐等特征。
将待检酵母菌接种到WL培养基上,28℃培养2 d、5 d、8 d,选取单菌落观察其颜色、大小和形状等特征。
(2)细胞形态
在载玻片上滴加1滴吕氏美兰染液,无菌操作,用接种环挑取少量酵母菌菌体置于染液中,混合均匀后盖上盖玻片,染色3 min后在40倍显微镜下观察[8]。
1.2.2.2生理生化鉴定
(1)糖发酵实验[9]
酵母菌株先在无碳培养基中饥饿培养3 d(防止假阳性),然后将其接种于含有不同2%碳源的培养基中,28℃下培养2周,每天观察杜氏管内气体产生情况,实验重复3次。
(2)碳源同化实验[10]
酵母在25℃下于液体无碳基础培养基中饥饿培养3 d,制备碳源饥饿酵母。然后在液体无碳基础培养基分别添加不同的碳源作为唯一碳源,接种碳源饥饿酵母后28℃培养1周,观察酵母是否生长,试管中出现浑浊为阳性,记作“+”;试管澄清为阴性,记作“-”,实验重复3次。
(3)氮源同化实验
酵母在25℃下用液体无氮基础培养基饥饿培养5 d,制备氮源饥饿酵母。然后在液体无氮基础培养基分别添加硝酸钾作为唯一氮源,接种氮源饥饿酵母后28℃培养数天,观察酵母是否生长,试管中出现浑浊为阳性,记作“+”;试管澄清为阴性,记作“-”,实验重复3次。
(4)尿素分解实验[11]
在尿素培养基上接种待测菌株,于28℃下培养5~7 d,菌体呈淡红色,表明待测菌株能分解尿素,为阳性,记为“+”;反之为阴性,记为“-”。
(5)明胶液化实验
在无菌操作台中进行酵母菌穿刺接种,深度约2/3。于28℃下培养1周,每天观察明胶是否有液化现象产生。若明胶液化,则是阳性,记为“+”;反之是阴性,记为“-”,实验重复3次。
(6)淀粉水解实验
将菌种点接在培养基上,每个平皿可同时点接4种不同的菌,将接种好的培养皿置于28℃下培养24 h,然后滴加少量碘液于平皿上,轻轻旋转,使碘液均匀铺满整个平皿。若菌落周围出现无色透明圈,则说明淀粉已经被水解,该菌种有分解淀粉的能力,反之则没有。同时,可以通过透明圈的大小反映出待测菌种水解淀粉能力的强弱。
(7)产类淀粉化合物实验
将酵母接种于PDY培养液中,28℃培养后加入2滴卢哥氏碘液,呈蓝色则为阳性,表示生成了类淀粉化合物。
1.2.3分子生物学鉴定
1.2.3.1酵母菌DNA的提取
将待测菌接种于YPD液体培养基中,28℃振荡培养24 h,取2 mL菌液于灭菌的离心管中,12000 r/min离心1 min,弃上清液,再加入无菌水与待测菌混匀,12000 r/min离心1 min,弃上清液,重复此步骤3次,得到菌体沉淀,按照酵母菌试剂盒说明书提取酵母菌DNA,-20℃保存备用。
1.2.3.2 PCR扩增[12]
酵母菌26S rDNAD1/D2区域特异性片段扩增引物为:
NL1(5′GCATATCAATAAGCGGAGGAAAG3′);NL4(5′GGTCCGTGTTTCAAGACGG3′)。
PCR(50 μL)反应体系:dNTP 4 μL,10×Buffer 5 μL,NL1和NL4各1 μL,模板DNA 1 μL,Taq酶0.25 μL,ddH2O 37.75 μL,充分混匀。
PCR反应程序:95℃预变性5 min;95℃变性1 min,52℃退火45 s,72℃延伸40 s,反应40个循环;72℃延伸5 min,-20℃保存。
PCR完成后,取PCR产物在2%的琼脂糖凝胶电泳上电泳,100 V恒压电泳。最后用凝胶成像仪观察结果,并将有结果的PCR产物送至北京奥维森基因科技有限公司测序。
1.2.3.3序列对比
将所测的酵母菌株26S rDNA D1/D2区域序列与NCBI数据库中的已知序列进行对比,选取基因序列同源性较高的相关酵母菌株的26S rDNA D1/D2区域序列作为参比对象,用MEGA6.0进行相似性分析,确定菌种。
2结果与分析
2.1酵母菌分离纯化结果
通过分离纯化,确定酵母菌有39株,见表1。

表1 葡萄、土壤中微生物的分布
由表1可以看出,从玛纳斯的葡萄表面和土壤中分别分离出了6株和7株酵母菌,从阜康的葡萄表面分离出了9株酵母菌,土壤中未分离,从昌吉的葡萄表面和土壤中分别分离出了15株和2株酵母菌。这些数据显示,酿酒葡萄表皮分离出的酵母菌明显多于土壤中的酵母菌,这主要由于新疆地区气候干旱,土壤保水性比较差,不利于微生物的繁殖,造成土壤中的微生物非常少,同时由于气候干燥,葡萄果皮中的微生物也远远低于从昌黎、沙城等酿酒产区分离的微生物数量[13],而且即使都是新疆产区,由于小区域气候的差异,造成玛纳斯、昌吉地区分离的酵母菌多于阜康地区。
2.2菌落形态及细胞形态鉴定结果
2.2.1菌落形态结果
39株酵母菌在麦汁培养基上28℃培养48 h后观察菌落形态,见表2。
由表2看出,从麦汁培养基上分离出的酵母菌大多数呈乳白色,少有白色,还有1株呈红色,直径在0.3~0.7 cm之间,菌体有凸起的,也有平坦的,并且菌体不透明,其表面湿润光滑,少有黏稠。就此来看,基本符合《酵母菌鉴定手册》中所描述的酵母菌的菌落形态,可继续进行后续实验。
2.2.2细胞形态结果
将39株酵母菌在显微镜下观察,结果见表3。

表3 酵母菌细胞形态
将酵母菌接种于WL培养基上,28℃培养2 d、5 d、8 d后观察,与参考文献中对生长于WL培养基上的酵母菌颜色、形态进行对比,结果见表4。
参照参考文献中对生长于WL培养基上酵母菌的菌落形态描述[14],观察本研究所分离纯化出的酵母菌,可初步将此39株酵母菌判断为6个种类:Saccharomyces cerevisiae、Rhodotorula glutinis、Hanseniaspora uvarum、Wickerhamomyces anomalus、Zygosaccharomyces bailli及Cyberlindnera fabianii。
2.3酵母菌生理生化鉴定结果
从表4初步判定的6种酵母菌中选出10株具有代表性的菌株进行生理生化实验,其结果见表5—表7。
根据资料报道,Saccharomyces cerevisiae可以发酵葡萄糖、蔗糖等,同化半乳糖、麦芽糖等碳源和硝酸钾;Wickerhamomyces anomalus对葡萄糖和蔗糖有弱发酵,可以同化麦芽糖、棉籽糖等碳源和L-赖氨酸;Cyberlindnera fabianii对半乳糖发酵有可变性,对同化半乳糖、淀粉、L-阿拉伯糖有可变性,可同化L-赖氨酸;Rhodotorula glutinis不发酵上述糖类,可以同化棉籽糖、琥珀酸等碳源和同化硝酸钾、L-赖氨酸[15-16]。因此,根据表5—表7结果,结合WL培养基上的菌落形态,本实验中39株酵母菌属于4个种类,即Saccharomyces cerevisiae、Cyberlindnera fabianii、Wickerhamomyces anomalus和Rhodotorula glutinis。
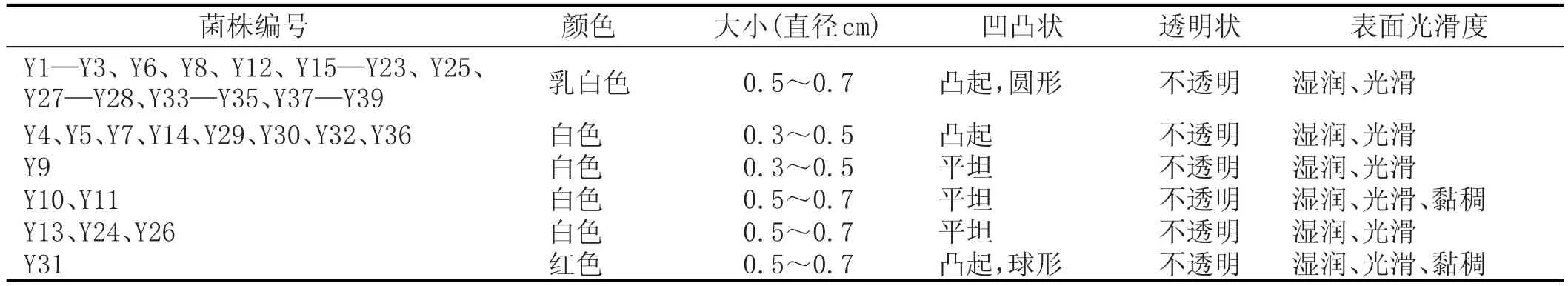
表2 麦汁培养基上酵母菌菌落形态

表4 39株酵母菌在WL培养基上的菌落形态描述
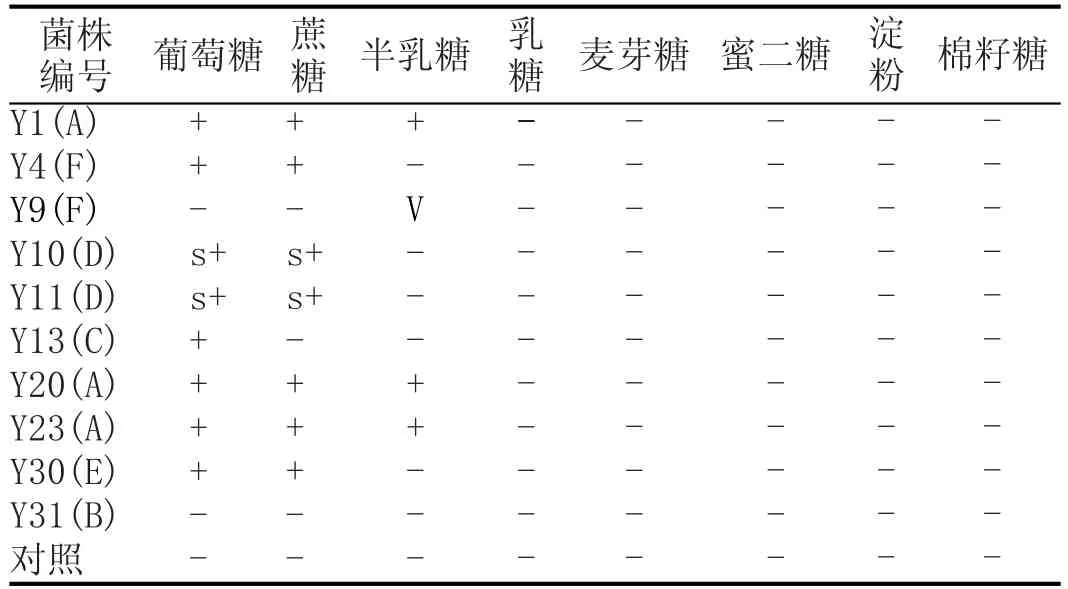
表5 酵母菌糖发酵实验
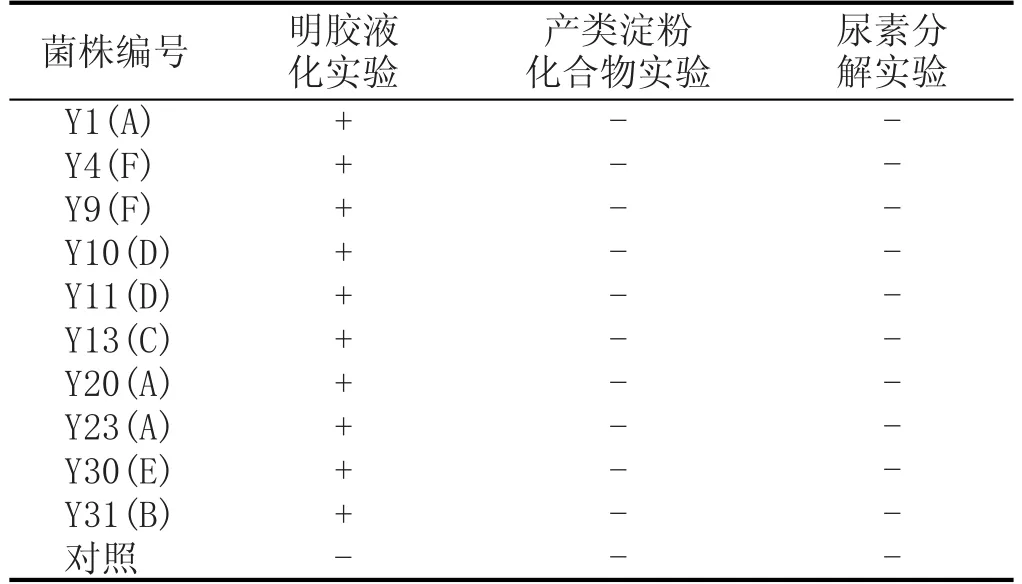
表7 酵母菌明胶液化、淀粉水解、尿素水解、产类淀粉化合物实验
2.4酵母菌分子生物学鉴定结果
2.4.1 26S rDNA区域扩增后电泳结果
根据1.2.3.2中PCR体系及条件,以酵母DNA为模版,扩增特异性序列,用琼脂糖凝胶电泳对PCR产物进行测试,结果见图1—图3。可以看出,酵母的特异性片段长度约为600 bp,扩增结果基本符合实际要求,可将其送交至测序公司测序。
2.4.2酵母菌菌种确定
将测序后的酵母菌与国际核酸数据库NCBI中已确定的核酸序列进行BLAST比对,确定为Saccharomyces cerevisiae、Wickerhamomyces anomalus、Rhodotorula glutinis和Cyberlindnera fabianii,结果见表8。
由测序结果可以看出,39株酵母菌中多数为酿酒酵母,后期将继续进行酵母菌耐受性实验,从而筛选出适合于新疆葡萄酒的优良酿酒酵母菌;同时,可以研究4株非酿酒酵母的特性,以期运用于葡萄酒的酿造。
3讨论与展望
通过平板涂布和划线,从葡萄表面和土壤中共分离纯化出39株酵母菌,经形态学、生理生化实验及26S rDNA基因序列鉴定,鉴定结果为35株Saccharomyces cerevisiae,1株Cyberlindnera fabianii(Y9),2株Wickerhamo-myces anomalus(Y10、Y11)和1株Rhodotorula glutinis (Y31),其中Saccharomyces cerevisiae占89.74%,为优势菌,Wickerhamomyces anomalus占5.12%,Cyberlindnera fabianii和Rhodotorula glutinis各占2.57%。

表6 酵母菌碳源同化、氮源同化实验
注:“+”表示试管中出现浑浊,可以同化此糖;“-”表示试管中未出现浑浊,不可以同化此糖;“V”表示具有可变性。

图1 Y1—Y10 26S rDNA区域扩增琼脂糖凝胶电泳图

图2 Y11—Y32 26S rDNA区域扩增琼脂糖凝胶电泳图

图3 Y33—Y39 26S rDNA区域扩增琼脂糖凝胶电泳图
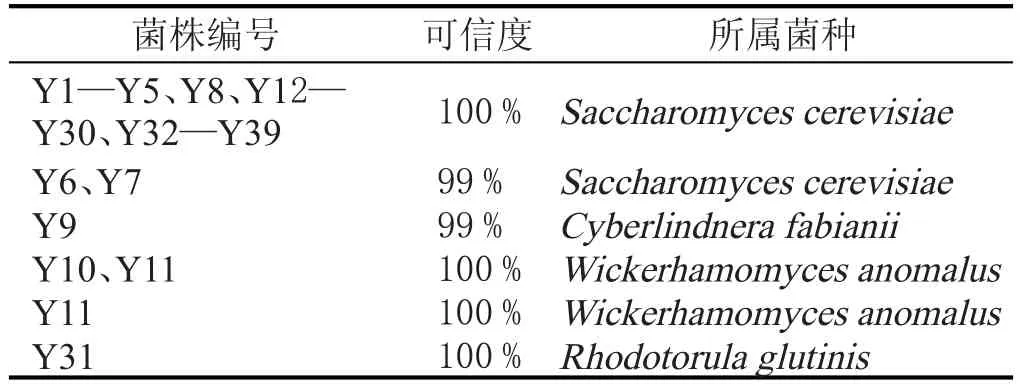
表8 酵母菌测序对比结果
从酵母菌的总体分布来看,3个地区的土壤中所分离的酵母菌较少,根据文献报道,该产区土壤为沙壤土,整体略偏碱性,土壤中有机质含量较低,其中全氮、有效氮含量处于低及以下水平,有效磷处于高水平,有效钾含量正常,而有效铁和锰在不同程度上存在缺乏状况,这就使得微生物生长所需的物质比例失去了平衡,氮源不足更是严重影响酵母菌的生长,同时酵母菌的最适pH值为4.5~5.0,碱性的土壤也使酵母菌数量有所减少。
将3个地区所分离的酵母菌进行对比,昌吉、玛纳斯地区稍比阜康地区的要多,很多研究表明,一个葡萄园中的酵母菌数量和种类与葡萄种植的时间(即葡萄树树龄)和管理有着密不可分的关系。玛纳斯、昌吉地区种植酿酒葡萄时间较长,从1995年开始就逐渐引进赤霞珠并严格管理葡萄园,以确保葡萄的健康生长,而阜康的种植时间与之相比晚了约10年,因此,从酵母菌的数量上来说,阜康地区略显逊色。本研究分离出的非酿酒酵母Wickerhamomyces anomalus和Rhodotorula glutinis来自昌吉地区的遗韵酒庄,Cyberlindnera fabianii来自阜康地区的天山冰湖葡萄酒庄。目前,国内外很多葡萄酒研究者已着手于非酿酒酵母在葡萄酒中的应用研究,其特异性的代谢活动,对葡萄酒的品质和风味尤其是香气具有非常大的影响[17-19]。例如Ciani研究表明,非酿酒酵母可以通过其数量及在发酵过程中存在的时间对葡萄酒产生影响,如果能够适当的控制其比例及存在时间,可有效提高葡萄酒风味的复杂性[20]。与玛纳斯的葡萄酒厂相比,遗韵酒庄和天山冰湖酒庄更注重葡萄酒的质量而不是产量,所以其葡萄园的管理条件更为严格,对土壤、水源等的要求都较高,这便给酵母菌创造了一个良好的生长环境,其种类自然会更丰富。
通过目前所进行的实验看出,这3个地区的土质还需要进一步进行合理的调节和改善,后期实验将对已经分离出的酿酒酵母菌进行耐受性实验,筛选出产酒精能力强、起酵速度快、酒精耐受性好、耐SO2能力强、耐酸性好的酿酒酵母菌,同时研究4株非酿酒酵母的特性,期望通过非酿酒酵母对葡萄酒的风味进行改善,提高葡萄酒的品质。
参考文献:
[1]王祖明.国际视角下的中国葡萄酒产业[J].中国酒,2014(9):34-35.
[2]汤晓宏,胡文效,魏彦锋,等.葡萄酒野生酿酒酵母的筛选及其生物特性的研究[J].山东大学学报:理学版,2014,49(3):12-17.
[3]Viana F,Gil J V,Genovés S,et al. Rational selection of non-Saccharomyces wine yeasts for mixed starters based on ester formation and enological traits[J].Food Microbiology,2008,25 (6):778-785.
[4]薛军侠,徐艳文,杨莹,等.WL培养基在酿酒酵母筛选中的应用[J].中国酿造,2007(9):36-39.
[5]周德庆.微生物学实验手册[M].上海:科学技术出版社,1986.
[6]王泽举.新疆、甘肃地区葡萄酒相关酵母菌的鉴定及多样性研究[D].杨凌:西北农林科技大学,2008.
[7]巴尼特.酵母菌的特征与鉴定手册[M].胡瑞卿,译.青岛:青岛海洋大学出版社.1991:140-174.
[8]沈萍,范秀容,李广武.微生物学实验[M]. 3版.北京:高等教育出版社,1999:43-44.
[9]徐军.大曲中酵母菌的分离及其鉴定[J].酿酒科技,2008(3):95-97.
[10]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2003.
[11]陈兰兰.优良酵母菌株的筛选及其在干红葡萄酒中的应用[D].石河子:石河子大学,2009.
[12]付方圆,薛洁,梁萌萌,等.葡萄酒贮存过程中氨基甲酸乙酯含量的变化[J].食品与发酵工业.2014,8(40):34-39.
[13]陈金丽,郭阳,薛洁,等.优良野生葡萄酒酵母菌的筛选和性能评价[J].食品与发酵工业,2012,38(5):106-111.
[14]杨莹,徐艳文,薛军侠,等.WL营养琼脂对葡萄酒相关酵母的鉴定效果验证[J].微生物学杂志,2007,27(5):75-78.
[15]杨莹.新疆地区葡萄酒相关酵母菌的生物多样性研究[D].杨凌:西北农林科技大学,2007.
[16]张珍,韩舜愈,王婧,等.祁连葡萄酒产区葡萄酒相关野生酵母菌株的分离及初步分类[J].食品工业科技.2013,34(8):179-182.
[17]Medina K,Boido E,Dellacassa E,et al. Growth of non-Saccharomyces yeasts affects nutrient availability for Saccharomyces cerevisiae during wine fermentation[J]. International Journal of Food Microbiology,2012,157(2):245-250.
[18]Takush D G,Osborne J P. Impact of yeast on the aroma and flavour of Oregon Pinot Noir wine[J].Australian Journal of Grape and Wine Research,2012,18(2):131-137.
[19]Hong YA,Park H D. Role of non-Saccharomyces yeasts in Korean wines produced from Campbell Early grapes:Potential use of Hanseniaspora uvarum as a starter culture[J]. Food Microbiology,2013,34(1):207-214.
[20]Ciani M,Beco L,Comitini F. Fermentation behaviour and metabolic interactions of multistarte wine yeast fermentations [J].International Journal of Food Microbiology,2006,108(2):239-245.
中图分类号:TS261.1;Q93-3;TS262.6
文献标识码:A
文章编号:1001-9286(2016)05-0042-06
基金项目:新疆自治区科技计划项目(201431113)。
收稿日期:2015-11-19
作者简介:魏玉洁(1991-),女,在读硕士研究生。
Screening of High-Quality Yeast Strains in Xinjiang Wine-Producing Regions
WEI Yujie1,ZOU Wan1,WANG Wei1,ZHANG Yanan1,WANG Deliang1,WU Yun1and XUE Jie2
(1. Xinjiang Agricultural University,Urumqi,Xinjiang 830052;2.China National Research Institute of Food and Fermentation Industries,Beijing 100015,China)
Abstract:Yeast strains in three major wine-producing regions in Xinjiang including Changji,Manasi and Fukang were selected as the research objects. Then 39 yeast strains were separated and purified through coating method and plate streak method with mature Cabernet Sauvignon and soil from the vineyards as raw materials. Through traditional morphology observation,physiological and biochemical experiment and molecular biological identification,those strains were identified as Saccharomyces cerevisiae,Wickerhamomyces anomalus,Rhodotorula glutinis and Cyberlindnera fabianii. This research was of important significance in the exploration of yeast strain resources in Xinjiang wine-producing regions.
Key words:microbe;S. cerevisiae;separate and purification;identification
