纤维素/生物质热解生成脱水糖衍生物的机理以及选择性制备技术研究进展
2016-07-14董晓晨叶小宁张智博胡斌陆强董长青华北电力大学生物质发电成套设备国家工程实验室北京102206
董晓晨,叶小宁,张智博,胡斌,陆强,董长青(华北电力大学生物质发电成套设备国家工程实验室,北京 102206)
综述与专论
纤维素/生物质热解生成脱水糖衍生物的机理以及选择性制备技术研究进展
董晓晨,叶小宁,张智博,胡斌,陆强,董长青
(华北电力大学生物质发电成套设备国家工程实验室,北京 102206)
摘要:纤维素/生物质快速热解过程中会形成多种脱水糖衍生物,包括左旋葡萄糖酮(LGO)、1,4:3,6-二脱水-α-D-吡喃葡萄糖(DGP)、1,5-脱水-4-脱氧-D-甘油基-己-1-烯-3-阿洛酮糖(APP)和 1-羟基-3,6-二氧二环[3.2.1]辛-2-酮(LAC)等,这些脱水糖衍生物均具有很高的化工应用价值。然而在常规热解过程中,这些产物的产率都非常低,使得后续的分离提取十分困难;而在适当的催化热解条件下,其产率可以大幅提升,从而实现目标产物的选择性制备。基于此,本文首先概述了国内外学者对这 4种脱水糖衍生物热解生成机理的实验以及密度泛函理论研究;随后总结了针对LGO和LAC这两种产物,现阶段已开发的选择性热解制备技术,包括最佳的催化剂以及催化热解反应条件;最后提出了未来在脱水糖衍生物生成机理以及选择性制备技术方面需要开展的工作。
关键词:纤维素;生物质;热解;选择性
第一作者:董晓晨(1991—),女,硕士研究生。联系人:陆强,副教授,研究方向为生物质高效热解转化研究。E-mail qianglu@mail. ustc.edu.cn。
快速热解是一种重要的生物质转化利用技术,该技术是在中温缺氧条件下,对生物质快速加热使其受热分解,而后对热解气进行快速冷凝从而主要获得液体产物生物油[1-3]。生物油可以作为一种新型的液体燃料应用于各种热力设备[4];此外,生物油中也含有多种难以通过常规手段合成的高附加值化学品。然而,生物质常规热解选择性较差,使得常规生物油中绝大多数物质的含量都很低,这给后续的分离提纯造成了很大困难,而且经济性也较差。为了获得特定的高附加值化学品,生物质选择性热解技术应运而生,通过各种手段对热解过程进行定向调控,从而直接获得富含特定目标产物的生物油。
作为生物质最重要的组分,纤维素在快速热解过程中会经历解聚和开裂两类互相竞争的反应途径,生成众多液体产物[5-7],其中包括多种脱水糖衍生物,以左旋葡聚糖(LG)为主,另外还有少量的左旋葡萄糖酮(LGO,1,6-脱水-3,4-双脱氧-β-D-吡喃-2-酮)、1,4:3,6-二脱水-α-D-吡喃葡萄糖(DGP)、1,5-脱水-4-脱氧-D-甘油基-己-1-烯-3-阿洛酮糖(APP)和 1-羟基-3,6-二氧二环[3.2.1]辛-2-酮(LAC)等脱水糖衍生物[8-10],其结构如图1所示。LG是纤维素热解最重要的产物,直接以纤维素为原料进行快速热解,LG的产率及其在生物油的中含量都很高,可以直接分离获得。但LGO、DGP、APP和LAC的产率都很低,为此需要首先了解各产物的热解形成机理,在此基础上开发合适的选择性热解制备技术。

图1 纤维素热解生成的4种高附加值脱水糖衍生物
1 纤维素/生物质热解生成LGO的机理
1.1 LGO的生成特性
LGO的结构于1973年首次确定[11],其独特的化学结构使其成为有机合成的重要原料,例如合成河豚毒素、硫糖和RAS活化抑制剂[12-13],因此具有很高的应用价值。在常规的生物质快速热解过程中,几乎难以检测到 LGO的存在;以纯纤维素为原料进行热解,可以在其产物中检测到少量的 LGO。 LGO主要在纤维素的热解初期生成,根据LU等[10]研究,在较低温度下对纤维素热解较短的时间后,即可得到LGO;在550℃以前,延长热解时间,LGO仅有少量增加;而在 450℃之后,提高热解温度,LGO的产率明显下降,这表明高温不利于LGO的生成。
1.2 LGO生成机理的实验
在早期的研究中,有学者认为 LGO是直接由LG脱水形成的,这是由于LG作为纤维素热解最重要的产物,容易发生二次裂解而形成多种与纤维素直接热解相似的产物[8]。HALPERN等[11]通过实验发现在酸催化条件下,纤维素及其热解生成的 LG容易进一步反应生成LGO,并提出了如图2所示的LGO生成路径;然而,该机理仅是基于酸催化条件下的LGO生成机理,不具有普遍性。鉴于LGO需要纤维素经历解聚和脱水两种反应而生成,OHNISHI等[14]认为LGO可以通过不止一种反应途径生成,即可由纤维素先解聚生成LG后脱水生成,也可由纤维素先脱水而后再解聚生成,如图3所示,视脱水和解聚反应发生的先后顺序不同,纤维素会经历不同的中间产物形成LGO,LG是LGO生成的前体之一,但不是唯一前体。
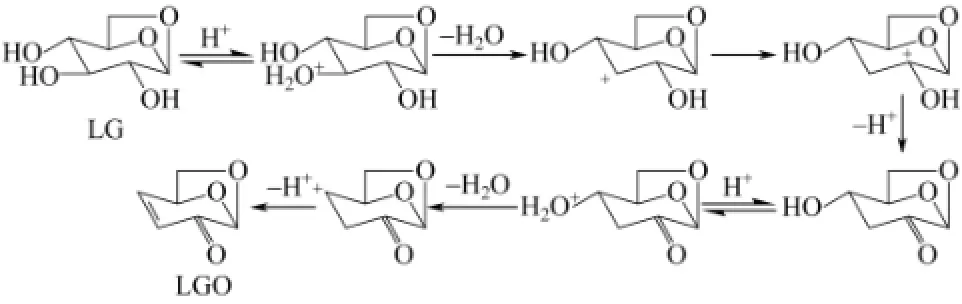
图2 HALPEN等[11]提出的酸催化LG生成 LGO的路径
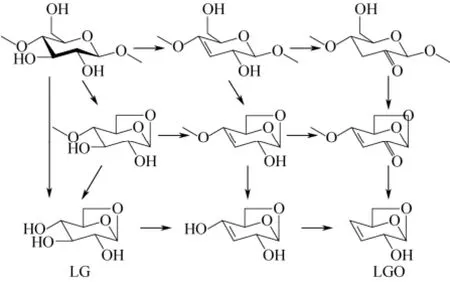
图3 OHNISHI等[14]提出纤维素热解生成LGO的路径
为了确定LGO是否直接来自于LG的脱水反应,LU等[10]分别以纤维素和纯LG为原料进行了热解实验,通过对纤维素进行不同热解温度和时间下的实验结果分析发现,LG与LGO的生成特性完全不同:提高热解温度能促进LG的生成但会抑制LGO的生成;此外,对纯LG的热解实验表明LG具有很好的热稳定性,即使在较高的热解温度下,也仅有少量分解,而且分解产物中 LGO极少。这一实验结果说明了在纤维素的热解过程中,LGO基本不来源于LG的二次分解反应。基于上述结论和前人的研究结果[14],LU等[10]确定LGO主要是由纤维素先脱水再发生糖苷键断裂等反应生成的。
此外,SHAFIZADEH等[15]提出LGO不仅可以由 LG脱水生成,还可以由另一种脱水糖衍生物DGP脱水生成;并通过酸催化热解DGP实验,发现其产物中含有数量可观的 LGO[16]。基于实验结果,SHAFIZADEH等[16]提出了由纤维素的热解产物DGP进一步反应生成LGO的路径,如图4所示。除了上述生成LGO的前体,LIN等[17]还提出LG的同分异构体1,6-脱水-呋喃葡萄糖(AGF)也可以脱水生成LGO,因此LIN等[17]将纤维素热解生成LGO的机理总结如图5所示。
1.3 LGO生成机理的理论
由于实验条件和检测方法的限制,常规的实验研究难以从微观层面揭示反应机理;而密度泛函理论方法可以在分子水平上模拟化学反应,深入揭示葡萄糖和纤维二糖)热解生成 LGO的路径进行了热解反应机理。LU等[18]利用密度泛函理论方法和Gaussian09软件对纤维素的两种模型化合物(吡喃全面计算,详细分析了多条可能的LGO生成路径,并确定了两种模化物各自热解生成 LGO的最优路径,如图6所示。通过计算,LU等[18]发现不论是葡萄糖还是纤维二糖,经由LG生成LGO的路径能垒都较高,不是生成 LGO的最优路径,因此进一步证实了LG不是生成LGO的必经的中间体,与此前的实验结果相吻合[10];葡萄糖和纤维二糖热解生成LGO的最优路径基本一致,由此,LU等[18]进一步推断了纤维素热解生成LGO的反应机理,如图6所示,在纤维素的热解过程中,其单体两侧糖苷键的断裂均可以生成双键;并发生脱水等反应生成LGO。在今后的研究中,还需要进一步对该反应机理的正确性进行验证。
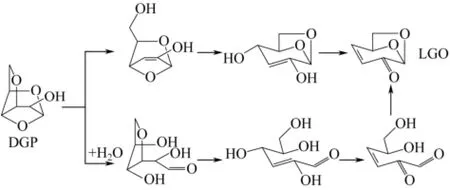
图4 SHAFIZADEH等[16]提出的DGP分解生成LGO的反应路径

图5 LIN等[17]提出的LGO生成机理
2 纤维素/生物质热解生成DGP、APP 和LAC的机理
2.1 DGP、APP和LAC的生成特性
DGP、APP和LAC是另外3种重要的脱水糖产物,但目前对其生成机理的研究还都较少。早先的研究中就已经确定了 DGP和 APP的结构,而LAC的结构于 1988年才首次确定[19]。根据 LU等[10]的研究,在纤维素热解过程中,DGP和APP的生成特性与LGO既有相同之处,也有不同之处。相同之处在于,随着热解温度的升高,DGP和APP的产率均是先增后减,说明高温不利于两者的生成;不同之处在于,LGO仅在纤维素的热解初期生成,而DGP和APP则在整个热解过程中都会生成,且随着热解时间的延长,DGP和APP的产率会有明显的增加。对于LAC,其生成特性与LGO相差很大,提高热解温度和延长热解时间均有利于LAC的生成,通常在500℃以上LAC的产率明显增加,说明充分的热解条件可以促进LAC的生成。
2.2 DGP的生成机理
SHAFIZADEH等[16]基于实验结果提出,DGP是由纤维素单体经过分子内的转糖苷作用和醚化反应生成的,其前体可能是1,4-脱水-α-D-吡喃葡萄糖;并提出了图7所示的DGP生成机理[15]。在图7所示的路径中,LG也是生成 DGP的前体之一,即LG首先异构生成 1,4-脱水-α-D-吡喃葡萄糖,然后进一步发生脱水反应生成DGP。这一观点也得到了LIN等[17]的支持。
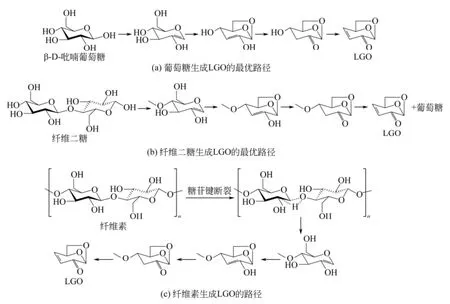
图6 LU等[18]提出的葡萄糖、纤维二糖和纤维素生成LGO的路径

图7 SHAFIZADEH[15]提出的DGP生成机理
2.3 APP和LAC的生成机理
SHAFIZADEH等[20]还对热解过程中APP的生成进行了研究,并基于实验结果提出了可能的APP生成机理,如图8所示,纤维素热解过程中,经历两次连续的糖苷键断裂形成APP。对于LAC的生成机理,FURNEAUX等[19]则提出了 APP是生成LAC的前体这一观点,APP通过苄基重排反应生成LAC,如图8所示。很显然,高温有利于解聚和重排反应的发生,与LAC的生成特性相吻合。
3 纤维素/生物质选择性热解制备LGO的技术开发
在纤维素或生物质的常规热解过程中,LGO的产率非常低。研究人员发现,在热解过程中引入合适的酸催化剂,并控制较低的热解反应温度,可以不同程度地提高LGO的产率[21]。基于此,不同学者对各种酸催化剂进行了筛选,并根据催化剂的特性选用合适的热解方式(酸催化剂直接浸渍负载于生物质原料,或者和生物质原料机械混合),发现了多种有效的酸催化剂,在此基础上开发了不同的纤维素/生物质选择性热解制备LGO的技术,一些重要技术所涉及的原料、催化剂以及 LGO选择性,均列于表1。
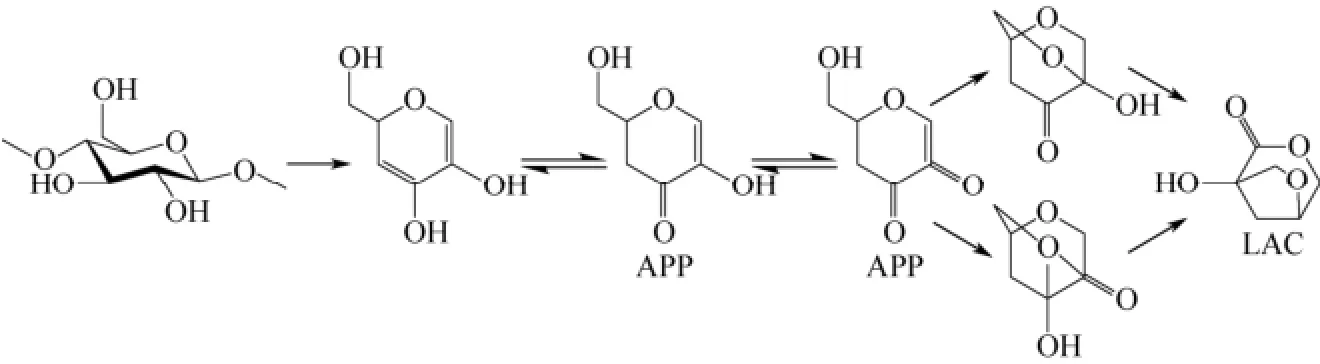
图8 SHAFIZADEH等[20]和FURNEAUX等[19]提出的APP和LAC的生成路径
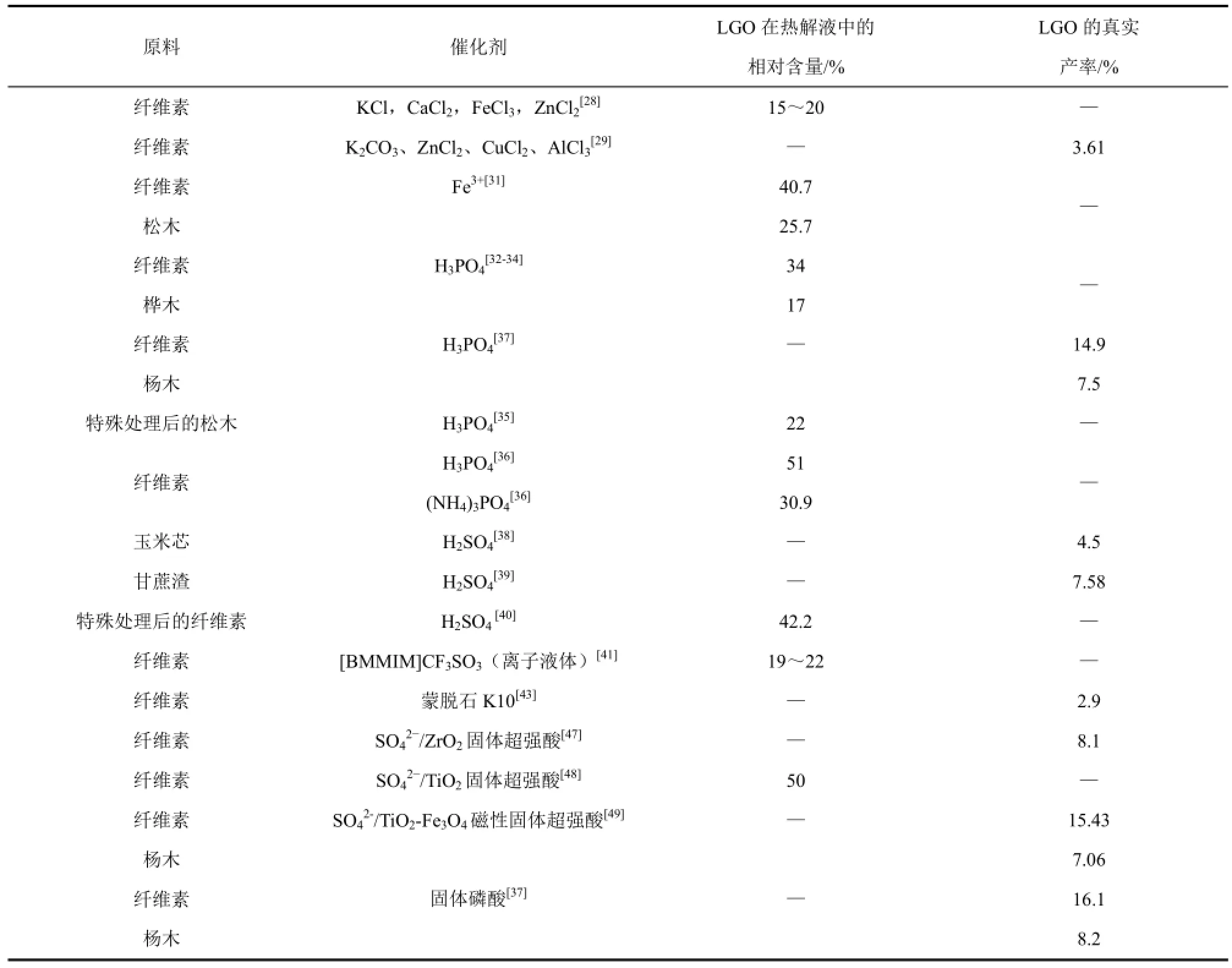
表1 纤维素/生物质催化热解选择性制备LGO的研究结果
3.1 纤维素/生物质浸渍负载酸催化剂后选择性热解制备LGO
3.1.1 金属盐催化剂
不同学者在对金属盐催化热解纤维素/生物质的研究中发现,多种金属氯化物均对 LGO的生成有一定的促进作用,包括 CuCl2、AlCl3、MgCl2、FeCl3以及ZnCl2[22-25],其中ZnCl2的催化效果相对较好[26-28]。当在纤维素/生物质上浸渍负载少量的ZnCl2时,即可抑制纤维素的开裂反应形成各种小分子物质(如羟基乙醛、羟基丙酮等),并显著促进多种脱水糖衍生物(包括LGO)以及呋喃类产物(以糠醛为主)的生成;然而,随着ZnCl2负载量的进一步增加,ZnCl2对LGO的选择性逐渐降低,取而代之的是高纯度的糠醛,这是因为 LGO等脱水糖衍生物在过量的ZnCl2存在下,二次分解生成了糠醛[22]。此外,不同学者还发现其他一些金属盐对LGO的生成也有一定的促进作用,包括K2CO3[29-30]、Fe2(SO4)3[31]等。总的来说,金属盐对LGO的生成虽然有一定的促进作用,但一般会同时促进多种脱水糖衍生物和呋喃类产物的生成,对LGO的选择性并不高。
3.1.2 无机酸催化剂
在众多无机酸催化剂中,对 LGO选择性最高的是磷酸。DOBELE等[32-34]在研究中发现,将纤维素或生物质浸渍磷酸后快速热解可获得富含 LGO的液体产物,并详细考察了磷酸负载量、热解温度、热解时间、纤维素结构等对 LGO形成的影响;以微晶纤维素为原料,浸渍2%的磷酸后在500℃下快速热解,获得的热解产物中 LGO的相对含量最高可达34%,远远高于纯纤维素热解的结果;以桦木为原料,浸渍2.5%的磷酸后在500℃下快速热解获得的液体产物中 LGO的相对含量达到 17%。FU等[35]将磷酸浸渍于铬化砷酸铜处理过的松木后热解也获得了很好的效果,在热解温度为 350℃以及6%磷酸负载量的条件下,其热解产物中LGO的相对含量达到 22%;但当继续增加磷酸浸渍量时,LGO的产率呈下降趋势。NOWAKOWSKI等[36]分别将磷酸和磷酸铵以2%的负载量浸渍于纤维素后,在 350℃温度下进行热解,发现浸渍磷酸和磷酸铵后,热解获得的液体产物中 LGO的相对含量分别增加为纤维素直接热解液体产物中 LGO相对含量的10倍和5倍。ZHANG等[37]采用Py-GC/MS技术,分别以微晶纤维素和杨木为原料,浸渍负载不同含量的磷酸后进行快速热解,确定了负载磷酸含量为5%和热解温度为300℃时,LGO的产率最高,分别达到14.9%和7.5%。
除了磷酸外,硫酸对LGO也有较好的选择性。BRANCA等[38]在研究中发现以玉米芯为原料,硫酸的浸渍量小于0.5%时,催化热解主要促进LG和5-羟甲基糠醛(HMF)的生成;当浸渍量为 1%~3%时,LGO和糠醛的生成得到大幅促进。SUI等[39]详细考察了生物质浸渍硫酸后在较低温度下热解生成 LGO的特性,发现以甘蔗渣为原料,在硫酸负载量为3%、热解温度为270℃时,LGO的产率最高可达7.58%。此外,KAWAMOTO等[40]利用硫酸在环丁飒溶剂中对纤维素进行了催化热解,负载0.1%硫酸在 200℃温度下热解 6min,热解产物中LGO的相对含量可达42.2%。然而,由于硫酸的酸性较强,极易促进 LGO的二次分解反应,因此以其为催化剂时,需要严格控制负载量和热解反应条件,尽量抑制二次反应的发生。
3.1.3 其他液体催化剂
KUDO等[41]考察了离子液体对纤维素催化热解的影响,发现以离子液体(1-丁基-2,3-二甲基咪唑三氟甲磺酸酯)为催化剂热解纤维素,在离子液体浓度为50%、温度为250℃的条件下,热解产物中LGO的相对含量达到了20%。然而采用离子液体作为催化剂,在热稳定性、价格等方面还有一定的欠缺。
3.2 纤维素/生物质与固体酸催化剂机械混合后催化热解制备LGO
上述磷酸、硫酸、氯化锌等作为催化剂时,需要通过浸渍的方式负载到纤维素或生物质上,虽然可以显著提高 LGO的选择性,但在实际应用过程中却会存在一定的问题。首先,LGO的产率极易受这些强酸性催化剂负载量的影响,因此需要严格控制负载量,这会导致原料的预处理过程较为复杂;其次,经热解反应后,催化剂附着于固体焦炭上,不仅难以回收利用,而且也影响了焦炭的使用;再次,这些催化剂的热稳定性多数较差,而且极易进入热解液体产物中,以催化剂的形式促进 LGO的二次反应,导致液体产物中 LGO难以稳定存在。基于上述原因,一些学者提出了采用热稳定性好的固体酸催化剂,和纤维素/生物质机械混合后进行热解制备LGO。
多种固体酸催化剂在和纤维素/生物质机械混合后进行热解时,均能够促进 LGO的生成,包括M/MCM-41(M=Sn,Zr,Ti,Mg等)[42]、蒙脱石K10[43]、金属氧化物(TiO2、Al2O3、MgO、CrO3)[44-46]等。然而,和金属氯化物相似,这些固体酸催化剂可同时促进多种产物的生成,对 LGO的选择性并不高。WANG等[47]首先报道了以固体超强酸(SO42-/ZrO2)为催化剂,和纤维素机械混合后进行快速热解,可以实现高选择性的 LGO制备;在原料与催化剂比例为1∶1、催化热解温度为335℃时,LGO的产率高达 8.1%。LU等[48]将纤维素与SO42-/TiO2型固体超强酸机械混合后进行催化热解,发现在原料与催化剂比例为1∶1、催化热解温度为 350℃时,热解产物中 LGO的相对含量超过50%。为了便于催化剂的回收再利用,LU等[49]进一步制备了磁性固体超强酸催化剂(SO42-/TiO2-Fe3O4),分别用于催化热解微晶纤维素和杨木,当原料与催化剂比例为1∶1、催化热解温度为 300℃时,LGO的产率分别高达 14.9%和7.5%。
除固体超强酸外,ZHANG等[37]还报道了固体磷酸催化剂也对 LGO有着很高的选择性,其以微晶纤维素和杨木为原料,催化热解制备LGO,并在温度为300℃,原料与催化剂比例为1∶1的条件下,获得了最高的LGO产率,分别为16.1%和8.2%。
综合前人的研究可知,无论是固体超强酸还是固体磷酸,用于催化热解纤维素/生物质时,LGO的产率及其在热解液体产物中的纯度都已经较高,选择性热解技术已经较为完善,可望后续进一步优化后进行工业示范,以实现工业化生产。需要说明的是,基于生物质选择性热解技术只能获得富含LGO的热解液体产物,还需进一步分离提纯,才能获得LGO纯品。由于LGO的沸点较低,可通过蒸馏等方法进行分离。MARSHALL[50]研究发现采用真空蒸馏法和硅胶柱层析法均可以有效提纯LGO,其中真空蒸馏法简便易行,分离获得的 LGO纯度可达90%~97%。
4 纤维素/生物质选择性热解制备LAC的技术开发
与LGO的选择性制备相似,LAC也需要在特定的催化热解条件下进行制备。FURNEAUX等[19]发现特定的Lewis酸催化剂能够促进LAC的形成,同时还证明了质子酸催化剂并不能大幅促进 LAC的形成。随后,FABBRI等[45-46]考察了多种沸石以及纳米氧化物对纤维素热解的影响,结果发现纳米钛酸铝催化剂能够选择性促进纤维素热解生成LAC,从而获得富含LAC的生物油,并确定了LAC的产率可高达6%[45]。TORRI等[51]考察了纤维素、淀粉、α-D-葡萄糖、D-甘露糖、D-半乳糖、乳糖、LG及其 4-O-乙酰基衍生物等碳水化合物催化热解的产物分布,进一步确认了纳米钛酸铝对LAC的高选择性,同时还发现了以非还原糖为原料催化热解获得的LAC显著高于还原糖原料。此外,由于Lewis酸位的数量在很大程度上决定了 LAC的形成,TOTTI等[42]制备了多种金属改性的MCM-41催化剂以提高催化剂的Lewis酸位,结果发现Sn(Ⅳ)和Zr(Ⅳ)的引入显著提高了催化剂的 Lewis酸位,在催化热解纤维素过程中,对LAC表现出了较好的选择性。此外还有一些催化剂也表现出了对LAC的选择性,例如锌盐[26,52]、蒙脱土K10[53]等,但选择性低于纳米钛酸铝和Sn-MCM-41。最近,MANCINI等[54]在前人的研究基础上采用1H NMR和FTIR技术对Sn-MCM-41、纳米钛酸铝和蒙脱土K10催化热解纤维素获得的LAC进行了定量分析,结果表明在500℃下,以Sn-MCM-41为催化剂催化热解纤维素获得了最大的LAC产率,为7.6 %。
综合前人的研究可知,现阶段已初步筛选获得了一些有效的催化剂,可实现LAC的选择性制备,但现有的研究均是以纤维素为原料,尚未有以生物质为原料催化热解制备LAC的报道,这可能是因为现有催化剂不能有效抑制半纤维素和木质素对LAC生成的不利影响。由于LAC选择性制备的核心是催化剂,因此今后的研究还需要开发高效的催化剂(含有较多Lewis酸位的纳米催化剂)以提高生物质催化热解生成LAC的产率。此外,关于从热解液体产物中分离提纯LAC,目前还少有研究。MANCINI等[54]从分析化学的角度,利用高效液相色谱(HPLC)技术成功分离得到了纯化的LAC;但适用于工业应用的LAC分离方法,目前还没有研究报道。
现阶段针对APP以及DGP的选择性制备的报道很少,主要是因为现阶段所研究的催化剂均没有表现出对这两种产物的选择性,因此今后的研究还需要在明确APP和DGP生成机理的基础上开发对APP和DGP具有高选择性的催化剂以及催化热解工艺。
5 结语和展望
纤维素/生物质快速热解过程中会生成多种脱水糖衍生物,其中LGO、DGP、APP和LAC 4种脱水糖衍生物均具有较高的化工应用附加值。LGO是纤维素经历解聚和脱水反应而形成的产物,不同学者基于实验研究提出了纤维素经由不同的解聚和脱水反应方式(不同的中间体)生成 LGO的反应途径,并证实了LGO基本不来源于LG的脱水反应;然而常规的实验研究无法确定 LGO的主要生成途径。此外,还有学者基于密度泛函理论计算方法,深入研究并确定了纤维素模型化合物(吡喃葡萄糖和纤维二糖)热解生成 LGO的最优路径,并据此推断出了纤维素热解生成 LGO的主要途径;今后还需要对该反应机理的正确性进行验证。对于DGP、APP和LAC的生成机理,目前还只有简单的实验研究,还需在今后的研究中采用密度泛函理论计算等手段进一步确认。
纤维素/生物质常规热解过程中,上述脱水糖衍生物的产率都很低;对于LGO和LAC,目前已有一些高效的选择性制备技术。以磷酸、硫酸、固体超强酸、固体磷酸等作为催化剂,对纤维素/生物质进行催化热解,可以实现LGO的高选择性制备,特别是以固体酸为催化剂制备 LGO时,工艺技术较为简单,可望后续进一步优化后进行工业示范以实现LGO的工业化生产。此外,以纳米钛酸铝、Sn-MCM-41等作为催化剂,对纤维素进行催化热解,可以实现LAC的选择性制备;但目前还无法以生物质为原料选择性制备LAC,因此今后还需要开发用于催化热解生物质选择性制备 LAC的高效催化剂。对于APP和DGP,现阶段还没有开发出高效的选择性制备催化剂;在今后的研究中,还需要进一步明确其热解生成机理,并在此基础上开发合适的催化剂以及催化热解工艺,实现其高选择性制备。
参 考 文 献
[1] 林木森,蒋剑春. 生物质快速热解技术现状[J]. 生物质化学工程,2006,40(1):21-26.
[2] SHEN Dekui,WEI Jin,JUN Hu,et al. An overview on fast pyrolysis of the main constituents in lignocellulosic biomass to valued-added chemicals:structures,pathways and interactions[J]. Renewable and Sustainable Energy Reviews,2015,51:761-774.
[3] 李军,魏海国,杨维军,等. 生物质热解液化制油技术进展[J]. 化工进展,2010,29(s1):43-47.
[4] 朱锡峰. 生物质热解液化技术研究与发展趋势[J]. 新能源进展,2013,1(1):32-37.
[5] 黄金保,刘朝,魏顺安. 纤维素单体热解机理的热力学研究[J]. 化学学报,2009,67(18):2081-2086.
[6] MA Longlong,WANG Tiejun,LIU Qiying,et al. A review of thermal-chemical conversion of lignocellulosic biomass in China[J]. Biotechnology Advances,2012,30(4):859-873.
[7] SHEN Dekui,GU Sai,BRIDGWATER A V. The thermal performance of the polysaccharides extracted from hardwood:cellulose and hemicellulose[J]. Carbohydrate Polymers,2010,82(1):39-45.
[8] PATWARDHAN P R,SATRIO J A,BROWN R C,et al. Product distribution from fast pyrolysis of glucose-based carbohydrates[J]. Journal of Analytical and Applied Pyrolysis,2009,86(2):323-330.
[9] DONG Changqing,ZHANG Zhifei,LU Qiang,et al. Characteristics and mechanism study of analytical fast pyrolysis of poplar wood[J]. Energy Conversion and Management,2012,57:49-59.
[10] LU Qiang,YANG Xiaochu,DONG Changqing,et al. Influence of pyrolysis temperature and time on the cellulose fast pyrolysis products:analytical Py-GC/MS study[J]. Journal of Analytical and Applied Pyrolysis,2011,92(2):430-437.
[11] HALPERN Y,RIFFER R,BROIDO A. Levoglucosenone (1,6-anhydro-3,4-dideoxy-△3-β-D-pyranosen-2-one). A major product of the acid-catalyzed pyrolysis of cellulose and related carbohydrates[J]. The Journal of Organic Chemistry,1973,38: 204-209.
[12] 卫新来,隋先伟,俞志敏,等. 生物质催化热解制备左旋葡萄糖酮的研究进展[J]. 化工进展,2014,33(4):873-877.
[13] URABE D,NISHIKAWA T,ISOBE M. An efficient total synthesis of optically active tetrodotoxin from levoglucosenone[J]. Chemistry:An Asian Journal,2006,1(1/2):125-135.
[14] OHNISHI A,KATO K,TAKAGI E. Curie-point pyrolysis of cellulose[J]. Polymer Journal,1975,7(4):431-437.
[15] SHAFIZADEH F. Saccharification of lignocellulosic materials[J]. Pure and Applied Chemistry,1983,55(4):705-720.
[16] SHAFIZADEH F,FURNEAUX R H,STEVENON T T,et al. Acid-catalyzed pyrolytic synthesis and decomposition of 1,4:3,6-dianhydro-α-D-glucopyranose[J]. Carbohydrate Research,1978,61:519-528.
[17] LIN Yuchuan,CHO J,TOMPSETT G A,et al. Kinetics and mechanism of cellulose pyrolysis[J]. The Journal of Physical Chemistry C,2009,113:20097-20107.
[18] LU Qiang,ZHANG Yang,DONG Cangqing,et al. The mechanism for the formation of levoglucosenone during pyrolysis of β-D-glucopyranose and cellobiose:a density functional theory study[J]. Journal of Analytical and Applied Pyrolysis,2014,110: 34-43.
[19] FURNEAUX R H,MASON J M,MILLER I J. A novel hydroxylactone from the Lewis acid catalysed pyrolysis of cellulose[J]. Journal of the Chemical Society Perkin Transactions,1988,1(1):49-51.
[20] SHAFIZADEH F,FURNEAUX R H,STEVENON T T,et al. 1,5-Anhydro-4-deoxy-d-glycero-hex-1-en-3-ulose and other pyrolysis products of cellulose[J]. Carbohydrate Research,1978,67(2): 433-447.
[21] OHTANI H,KOMURA T,SONODA N,et al. Evaluation of acidic paper deterioration in library materials by pyrolysis-gas chromatography[J]. Journal of Analytical and Applied Pyrolysis,2009,85(1):460-464.
[22] RUTKOWSKI P. Pyrolysis of cellulose,xylan and lignin with the K2CO3and ZnCl2addition for bio-oil production[J]. Fuel Processing Technology,2011,9(3):517-522.
[23] BLABI C D,BRANCA C,GALGANO A. Products and global weight loss rates of wood decomposition catalyzed by zinc chloride[J]. Energy and Fuels,2008,22(1):663-670.
[24] RUTKOWSKI P. Chemical composition of bio-oil produced by co-pyrolysis of biopolymer/polypropylene mixtures with K2CO3and ZnCl2addition[J]. Journal of Analytical and Applied Pyrolysis,2012,95(5):38-47.
[25] SCHWARZINGER C,BREUER G,KLAMPFL C,et al. Investigations on the effect of metal ions on the products obtained from the pyrolysis of cellulose[J]. Acta Chimica Slovenica,2006,53 (4):437-443.
[26] LU QIANG,DONG Changqing,ZHANG Xuming,et al. Selective fast pyrolysis of biomass impregnated with ZnCl2to produce furfural:analytical Py-GC/MS study[J]. Journal of Analytical and Applied Pyrolysis,2011,90(2):204-212.
[27] LU Qiang,WANG Zhi,DONG Changqing,et al. Selective fast pyrolysis of biomass impregnated with ZnCl2:furfural production together with acetic acid and activated carbon as by-products[J]. Journal of Analytical and Applied Pyrolysis,2011,91(1):273-279.
[28] 陆强,张栋,朱锡锋. 四种金属氯化物对纤维素快速热解的影响(Ⅱ)机理分析[J]. 化工学报,2010,4(4):1025-1032.
[29] PIOTR R. Chemical composition of bio-oil produced by co-pyrolysis of biopolymer/polypropylene mixtures with K2CO3and ZnCl2addition[J]. Journal of Analytical and Applied Pyrolysis,2012,95: 38-47.
[30] PIOTR R. Catalytic effects of copper (Ⅱ) chloride and aluminum chloride on the pyrolytic behavior of cellulose[J]. Journal of Analytical and Applied Pyrolysis,2012,98:86-97.
[31] DOBELE G,ROSSINSKAJA G,DIZHBITE T,et al. Application of catalysts for obtaining 1,6-anhydrosaccharides from cellulose and wood by fast pyrolysis[J]. Journal of Analytical and Applied Pyrolysis,2005,74(1/2):401-405.
[32] DOBELE G,ROSSINSKAJA G,TELYSHEYA G,et al. Cellulose dehydration and depolymerization reactions during pyrolysis in the presence of phosphoric acid[J]. Journal of Analytical and Applied Pyrolysis,1999,49(1):307-317.
[33] DOBELE G,MEIER D,FAIX O,et al. Volatile products of catalytic flash pyrolysis of celluloses[J]. Journal of Analytical and Applied Pyrolysis,2001,58(2):453-463.
[34] DOBELE G,DIZHBITE T,ROSSINSKAJA G,et al. Pre-treatment of biomass with phosphoric acid prior to fast pyrolysis:a promising method for obtaining 1,6-anhydrosaccharides in high yields[J]. Journal of Analytical and Applied Pyrolysis,2003,3:197-211.
[35] FU Q,ARGYROPOULOS D S,TILOTTA D C,et al. Understanding the pyrolysis of CCA-treated wood:Part Ⅱ. Effect of phosphoricacid[J]. Journal of Analytical and Applied Pyrolysis,2008,82(1): 140-144.
[36] NOWAKOWSKI D J,WOODBRIDGE C R,JONES J M. Phosphorus catalysis in the pyrolysis behaviour of biomass[J]. Journal of Analytical and Applied Pyrolysis,2008,83(2):197-204.
[37] ZHANG Zhibo,LU Qiang,YE Xiaoning,et al. Selective production of levoglucosenone from catalytic fast pyrolysis of biomass mechanically mixed with solid phosphoric acid catalysts[J]. Bioenergy Research,2015,8(3):1-12.
[38] BRANCA C,GALGANO A,BLASI C,et al. H2SO4-catalyzed pyrolysis of corncobs[J]. Energy Fuels,2010,25(1):359-369.
[39] SUI Xianwei,WANG Zhi,LIAO Bing,et al. Preparation of levoglucosenone through sulfuric acid promoted pyrolysis of bagasse at low temperature[J]. Bioresource Technology,2012,103:466-469.
[40] KAWAMOTO H,SAITO S,HATANAKA W,et al. Catalytic pyrolysis of cellulose in sulfolane with some acidic catalysts[J]. Journal of Wood Science,2007,53(2):127-133.
[41] KUDO S,ZHOU Z,NORINAGA K,et al. Efficient levoglucosenone production by catalytic pyrolysis of cellulose mixed with ionic liquid[J]. Green Chemistry,2011,13(11):3306-3311.
[42] TORRI C,LESCI I G,FABBRI D. Analytical study on the pyrolytic behaviour of cellulose in the presence of MCM-41 mesoporous materials[J]. Journal of Analytical and Applied Pyrolysis,2009,85: 192-196.
[43] PIOTR R. Pyrolytic behavior of cellulose in presence of montmorillonite K10 as catalyst[J]. Journal of Analytical and Applied Pyrolysis,2012,98:115-122.
[44] FU Q,ARGYROPOULOS D S,TILOTTA D C,et al. Understanding the pyrolysis of CCA-treated wood:Part I. effect of metal ions[J]. Journal of Analytical and Applied Pyrolysis,2008,81(1):60-64.
[45] FABBRI D,TORRI C,MANCINI I. Pyrolysis of cellulose catalysed by nanopowder metal oxides:production and characterisation of a chiral hydroxylactone and its role as building block[J]. Green Chemistry,2007,9(9):1374-1379.
[46] FABBRI D,TORRI C,BARAVELLI V. Effect of zeolites and nanopowder metaloxides on the distribution of chiral anhydrosugars evolved from pyrolysis of cellulose:an analytical study[J]. Journal of Analytical and Applied Pyrolysis,2007,80(1):24-29.
[47] WANG Zhi,LU Qiang,ZHU Xifeng,et al. Catalytic fast pyrolysis of cellulose to prepare levoglucosenone using sulfated zirconia[J]. ChemSusChem,2011,4(1):79-84.
[48] LU Q,ZHANG Xuming,ZHANG Zhibo,et al. Catalytic fast pyrolysis of cellulose mixed with sulfated titania to produce levoglucosenone:analytical Py-GC/MS sdtdy[J]. Bioresources,2012,7(3):2820-2834.
[49] LU Q,YE Xiaoning,ZHANG Zhibo,et al. Catalytic fast pyrolysis of cellulose and biomass to produce levoglucosenone using magnetic SO42-/TiO2-Fe3O4[J]. Bioresource Technology,2014,171(171C): 10-15.
[50] MARSHALL J A. An improved preparation of levoglucosenone from cellulose[D]. US,Iowa:Iowa State University,2008.
[51] TORRI C,LESCI I G,FABBRI D. Analytical study on the production of a hydroxylactone from catalytic pyrolysis of carbohydrates with nanopowder aluminium titanate[J]. Journal of Analytical and Applied Pyrolysis,2009,84(1):25-30.
[52] EIBONER S,FRANCOIS B,JOEL B,et al. Catalytic effect of metal nitrate salts during pyrolysis of impregnated biomass[J]. Journal of Analytical and Applied Pyrolysis,2015,113:143-152.
[53] RUTKOWSKI P. Pyrolytic behavior of cellulose in presence of montmorillonite K10 as catalyst[J]. Journal of Analytical and Applied Pyrolysis,2012,98(10):115-122.
[54] MANCINI I,DOSI F,DEFANT A,et al. Upgraded production of (1R,5S)-1-hydroxy-3,6-dioxa-bicyclo[3.2.1]octan-2-one from cellulose catalytic pyrolysis and its detection in bio-oils by spectroscopic methods[J]. Journal of Analytical and Applied Pyrolysis,2014,110:285-290.
Progress in formation mechanism and selective production of anhydrosugar derivatives from pyrolysis of cellulose/biomass
DONG Xiaochen,YE Xiaoning,ZHANG Zhibo,HU Bin,LU Qiang,DONG Changqing
(National Engineering Laboratory for Biomass Power Generation Equipment,North China Electric Power University,Beijing 102206,China)
Abstract:During the fast pyrolysis of cellulose/biomass,various anhydrosugar derivatives are produced,including levoglucosenone (LGO),1,4:3,6-dianhydro-α-D-glucopyranose (DGP),1,5-anhydro-4-deoxy-D-glycero-hex-1-en-3-ulose (APP) and 1-hydroxy-3,6-dioxabicyclo[3.2.1]octan-2-one (LAC). The four anhydrosugar derivatives all have high application values in chemical industry. However,for the conventional pyrolysis process,the yields of them are very low,which makes their separation very difficult. Whereas,under proper catalytic pyrolysis conditions,the yields can be greatly improved,so as to achieve their selective production. This paper firstly summarizes the experimental and theoretical studies on the formation mechanism of the four anhydrosugar derivatives,and then describes the selective production techniques of the LGO and LAC,including the best catalysts and the catalytic pyrolysis reaction conditions. Finally,future researches are proposed to disclose the formation mechanism and optimize the selective production techniques of the anhydrosugar derivatives.
Key words:cellulose;biomass;pyrolysis;selectivity
中图分类号:TK 6
文献标志码:A
文章编号:1000-6613(2016)05-1387-09
DOI:10.16085/j.issn.1000-6613.2016.05.018
收稿日期:2015-10-20;修改稿日期:2015-11-06。
基金项目:国家自然科学基金(51276062)及中央高校基本科研业务经费(2014ZD17)项目。
