催产素受体在雌性山羊颈动脉体的分布
2016-07-14金秀芳徐永平
黄 双,孙 曼,金秀芳,徐永平,李 强
(西北农林科技大学动物医学院,杨凌 712100)
催产素受体在雌性山羊颈动脉体的分布
黄双,孙曼,金秀芳,徐永平*,李强
(西北农林科技大学动物医学院,杨凌 712100)
研究催产素受体(OTR)在雌性山羊颈动脉体(CB)中是否存在及其分布特点,为催产素(OT)是否对CB起调节作用提供形态学基础。用免疫组织化学SP法对雌性山羊的CB进行OTR免疫组织化学染色,观察CB中OTR的分布特点。结果显示,在雌性山羊CB的实质细胞群和间质组织中均有不同程度的OTR阳性反应产物存在。OTR强阳性产物分布在Ⅰ型细胞、Ⅱ型细胞的细胞质和细胞膜,在Ⅰ型细胞的细胞核呈弱阳性表达,在Ⅱ型细胞的细胞核呈强阳性表达。在间质组织中,血管内皮细胞和神经纤维中有中等阳性反应产物存在,并且实质细胞群和间质组织的OTR相对表达量差异性极显著(P<0.01)。结果表明,OTR主要分布于CB的实质细胞群中,CB具备接受OT调控的条件。因此,催产素可以通过激活CB中的OTR来影响CB的功能活动。
颈动脉体;催产素受体;免疫组织化学SP法;雌性山羊
1895年,G.Oliver等研究发现垂体后叶提取物具有血管收缩活性[1],1906年,英国生理学家H.H.Dale证实垂体后叶提取物具有促进子宫收缩的活性[2]。1928年,O.Kamm在垂体后叶提取物中分离出血管加压素(vasopressin)和催产素(oxytocin,OT)[3],直至1953年,V.Du Vigneaud等研究确定了催产素的化学结构,为一种九肽化合物,并进行了人工合成[4],因此获得1955年诺贝尔化学奖。催产素(oxytocin,OT)主要是由下丘脑室旁核和室上核神经元合成后经轴浆运输并贮存于神经垂体的一类神经肽类化合物,OT具有促进子宫收缩和乳汁分泌的作用。但是,随着对OT研究的不断深入,发现OT除了对生殖系统发挥作用外,也可作为神经递质或神经调质影响中枢神经系统的活动,如学习、记忆、睡眠觉醒、影响药物成瘾性及对社会适应性行为等,还可以参与机体其他系统的活动,如体温的调节和心血管系统的调节等活动[5]。M.V.Sofroniew等发现,来自室旁核的催产素能神经纤维可直接投射到脑干背侧,脑干背侧是调节心血管活动的重要区域[6]。W.Gaida等发现在患高血压大鼠的下丘脑OT表达量明显降低,并且在外周注射催产素可以降低大鼠的平均动脉压,提示OT与血压、血管紧张性调节相关[7]。OT的生物活性是由催产素受体(oxytocin receptor,OTR)介导的[8],在杏仁核、海马、脑干等脑区都有OTR分布,提示OT可以通过影响中枢神经系统的OTR进而对心血管系统发挥调节作用。OT不仅可作用于中枢OTR网络,也可经神经垂体系统释放到外周循环,作用于外周的OTR。M.Jankowski等在大鼠的心以及肺动脉和腔静脉等大血管的血管内皮细胞内也检测到OTR的分布[9],提示OT也可以直接作用于分布在心血管系统的OTR,从而影响心血管的功能活动。 因此,OT可以直接作用于心血管系统的OTR或者间接作用于心血管神经中枢的OTR进而影响心血管的功能活动。
颈动脉体(carotid body,CB)是由神经嵴衍生而来的一个重要的外周化学感受器[10],位于颈总动脉的分叉处,能感受动脉血液中的PO2、PCO2和pH的变化,并将化学信号转为电信号,通过窦神经传入到脑干区域的呼吸中枢和心血管中枢,在呼吸、心血管和神经体液的调节中发挥重要作用。OT能通过中枢神经系统间接调节心血管活动,也能通过外周循环直接作用于心血管系统,颈动脉体作为重要的外周化学感受器,对心血管活动的调节发挥着重要的作用。那么,在颈动脉体内是否存在OTR?OT能否通过作用于CB进而影响心血管的活动呢?作者采用免疫组织化学SP法检测OTR在颈动脉体的分布,为进一步探索OT能否通过影响外周化学感受器CB进而对心血管活动进行调节提供形态学依据。
1 材料与方法
1.1试验材料
健康非妊娠雌性成年关中奶山羊5只(均来自陕西杨凌屠宰场);内源性生物素阻断试剂盒(货号:BLK-0001,购自福州迈新生物技术开发有限公司);免疫组织化学SP超敏试剂盒(兔)(货号:KIT-9706,购自福州迈新生物技术开发有限公司);兔抗大鼠OTR多克隆抗体(货号:BA23081,购自武汉博士德生物工程有限公司);DAB试剂盒(美国sigma,货号:M1417-1,购自福州迈新生物技术开发有限公司);抗体稀释液(货号:CW2340,购自北京康为世纪生物公司);Leica石蜡切片机(型号:LeicaRM2235,德国Leica公司),Motic生物显微镜(型号:BA310,Motic实业集团有限公司厦门总部)等。
1.2方法
1.2.1颈动脉体石蜡切片制作将山羊保定、麻醉、颈动脉放血处死后,从寰枕关节处将羊头取下,从颈动脉的断端分离至颈动脉分叉处,迅速取下两侧CB,立即投入40 g·L-1多聚甲醛磷酸缓冲固定液中固定10 h以上。固定好的组织块经修整后用流动自来水冲洗12 h,在体积分数分别为50%、70%、80%、90%、95%、100%的梯度酒精中脱水,二甲苯透明,石蜡包埋,蜡块修整后,切片(5 μm),恒温水浴锅中展片,贴片,烘箱烘干。切片分为4套,第一套做HE染色,作为组织定位对照,第二套做免疫组织化学SP法OTR阳性组织细胞定位,第三套切片用于免疫组织化学SP法染色后做苏木精复染,第四套做免疫组织化学SP法OTR空白对照,以确定反应的特异性。
1.2.2HE染色将第一套切片脱蜡、复水后,苏木精染色10 min、1%盐酸-乙醇分化20 s、流动自来水冲洗30 min、伊红染色5 min、脱水、透明、中性树胶封片、晾干、Motic显微镜下观察,拍照。
1.2.3免疫组织化学SP法染色第二套和第三套切片经脱蜡、复水后,放入柠檬酸盐缓冲液中进行抗原热修复20 min后,自然冷却至室温,滴加内源性生物阻断剂A、B液各孵育20 min,按照免疫组织化学SP法试剂盒说明书,依次滴加A、B液各孵育10 min,之后加兔抗大鼠OTR多克隆抗体(稀释倍数为1∶200)于4 ℃条件下过夜,隔天取出复温后,再依次滴加C、D液各孵育10 min,各步骤之间用PBS液冲洗,DAB显色。其中第三套切片DAB显色后进行苏木精复染,以对阳性结构进行定位观察,脱水,透明,封片。第四套切片染色过程用PBS液代替一抗,其余过程同上。

2 结 果
山羊颈动脉体HE染色见图1,OTR免疫组织化学SP法染色见图2。

a.Ⅰ型细胞;b.Ⅱ型细胞;c.微血管;d.血管内皮细胞a.Type Ⅰ cell;b.Type Ⅱ cell;c.Microvascular;d.Vascular endothelial cells图1 雌性山羊颈动脉体HE染色Fig.1 HE staining of the CB of female goat

A.OTR的免疫组织化学SP法染色;B.OTR的免疫组织化学SP法染色;C.OTR的免疫组织化学SP法染色及苏木精复染;D.OTR的免疫组织化学SP法阴性对照组及苏木精复染;比例尺=20 μm;a.Ⅰ型细胞;b.Ⅱ型细胞;c.微血管;d.小动脉;e.小静脉;f.血管内皮细胞A.Immunohistochemical SP staining of OTR;B.Immunohistochemical SP staining of OTR;C.Immunohistochemical SP staining of OTR and hematoxylin counterstain of OTR;D.Immunohistochemical SP staining of OTR of the negative control group and hematoxylin counterstain;bar=20 μm;a.Type Ⅰ cell;b.Type Ⅱ cell;c.Microvascular;d.Small artery;e.Small vein;f.Vascular endothelial cells图2 雌性山羊颈动脉体OTR免疫组织化学SP法染色Fig.2 Immunohistochemical staining of OTR in CB of female goat
2.1颈动脉体HE染色
雌性山羊的CB位于颈总动脉的分叉处后方,借由结缔组织连于动脉壁上,其上连接有舌咽神经、鲱鱼神经等。HE染色结果显示,雌性山羊CB由实质细胞、毛细血管和神经纤维以及结缔组织成分构成,实质细胞包括有Ⅰ型细胞和Ⅱ型细胞,Ⅰ型细胞细胞核呈椭圆形,数量多,体积大,Ⅱ型细胞细胞核呈长条形,数量少,体积小,两种细胞数量比为(3~5)∶1,数个Ⅰ型细胞聚集成团,Ⅱ型细胞包绕在其周围,形成小叶状结构,结缔组织包绕小叶,中间穿插着毛细血管和神经纤维等结构(图1)。
2.2雌性山羊颈动脉体OTR免疫组织化学SP法染色
阴性对照组经苏木精复染后只见蓝色(图2,D),无其他着色,表明OTR的SP染色无非特异性着色。根据颈动脉体内阳性颗粒产物的染色程度,将结果分为四个等级:棕黄色为强阳性;黄色为中等阳性;淡黄色为弱阳性;无着色为阴性。
试验组SP染色结果显示,OTR在雌性山羊的CB中广泛分布,在实质细胞群中,Ⅰ型细胞、Ⅱ型细胞和微血管内皮细胞有不同程度阳性着色,在间质组织中,神经纤维、小动脉和小静脉的血管内皮细胞有不同程度着色,结缔组织无着色。在Ⅰ型细胞(图2,A-a,B-a)中有呈颗粒状的OTR免疫阳性产物分布,在细胞膜和细胞质的染色最强,为棕黄色,呈强阳性;细胞核染色为无色或淡黄色,基本为空泡状,呈阴性或弱阳性。Ⅱ型细胞(图2,A-b,B-b)中OTR免疫阳性产物为棕黄色,呈强阳性。实质细胞群和间质中穿插的微血管、小动脉、小静脉的血管内皮细胞呈黄色,呈中等阳性(图2,A-c,B-d,B-e)。在包裹着实质细胞群的周围结缔组织结构中,基本无OTR免疫阳性着色,呈阴性,结缔组织中穿行的神经纤维呈黄色,呈中等阳性。图像分析显示CB中OTR免疫阳性物质在实质细胞群的平均光密度为0.447±0.560,非实质细胞的平均光密度为0.214±0.423,实质细胞群的平均光密度极显著高于非实质细胞结构(P<0.01)。
2.3雌性山羊颈动脉体OTR阳性表达区域的平均光密度
平均光密度值分析结果(表1)表明:雌性山羊CB中实质细胞群的平均光密度值极显著高于间质组织(P<0.01)。

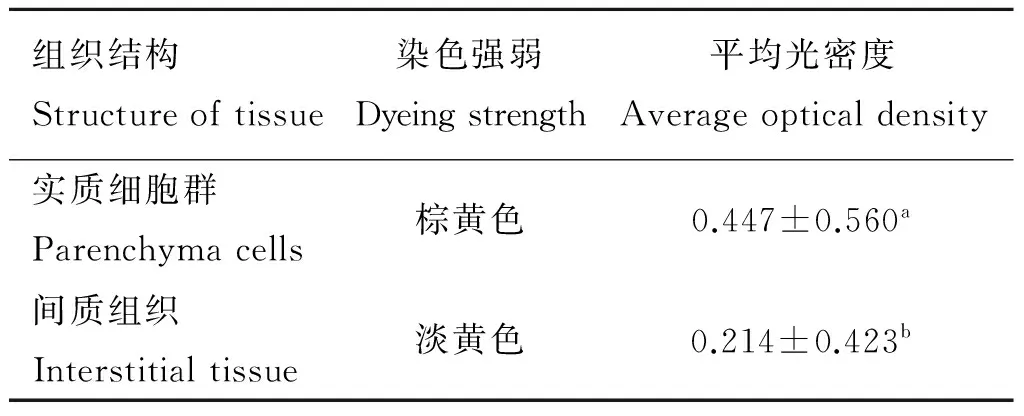
组织结构Structureoftissue染色强弱Dyeingstrength平均光密度Averageopticaldensity实质细胞群Parenchymacells棕黄色0.447±0.560a间质组织Interstitialtissue淡黄色0.214±0.423b
所标字母不同表示差异极显著(P<0.01)
Different letter in the same row means very significant different between treatments(P<0.01)
3 讨 论
OT主要是由下丘脑室旁核和视上核的神经元合成,具有激素和神经递质的双重作用。OT除了能作为生殖激素发挥促进子宫收缩和排乳等生理作用外,还可以作为神经递质发挥非生殖调控作用,如社会行为、认知、体温调节、心血管活动调节等[11]。OT对心血管活动的作用途径相当广泛,它可通过作用于中枢和外周神经系统、外周器官(如心、血管和肾)以及通过影响其他调节因子(如心房钠尿肽、NO和α2肾上腺素能受体)影响心血管系统的活动[12]。
在中枢神经系统,OT能神经纤维投射到不同的脑区,可以与脑干内调节心血管系统的神经核团形成突触联系[13]。在大脑孤束核也存在较高浓度的OT,孤束核接受内脏反射和心血管系统压力感受器的感觉传入神经纤维。在大鼠的迷走神经运动背核显微注射OT也能降低心率。OT发挥调节作用和信号传导都是由OTR介导的,OTR属于G蛋白偶联受体家族[14],根据OTR偶联的特异的G蛋白,细胞类型以及在膜上的不同位置,催产素能激活不同的第二信使,导致不同的生理作用[15]。OTR mRNA在脑中的分布区域基本上与OT的结合位点一致[16-17]。在外周神经系统,任妮等通过采用免疫组织化学SP法证明OTR在雌性山羊颈胸神经节中广泛分布,心及附近大血管的交感神经支配主要来自颈胸神经节[18],OT能通过影响该交感神经途径调节心血管的活动。OT不仅能通过作用于中枢和外周神经系统间接的影响心血管系统活动,也能通过神经垂体后叶释放到外周血液循环,对心血管系统发挥直接的调节作用。在外周注射OT会降低大鼠的平均动脉压[19],M.Jankowski等发现,在离体灌注的心中,OT具有促进心房钠尿肽(atrial natriuretic peptide,ANP)释放和降低心率以及心肌收缩力的作用[20]。在主动脉和腔静脉内的OT浓度高于心脏右心室浓度,说明OT可能通过自分泌或旁分泌作用对血压和血流量发挥直接的调节作用[9]。在大鼠的心以及肺动脉和腔静脉等大血管的血管内皮细胞内也检测到OTR的分布,提示OT可能作为内分泌激素通过直接作用于心和血管内的OTR,参与内分泌调节作用,调节心血管活动[21-22]。以上资料表明,OT可通过中枢神经系统、外周交感神经途径以及直接作用于靶器官来调节心血管系统的活动,但OT能否通过影响外周化学感受器来调节心血管的活动尚未见报道。受体的存在对激素的调节作用具有重要的意义,因此,采用免疫组织化学方法检测OTR在外周化学感受器CB内是否存在,能为OT是否能影响CB的活动提供一定的形态学依据。
CB是机体内重要的感知血液内化学信号的外周化学感受器,在机体血液内出现O2分压降低、CO2分压升高、H+浓度增加等变化时,CB能感受动脉血变化而使机体发生适应性改变[23]。CB的实质细胞群包括Ⅰ型细胞(球细胞)和Ⅱ型细胞(支持细胞)[24],球细胞内含有丰富的神经递质,认为其属神经内分泌细胞,是CB神经体液调节体系中的一个重要的信息整合枢纽[25-26]。试验结果显示,OTR在球细胞的细胞质和细胞膜表达呈强阳性,说明CB的球细胞是OT影响CB作用的主要靶点,OT可能通过激活球细胞内的OTR影响球细胞内神经递质的释放,进而通过神经内分泌的途径影响CB对心血管活动的调节作用。在包裹着实质细胞的间质组织中穿行的神经纤维上OTR免疫阳性产物呈中等阳性,熊喜龙等利用HRP法对CB的神经支配进行分析,发现CB受舌咽神经远节(岩神经节)和颈上节(颈前神经节)发出的神经支配,CB还接受发自颈动脉窦神经、结状神经节的神经支配,丰富的神经纤维成分为颈动脉体调节心血管活动提供丰富的神经通路[27],提示OT对CB的影响可能存在感觉、交感、副交感神经通路。颈动脉体是一个血管极其丰富的器官,具有很高的血流/体积比,颈动脉体的供血小动脉主要来自枕动脉和颈内动脉、颈外动脉的分支,后又分支为无数微动脉,穿行于颈动脉体的实质细胞群和间质中,在间质间的小动脉和小静脉的血管内皮细胞也存在OTR免疫阳性产物,提示催产素可能通过OTR调节CB的局部血流量。
CB作为重要的化学感受器,其功能活动直接影响机体的心血管活动,以适机体不同生理时期的活动。本试验通过从外周化学感受器CB着手,通过对其上OTR的检测,发现OTR在CB内广泛分布,提示CB具备接受OT调控的条件,并将外周化学感受器和中枢神经系统的作用相互联系起来,丰富了OT的非生殖调控作用和CB的神经内分泌调节作用。
[2]DALE H H.On some physiological actions of ergot[J].JPhysiol,1906,34(3):163-206.
[3]KAMM O.The dialysis of pituitary extracts[J].Science,1928,67(1729):199-200.
[4]DU VIGNEAUD V,RESSLER C,TRIPPETT S.The sequence of amino acids in oxytocin,with a proposal for the structure of oxytocin[J].JBiolChem,1953,205(2):949-957.
[5]LUDWIG M.Dendritic release of vasopressin and oxytocin[J].JNeuroendocrinol,1998,10(2):881-895.
[6]SOFRONIEW M V,WEINDL A,SCHRELL U,et al.Immunohistochemistry of vasopressin,oxytocin and neurophysin in the hypothalamus and extrahypothalamic regions of the human and primate brain[J].ActaHistochemSuppl,1981,24:79-95.
[7]GAIDA W,LANG R E,KRAFT K,et al.Altered neuropeptide concentrations in spontaneously hypertensive rats:cause or consequence[J].ClinSci(Lond),1985,68(1):35-43.
[8]BARBERIS C,MOUILLAC B,DURROUX T.Structural bases of vasopressin/oxytocin receptor function[J].JEndocrinol,1998,156(2):223-229.
[9]JANKOWSKI M,WANG D,HAJJAR F,et al.Oxytocin and its receptors are synthesized in the rat vasculature[J].ProcNatlAcadSciUSA,2000,97(11):6207-6211.
[10]蔡英年.关于颈动脉体的研究进展[J].河北医学院学报,1989,10(3):185-187.
CAI Y N.Research progress of cartid body[J].ActaAcademiaeMedicinaeHebei,1989,10(3):185-187.(in Chinese)
[11]CARSON D S,GUASTELLA A J,TAYLOR E R,et al.A brief history of oxytocin and its role in modulating psychostimulant effects[J].JPsychopharmacol,2013,27(3):231-247.
[12]PETERSSON M.Cardiovascular effects of oxytocin[J].ProgBrainRes,2002,139:281-288.
[13]ORLOWSKA-MAJDAK M.Effect of excitatory amino acids on activity of vasopressinergic and oxytocinergic neurons[J].EndocrRegul,2004,38(1):23-28.
[14]GIMPL G,FAHRENHOLZ F.The oxytocin receptor system:structure,function,and regulation[J].PhysiolRev,2001,81(2):629-683.
[15]ZINGG H H,LAPORET S A.The oxytocin receptor[J].TrendsEndocrinolMetab,2003,14(5):222-227.
[16]YOSHIMURA R,KIYAMA H,KIMURA T,et al.Localization of oxytocin receptor messenger ribonucleic acid in the rat brain[J].Endocrinology,1993,133(3):1239-1246.
[17]OSTROWSKI N L.Oxytocin receptor mRNA expression in rat brain:implications for behavioral integration and reproductive success[J].Psychoneuroendocrinology,1998,23(8):989-1004.
[18]任妮,王志豪,吴卫妮,等.催产素受体在雌性山羊颈胸神经节的分布[J].中国兽医学报,2013,33(6):908-912.
REN N,WANG Z H,WU W N,et al.Immunohistochemical localization of OTR on cervicothoracic ganglion in female goat[J].ChineseJournalofVeterinaryScience,2013,33(6):908-912.(in Chinese)
[19]PETTY M A,LANG R E,UNGER T,et al.The cardiovascular effects of oxytocin in conscious male rats[J].EurJPharmacol,1985,112(2):203-210.
[20]JANKOWSKI M,HAJJAR F,KAWAS S A,et al.Rat heart:a site of oxytocin production and action[J].ProcNatlAcadSciUSA,1998,95(24):14558-14563.
[21]THIBONNIER M,CONARTY D M,PRESTON J A,et al.Human vascular endothelial cells express oxytocin receptors[J].Endocrinology,1999,140(3):1301-1309.
[22]CONRAD K P,GELLAI M,NORTH W G,et al.Influence of oxytocin on renal hemodynamics and sodium excretion[J].AnnNYAcadSci,1993,689:346-362.
[23]乌仁套迪,础鲁,包双江.机体内一种化学感受器--颈动脉体研究进展[J].动物医学进展,2005,26(1):16-18.
WUREN T D,CHU L,BAO S J.Research progress of cartid body chemical receptor[J].ProgressinVeterinaryMedicine,2005,26(1):16-18.(in Chinese)
[24]NURSE C A.Neurotransmission and neuromodulation in the chemosensory carotid body[J].AutonNeurosci,2005,120(1-2):1-9.
[25]NAJAFI G,SOLTANALINEJAD F,HASANZADEH H.A preliminary anatomical study on carotid body of Makouei sheep[J].VetResForum,2013,4(2):129-131.
[26]DE CARO R,MACCHI V,SFRISO M M,et al.Structural and neurochemical changes in the maturation of the carotid body[J].RespirPhysiolNeurobiol,2013,185(1):9-19.
[27]熊喜龙,李育良.兔颈动脉窦和颈动脉体的神经支配[J].动物医学进展,1998,19(4):27-28.
XIONG X L,LI Y L.The innervation of carotid body and sinus in rabbit[J].ProgressinVeterinaryMedicine,1998,19(4):27-28.(in Chinese)
(编辑白永平)
Distribution of Oxytocin Receptor in the Carotid Body of Female Goat
HUANG Shuang,SUN Man,JIN Xiu-fang,XU Yong-ping*,LI Qiang
(CollegeofAnimalMedicine,NorthwestA&FUniversity,Yangling712100,China)
This experiment was conducted to detect the existence of oxytocin receptors (OTR) in the carotid body (CB) of female goats to discuss effects of oxytocin (OT) on the activity of CB.The distribution characteristics of OTR in the carotid body of female goats were studied by using immunohistochemical SP staining.The results showed that,the parenchyma cells and the interstitial tissue were immunolabelled in different degrees.In the type Ⅰ cells and type Ⅱ cells of CB,uniformly strong immunostaining was found in the whole cell membrane and cytoplasm,whereas the nucleus of type Ⅰ cells were not or weekly immunolabelled,the nucleus of type Ⅱ cells were strong immunolabelled.In the interstitial tissue,moderate immunoreactivity products distribute in the vascular endothelial cells and nerve fibers.Image analysis documented a significant difference of OTR expression between the parenchyma cells and the interstitial tissue.The OTRs were widely distributed in CB of female goat,suggesting that oxytocin may exert potential effects on carotid body.
carotid body;oxytocin receptor;immunohistochemical SP method;female goat
10.11843/j.issn.0366-6964.2016.06.023
2015-12-15
国家自然科学基金(31072184);陕西省农业推广项目(K332021401)
黄双(1990-),女,湖北松滋人,硕士生,主要从事基础兽医学研究,E-mail:huangshuang519@163.com
徐永平,E-mail:xuyp717@nwsuaf.edu.cn,Tel:029-87091117
S852.1
A
0366-6964(2016)06-1260-06
