Let-7a对犬流感病毒诱导细胞凋亡调控作用的初步研究
2016-07-14胡仁峻涂黎晴孙凌霜远立国李守军
胡仁峻,涂黎晴,孙凌霜,贾 坤,远立国,李守军*
(1.华南农业大学兽医学院,广州 510642;2.广东省兽医临床重大疾病综合防控重点实验室,广州 510642)
Let-7a对犬流感病毒诱导细胞凋亡调控作用的初步研究
胡仁峻1,2,涂黎晴1,2,孙凌霜1,2,贾坤1,2,远立国1,2,李守军1,2*
(1.华南农业大学兽医学院,广州 510642;2.广东省兽医临床重大疾病综合防控重点实验室,广州 510642)
犬流感(CI)是由犬流感病毒(CIV)感染犬引起的传染性疾病,感染犬主要表现为急性呼吸道症状。为了探究犬microRNA let-7a对CIV诱导细胞凋亡的调控作用,在体外用CIV对MDCK细胞进行感染,通过AO/EB染色和流式细胞术检测是否能引起细胞凋亡,并用荧光定量PCR测定let-7a的转录水平,最后通过转染let-7a来评价其对于细胞凋亡的影响。结果表明,CIV能够引起MDCK细胞发生凋亡且被感染细胞内let-7a转录下调,而过转录细胞内let-7a则能够有效地抑制病毒诱导的凋亡。研究结果显示,犬let-7a在CIV感染细胞中起着抗凋亡作用,而let-7a的低转录促进了细胞凋亡,并且这一机制可能在CIV感染犬的呼吸道损伤中扮演了一定的角色。
let-7a;H3N2;犬流感;MDCK;细胞凋亡
犬流感(canine influenza,CI)是由犬流感病毒(CIV)引起的,CIV属于正黏病毒科、甲型流感病毒属,包括H3N8和H3N2亚型[1-2]。2006年,本实验室在中国华南地区分离得到第一株禽源性H3N2亚型CIV[3]。CIV能够引起犬的体温升高、咳嗽、流鼻涕、打喷嚏、呼吸困难、精神沉郁、厌食等症状[4]。据报道犬多有偶发感染其他亚型流感病毒的情况[5-6],作为伴侣动物,犬携带CIV对人类和其他动物造成潜在的威胁,所以犬流感的流行研究和机制研究对于其预防和治疗具有很重要意义。microRNA是一类大小为20~22个核苷酸(nt)的RNA分子,它来源于基因编码区的内含子[7]。它是由大小约为70 nt的发卡状前体剪切得来,并对基因在转录后水平起调节作用[8]。CIV感染犬后,会导致呼吸系统损伤,而在基因层面上,会导致犬肺和气管细胞内一系列microRNA和炎症及凋亡基因表达的变化[9-11]。Let-7a作为犬肺和气管内表达丰度第二高的家族,其对细胞免疫或凋亡起着重要作用[9]。
目前对于CIV的研究,主要集中在流行病学调查、病毒基因测序、动物感染性或传播性试验,更深入的研究主要是在转录组学和蛋白质组学方面。作者用CIV在体外感染MDCK细胞,测定其能否引起细胞凋亡,后通过转染microRNA,测定microRNA对于细胞凋亡的影响,从而了解microRNA在生物体内可能扮演的角色。
1 材料与方法
1.1病毒和细胞
病毒株H3N2亚型犬流感(A/canine/Guangdong/1/2006(H3N2))和犬肾细胞(MDCK)均由本实验室(广东省兽医临床重大疫病综合防控重点实验室)保存。
1.2主要试剂和仪器
AO/EB细胞凋亡检测试剂盒购自南京凯基生物;FITC/PI细胞凋亡检测试剂盒购自美国贝克曼(Beckman)公司;反转录酶M-MLV购自日本TaKaRa公司;荧光定量PCR Mix购自瑞士罗氏(Roche)公司;microRNA反转录引物、PCR引物及microRNA拟似物和抑制物合成自广州锐博生物技术有限公司;DNA酶和转染试剂Lip2000购自美国英杰生命技术有限公司(Invitrogen)。流式细胞仪购自美国Beakman公司;荧光定量PCR仪购自瑞士罗氏(Roche)公司。
1.3microRNA拟似物和抑制物序列
Let-7a,正义链,5′-UGAGGUAGUAGGUUGUAUAGUU-3′,反义链,5′-AGCUGUACGCCG-CCCAUUUGG-3′;阴性对照,正义链,5′-GAAAG-CCAAACGAGGGCAGGCG-3′,反义链,5′-CCUG-CCCUCGUUUGGCUUUCCG-3′;抑制剂,5′-AA-CUAUACAACCUACUACCUCA-3′;抑制剂阴性对照,5′-CAGUACUUUUGUGUAGUACAA-3′。
1.4病毒培养及病毒细胞半数感染量(TCID50)测定
将病毒接种到9到11日龄的鸡胚尿囊腔,37 ℃培养48 h,然后将鸡胚置于4 ℃环境过夜,次日以无菌操作收获尿囊液,-80 ℃储存备用。测定TCID50,将病毒样按10-1到10-8进行倍比稀释,后接种到铺满单层细胞的96孔板中。每个稀释度接种8孔,设2列正常细胞对照。置于37 ℃,5%CO2的培养箱中培养,观察细胞病变(CPE),根据Reed-Muench法计算TCID50值。
1.5病毒感染MDCK细胞
将3×105个MDCK细胞接种到12孔板中,等到细胞密度达到80%以上,将100TCID50CIV和1 μg·mL-1TPCK胰酶接种到细胞上。于感染后24和48 h检测细胞凋亡。
1.6细胞凋亡检测
1.6.1AO/EB法检测细胞凋亡感染病毒的细胞按AO/EB细胞凋亡检测试剂盒操作方法收集并处理之后,在荧光倒置显微镜下观察,绿色细胞为正常细胞,橙红色细胞为凋亡细胞。计数200个以上细胞,计算凋亡率。
1.6.2流式细胞术检测细胞凋亡感染病毒的细胞按Annexin-V FITC/PI细胞凋亡检测试剂盒操作方法收集并处理后,在流式细胞仪(Beckman)上测定,最终结果用CXP软件(Beckman)进行分析。
1.7荧光定量PCR测定let-7a转录及其转染条件
分别在病毒感染细胞后24和48 h,收集全部细胞,并用TRIzol抽提总RNA,之后用DNA酶处理。通过分光光度计测定其浓度和纯度,并通过RNA电泳检测其质量。然后取1 μg RNA,在20 μL的体系里用microRNA特异性的颈环引物进行反转录,小分子RNA U6作为内参。荧光定量PCR反应体系20 μL,PCR mix 10 μL,模板1 μL,上下引物各0.5 μL,其余用DEPC水补足。条件设置:预变性95 ℃ 5 min,扩增,95 ℃ 10 s,60 ℃ 10 s,72 ℃ 15 s,45个循环,设置溶解曲线。结果计算用2-ΔΔCT法。测定let-7a转染条件,待12孔板里的MDCK细胞铺满单层后,用Lip2000转染相同浓度(50 μmol·L-1)和不同浓度(25~200 μmol·L-1)let-7a mimic,转染相同浓度microRNA的细胞在不同时间点(12~48 h)收集,转染不同浓度microRNA的细胞在相同时间收集(24 h)。总RNA提取及PCR反应按上述过程进行。
1.8流式细胞术测定转染microRNA后MDCK细胞的凋亡情况
根据最佳转染条件转染microRNA mimic(拟似物)及其inhibitor(抑制剂),并设置不同的组别。在转染后24 h,接种100TCID50病毒量和1 μg·mL-1TPCK胰酶,接种病毒48 h后,通过流式细胞仪测定凋亡率。
1.9数据分析
2 结 果
2.1犬流感病毒感染MDCK细胞后引起细胞凋亡
测得本试验所用毒株效价为103.83TCID50·0.1 mL-1,以100TCID50病毒量接种细胞后,细胞出现了明显的病变,包括细胞聚集、脱壁漂浮、细胞皱缩、破裂等现象(图1)。

图1 CIV感染MDCK细胞后,引起了明显的细胞病变(100×)Fig.1 Obviously cytopathic changes are observed after CIV infection(100×)
AO/EB染色结果可见在流感病毒处理后24和48 h,细胞都发生了显著的凋亡。计数200个细胞,测得感染后24和48 h,凋亡率分别为(20.7±1.6)%和(22.3±2.2)%,显著高于对照组的(8.1±1.1)%和(8.9±1.7)%(图2)。

图2 AO/EB染色检测感染病毒后细胞的凋亡率(100×)Fig.2 AO/EB staining was used to detect the apoptosis rate of the cells infected with CIV(100×)
流式细胞术测定结果显示感染后24 和48 h,凋亡率分别达到(15.53±0.49)%和(15.87±0.58)%,显著高于对照组的(4.13±0.24)%和(7.20±0.38)%(图3)。

图3 流式细胞术检测感染病毒后细胞的凋亡率Fig.3 The apoptosis rate of infected cells was detected by flow cytometry
2.2病毒感染细胞后let-7a转录及其转染条件优化
AO/EB染色和流式细胞术分析结果表明CIV能够诱导MDCK细胞发生凋亡。通过荧光定量PCR测得,在细胞凋亡发生的同时,犬let-7a的转录是显著下调的。与对照组相比,病毒感染后24和48 h,let-7a转录水平下调到(39.37±2.46)%和(26.90±7.58)%(图4),具体扩增曲线和熔解曲线如图5所示。为了进一步探究let-7a对MDCK细胞凋亡的影响,作者转染let-7a进细胞,并对转染条件进行优化,结果表明50 μmol·L-1let-7a mimic转染24 h的let-7a转录水平最高(图6)。
2.3let-7a对CIV诱导的细胞凋亡产生明显的抑制作用
为了探究let-7a在凋亡过程中所起的作用,作者转染let-7a拟似物或抑制剂进MDCK细胞,测定拟似物或抑制剂对细胞凋亡的影响。如图7各组顺序,流式细胞术测得各转染组凋亡结果为(8.83±0.55)%、(24.90±1.39)%、(24.17±0.74)%、(22.83±0.73)%、(43.33±1.76)%、(13.07±0.75)%、(28.93±0.95)%和(18.87±1.36)%。通过统计学软件计算得出,与对照组相比,MDCK细胞感染CIV以后凋亡率极显著增加(P<0.01),而脂质体Lip2000对细胞凋亡影响不大(P>0.05)。与scrambled mimic组相比,let-7a过转录组凋亡率极显著降低(P<0.01),而let-7a低转录组的凋亡率则极显著上升(P<0.01)。转染let-7a mimic的同时转染inhibitor能使得凋亡率极显著上升(P<0.01),而scrambled inhibitor尽管也使得凋亡率上升(P=0.02),但其对于细胞凋亡的影响不如let-7a inhibitor。
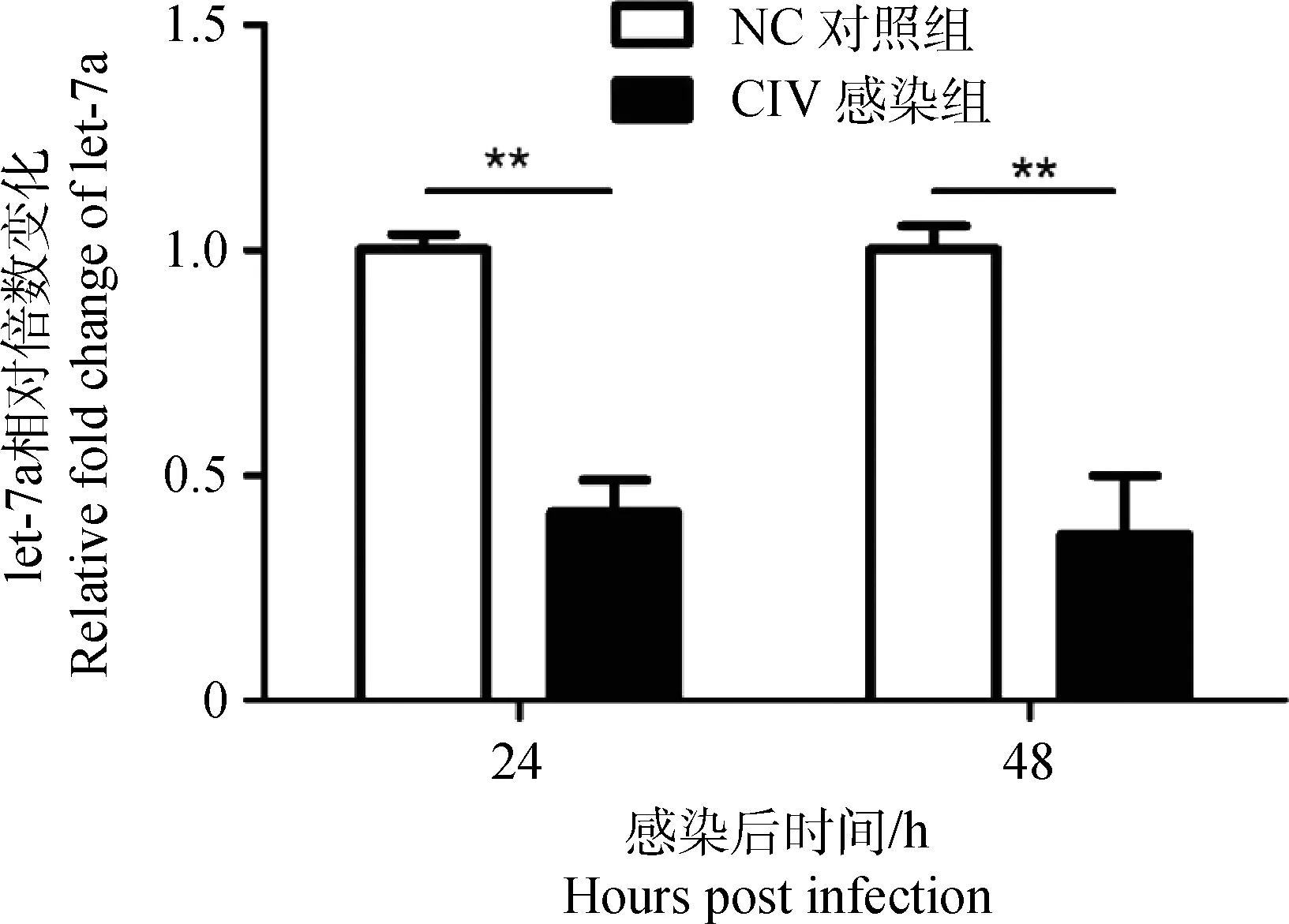
图4 感染CIV后,细胞内let-7a转录变化Fig.4 Let-7a transcription changes of MDCK cells after CIV infection
图5 let-7a和U6的扩增曲线及熔解曲线Fig.5 Amplification and dissolution curve of let-7a and U6
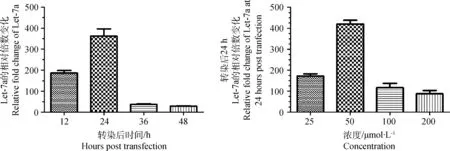
图6 let-7a转染条件优化Fig.6 Optimization of transfection conditions of let-7a
图7 let-7a或抑制剂对CIV诱导细胞凋亡的影响Fig.7 Effect of let-7a or inhibitor on apoptosis of MDCK cells induced by CIV
3 讨 论
2003年美国报道了H3N8亚型犬流感的出现,随后中国和韩国相继在2006年和2007年发现了H3N2亚型CIV。一直以来美国均未曾有过H3N2亚型CIV的报道,然而近年美国却报道了犬感染H3N2亚型CIV。因为CIV流行区域的扩大并且具有和其他流感病毒重组的可能性,所以它对犬和人类都有一定潜在的威胁[12-13]。因此阐明CIV感染犬的内在分子机制,对于其预防和治疗都具有重要的意义。很多研究表明流感病毒感染细胞,都有凋亡现象的发生[14-16],虽未经证实,但不难推测H3N2亚型CIV也能够诱导细胞凋亡。本研究证实H3N2亚型CIV感染MDCK细胞后,诱导细胞产生了凋亡,这与蛋白质组学和转录组学所得出的结论,即凋亡相关蛋白质和基因的广泛表达的结果相吻合[9-11]。凋亡作为机体的一种保护机制,其意义在于能够有效地限制病毒复制。本研究从侧面为CIV诱导的呼吸道损伤提供了理论依据,即CIV感染呼吸道上皮细胞后,机体细胞为了限制病毒复制,受凋亡信号刺激,激活凋亡通路,执行凋亡过程,从而使得病毒复制受阻,挽救整个器官。本研究也是对流感病毒诱导凋亡研究的一个补充,某种程度上为流感病毒的基础研究、防治提供进一步的理论支持。
microRNA具有非常广泛和强大的功能,其在生物体内的功能不容忽视[17]。作者还初步探究了let-7a对于CIV诱导凋亡的影响,结果表明,let-7a为一个抗凋亡因子,细胞内的某些凋亡蛋白可能是其靶点[18-19]。CIV感染的细胞下调了let-7a的转录,可能是为了利于凋亡相关蛋白质的表达,从而有助于凋亡的发生。作者所阐述的关于let-7a在凋亡机制中所扮演的角色,在小分子RNA方面为抗病毒复制提供了新的思路。结果可为microRNA与流感病毒的进一步研究从量上提供一定的参考。未来通过控制细胞凋亡来对付流感病毒,具有理论上的可行性,但其实际应用还有待对凋亡的机制作更深入的研究和临床试验。
4 结 论
犬let-7a在CIV感染细胞中起着抗凋亡作用,而let-7a的低转录促进了细胞凋亡,并且这一机制可能在CIV感染犬的呼吸道损伤中扮演了一定的角色。
[1]PAYUNGPORN S,CRAWFORD P C,KOUO T S,et al.Influenza A virus (H3N8) in dogs with respiratory disease,Florida [J].EmergInfectDis,2008,14(6):902-908.
[2]SONG D,KANG B,LEE C,et al.Transmission of avian influenza virus (H3N2) to dogs[J].EmergInfectDis,2008,14(5):741-746.
[3]LI S J,SHI Z H,JIAO P R,et al.Avian-origin H3N2 canine influenza A viruses in Southern China[J].InfectGenetEvol,2010,10(8):1286-1288.
[4]PARK S J,MOON H J,KANG B K,et al.Complete genome sequence of an avian-origin H3N2 canine influenza virus isolated from dogs in South Korea[J].JVirol,2012,86(17):9548-9549.
[5]BUTLER D.Thai dogs carry bird-flu virus,but will they spread it?[J].Nature,2006,439(7078):773.
[6]CHEN Y,MO Y N,ZHOU H B,et al.Emergence of human-like H3N2 influenza viruses in pet dogs in Guangxi,China[J].VirolJ,2015,12:10.
[7]THOMSON J M,NEWMAN M,PARKER J S,et al.Extensive post-transcriptional regulation of microRNAs and its implications for cancer[J].GenesDev,2006,20(16):2202-2207.
[8]SKALSKY R L,CULLEN B R.Viruses,microRNAs,and host interactions [J].AnnuRevMicrobiol,2010,64:123-141.
[9]ZHAO F R,SU S,ZHOU D H,et al.Comparative analysis of microRNAs from the lungs and trachea of dogs (Canis familiaris) infected with canine influenza virus[J].InfectGenetEvol,2014,21:367-374.
[10]KANG Y M,KIM H M,KU K B,et al.H3N2 canine influenza virus causes severe morbidity in dogs with induction of genes related to inflammation and apoptosis[J].VetRes,2013,44:92.
[11]SU S,TIAN J,HONG M L,et al.Global and quantitative proteomic analysis of dogs infected by avian-like H3N2 canine influenza virus[J].FrontMicrobiol,2015,6:228.
[12]CHEN Y,MO Y N,ZHOU H B,et al.Emergence of human-like H3N2 influenza viruses in pet dogs in Guangxi,China[J].VirolJ,2015,12:10.
[13]HONG M,NA W,YEOM M,et al.Complete genome sequences of H3N2 canine influenza virus with the matrix gene from the pandemic A/H1N1 virus [J].GenomeAnnounc,2014,2(5):e01010-e01014.
[14]王存连,魏东,徐明举,等.p38MAPK信号通路在猪源H9N2流感病毒导致小鼠肺损伤中作用的研究[J].畜牧兽医学报,2014,45(2):281-288.
WANG C L,WEI D,XU M J,et al.The role of p38MAPK in acute lung injury induced by H9N2 influenza virus isolated from swine[J].ActaVeterinariaetZootechnicaSinica,2014,45(2):281-288.(in Chinese)
[15]李玉谷,叶远兰,崔聪颖,等.1株H5N1亚型高致病力禽流感病毒人工感染鸭的细胞凋亡观察[J].畜牧兽医学报,2009,40(7):1069-1073.
LI Y G,YE Y L,CUI C Y,et al.Induction of apoptosis by a highly pathogenic avian influenza virus,A/duck/Guangdong/220/ 2004(H5N1) in experimentally infected ducks[J].ActaVeterinariaetZootechnicaSinica,2009,40(7):1069-1073.(in Chinese)
[16]郑良焰,陈龙,徐家华,等.H9亚型禽流感病毒感染引起MDCK细胞内抗氧化功能的变化[J].中国畜牧兽医,2013,40(11):175-179.
ZHENG L Y,CHEN L,XU J H,et al.Effect of avian influenza virus subtype H9 on antioxidant function in MDCK cells[J].ChinaAnimalHusbandryandVeterinaryMedicine,2013,40(11):175-179.(in Chinese)
[17]BARTEL D P.MicroRNAs:Genomics,biogenesis,mechanism,and function [J].Cell,2004,116(2):281-297.
[18]BAO M H,ZHANG Y W,LOU X Y,et al.Protective effects of let-7a and let-7b on oxidized low-density lipoprotein induced endothelial cell injuries [J].PLoSOne,2014,9(9):e106540.
[19]HAM O,LEE S Y,LEE C Y,et al.Let-7b suppresses apoptosis and autophagy of human mesenchymal stem cells transplanted into ischemia/reperfusion injured heart 7by targeting caspase-3 [J].StemCellResTher,2015,6:147.
(编辑白永平)
Study on Regulation Function of Let-7a on Canine Influenza Virus Induced Cells Apoptosis
HU Ren-jun1,2,TU Li-qing1,2,SUN Ling-shuang1,2,JIA Kun1,2,YUAN Li-guo1,2,LI Shou-jun1,2*
(1.CollegeofVeterinaryMedicine,SouthChinaAgriculturalUniversity,Guangzhou510642,China;2.GuangdongProvincialKeyLaboratoryofPreventionandControlforSevereClinicalAnimalDiseases,Guangzhou510642,China)
Canine influenza (CI) is an infectious disease caused by canine influenza virus (CIV) infection,which is mainly manifested as acute respiratory symptoms.In order to explore the effect of let-7a on CIV induced cells apoptosis,MDCK cells were infected by CIVinvitro,and AO/EB staining and flow cytometry were used to detect cells apoptosis,and the transcription of let-7a was also determined by real time PCR,and the effect of let-7a on cell apoptosis was evaluated by the transfection of let-7a.The results showed that CIV could induce apoptosis of MDCK cells and downregulate the transcription of let-7a in infected cells,and over-transcription of let-7a could effectively inhibit the virus induced apoptosis.This study showe that let-7a plays an anti-apoptotic role in CIV infected cells,and the low transcription of let-7a promotes apoptosis,and this mechanism may play a role in the respiratory tract injury of CIV infected dogs.
let-7a;H3N2;canine influenza;MDCK;cells apoptosis
10.11843/j.issn.0366-6964.2016.06.021
2015-11-25
国家自然科学基金(31372448);公益性行业(农业)科研专项(201303042);广东省自然科学基金(S2013020013858);广东省促进科技服务业发展计划项目(2013B040200032);广东省科技计划项目(2013B020202001;2013B020224001);广东省兽医临床重大疾病综合防控重点实验室(2013A061401013)
胡仁峻(1990-),男,江苏盐城人,硕士生,主要从事犬流感感染与microRNA相关研究,E-mail:1149243709@qq.com
李守军,男,博士,教授,博士生导师,主要从事犬流感及其流行病学相关研究,E-mail:shoujunli@scau.edu.cn
S855.3
A
0366-6964(2016)06-1247-06
