应用多重GeXP-PCR同时检测6种鸡免疫抑制病病毒的研究
2016-07-14曾婷婷谢芝勋谢丽基邓显文谢志勤罗思思黄娇玲
曾婷婷,谢芝勋,谢丽基,邓显文,谢志勤,罗思思,黄 莉,黄娇玲
(广西壮族自治区兽医研究所广西畜禽疫苗新技术重点试验室,南宁 530001)
应用多重GeXP-PCR同时检测6种鸡免疫抑制病病毒的研究
曾婷婷,谢芝勋*,谢丽基,邓显文,谢志勤,罗思思,黄莉,黄娇玲
(广西壮族自治区兽医研究所广西畜禽疫苗新技术重点试验室,南宁 530001)
拟建立一种基于GeXP多基因表达分析系统的多重PCR方法,同时检测6种鸡免疫抑制病病毒——鸡马立克病毒、禽白血病病毒(包括A、B和J亚群)、禽网状内皮组织增生症病毒、禽呼肠孤病毒、鸡传染性贫血病毒和传染性法氏囊炎病毒。多重PCR反应使用嵌合引物和通用引物组合的反应体系,经过GeXP多基因表达分析系统进行毛细管电泳,鉴别PCR产物片段;通过调整嵌合引物浓度、Mg2+浓度、Taq酶浓度优化反应体系及调整退火温度和时间优化反应条件。应用建立的多重GeXP-PCR,分别单独和同时检测6种鸡免疫抑制病病毒的8个目的基因,同时以其他常见禽类病毒和鸡组织器官核酸为对照,验证其特异性;检测8个目的基因不同浓度的克隆质粒,验证其敏感性;应用建立的多重PCR检测300份临床样品,并同时用荧光定量PCR和测序验证其检测结果的准确性。结果表明建立的多重GeXP-PCR方法能够分别扩增出6种病毒,8个特异性目的片段,不能扩增其他常见禽类病毒和鸡组织器官的基因;在低至100 copies·20 μL-1的水平能同时特异性地检测出6种鸡免疫抑制病病毒核酸;检测300份临床病死鸡样品,190份样品显示为阳性,PCR和测序结果与多重GeXP-PCR结果相符。本研究建立的多重GeXP-PCR方法可特异、敏感、高通量地检测6种鸡免疫抑制性病毒,可用于临床鉴别诊断和分子流行病学调查,具有很高的临床应用价值。
GeXP多基因表达分析系统;多重PCR;高通量;鸡免疫抑制病病毒
GuangxiVeterinaryResearchInstitute,Nanning530001,China)
鸡免疫抑制病病毒主要包括鸡马立克病毒(Marek’s disease virus,MDV)[1]、禽白血病病毒(avian leucosis virus,ALV,以A、B和J亚群ALV为主)[2]、禽网状内皮组织增生症病毒(reticuloendotheliosis virus,REV)[3]、禽呼肠孤病毒(avian reovirus,ARV)[4]、鸡传染性贫血病毒(chicken infectious anaemia virus,CIAV)[5]和传染性法氏囊炎病毒(infectious bursal disease virus,IBDV)[6-7],这些病毒都能破坏鸡的免疫功能造成免疫抑制。鸡群感染免疫抑制病病毒后,对致病菌和其他病毒更加易感,发生继发感染,接种疫苗后达不到预期免疫效果[8-9],饲料报酬降低和生长缓慢。鸡感染这些病毒后的临床症状各有不同,但有些不是马上表现出来。鸡感染MDV、ALV和REV后,免疫抑制比肿瘤出现早得多[1,3]。小于3周龄的雏鸡感染IBDV有时不会出现典型症状,但仍出现免疫抑制[9]。超过3周龄的雏鸡感染CIAV后,能产生一定的免疫力,不会引起贫血,但仍然会发生免疫抑制[10]。临床上常见几种免疫抑制病毒混合感染,使诊断更加困难[11-12]。
故对以上所述病毒感染进行鉴别诊断和检测尤为重要。常规的检测方法是病毒分离,需要花费较长的周期。普通PCR、荧光PCR和LAMP等分子生物学方法检测病毒比较快速,但一个反应体系只能检测2~4种病毒。
GeXP多基因表达分析系统是一种新的、高通量的基因检测平台[13]。通过毛细管电泳鉴定经过荧光基团标记的多重PCR产物。PCR体系使用嵌合引物和通用引物组合,嵌合引物由特异性引物的5′端添加通用引物组成。上游嵌合引物由特异性引物和连接在其5′端的通用引物组成,通用引物的5′端标记荧光基团,下游嵌合引物亦由特异性引物和连接在其5′端的通用引物组成,但不标记荧光基团。设计引物时,使每对引物扩增的PCR产物之间至少相差7~10 bp,然后通过毛细管电泳辨认扩增片段大小。这项技术目前已经应用于诊断多种疾病,如同时检测11种人乳头瘤病毒[14],9种血清型的手足口病[15],癌症基因[16],7种肠炎病毒[17]和人的H1N1病毒[18]。这项技术第一次应用于兽医领域是2014年本实验室用于检测9种鸡呼吸道病原[19]。
本研究旨在建立一种同时检测MDV、ALV-A/B/J、REV、CIAV、IBDV和ARV的多重GeXP-PCR方法。
1 材料与方法
1.1动物福利声明
本研究经过广西壮族自治区兽医研究所的动物福利委员会批准,所使用的鸡胚和SPF鸡均符合动物福利标准,动物宰杀和样品采集过程按照章程将动物的痛苦降至最低。
1.2病毒毒株和临床样品采集
本研究中所使用病毒毒株为本实验室保存,如表1所示。MDV、ALV-A/B/J和REV使用SPF鸡胚制作的鸡胚成纤维细胞(CEF)增殖,IBDV和ARV使用9日龄SPF鸡胚增殖,CIAV使用1日龄SPF雏鸡增殖,雏鸡腹膜注射含病毒的组织上清液,2周后收集雏鸡骨髓。临床样品采自送检病死鸡,共300羽病死鸡,包括鸡胸腺、法氏囊、脾、肝、骨髓和血液,将这些组织混合匀浆保存。病死鸡的日龄介于50~135 d,包括种鸡、蛋鸡和肉鸡。
表1毒株来源
Table 1Sources of pathogens

病原Pathogen来源Source参考毒株Referenceviruses 马立克病毒Marek’sdiseasevirusKC453972,KC453973,GX130112,GX140301,050118,070123,090201,100428GVRI 禽白血病病毒A亚群AvianleucosisvirussubgroupAisolateRSV-1CVCC 禽白血病病毒A亚群AvianleucosisvirussubgroupAisolateGX110521,GX110522,ALVA01,ALVA02,ALVA03GVRI 禽白血病病毒B亚群AvianleucosisvirussubgroupBisolateRSV-2CVCC 禽白血病病毒B亚群AvianleucosisvirussubgroupBisolateGX111230,GX130401,ALVB15,ALVB23,ALVB28GVRI 禽白血病病毒J亚群AvianleucosisvirussubgroupJisolateKC453974,KC453975,GX090201,GX090521,GX110110,GX120081,GX130018,GX140010GVRI 禽网状内皮组织增生症病毒ReticuloendotheliosisvirusAV235CVCC 禽网状内皮组织增生症病毒ReticuloendotheliosisvirusKC453976,KC453977,GX120825,GX131118GVRI 禽呼肠孤病毒AvianreovirusS1133,1733,526,C78,GuangxiR1,GuangxiR2,GX110058GVRI 传染性法氏囊炎病毒InfectiousbursaldiseasevirusCA,AV162,AV144CVCC 传染性法氏囊炎病毒InfectiousbursaldiseasevirusAV6CIVDC 传染性法氏囊炎病毒Infectiousbursaldiseasevirus070124,080113,090053,100008,110110,130223GVRI 鸡传染性贫血病毒ChickeninfectiousanaemiavirusCAU0728,CAU0729,CAU0730,CAU0731,CAU0732CVCC 鸡传染性贫血病毒ChickeninfectiousanaemiavirusGXC060821GVRI其他病毒Otherviruses 禽流感病毒InactivatedH5N1avianinfluenzavirusRe-1HVRI 禽流感病毒AvianinfluenzavirusH9N6/Duck/HK/147/77HKU 禽流感病毒AvianinfluenzavirusH7N2/chickenPA/3979/97PU 新城疫病毒NewcastlediseasevirusF48E9GVRI 新城疫病毒NewcastlediseasevirusGX6/02GVRI 鸡传染性支气管炎病毒InfectiousbronchitisvirusMassachusetts41GVRI 鸡传染性喉气管炎病毒InfectiouslaryngotracheitisvirusAV1231CIVDC 鸡滑液囊支原体MycoplasmasynoviaeCAU0748CVCC
HVRI.哈尔滨兽医研究所;HKU.香港大学;GVRI.广西兽医研究所;CIVDC.中国兽医药品监察所;PU.宾夕法尼亚大学;CVCC.中国兽医微生物保藏中心
HVRI.Harbin Veterinary Research Institute,China;HKU.University of Hong Kong,China;GVRI.Guangxi Veterinary Research Institute,China;CIVDC.China Institute of Veterinary Drugs Control,China;PU.University of Pennsylvania,USA;CVCC.China Veterinary Culture Collection Centre,China
1.3试剂与仪器
RNA/DNA共提试剂盒(E.Z.N.A.®Total DNA/RNA Isolation Kit)购自OMEGA(Norcross,GA,USA);反转录试剂盒TransScript II Reverse Transcriptase[M-MLV,RNase-](High Temperature RT)购自全式金生物(北京,中国);多重PCR试剂盒Genome Lab GeXP Starter Kit购自贝克曼(Beckman Coulter,Brea,USA);样品缓冲液,DNA Marker,上样板,液体石蜡均购自贝克曼(Beckman Coulter,Brea,USA);pGEM-T载体购自Promega(Madison,USA),普通PCR酶,胶回收试剂盒,感受态细胞购自全式金生物(北京,中国);限制性内切酶SpeⅠ购自宝生物(大连,中国);DNA体外转录试剂盒RiboMAX Large Scale RNA Production Systems SP6/T7 Kit购自Promega(Madison,USA);PCR仪购自Thermo (Milford,USA);超微量分光光度计NanoDrop 2000购自Thermo Fisher Scientific(Milford,USA);GeXP多基因表达分析系统GenomeLab GeXP Genetic Analysis System购自贝克曼(Beckman Coulter,Brea,USA)。
1.4 RNA/DNA抽提和RNA反转录
使用RNA/DNA共提试剂盒抽提MDV毒株细胞培养物;REV和 ALV-A/B/J毒株细胞培养物(含有REV和 ALV-A/B/J的前病毒DNA,proviral DNA)[20],CIAV人工感染SPF鸡的骨髓,IBDV和ARV的鸡胚增殖的尿囊液的总RNA/DNA。用无核酸酶超纯水溶解抽提好的DNA/RNA,于-80 ℃条件保存备用。按照说明书将IBDV和ARV的RNA反转录为cDNA备用(反转录过程对抽提产物中的DNA无影响)。
1.5引物设计和引物合成
将本实验室保存毒株的序列与GenBank公布的毒株序列经过MEGA5.0软件比对后,在它们的保守区域用Primer premier 5.0软件设计特异性引物。通用引物为贝克曼公司专利产品,不与任何现有物种的基因互补配对,序列由贝克曼公司提供。特异性上游引物及其5′端加上通用引物序列,并在通用引物的5′端标记荧光基团Cy5组成上游嵌合引物,下游嵌合引物由下游特异性引物及其5′端加上通用引物序列组成,但不标记荧光基团。所有的嵌合引物由上海英骏生物公司合成和纯化。引物序列见表2。
1.6建立多重PCR体系和反应程序
应用贝克曼Genome Lab GeXP Starter Kit建立多重PCR体系:总反应体积为20 μL,其中5× buffer 4 μL,buffer内含通用引物,工作浓度为0.25 μmol·L-1;MgCl2(25 μmol·L-1) 2 μL;嵌合引物混合物1 μL;Thermo-Start DNA polymerase 0.35 μL;cDNA/DNA模板 1 μL;无核酸酶超纯水补足体积。
多重PCR反应程序包括3步:95 ℃ 5 min预变性后,94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,10个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 30 s,10个循环;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 30 s,10个循环;72 ℃延伸5 min,结束反应。
1.7毛细管电泳和结果分析
取1 μL PCR产物和38.75 μL样品缓冲液,0.25 μL DNA Marker混合均匀,加入上样板中,滴加石蜡封闭液体表面。将上样板置于GeXP多基因表达分析系统仪器卡槽中,进行高分辨率的毛细管电泳。不同大小片段的PCR产物在电泳过程中分离,通过PCR产物携带的荧光基团辨认其片段大小和信号强度。电泳完成后,使用仪器自带软件eXpress Profiler software分析结果,横坐标表示片段大小,纵坐标表示信号强度,即PCR产物的含量。
1.8基于GeXP的多重PCR方法的特异性和敏感性试验
根据电泳分析结果,调整嵌合引物浓度、Mg2+浓度、Taq酶浓度优化反应体系及调整退火温度和时间优化反应条件。使用建立的多重GeXP-PCR方法,分别以各毒株核酸、其他常见鸡病毒毒株(包括H5/H7/H9 三个血清型的禽流感病毒、新城疫病毒、传染性支气管炎病毒和传染性喉气管炎病毒的核酸,以及健康SPF鸡的胸腺、脾和法氏囊的核酸为模板),检测该方法的特异性。
构建多重GeXP-PCR的各目的片段的重组质粒,以此为模板测试建立的多重GeXP-PCR方法的敏感性。用特异性引物扩增各毒株的目的片段,与pGEM-T载体连接后转化感受态细胞增殖,并抽提质粒。构建好的质粒经过纯化和测序验证其序列的准确性。IBDV和ARV的质粒经过SpeⅠ酶切线性化之后体外转录为ssRNA。所有DNA质粒和ssRNA均用紫外分光光度计测定浓度。以构建好的DNA质粒和ssRNA为模板,按照建立的多重GeXP-PCR的流程,单一模板的终浓度分别调整为105copies·20 μL-1至1 copy·20 μL-1,测定多重GeXP-PCR对单一模板的敏感性;将单一模板等浓度混合为多重模板,将每种模板的终浓度均调整为105copies·20 μL-1至1 copy·20 μL-1,测定多重GeXP-PCR对多重模板的敏感性。
表2引物序列信息
Table 2Primer sequences

病毒Virus引物序列(5'-3')Primersequence扩增片段/bpAmpliconsize目的基因Targetregion引物浓度/(μmol·L-1)PrimerconcentrationMDVF:AGGTGACACTATAGAATAAGGGAGCAGACGTACTATGTAGACAAR:GTACGACTCACTATAGGGATGGTAAGCAGTCCAAGGGTCA227meq0.16ALV-AF:AGGTGACACTATAGAATACAAGGGGTTCCTTGGTATCTR:GTACGACTCACTATAGGGATGTGCCTATCCGCTGTCA155gp850.2ALV-BF:AGGTGACACTATAGAATATCAATCACGATTCTCCCACCR:GTACGACTCACTATAGGGATGTGACGCTTCGTTTACGTCTT285gp850.2ALV-JF:AGGTGACACTATAGAATACTGATGCAACAACCAGGAAAR:GTACGACTCACTATAGGGAGCAGTGACATTAGTGACATACCC204gp850.2REVF:AGGTGACACTATAGAATAGACCAGGCGAGCAAAATCR:GTACGACTCACTATAGGGAGGTGTAATAGGTAGGTATGGAGGA182gp900.2IBDVF:AGGTGACACTATAGAATAGGGTCAGGGCTAATTGTCTTR:GTACGACTCACTATAGGGATCTGTCAGTTCACTCAGGCTTC294VP20.2CIAVF:AGGTGACACTATAGAATAAAAGGCGAACAACCGATGAR:GTACGACTCACTATAGGGATGCCCTGGAGGAAAAGACC269VP10.2ARVF:AGGTGACACTATAGAATAGGACCCCTACTTCTGTTCTCAR:GTACGACTCACTATAGGGAATTTCCCGTGGACGACAT215S10.16
F.上游引物;R.下游引物;带下划线的为通用引物,嵌合引物由通用引物和特异性引物一起合成组成
F.Forward primer;R.Reverse primer;Universal tag sequences are underlined.Chimeric primers were synthesised using universal tags and specific primers
1.9模拟混合感染和干扰试验
为了测试建立的多重GeXP-PCR方法应用于临床时的准确性和敏感性,将经过病毒分离和测序鉴定确诊为免疫抑制病病毒感染的病鸡组织器官样品:胸腺、法氏囊、骨髓、肝和血液随机组合并以任意比例混合,抽提总DNA/RNA,按照建立的多重GeXP-PCR方法流程进行检测。
为了测试不同模板之间的浓度差异较大时,不同浓度的模板对建立的多重GeXP-PCR方法引物扩增效率的影响和是否仍能敏感的检测到低浓度的模板,使用不同浓度的阳性毒株核酸(最高模板浓度至少是最低模板浓度的104倍)随机组合为模板进行多重GeXP-PCR,并以单一模板为对照进行多重GeXP-PCR。如随机挑选了ALV-J、MDV和CIAV作为组合。先以探针法荧光定量PCR测定模板浓度,调整模板终浓度依次为107、102和103copies·20 μL-1进行多重GeXP-PCR,同时分别以相同浓度的ALV-J和MDV为单一模板进行多重GeXP-PCR。
1.10应用建立的多重PCR方法检测临床样品
采集病死鸡的胸腺、法氏囊、骨髓、脾、肝和血液,混合匀浆后抽提总DNA/RNA,按照建立的多重GeXP-PCR方法进行检测。同时以本研究设计的特异性引物进行SYBR GreenⅠ定量PCR,并将PCR产物克隆测序,验证阳性结果。
2 结 果
2.1特异性试验
经过体系优化,最终嵌合引物的比例和浓度见表2。应用建立的多重GeXP-PCR方法,以表1中所列毒株为模板进行单一模板特异性试验,经过GeXP电泳,均得到特异性单峰,图1A~H所示为单一模板电泳图,片段大小与引物设计预期相符;进行多模板特异性试验,经过GeXP电泳,同时得到8个特异性单峰;以表1中其他禽病原体和SPF健康鸡组织核酸为模板,无扩增片段。单重模板、多重模板均无非特异扩增峰,见图1。
多重GeXP-PCR的单一模板特异性试验:A.ALV-A,155.38 bp;B.ALV-B,284.65 bp;C.ALV-J,204.55 bp;D.MDV,227.35 bp;E.REV,182.64 bp;F.CIAV,268.61 bp;G.ARV,215.83 bp;H.IBDV,294.27 bp;多重GeXP-PCR的多重模板特异性试验:I.6种病毒,8个特异性片段依次为ALV-A,155.80 bp;REV,182.67 bp;ALV-J,204.50 bp;ARV,215.75 bp;MDV,227.16 bp;CIAV,268.59 bp;ALV-B,285.09 bp;IBDV,294.02 bp;J.阴性对照以其他禽病原体和SPF鸡组织核酸为模板,单峰为markerThe GeXP-multiplex PCR assay was performed using a single template and mixed primers for the following:A.ALV-A,155.38 bp;B.ALV-B,284.65 bp;C.ALV-J,204.55 bp;D.MDV,227.35 bp;E.REV,182.64 bp;F.CIAV,268.61 bp;G.ARV,215.83 bp;H.IBDV,294.27 bp;I.The GeXP-multiplex PCR assay was performed using mixed templates and mixed primers for the following:8 single products:ALV-A,155.80 bp;REV,182.67 bp;ALV-J,204.50 bp;ARV,215.75 bp;MDV,227.16 bp;CIAV,268.59 bp;ALV-B,285.09 bp;IBDV,294.02 bp;J.Negative control was performed using nucleic acid of others avian viruses and SPF chicken,signal was marker图1 多重GeXP-PCR特异性试验经GeXP电泳结果Fig.1 Specificity of GeXP-multiplex PCR assay
2.2敏感性试验
应用建立的多重GeXP-PCR方法进行敏感性试验,使用构建的DNA质粒或ssRNA为单一模板时,ALV-A、ALV-J、REV、CIAV和ARV的最低检测值为10 copies·20 μL-1;MDV、 ALV-B和IBDV为102copies·20 μL-1。6种病毒8个目的基因的质粒和ssRNA等比例混合时,每个目的基因的最低检测值均为102copies·20 μL-1。图2所示为多重GeXP-PCR多重模板,每种模板分别为105copies·20 μL-1(A),104copies·20 μL-1(B),103copies·20 μL-1(C)和102copies·20 μL-1(D)的电泳结果。
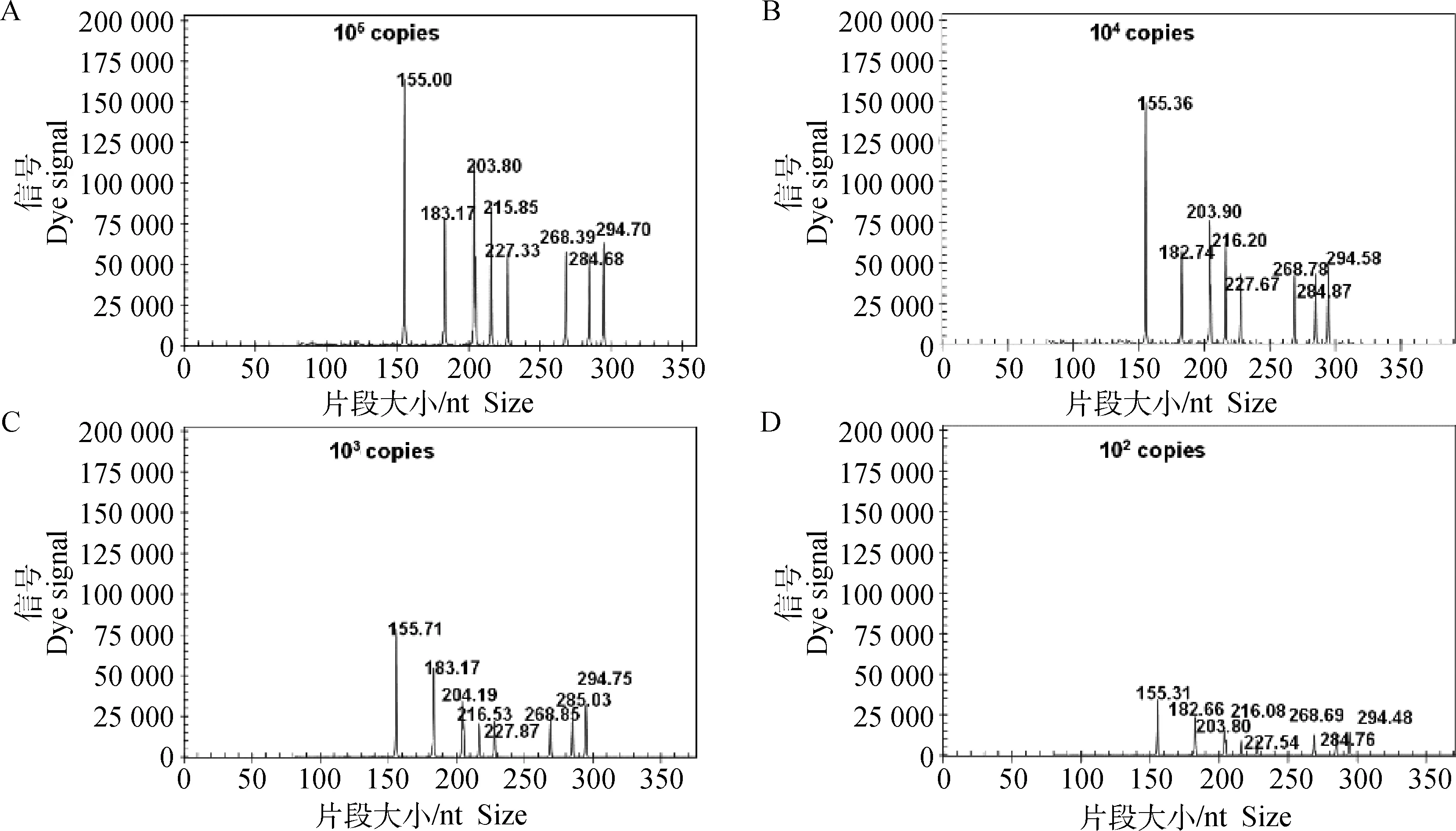
使用构建的DNA质粒和ssRNA为模板进行多重GeXP-PCR方法,每个反应每种模板分别为A.105 copies·20 μL-1;B.104 copies·20 μL-1;C.103 copies·20 μL-1;D.102 copies·20 μL-1The GeXP-multiplex PCR assay was performed using equal amounts of specific DNA-containing plasmid template and in vitro transcribed ssRNA corresponding to 6 immunosuppressive viruses,8 templates at concentrations:A.105 copies·20 μL-1,B.104 copies·20 μL-1,C.103 copies·20 μL-1,D.102 copies·20 μL-1图2 多重PCR敏感性试验GeXP电泳结果Fig.2 Sensitivity of GeXP-multiplex PCR assay
2.3模拟混合感染和干扰试验
将确诊为免疫抑制病病毒阳性的病料随机混合,应用建立的多重GeXP-PCR方法进行检测,得到与预期相符合特异性单峰,图3所示为随机混合ARV 和IBDV,ALV-J和ALV-B以及6种病毒病料混合的电泳结果。将构建的DNA质粒和ssRNA按照ALV-J 107copies·20 μL-1,MDV 102copies·20 μL-1和CIAV 103copies·20 μL-1为反应体系终浓度的比例混合,应用建立的多重GeXP-PCR方法进行检测,同时分别以同一浓度的单一模板为对照,结果显示,当不同模板的浓度悬殊时,仍能准确敏感地检测出低浓度的模板,并且多重模板和单一模板的产物浓度相差不大,如图4所示。
2.4临床样品检测
300份临床样品检测结果见表3。同时使用本研究中设计的特异性引物进行单重SYBR GreenⅠ定量PCR检测临床样品,将PCR产物克隆测序,并与建立的多重GeXP-PCR对比检测结果。结果显示,应用建立的多重GeXP-PCR结果与定量PCR结果相符,并且测序结果显示阳性结果均为对应的病毒。300份临床样品中,190份样品检测结果为阳性,其中单重感染119份,ALV-A 6份,ALV-B 2份,ALV-J 21份,MDV 26份,REV 15份,IBDV 17份,CIAV 9份和ARV 23份;混合感染71份:MDV+ALV-A 4份,MDV+ALV-J 25份,ALV-B+ALV-J 1份,MDV+ALV-J+REV 6份,MDV+CIAV 5份,MDV+REV 6份,ALV-J+REV 3份,IBDV+ALV-J 5份,MDV+CIAV+ALV-J 4份,REV+ARV 3份,ALV-J+ARV 6份,ALV-J+IBDV 3份。

将ARV和 IBDV,ALV-J 和ALV-B,以及6种免疫抑制病病毒的病料为模板,模拟混合感染情况:A.ARV和 IBDV;B.ALV-J 和ALV-B;C.6种免疫抑制病病毒The GeXP-multiplex PCR assay was performed using artificially mixed templates and mixed primers for ARV and IBDV,ALV-J and ALV-B,or 6 immunosuppressive viruses:A.ARV and IBDV;B.ALV-J and ALV-B;C.6 immunosuppressive viruses图3 多重PCR模拟混合感染的GeXP电泳结果Fig.3 Artificially mixed templates for the GeXP-multiplex PCR assay

A.ALV-J 107 copies·20 μL-1,MDV 102 copies·20 μL-1 和CIAV 103 copies·20 μL-1的反应体系终浓度的比例混合为模板进行多重GeXP-PCR检测;B.以MDV 102 copies·20 μL-1的浓度为模板进行多重GeXP-PCR检测;C.以ALV-J 107 copies·20 μL-1的浓度为模板进行多重GeXP-PCR检测A.The GeXP-multiplex PCR assay was performed using templates for ALV-J 107 copies·20 μL-1,MDV 102 copies·20 μL-1 and CIAV 103 copies·20 μL-1;B.MDV 102 copies·20 μL-1;C.ALV-J 107 copies·20 μL-1图4 干扰试验多重PCR反应经GeXP电泳结果Fig.4 GeXP-multiplex PCR interference assays
表3临床样品检测结果
Table 3Detection results for clinical specimens
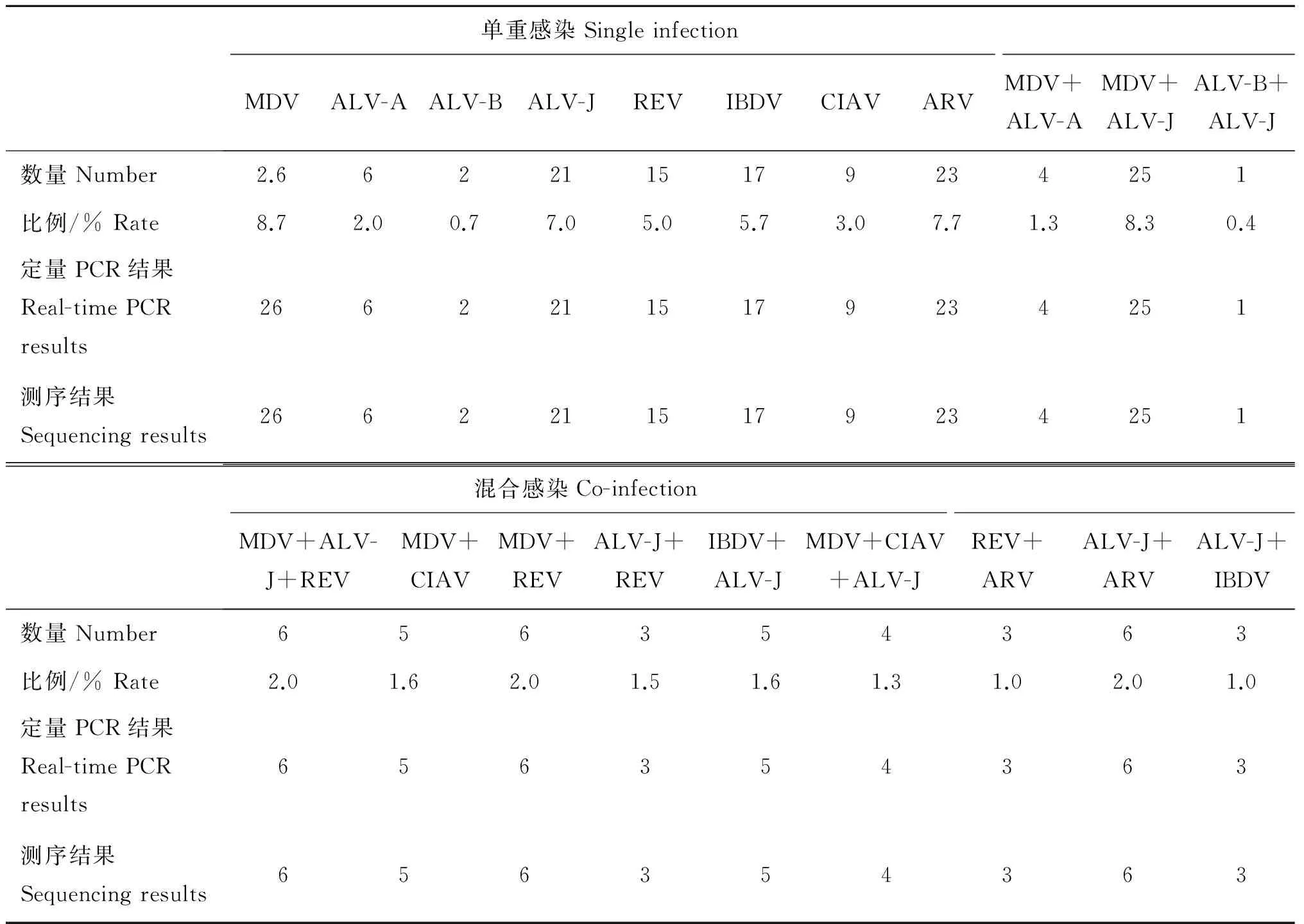
单重感染SingleinfectionMDVALV-AALV-BALV-JREVIBDVCIAVARVMDV+ALV-AMDV+ALV-JALV-B+ALV-J数量Number2.6622115179234251比例/%Rate8.72.00.77.05.05.73.07.71.38.30.4定量PCR结果Real-timePCRresults26622115179234251测序结果Sequencingresults26622115179234251混合感染Co-infectionMDV+ALV-J+REVMDV+CIAVMDV+REVALV-J+REVIBDV+ALV-JMDV+CIAV+ALV-JREV+ARVALV-J+ARVALV-J+IBDV数量Number656354363比例/%Rate2.01.62.01.51.61.31.02.01.0定量PCR结果Real-timePCRresults656354363测序结果Sequencingresults656354363
3 讨 论
MDV、ALV (以ALV-A/B/J为主)、REV、IBDV、CIAV 和ARV是引起鸡免疫抑制的主要几种病原,并且常常发生混合感染,给诊断带来极大的难度[11-12,21]。传统的分子生物学检测方法存在比较耗时和每个反应检测项目少的限制,常规的PCR或定量PCR往往每个反应只能检测2~4种病原。
基于GeXP多基因表达分析系统的多重PCR方法,以其优越的特异性,敏感性和高通量为同时鉴别诊断以上几种病原提供了解决方案[22-23]。首先,利用嵌合引物和通用引物组合的3步法的PCR扩增程序为多重PCR提高了特异性和大大降低引物间互相干扰扩增效率的影响。第一步10个循环的PCR扩增是由嵌合引物中的特异性引物部分引发,特异性引物结合在目的基因上引发原始扩增,同时通用引物经过特别设计不会与常见的生物序列结合,故不会出现通用引物引发的非特异性扩增;第二步10个循环是由嵌合引物引发,嵌合引物结合在之前10个循环的PCR产物的两端,继续进行指数型扩增,由于这一步的退火温度比第一步高13 ℃,特异性引物部分不会再结合到原始模板上,保证了嵌合引物整体结合在前10个循环的PCR产物上;第三步10个循环主要是通用引物介导的所有PCR产物的同步扩增,通用引物结合在含有通用引物序列的PCR产物上,最大化降低由于不同特异性引物混合对扩增效率的影响,使所有的PCR产物都得到几乎相同的扩增效率,避免在检测临床样品时,某种病毒载量较低时导致假阴性。
其次,建立的多重GeXP-PCR方法具优良的敏感性。多重PCR扩增后,PCR产物经过毛细管电泳辨认产物片段大小,结果与预期片段大小相差1 bp内可判断为阳性结果,如ALV-A的预期PCR产物片段大小为155 bp,若得到的PCR产物含有154~156 bp的片段,即可认为ALV-A检测结果为阳性。GeXP毛细管电泳后,经过软件分析,PCR产物以单峰形式呈现,单峰峰值2 000荧光单位(absorbance units,A.U.)以上为阳性扩增。本研究的敏感性试验中,多重模板的最低检测水平为每种模板100 copies·20 μL-1反应体系,最小的峰值为9 000 A.U.,远远高于阳性阈值,说明建立的多重GeXP -PCR方法具有优良的敏感性。
再次,建立的多重GeXP-PCR方法具高通量的优点[16]。GeXP能辨认110~400 bp范围内的PCR片段,只要两个目的片段之间相差7~10 bp即可分辨,故每个反应可检测20个以上目的基因;应用嵌合引物和通用引物的多重PCR,一个反应也可以同时检测8个以上目的基因[14,23-25],比传统的多重PCR或多重定量PCR每个反应检测目的基因数目多一倍以上[26-27]。检测一份样品,只需抽提一次,PCR加样一次,电泳一次,即可得到8种以上目的基因的检测结果。一个电泳上样板为96孔板,操作一次GeXP即可检测96份样品。这在进行大规模检测或流行病学调查时,尤其凸显其高通量的优势。
应用建立的多重GeXP-PCR方法检测300份临床样品,同时用本研究设计的特异性引物进行单重定量PCR检测,PCR产物测序验证阳性结果的准确性为100%。同时经过不断的流行病学调查,我们也发现病毒不断处于变异的状态,故一套多重GeXP-PCR体系将不能长期满足临床检测的需求,需要不断更新病毒序列信息,设计更多的引物来达到应对病毒不断变异的要求。
在实际操作中,MDV和 CIAV 是DNA病毒,ALV (以ALV-A/B/J为主)、REV、IBDV和ARV是RNA病毒,故使用RNA/DNA共提试剂盒进行核酸提取,再进行反转录,使用的反转录试剂盒对核酸中的DNA成分无影响。同时ALV和REV属于逆转录病毒,抽提的DNA中也含有病毒基因组逆转录嵌入宿主基因组的前病毒DNA,故进行多重PCR检测时,是同时以ALV和REV的基因组RNA和前病毒DNA为模板。
4 结 论
本研究建立的基于GeXP多基因表达分析系统的多重PCR方法,能够特异、敏感和高通量的鉴别检测6种鸡免疫抑制病病毒,可以成为临床鉴别诊断和流行病学调查时的有力工具。
[1]CALNEK B.Pathogenesis of Marek’s disease virus infection[M].Marek’s Disease. Berlin:Springer,2001:25-55.
[2]FADLY A M,WITTER R L,LEE L F.Effects of chemically or virus-induced immunodepression on response of chickens to avian leukosis virus[J].AvianDis,1985,29(1):12-25.
[3]ENRIETTO P J,WYKE J A.The pathogenesis of oncogenic avian retroviruses[J].AdvCancerRes,1983,39:269-314.
[4]ROESSLER D E.Studies on the pathogenicity and persistence of avian reovirus pathotypes in relation to age resistance and immunosuppression[M].Delaware:University of Delaware,1987.
[5]SMYTH J A,MOFFETT D A,CONNOR T J,et al.Chicken anaemia virus inoculated by the oral route causes lymphocyte depletion in the thymus in 3-week-old and 6-week-old chickens[J].AvianPathol,2006,35(3):254-259.
[6]SHARMA J M,KIM I J,RAUTENSCHLEIN S,et al.Infectious bursal disease virus of chickens:pathogenesis and immunosuppression[J].DevCompImmunol,2000,24(2-3):223-235.
[7]佟美姣,高雪丽,李博韬,等.传染性法氏囊病毒对 SPF 雏鸡免疫器官细胞凋亡及bcl-2 mRNA 表达的影响[J].畜牧兽医学报,2013,44(4):617-621.
TONG M J,GAO X L,LI B T,et al.The apoptosis and expression ofbcl-2 mRNA in the immune organs of SPF chicks infected with infectious bursal disease virus[J].ActaVeterinariaetZootechnicaSinica,2013,44(4):617-621.(in Chinese)
[8]CUI Z Z,SUN S,WANG J.Reduced serologic response to Newcastle disease virus in broiler chickens exposed to a Chinese field strain of subgroup J avian leukosis virus[J].AvianDis,2006,50(2):191-195.
[9]FARAGHER J T,ALLAN W H,WYETH P J.Immunosuppressive effect of infectious bursal agent on vaccination against Newcastle disease[J].VetRec,1974,95(17):385-388.
[10]MCCONNELL C D,ADAIR B M,MCNULTY M S.Effects of chicken anemia virus on cell-mediated immune function in chickens exposed to the virus by a natural route[J].AvianDis,1993,37(2):366-374.
[11]张洪海,刘青,邱波,等.地方柴鸡中 J 亚群禽白血病与马立克氏病的混合感染[J].畜牧兽医学报,2009,40(8):1215-1221.
ZHANG H H,LIU Q,QIU B,et al.Mixed infection of ALV-J and MDV in a flock of Shandong free range chickens[J].ActaVeterinariaetZootechnicaSinica,2009,40(8):1215-1221.(in Chinese)
[12]秦立廷,高玉龙,潘伟,等.我国部分地区蛋鸡群ALV- J 及与REV、MDV、CAV 混合感染检测[J].中国预防兽医学报,2010,32(2):90-93.
QIN L T,GAO Y L,PAN W,et al.Investigation of co-infection of ALV-J with REV,MDV,CAV in layer chicken flocks in some regions of China[J].ChineseJournalofPreventiveVeterinaryMedicine,2010,32(2):90-93.(in Chinese)
[13]DREW J E,MAYER C D,FARQUHARSON A J,et al.Custom design of a GeXP multiplexed assay used to assess expression profiles of inflammatory gene targets in normal colon,polyp,and tumor tissue[J].JMolDiagn,2011,13(2):233-242.
[14]YANG M J,LUO L,NIE K,et al.Genotyping of 11 human papillomaviruses by multiplex PCR with a GeXP analyzer[J].JMedVirol,2012,84(6):957-963.
[15]HU X,ZHANG Y,ZHOU X,et al.Simultaneously typing nine serotypes of enteroviruses associated with hand,foot,and mouth disease by a GeXP analyzer-based multiplex reverse transcription-PCR assay[J].JClinMicrobiol,2012,50(2):288-293.
[16]RAI A J,KAMATH R M,GERALD W,et al.Analytical validation of the GeXP analyzer and design of a workflow for cancer-biomarker discovery using multiplexed gene-expression profiling[J].AnalBioanalChem,2009,393(5):1505-1511.
[17]LIU Y,XU Z,ZHANG Q,et al.Simultaneous detection of seven enteric viruses associated with acute gastroenteritis by a multiplexed Luminex-based assay[J].JClinMicrobiol,2012,50(7):2384-2389.
[18]QIN M,WANG D Y,HUANG F,et al.Detection of pandemic influenza A H1N1 virus by multiplex reverse transcription-PCR with a GeXP analyzer[J].JVirolMethods,2010,168(1-2):255-258.
[19]XIE Z,LUO S,XIE L,et al.Simultaneous typing of nine avian respiratory pathogens using a novel GeXP analyzer-based multiplex PCR assay[J].JVirolMethods,2014,207:188-195.
[20]TELESNITSKY A,GOFF S P.Reverse transcriptase and the generation of retroviral DNA[M].Retroviruses.Cold Spring Harbor (NY):Cold Spring Harbor Laboratory Press,1997.
[21]崔治中,孟姗姗,姜世金,等.我国白羽肉用型鸡群中CAV、REV和REOV感染状况的血清学调查[J].畜牧兽医学报,2006,37(2):152-157.
CUI Z Z,MENG S S,JIANG S J,et al.Serological surveys of chicken anemia virus,avian reticuloendotheliosis virus and avian reovirus infections in white meat-type chickens in China[J].ActaVeterinariaetZootechnicaSinica,2006,37(2):152-157.(in Chinese)
[22]罗思思,谢芝勋,谢丽基,等.同时鉴别6种鸡病毒性呼吸道病GeXP检测方法的建立[J].病毒学报,2013,29(3):250-257.
LUO S S,XIE Z X,XIE L J,et al.Development of a GeXP assay for simultaneous differentiation of six chicken respiratory viruses[J].ChineseJournalofVirology,2013,29(3):250-257.(in Chinese)
[23]ZHANG M X,XIE Z X,XIE L J,et al.Simultaneous detection of eight swine reproductive and respiratory pathogens using a novel GeXP analyser-based multiplex PCR assay[J].JVirolMethods,2015,224:9-15.
[24]李瑾,毛乃颖,秦萌,等.GeXP多重PCR技术同时检测12种常见呼吸道病毒[J].病毒学报,2011,27(6):526-532.
LI J,MAO N Y,QIN M,et al.A GeXP based multiplex RT-PCR assay for simultaneous detection of twelve human respiratory viruses[J].ChineseJournalofVirology,2011,27(6):526-532.(in Chinese)
[25]ZHANG Y F,XIE Z X,XIE L J,et al.GeXP analyzer-based multiplex reverse-transcription PCR assay for the simultaneous detection and differentiation of eleven duck viruses[J].BMCMicrobiol,2015,15:247.
[26]XIE Z X,XIE L J,PANG Y S,et al.Development of a real-time multiplex PCR assay for detection of viral pathogens of penaeid shrimp[J].ArchVirol,2008,153(12):2245-2251.
[27]何玮玲,张驰,杨静,等.食品中 4 种肉类成分多重 PCR 的快速鉴别方法[J].中国农业科学,2012,45(9):1873-1880.
HE W L,ZHANG C,YANG J,et al.A quick multiplex PCR method for the identification of four meat ingredients in food products[J].ScientiaAgriculturaSinica,2012,45(9):1873-1880.(in Chinese)
(编辑白永平)
Simultaneous Detecting Six Immunosuppressive Chicken Viruses by a GeXP Analyser-based Multiplex PCR Assay
ZENG Ting-ting,XIE Zhi-xun*,XIE Li-ji,DENG Xian-wen,XIE Zhi-qin,LUO Si-si,HUANG Li,HUANG Jiao-ling
(GuangxiKeyLaboratoryofAnimalVaccinesandDiagnostics,
The objective of this research was to develop a novel,high-throughput Genome Lab Gene Expression Profiler Analyser-based multiplex PCR method (GeXP-multiplex PCR) for simultaneous detection of 6 immunosuppressive chicken viruses.Using chimeric primers,6 immunosuppressive chicken viruses,including Marek’s disease virus (MDV),three subgroups of avian leucosis virus (ALV-A/B/J),reticuloendotheliosis virus (REV),infectious bursal disease virus (IBDV),chicken infectious anaemia virus (CIAV) and avian reovirus (ARV) were amplified and identified by their respective amplicon sizes.The concentration of the chimeric primers,Mg2+andTaq,and annealing temperature,and time were optimised according to the amplification efficiency of the GeXP-multiplex PCR assay.The assay specificity for each immunosuppressive viral target was individually and simultaneously tested with a mixture of 8 sets of chimeric primers in a multiplex PCR assay.Plasmid DNA and transcribed ssRNA were diluted to a final concentration ranging from 105copies·20 μL-1to 1 copy·20 μL-1and then subjected to the GeXP-multiplex PCR assay with 8 sets of chimeric primers,both individually and in pre-mixed solutions.A total of 300 clinic specimens of disease chicken were detected by using GeXP-multiplex PCR.The results were confirmed using independent real-time PCR and sequencing to determine true positives.The specificity and sensitivity of the optimised GeXP-multiplex PCR assay were evaluated,and the data demonstrated that this technique could selectively amplify these 6 viruses at a sensitivity of 100 copies·20 μL-1when all 6 viruses were present.Of the 300 examined clinical specimens,190 were positive for immunosuppressive viruses according to the GeXP-multiplex PCR assay.The GeXP-multiplex PCR assay is a high-throughput,sensitive and specific method for the detection of 6 immunosuppressive viruses that can be used for differential diagnosis and molecular epidemiologic surveys.
GeXP analyser;multiplex PCR;high-throughput;chicken immunosuppressive viruses
10.11843/j.issn.0366-6964.2016.06.015
2015-09-29
国家自然科学基金(31160512);广西自然科学基金(2014GXNSFCA118006);广西特聘专家专项基金 (2011B020);广西水产畜牧兽医局科技项目(桂渔牧科201452003;201528013)
曾婷婷(1986-),广西合浦人,硕士,助理研究员,主要从事禽病原分子生物学研究,E-mail:tingtingzeng1986@163.com
谢芝勋,研究员,广西特聘专家,E-mail:xiezhixun@126.com
S858.315.3
A
0366-6964(2016)06-1198-11
