BMPR-IB基因的克隆及其在绒山羊成纤维细胞中的表达
2016-07-14孙洪新王红娜张英杰刘月琴陈晓勇敦伟涛
孙洪新,王红娜,张英杰*,刘月琴,陈晓勇,敦伟涛
(1.河北农业大学动物科技学院,保定 071001; 2.河北省畜牧兽医研究所,保定 071000)
BMPR-IB基因的克隆及其在绒山羊成纤维细胞中的表达
孙洪新1,2,王红娜1,张英杰1*,刘月琴1,陈晓勇2,敦伟涛2
(1.河北农业大学动物科技学院,保定 071001; 2.河北省畜牧兽医研究所,保定 071000)
本研究旨在克隆BB基因型小尾寒羊的BMPR-IB基因编码区,构建重组载体,瞬时转染绒山羊成纤维细胞,并对BMPR-IB等基因的表达情况进行检测。采用 RT-PCR方法扩增BMPR-IB基因完整编码区,构建真核表达载体pEGFP-BMPR-IB,经脂质体Lipofectamine LTX&PLUS介导转染绒山羊成纤维细胞,并分别于转染后48和72 h收集细胞,分别提取RNA和蛋白,利用RT-PCR和Western blot方法检测相关基因的表达情况。结果扩增得到了包含BMPR-IB基因完整编码区全长在内的1 550 bp片段,与已知序列高度同源;Real-time PCR检测结果均表明,转基因组细胞中BMPR-IB表达量显著高于空白对照组(P<0.01),IGF-Ⅰ基因表达量也显著上调(P<0.01),TLR4、IFN、MHC、PNRP、GDF5、INH基因的表达量显著降低(P<0.01);Western blot检测表明,转染组BMPR-IB、IGF-I的表达有所增加,BMP4、TLR4的表达略有降低,但差异均不显著(P>0.05)。本研究成功实现了小尾寒羊BMPR-IB基因在山羊成纤维细胞中的表达,为转BMPR-IB基因阳性细胞株和细胞系的建立提供了基础;研究表明BMPR-IB(BB型)基因的过表达能上调IGF-Ⅰ基因的表达,下调TLR4基因的表达。
BMPR-IB基因;真核表达载体;绒山羊成纤维细胞;表达
FecB基因最早是在澳大利亚Booroola羊中发现的一个与高繁殖率相关的主效基因,能显著提高羊的繁殖率。后来的研究证明FecB基因的本质为骨形态蛋白Ⅰ型受体基因(Bone morphogenetic protein receptor-IB,BMPR-IB)。BMPR-IB基因属于转移生长因子β亚基(TGF-β)受体家族成员,存在于许多细胞类型中,是调节生长和分化的多功能蛋白[1]。该基因编码区由10个外显子组成,共1 509 bp,编码502个氨基酸[2-3],在生殖器官中,BMPR-IB可能是参与联结前列腺素通路和下游前列腺素作用的平行通路[4]。
2001年,3个研究小组几乎同时发现在Booroola绵羊BMPR-IB基因编码区第746位上发生了A→G置换,使受体细胞内激酶区编码蛋白由野生型的谷胺酰氨变为精氨酸(Q249R),正是这个突变 (Q249R)与Booroola母羊高繁殖力完全相关[2-3,5]。激酶区3亚区的突变改变了Smads的表达和磷酸化,导致了Booroola羊表现出大量小的有腔卵泡早熟和排卵率提高[2]。P.Mulsant等[3]通过研究重组GDF5和BMP4在体外对颗粒细胞分化和孕酮分泌的影响,发现BMPR-IB基因(A746G)突变减少了小型有腔卵泡的分化活性;BMP4对野生型(++)绵羊颗粒细胞的促分化作用比对突变型(BB)有所增强;BB型母羊颗粒细胞对GDF5和BMP4的敏感性明显低于++型母羊的颗粒细胞。这说明BB型母羊的Q249R突变致使BMPR-IB基因部分失活,对颗粒细胞生成的抑制作用减弱,因此颗粒细胞可进一步分化,排卵卵泡进一步成熟,表现为排卵数的增加,进而提高绵羊的排卵率和繁殖力。
研究表明,BMPR-IB基因编码区的A746G突变对Booroola Merino羊(澳大利亚)、Javanese绵羊(印度尼西亚)、Garole绵羊(印度)以及中国的湖羊、小尾寒羊和中国美利奴羊多胎品系等的排卵数或产羔数都有显著影响[6-9],该基因作为影响绵羊产羔数的主效基因,可用于对绵羊产羔数的选择[10]。目前,该基因已被用于小尾寒羊、湖羊等品种的纯种选育及其与引进品种杂交育种中多胎的辅助选择的标记基因,如寒泊羊、鲁西黑头杜泊羊等种群的选育[11-12]。
除了绵羊,国内还开展了多个山羊品种BMPR-IB基因多态性研究,但迄今未见在山羊中存在BMPR-IB基因A746G突变的报道。如李丽萍[13]、储明星[14]、孟丽娜[15]、李文杨[16]等分别对云岭黑山羊、济宁青山羊、河北绒山羊、美姑黑山羊、承德黑山羊和河南槐山羊、崇明白山羊、徐淮山羊、奶山羊、努比山羊、戴云山羊、闽东山羊、福清山羊和南江黄羊等品种的BMPR-IB基因多态性进行了检测,均未检测到A746G突变。在转基因方面,于振兴等[17]获得了转湖羊FecB基因的新疆细毛羊阳性细胞株。李新秀[18]研究了沉默BMPR-IB基因对猪卵巢颗粒细胞凋亡及BMP通路上相关基因表达的影响。而有关该基因在山羊细胞中的表达情况未见报道。本研究旨在克隆BB型小尾寒羊BMPR-IB基因完整编码区序列,构建重组真核表达载体 pEGFP-BMPR-IB,瞬时转染绒山羊成纤维细胞,对其中BMPR-IB基因及与繁殖、免疫、生长发育等相关基因的表达情况进行检测,为进一步研究BMPR-IB基因的功能和转基因优质肉羊品种培育提供基础。
1 材料与方法
1.1试验材料
1.1.1细胞培养用组织及采样方法自河北易县绒山羊场采集7日龄辽宁绒山羊耳组织。用剃须刀除净耳边缘部耳毛,碘酒、酒精(脱碘)消毒干净后,用消过毒的耳号钳快速剪下耳边缘组织块,在盛有酒精的小烧杯中涮洗30 s,最后用含双抗(250 U·mL-1青霉素和250 U·mL-1链霉素)的无菌生理盐水冲洗2~3遍后,将组织块浸泡入装有含双抗的PBS溶液1.5 mL离心管中,用封口膜封口,4℃保存,3~4 h 送回实验室。
1.1.2药品试剂pEGFP-N2质粒为本实验室保存,限制性核酸内切酶购自TaKaRa公司,胶回收纯化试剂盒购自上海生工公司,质粒提取试剂盒购自北京天根生化科技有限公司。基因组提取试剂盒和大肠杆菌DH5a购自全式金生物技术有限公司。DMEM/F12购自 Hyclone,胎牛血清购自GIBCO公司,脂质体Lipofectamine LTX & PLUS Reagent购自Invitrogen公司,细胞培养瓶、6孔板购自CORNING公司。荧光定量用SYBR Green购自东洋纺生物科技有限公司。Western blot用抗体分别购自Eterlife 和Santa公司。
1.2试验方法
1.2.1卵巢组织的采集、RNA提取及反转录在唐县肉羊养殖开发中心,选取已知BMPR-IB基因型为 BB型(突变型)的小尾寒羊进行屠宰,采集卵巢,于液氮保存,带回实验室,用Trizol法提取总RNA,利用全式金公司反转录试剂盒进行反转录获得cDNA。
1.2.2BMPR-IB基因CDS区的扩增根据GenBank中公布的序列(GI:AF357007),用Primer Premier 5.0软件设计引物,并根据该序列编码区和pEGFP-N2质粒多克隆位点的限制性内切酶酶切位点分析比对结果,在引物5′端分别添加BamH I和EcoR I限制性内切酶酶切位点和保护碱基,用于扩增BMPR-IB基因编码区序列。引物序列:上游:5′-CgCGGATCCAAACAAgCAAgCCTgTCATAC -3′(下划线处为BamH I酶切位点),下游:5′-CCggAATTCgAgCTTAATGTCCTGGGACTCT-3′(下划线处为EcoR I 酶切位点)。
PCR扩增反应体系为25 μL:buffer 3.0 μL,dNTP 4.0 μL,引物 1.0 μL,LA Taq 0.3 μL (1.5U),cDNA 1.0 μL,ddH2O 15.7 μL。预期扩增产物长度大小约为1 550 bp。 扩增程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 95 s,5个循环;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 95 s,30个循环;72 ℃ 10 min。用1.5%琼脂糖凝胶电泳检测扩增情况。
1.2.3pEGFP-BMPR-IB表达载体的构建分别取pEGFP-N2质粒和上述PCR产物各40 μL,分别加入10×M Buffer 12 μL,BamH I 和EcoR I各6 μL,ddH2O 36 μL组成100 μL体系,37 ℃水浴6 h,进行双酶切。琼脂糖凝胶电泳酶切产物,胶回收BMPR-IB片段和pEGFP-N2骨架片段,用T4连接酶进行16 ℃过夜连接,转化E.coliDH5α感受态细胞,涂具有卡那霉素抗性的LB平板,37 ℃培养过夜,筛选阳性克隆,摇菌,提取质粒,进行酶切和测序鉴定。对双酶切和测序均正确的菌液,进行质粒中提,测定浓度后备用,获得的重组真核表达载体命名为pEGFP-BMPR-IB。
1.2.4耳组织成纤维细胞的培养辽宁绒山羊耳组织成纤维细胞的培养采用组织块法进行。具体方法见参考文献[19]。将绒山羊耳缘组织在无菌条件下用PBS洗涤2~3次后,用眼科剪刀将组织剪成为1 mm3左右的小块,用黄色灭菌枪头将其放入25 mL培养瓶中。按每块间隔0.3~0.5 cm放置贴于培养瓶中,倒置在37 ℃,5% CO2的培养箱中,待组织块周围开始变干(约3~4 h)缓慢加入含15%胎牛血清的DMEM/F12培养液浸润组织块后翻转培养瓶,进行过夜培养。培养6~7 d后,开始有细胞长出,待细胞长成致密单层后,用0.25%胰酶消化,待大部分细胞变圆时,加培养液终止消化,并反复吹打,只收集脱壁细胞。鉴于成纤维细胞消化脱壁比上皮细胞快,在前3代传代经酶消化,待细胞刚变圆即终止消化,可得到纯化的成纤维细胞。细胞生长至70%~80%汇合状态时即可冷冻保存,以备基因转染使用。
1.2.5细胞转染细胞转染利用 Lipofectamine LTX & PLUS Reagent试剂盒进行。转染前将生长状态良好的G4代绒山羊耳组织成纤维细胞分别接种到6孔板中,密度为1×105个·mL-1,进行常规培养,待细胞长到70%~80% 汇合时,在脂质体介导下,用重组质粒pEGFP-BMPR-IB进行细胞转染。根据转染试剂说明进行转染。取125 μL双无细胞培养液,加入2.5 μg pEGFP-BMPR-IB质粒,加入3 μL PLUS,轻轻混匀后备用,另取125 μL细胞培养液稀释12 μL 脂质体。将上两种稀释液轻轻混合后在室温下孵育5 min形成复合物(此为6孔板每孔用量)。将上述复合物加入6孔培养板中,轻轻摇动混匀。在37 ℃、5% CO2条件下培养6 h后,更换为含10% FBS的DMEMF12培养液。转染后12 h开始利用倒置荧光显微镜观察EGFP表达情况。以未转染的细胞作为空白对照,分别于转染后48和72 h后收集细胞,进行RNA和蛋白提取。
1.2.6RT-PCR检测转染山羊细胞中有关基因表达转染48 h后,分别收集试验组和空白组细胞,利用Trizol提取总RNA,按 Revert AidTM First Strand cDNA Synthesis Kit 说明书进行逆转录,以GAPDH作为内参对照,利用Real-time PCR对BMPR-IB等基因的表达量进行检测,检测基因及所用引物见表1。
表1实时荧光定量所用引物
Table 1Primers used in real-time fluorescence quantitative PCR
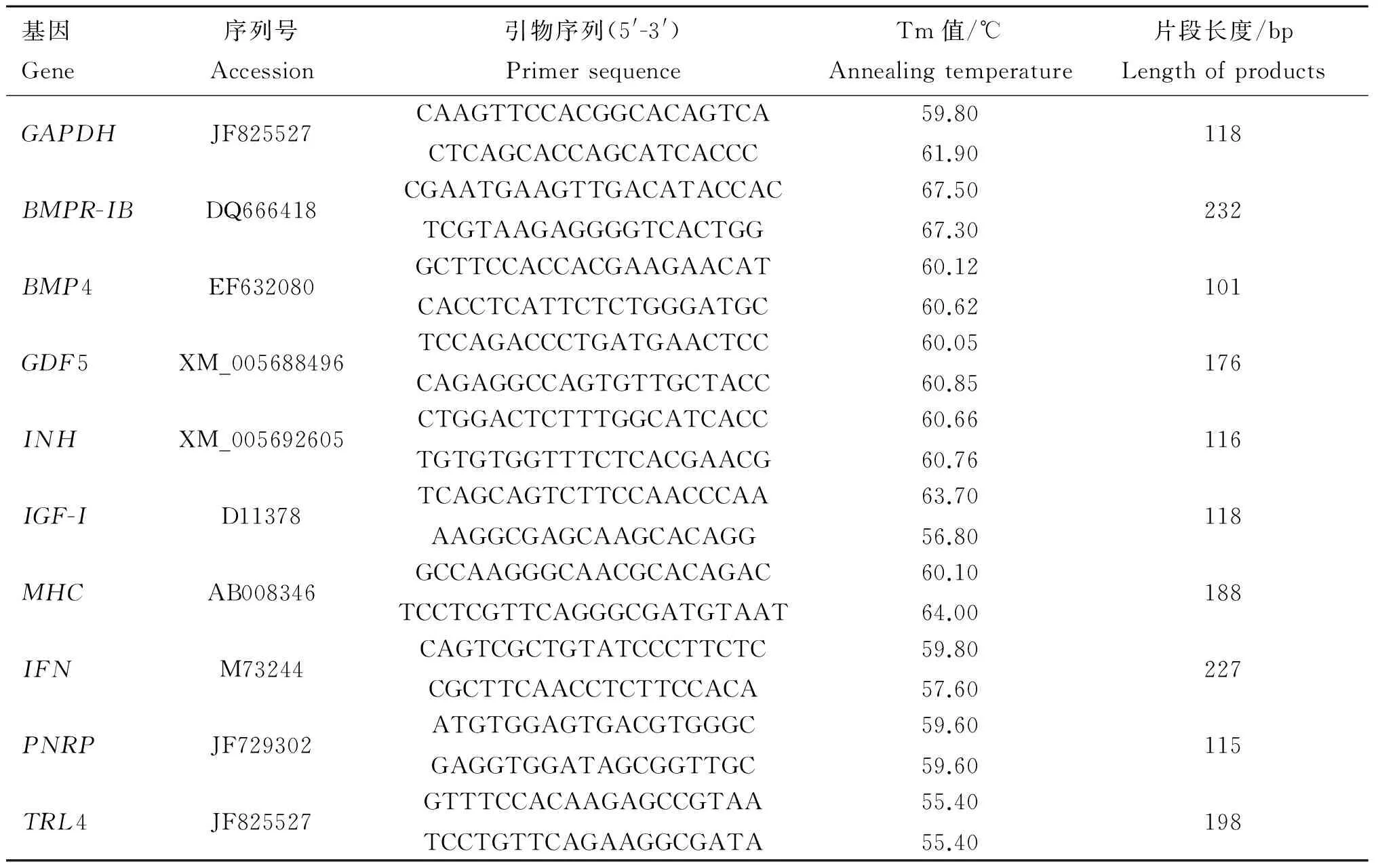
基因Gene序列号Accession引物序列(5'-3')PrimersequenceTm值/℃Annealingtemperature片段长度/bpLengthofproductsGAPDHJF825527CAAGTTCCACGGCACAGTCACTCAGCACCAGCATCACCC59.8061.90118BMPR-IBDQ666418CGAATGAAGTTGACATACCACTCGTAAGAGGGGTCACTGG67.5067.30232BMP4EF632080GCTTCCACCACGAAGAACATCACCTCATTCTCTGGGATGC60.1260.62101GDF5XM_005688496TCCAGACCCTGATGAACTCCCAGAGGCCAGTGTTGCTACC60.0560.85176INHXM_005692605CTGGACTCTTTGGCATCACCTGTGTGGTTTCTCACGAACG60.6660.76116IGF-ID11378TCAGCAGTCTTCCAACCCAAAAGGCGAGCAAGCACAGG63.7056.80118MHCAB008346GCCAAGGGCAACGCACAGACTCCTCGTTCAGGGCGATGTAAT60.1064.00188IFNM73244CAGTCGCTGTATCCCTTCTCCGCTTCAACCTCTTCCACA59.8057.60227PNRPJF729302ATGTGGAGTGACGTGGGCGAGGTGGATAGCGGTTGC59.6059.60115TRL4JF825527GTTTCCACAAGAGCCGTAATCCTGTTCAGAAGGCGATA55.4055.40198
Real-time PCR的反应体系为20 μL:SYBR qPCR Mix 10 μL,上、下游引物各0.6 μL,ROX 0.4 μL,cDNA模板1.0 μL,H2O 7.4 μL。Real-time PCR程序为:95 ℃ 10 min;95 ℃ 30 s,60 ℃ 1 min,40个循环;95 ℃ 1 min,55 ℃ 30 s,95 ℃ 30 s。自动生成Ct值,以GAPDH为内参,2-ΔΔCt法对结果进行校正,各基因的相对表达量重复3次,取平均值。其中ΔCtl=转染后的Ct值-对应内参Ct值,ΔCt2=空白组的Ct值-对应内参Ct值,ΔΔCt=ΔCtl-ΔCt2,2-ΔΔCt值为转染后较空白组各基因表达量的倍数。
1.2.7Western blot检测山羊细胞中相关基因的表达转染72 h后收集细胞,制备裂解液,4℃离心取上清提取蛋白,测定浓度后使用Western blot方法检测蛋白表达情况。利用Total Lab Quant软件读出样品和内参的灰度值,按蛋白表达量=目的灰度数值/内参灰度数值,对蛋白表达情况进行分析统计。1.2.8数据分析基因表达试验数据用Excel和 GraphPad软件进行分析,每个处理做3个重复。P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1BMPR-IB基因的RT-PCR
以反转录获得的cDNA为模板,用PCR技术扩增目的基因,PCR 产物经 1.5%琼脂糖凝胶电泳,在1.5和 2 kb之间有特异性条带,约1 550 bp,与预期条带大小一致(图 1),条带明亮清晰,可用于后续试验。

1~3.PCR产物;M.DNA相对分子质量标准1-3. PCR products; M. Marker DL2000图1 PCR产物电泳图Fig.1 Electrophoresis of PCR products
2.2重组表达载体pEGFP-BMPR-IB的构建及鉴定
将经BamH I和EcoR I双酶切后的目的片段与pEGFP-N2线性化片段用T4连接酶进行过夜连接后转化培养,随机挑取10个克隆进行PCR检测,对阳性克隆菌液进行扩大培养,提取质粒后用BamH I和EcoR I进行双酶切,对酶切产物进行电泳,结果产生了长约1.5和4.7 kb的两条带,与预期的片段长度一致(图2)。对双酶切正确的质粒样品进行测序,结果发现,酶切较短片段长度为1 550 bp,该片段包含BMPR-IB基因完整编码区,经 BLAST比对发现,除A746G外,序列与已知绵羊BMPR-IB编码区序列一致。表明BMPR-IB基因已成功克隆入pEGFP-N2质粒的MCS区,pEGFP-BMPR-IB载体构建成功,重组质粒图谱见图3。
2.3细胞转染
使用Lipofectamine LTX & PLUS Reagent试剂盒进行细胞转染。更换培养液培养12 h后,在倒置显微镜下观察,细胞生长状态良好,转染24 h后有少量绿色荧光,转染48 h后荧光有所增加,转染72 h后呈现荧光细胞数最多。表明所克隆基因可以和报告基因融合表达。

1~2.双酶切产物;M.DNA相对分子质量标准1-2.The double digestion products; M. Marker DL5000图2 pEGFP-BMPR-IB的双酶切鉴定Fig.2 Identification of pEGFP-BMPR-IB digested by BamHⅠ and EcoRⅠ

图3 重组pEGFP-BMPR-IB质粒图谱Fig.3 Vector map of recombinant plasmid

A.未转染;B.转染24 h; C.转染48 h;D.转染72 hA.Control; B. Transfection for 24 hours; C. Transfection for 48 hours; D. Transfection for 72 hours图4 pEGFP-BMPR-IB转染山羊成纤维细胞 100×Fig.4 The transfection of pEGFP-BMPR-IB into goat fibroblast cells 100×
2.4转染pEGFP-BMPR-IB山羊成纤维细胞相关基因mRNA表达水平
利用实时荧光定量PCR方法对转染48 h后辽宁绒山羊成纤维细胞中BMPR-IB基因的表达量进行检测。以未转染细胞组做为空白(对照组),以GAPDH做为内参基因。定量结果表明,转染后BMPR-IB表达量有所增加。当Lipofectamine LTX用量为12 μL,质粒用量为2.5 μg,PLUS用量为3 μL时,试验组BMPR-IBmRNA的表达量显著高于未转染组(P<0.01)(图5)。

图5 相关基因mRNA相对表达量的变化Fig.5 The relative expression change of different genes
以GAPDH做为内参基因,利用实时荧光定量方法分别对未转染和pEGFP-BMPR-IB质粒瞬时转染辽宁绒山羊成纤维细胞中BMP4、GDF5、INH、IGF-I、TLR4、IFN、MHC和PNRP基因的表达情况进行检测,结果,转染组IGF-I基因表达量显著高于空白组(P<0.01);BMP4基因表达量基本无变化(P>0.05), 转染组GDF5、INH、TLR4、IFN、MHC、PNRP基因表达量显著低于空白组(P<0.01)(图5)。
2.5pEGFP-BMPR-IB转染山羊成纤维细胞中相关基因蛋白水平的表达
转染72 h后分别收集空白对照和转染细胞,提取蛋白后,分别利用Western blot方法对BMPR-IB、IGF-I、BMP4和TLR4蛋白的表达情况进行检测,结果见图6、图7。
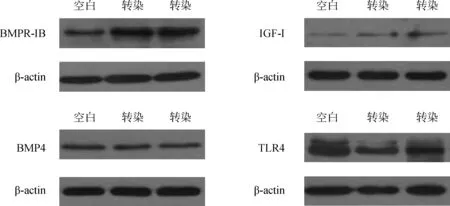
图6 相关蛋白表达情况Fig.6 The expression of different proteins

图7 部分蛋白相对表达量的变化Fig.7 The relative expression change of different proteins
由图6、7均可以看出,相对于空白对照组,瞬时转染组BMPR-IB、IGF-I的表达均有所升高但差异均不显著(P>0.05),BMP4和TLR4的表达略有降低,差异也不显著(P>0.05)。
综合看,转染组和未转染租BMPR-IB、IGF-I、BMP4和TLR4的mRNA和蛋白水平表达趋势基本趋于一致。
3 讨 论
本研究采用分子克隆技术,通过在上、下游引物两端分别引入BamH I和EcoR I酶切位点以及保护碱基进行扩增,直接对RT-PCR产物和pEGFP-N2质粒进行BamH I和EcoR I双酶切、回收,用T4连接酶进行16 ℃过夜连接、转化、克隆、酶切及测序鉴定构建载体,相比于克隆目的基因后,再进行酶切、连接,构建载体省时省力;PCR扩增和双酶切产物电泳及测序后均证实重组真核表达载体 pEGFP-BMPR-IB构建成功。
试验过程中利用组织块贴壁法进行辽宁绒山羊耳组织成纤维细胞培养,根据上皮样细胞与成纤维细胞对胰酶消化敏感性的不同,采用低浓度胰蛋白酶作用分离纯化成纤维细胞,经2~3次传代得到了高纯度的成纤维细胞,为后续细胞转染研究提供了保障。
试验将成功构建的重组pEGFP-BMPR-IB经Lipofectamine LTX & PLUS介导瞬时转染绒山羊耳组织成纤维细胞,并分别提取RNA和蛋白对BMPR-IB等基因的表达情况进行了检测,定量和蛋白检测结果均表明,BMPR-IB表达量有所增加,成功实现了小尾寒羊BMPR-IB(BB型)基因在山羊成纤维细胞中的表达,为转BMPR-IB基因阳性细胞株和细胞系的建立提供了基础。
应用成纤维细胞进行核移植生产体细胞克隆动物具有许多优势,但克隆中存在孕期流产率高、围产期死亡率高、胎儿过度生长以及出生后生长异常等问题。甚至有些克隆动物在出生后不久死亡,并表现出某些器官发育异常。李世杰对成纤维细胞克隆新生死亡牛器官中的染色质修饰基因、类胰岛素生长因子系统等22个对发育有重要作用的基因表达差异进行研究,认为它们的异常表达可能是造成克隆动物出生死亡和器官发育异常的原因[20]。瞬时转染过表达BMPR-IB基因细胞中,繁殖、生长发育以及抗病基因的表达是否也存在异常呢? IGF-I具有类似于胰岛素样的生物合成代谢功能,一方面可提高组织摄取葡萄糖的能力,另一方面抑制肝糖原的分解并促进肝糖原及肌糖原的合成,同时,IGF-I本身又是生长激素的介质,具有促进生长的作用。BMP4除作为形态发生过程的信号因子外,还能促进或维持有关组织的细胞分裂。而TLR4 作为TLRs家族成员之一,能够识别革兰阴性菌细胞壁成分中的脂多糖和脂磷壁酸,通过信号转导,诱发炎症因子(例如TNF-α、IL-1、IL-6)与Type I型IFN的产生[21]。TypeⅠ型 IFN可以在病毒复制的任何阶段发挥作用,由于其在天然免疫与获得性免疫中具有抗病毒的活性与调节功能,Ⅰ型IFN能够通过调节NK细胞、T 细胞等重要的免疫细胞来发挥功能,是连接天然免疫和适应性免疫的桥梁,在抗病毒和其他型的感染与免疫方面具有重要的作用[22]。试验分别对BMP4、GDF5、INH、IGF-I、TLR4、IFN、MHC和PNRP等的表达量进行检测,发现转染BMPR-IB基因后,IGF-I基因表达量显著增加(P<0.01);TLR4、IFN、MHC、PNRP、GDF5、INH基因表达量显著降低(P<0.01),表明BMPR-IB基因的过表达可上调IGF-I的表达,下调TLR4、IFN、MHC、PNRP、GDF5、INH基因的表达。转染后细胞中生长发育相关IGF-I表达量的升高,免疫相关的TLR4、IFN、MHC和PNRP基因的表达降低,是否和体细胞克隆转基因羊后代存在的体型大,先天免疫力低,抗病性差存在关联,需进一步研究。
基因表达分为转录和翻译两个层面,即mRNA和蛋白水平。试验中因未能找到合适的抗体,只对BMPR-IB、BMP4、IGF-I和TIR4基因的蛋白表达情况进行了检测。真核基因表达的转录和翻译发生的时间和位点存在时空间隔,而转录后又会有转录后加工,转录产物的降解、翻译、翻译后加工及修饰等几个层面,所以转录水平和翻译水平并不完全一致。本试验中,未转染组BMPR-IB、IGF-I和TLR4基因的mRNA和蛋白水平表达趋势趋于一致,而BMP4基因mRNA和蛋白水平表达的变化刚好相反,可能是由于BMP4蛋白的表达还在增加中。
基因的表达受多种因素影响,BMPR-IB基因的过表达直接或间接通过某个途径导致转基因细胞中BMP4、GDF5、INH、IGF-I、TLR4、IFN、MHC和PNRP等基因表达的变化,其具体原因还需进一步研究。
4 结 论
本研究成功克隆了小尾寒羊BB型BMPR-IB(即FecB)基因完整编码区,构建了重组表达载体pEGFP-BMPR-IB,并实现了其在山羊成纤维细胞中的表达,为转BMPR-IB基因阳性细胞株和细胞系的建立提供了基础;RT-PCR和Westen blotting检测表明,BMPR-IB基因在山羊成纤维细胞中的表达能上调IGF-I和下调TLR4基因的表达,具体原因需进一步研究。
[1]TAVARÉ J M,FLETCHER L M,WELSH G I.Using green fluorescent protein to study intracellular signalling[J].JEndocrinol,2001,170(2):297-306.
[2]SOUZA C J,MACDOUGALL C,MACDOUGALL C,et al.The Booroola(FecB) phenotype is associated with a mutation in the bone morphogenetic receptor type 1B (BMPRIB) gene[J].JEndocrinol,2001,169(2):1-6.
[3]MULSANT P,LECERF F,FABRE S,et al.Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Mérino ewes[J].ProcNatlAcadSciUSA,2001,98(9):5104-5109.
[4]YI S E,LAPOLT P S,YOON B S,et al.The type I BMP receptor BMPR-IB is essential for female reproductive function [J].ProcNatlAcadSciUSA,2001,98(14):7994-7999.
[5]WILSON T,WU X Y,JUENGEL J L,et al.Highly prolific Booroola sheep have a mutation in the intracellular kinase domain of bone morphogenetic protein IB receptor (ALK-6) that is expressed in both oocytes and granulosa cells[J].BiolReprod, 2001,64(4):1225-1235.
[6]SMITH P,O W S,HUNDSON N L,et al.Effects of the Booroola gene (FecB) on body weight,ovarian development and hormone concentrations during fetal life[J].JReprodFertil,1993,98(1):41-54.
[7]王根林,毛鑫智,GEORGE H D,等.DNA分析发现我国湖羊和小尾寒羊存在Booroola (FecB)多胎基因[J].南京农业大学学报,2003,26(1):104-106.
WANG G L,MAO X Z,GEORGE H D,et al.DNA tests in Hu sheep and Han sheep(small tail) showed the existence of Booroola(FecB) mutation[J].JournalofNanjingAgriculturalUniversity,2003,26(1):104-106.(in Chinese)
[8]柳淑芳,姜运良,杜立新.BMPR-IB和BMP15基因作为小尾寒羊多胎性能候选基因的研究[ J ].遗传学报,2003,30(8):755-760.
LIU S F,JIANG Y L,DU L X.Studies ofBMPR-IBandBMP15 as candidate genes for fecundity in little tailed Han sheep[J].ActaGeneticaSinica,2003,30(8):755-760.(in Chinese)
[9]管峰,刘守仁,程瑞禾,等.绵羊BMPR-IB基因多态性及其与中国美利奴肉用多胎品系产羔数和生长发育的相关性[J].南京农业大学学报,2005,28(2):75-79.
GUAN F,LIU S R,CHENG R H,et al.Polymorphism of BMPR-IB gene and its relationship to litter size and growth and development in Chinese Merinomeat-Prolificacy strain[J].JournalofNanjingAgriculturalUniversity,2005,28(2):75-79.(in Chinese)
[10]王启贵,钟发刚,李辉,等.绵羊BMPR-IB基因多态性与其产羔数的相关研究[J].草食家畜,2003(2):20-23.
WANG Q G,ZHONG F G,LI H,et al.The polymorphism of BMPR-IB gene associated with litter size in sheep[J].Grass-FeedingLivestock,2003(2):20-23.(in Chinese)
[11]王金文,崔绪奎,张果平,等.对鲁西黑头肉羊育种工作的回顾与展望[J].中国草食动物科学专辑,2014(专刊):392-395.
WANG J W,CUI X K,ZHANG G P,et al.Review and prospect of Luxi black sheep breeding works[J].ChinaHerbivoreScience,2014(S1):392-395.(in Chinese)
[12]陈晓勇,孙洪新,田树军,等.BMPR1B基因在寒泊肉羊世代选育中的遗传变异及其与产羔性状的关联分析[J].河北农业大学学报,2015,38(2):99-102.
CHEN X Y,SUN H X,TIAN S J,et al.Association variations BMPR1B gene with litter size trait and genetic variations in different generations of Hanper mutton sheep[J].JournalofAgriculturalUniversityofHebei,2015,38(2):99-102.(in Chinese)
[13]李丽萍,称美玲,刘维全,等.云岭黑山羊BMPR-IB基因部分编码区的克隆及多态性分析[J].畜牧兽医学报,2007,38(5):452-457.
LI L P,CHENG M L,LIU W Q,et al.Molecular cloning and polymorphism analysis of the partial coding region ofBMPR-IBgene in Yunling black goat[J].ActaVeterinariaetZootechnicaSinica,2007,38(5):452-457.(in Chinese)
[14]储明星,方丽,叶素成.山羊高繁殖力骨形态发生蛋白受体IB候选基因的RFLP分析[J].农业生物技术学报,2006,14(1):139-140.
CHU M X,FANG L,YE S C.RFLP analysis on bone morphogentic protein receptor IB as a candidate gene for prolificacy in goats[J].JournalofAgriculturalBiotechnology,2006,14(1):139-140.(in Chinese)
[15]孟丽娜.5个候选基因在4个山羊品种的多态性分析[D].保定:河北农业大学,2014.
MENG L N.Polymorphism analysis of five candidate genes in four goats breeds[D].Baoding:Agricultural University of Hebei,2014.(in Chinese)
[16]李文杨,刘远,林仕欣,等.BMPR-IB,BMP15,GDF9基因作为福建省4个主要山羊品种多胎性能候选基因的研究[J].浙江农业学报,2012,24(6):975-979.
LI W Y,LIU Y,LIN S X,et al.Studies onBMPR-IB,BMP15 andGDF9 as candidate genes of fecundity in four breeds of goats in Fujian[J].ActaAgriculturaeZhejiangensis,2012,24(6):975-979.(in Chinese)
[17]于振兴,贺志锐,吾热力哈孜,等.湖羊FecB基因在新疆细毛羊胎儿成纤维细胞中的表达[J].动物医学进展,2012,33(6):99-102.(in Chinese)
YU Z X,HE Z R,WURELI H,et al.Expression of Hu sheep FecB gene in fetal fibroblasts of Xinjiang fine-wool sheep[J].ProgressinVeterinaryMedicine,2012,33(6):99-102.(in Chinese)
[18]李新秀.沉默BMPR-IB基因对猪卵巢颗粒细胞凋亡及BMP通路上相关基因表达的影[D].南京:南京农业大学,2010.
LI X X.Effects of BMPR-IB gene silencing by small interfering RNA on apoptosis of porcine follicular graunlosa cells and expression of BMP pathy-way-ralted genes[D].Nanjing:Nanjing Agricultural University,2010.(in Chinese)
[19]关伟军,马月辉,周雪雁,等.太行黑山羊成纤维细胞系建立与生物学特性研究[J].中国农业科技导报,2005,7(5):25-33.
GUAN W J,MA Y H,ZHOU X Y,et al.The establishment of fibroblast cell line and its biological characteristic research in Taihang black goat[J].ReviewofChinaAgriculturalScienceandTechnology,2005,7(5):25-33.(in Chinese)
[20]李世杰.发育相关基因在新生死亡体细胞克隆牛中的表达[D].北京:中国农业大学,2004.
LI S J.Aberrant gene expression in cloned bovine of neonatal death[D].Beijing:China Agricultural University,2004.(in Chinese)
[21]KAWA T,AKIRA S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].NatImmunol,2010,11(5):373-384.
[22]MAURISSE R,DE SEMIR D,EMAMEKHOO H,et al.Comparative transfection of DNA into primary and transformed mammalian cells from different lineages[J].BMCBiotechnol,2010,10:9.
(编辑郭云雁)
Cloning and Expression ofBMPR-IBGene in Cashmere Goat Fibroblast Cells
SUN Hong-xin1,2,WANG Hong-na1,ZHANG Ying-jie1*,LIU Yue-qin1,CHEN Xiao-yong2,DUN Wei-tao2
(1.CollegeofAnimalScienceandTechnology,AgriculturalUniversityofHebei,Baoding071001,China;2.HebeiInstituteofAnimalScienceandVeterinaryMedicine,Baoding071000,China)
The research was conducted to cloneBMPR-IBgene coding sequence of the Small-tailed Han sheep with BB genotype,construct the recombinant eukaryotic expression vectorwhich was transiently transfected into cashmere goat fibroblast cells,and detect the expression ofBMPR-IBand other genes.TheBMPR-IBgene was amplified by RT-PCR and the eukaryotic expression vector pEGFP-BMPR-IB was constructed by cloningBMPR-IBgene fragments into the pEGFP-N2vector frame,which were followed by the transfer of recombinant plasmids into goat fibroblast cells by liposome Lipofectamine LTX&PLUS.After transfection for 48 and 72 h,transfection cells were collected to extract RNA and total protein.Real-time quantitative PCR and Western blot approachs were used to identify the expression level of target genes and other related genes.The results showed thatBMPR-IBgene which was amplified including CDS region was about 1 550 bp in length,and highly homologous with the published sequences.Real-time PCR detection results showed that the expression ofBMPR-IBgene in transgenic cells were significantly higher than that in control group (P<0.01).The expression level ofIGF-Igene in transfected cells were significantly higher than that in control group (P<0.01),while the expression ofTLR4,IFN,MHC,PNRP,GDF5 andINHgenes were significantly lower (P<0.01).Western blot detection results showed that the expression of BMPR-IB and IGF-I in transgenic cells was higher than that in control group,although the expression of BMP4 and TLR4 decreased,the difference did not reach significant level (P>0.05).The result showed that expression vector ofBMPR-IBwas constructed successfully and the expression ofBMPR-IBgene in goat fibroblast cells was realized,which provide the basis for the preparation of positive cell strains,cell lines and transgenic animals.It is also concluded that the over-expression ofBMPR-IBgene up-regulates theIGF-Iexpression and down-regulates theTLR4 expression in transfected cells.
BMPR-IBgene;eukaryotic expression vector;cashmere goat fibroblast cells;expression
10.11843/j.issn.0366-6964.2016.06.006
2015-11-05
国家肉羊产业技术体系资助项目(CARS-39)
孙洪新(1978-),女,山东临清人,高级畜牧师,博士生,主要从事羊遗传繁育研究,E-mail:sdlqshx@126.com
张英杰,教授,博导,主要从事羊遗传育种及营养研究,E-mail:zhangyingjie66@126.com
S827;S813.3
A
0366-6964(2016)06-1124-09
