光声成像技术及其医学应用进展
2016-07-13曾礼漳杨思华
曾礼漳, 杨思华, 邢 达
(华南师范大学生物光子学研究院,激光生命科学研究所暨激光生命科学教育部重点实验室,广州 510631)
光声成像技术及其医学应用进展
曾礼漳, 杨思华*, 邢达
(华南师范大学生物光子学研究院,激光生命科学研究所暨激光生命科学教育部重点实验室,广州 510631)
摘要:光声成像技术是一种具有广泛应用前景的无损生物医学成像技术,其结合了纯光学成像高选择特性和纯超声成像中深穿透特性的优点,克服了光在组织中的高散射限制,实现了对活体深层组织的高分辨、高对比度成像.近年,光声成像技术得到了飞速发展,从技术层面到应用层面都在不断突破.文中阐述了光声成像技术的基本原理,介绍各种光声成像方法模式的发展现状,总结光声成像技术的优点并展望其在生物医学领域的应用前景及面临的挑战.
关键词:光声成像; 高分辨率; 生物医学
光声成像技术是即将临床应用的新一代医学影像方法.目前开展光声成像在生物医学方向研究的国家主要有美国、英国、中国、日本等.具有代表性的研究团队和他们的成果有:由美国华盛顿大学圣路易斯分校的WANG等设计开发的光声显微成像系统[1-2],美国休斯敦TomoWave实验室的ORAEVSKY等研发的基于多元阵列换能器和并行采集电路的Louisa 3D小动物与Louisa 3D乳腺光声成像系统[3-4],美国佛罗里达大学的JIANG等将有限元算法用于光声成像中[5-6],英国伦敦学院大学的Beard PC团队发展了基于Fabry Perot聚合物薄膜传感干涉仪的光声成像技术[7], 德国慕尼黑技术大学的RAZANSKY小组通过应用多波长成像以反映心脏、肿瘤的血流状况,同时像吲哚青绿 (ICG)、纳米壳和纳米棒等外源造影剂也被应用到光声成像中来解决一些诊断问题[8-11].
近10余年来,华南师范大学邢达教授课题组深入研究成像算法、探测模式以及应用基础等,取得了一些重要的科研成果:在算法方面,WANG等[12]提出将光声信号进行逆卷积的方法去除探测器脉冲响应对探测光声信号的影响,YANG等[13-14]成功地将小角度滤波反投影应用于多元线性阵列探测技术进行图像重建,使图像的分辨率得到大幅提高;在系统研发方面,YIN等[15]首次采用多元线性阵列探测器结合相控聚焦技术,实现了快速的光声信号采集;在应用方面,YANG等[16-17]首先将光声成像技术应用于脑损伤的无损检测,XIANG等[18]将光声成像引入光动力治疗中对血管损伤的检测,YIN等[19]将光声成像和双环检测系统相结合,实现了血氧饱和度的定点连续实时检测,2010年以来该课题组将预临床光声内窥镜系统用于离体肠癌组织以及正常肠组织的甄别[20],发展了基于扫描振镜的光声显微系统,实现了光学分辨率的光声成像,在国际上首次提出了光声成像检测生物组织粘弹性的新方法[21-23].目前,课题组利用光声粘弹成像方法开展识别易损动脉粥样硬化斑块的应用研究;发展了基于功能纳米探针的光声成像——光声分子成像,可以在活体层面对病理过程进行分子水平的定性和定量研究,将为实现目标疾病的早期诊断提供强大的技术支持[24-28];进一步发展了微型多光谱光声内窥成像系统,该系统用于检测心脑血管疾病,已经在动物模型中开展实验研究,取得重大研究成果[29],内窥光声成像系统目前已经开始着手临床研究.此外,华南师范大学唐志列教授研究小组[30]、福建师范大学的李晖教授研究小组[31]、天津大学的姚建全院士研究小组[32]、南开大学的方晖教授研究小组以及中国科学院深圳先进技术研究院的宋亮博士研究小组也在开展光声成像技术研究[33-35].
本文从光声成像技术的基本原理出发,简单介绍光声成像的研究热点问题,包括光声显微成像技术、光声粘弹成像成像技术、光声内窥成像技术、光声分子功能成像及光声多模态成像,并展望了光声成像技术的未来发展方向及亟待解决的问题.
1光声成像技术的原理
脉冲激光照射生物组织时,位于组织体内的吸收体吸收脉冲光能量,产生瞬时升温并膨胀,产生超声波.这时位于组织体表面的超声探测器可以接收到这些外传的超声波,并根据探测到的光声信号来重建组织内光能量吸收分布的图像[12-15](图 1).该方法有机地结合了光学成像和声学成像的特点,可提供深层组织高分辨率和高对比度的组织断层图像,通过光声成像得到高分辨率和高对比度的组织图像,从原理上避开了光散射的影响,突破了高分辨率光学成像深度“软极限”(约1 mm),可实现50 mm的深层活体内组织成像.因此,光声成像必将带来生物医学影像领域的一次革新.光声成像技术引起了众多研究者的关注,成为近年来医学成像领域的研究热点.
光声成像将光学成像和超声成像的优点结合起来,一方面,在光声成像中用来重建图像的信号是超声信号,生理组织对超声信号的散射要比对光信号的散射低2~3个数量级,因此可提供较深的成像深度和较高的空间分辨率;另一方面,相比纯超声成像,光声图像中不同组织间的光学对比度较高.与传统医学影像技术相比,光声成像具有如下特点:(1)光声成像能够实现高特异性光谱组织的选择激发,不仅可以反映组织结构特征,更能够实现功能成像,开创一种有别于传统医学影像技术的新成像方法与技术手段.(2)光声成像结合了光学成像和声学成像的优点,可突破激光共聚焦显微成像、双光子激发显微成像、光学弱相干层析成像等高分辨率光学成像深度“软”极限(约1 mm);另一方面,拥有更高的分辨率,其图像分辨率可达到亚微米、微米量级,可实现高分辨率的分子成像.(3)光声成像是一种非入侵、非电离的无损伤的成像技术.因此,无损光声成像作为一种新兴的医学影像技术在一定深度下获得足够高的分辨率和图像对比度,图像传递的信息量大,可以提供形态及功能信息,将在生物医学应用领域具有广阔的应用前景.
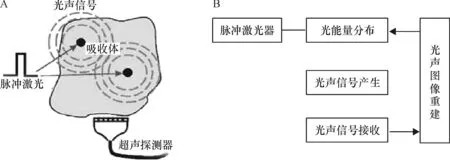
图1 光声信号激发与探测(A)和光声成像实现过程示意图(B)
2光声成像模式
目前光声成像技术主要集中在以下几个方面:光声显微成像、光声粘弹成像、光声内窥成像、光声分子功能成像及光声多模态联合成像技术.
2.1光声显微成像
光声显微成像技术是光声成像技术的重要组成部分[21,36],其原理图如图2所示.光声显微成像结合了纯光学成像高对比度特性和纯超声成像高穿透深度特性的优点,从原理上避开了光散射的影响,可以提供高分辨率和高对比度的组织成像.与常用的纯光学高分辨显微成像技术,如激光共聚焦显微成像、双光子激发显微成像、光学干层析成像等相比,光声显微成像分辨率可达到微米甚至亚微米,成像深度达到1~2 mm,成像深度/分辨率达到100以上.光声显微镜可直接成像黑色素、血色素等人体内源性分子,无需引进外源性染料分子或者其他造影剂.

图2 光声显微成像系统[21]1
2.2光声粘弹成像
生物组织的粘弹性在很大程度上依赖于组织的分子构成以及这些分子构成块在宏观、微观上的组织形式.光声粘弹成像作为一种新的成像方法,其成像原理图如图3所示[22-23].光声粘弹成像通过检测光声激发与光声信号产生过程中的相位延迟来获取有关组织的粘弹性信息进行成像,弥补了传统的光声成像不能提供组织粘弹特性的不足.生物组织粘弹特性的研究引起医学界的广泛关注,如正常细胞比癌细胞以及药物作用的癌细胞的粘弹性系数均有明显差异.光声粘弹成像以相位作为对比度,反应的是力学特性信息;光声吸收成像以光声信号幅值作为对比度,反映的是结构形态信息.2种成像模式结合互补检测可以提高检测的准确性和完整性,具有很大的临床应用前景.

图3 光声粘弹成像系统[23]2565
2.3光声内窥成像
光声内窥成像技术将会成为光声成像技术的主要发展方向[29],将主要用于心脑血管疾病中易损斑块的早期检测与诊断以及胃肠癌诊断方面,血管内光声成像系统结构见图4.大量研究证明,易损斑块破裂是急性心脑血管事件的主要发病机制,约70%的致命性急性心肌梗塞和冠心病猝死都由其引起.易损斑块就像体内的定时炸弹,会导致健康人在毫无征兆的情况下突然死亡.因此,在易损斑块发展早期对其进行识别是心脑血管界面临的核心挑战.
现有的易损斑块影像识别手段如CT、MRI及IVUS等虽然具备各自的优势,但依然无法满足对易损斑块研究的需要.光声血管内窥成像针对现有斑块组分成像方法与技术存在的缺点和不足,可有效显示斑块微细结构,定量分析胶原、脂质和纤维的相对与绝对含量,为斑块组织成分的精确识别和易损性的早期判断提供新的高特异性、敏感性和高分辨的在体检测方法.
2.4光声分子成像
光声成像技术与分子标记技术结合是光声成像发展的一个新方向——光声分子成像.光声分子成像有望在活体层面实现分子水平的病理成像[25,37-38],可使疾病的诊断水平提前至分子异常阶段,可在体内直接观察疾病的起因、发生、发展等一系列过程,并观察疾病的基因、分子水平异常变化和特征,是一种非侵入性诊断疾病的方法.光声分子成像的基本思想是将靶向分子特异性抗体或配体连接到光声造影剂表面构成具有靶向性光声探针,依靠抗原-抗体或配体-受体之间的特异性结合,使光声探针主动结合到病变组织特异分子位置,从而实现特异性光声分子成像.光声分子成像技术的关键在于构建高光-声转化效率的探针.结合分子标记技术,再对检测目标物分子实现选择性激发,显著提高目标分子和正常组织的选择性光吸收差异,提高激发效率和光声强度,从而提高光声成像的对比度和分辨率,实现高灵敏度、高选择性的光声分子成像.光声分子成像技术将为分子影像技术研究开辟一条全新的途径,可望在细胞与分子水平对病变组织的改变进行观察和分析,并得出早期诊断信息.
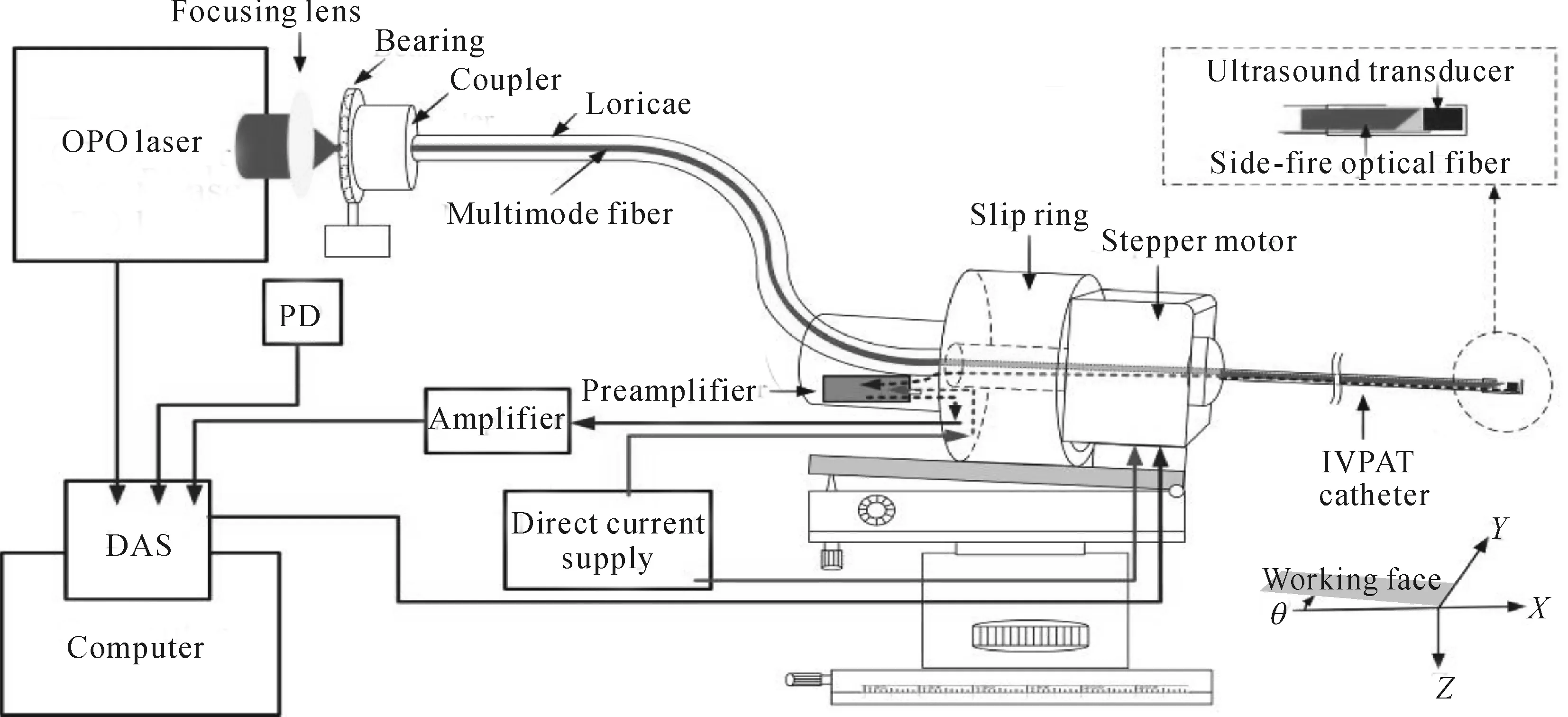
图4 血管内光声成像系统示意图
2.5光声与多模态联合成像
光声与其他成像方法结合实现多模态联合成像,是光声成像向纵深发展的一个重要方向[39-41].光声与多模态联合成像可同时进行结构和功能成像,为肿瘤诊断等生理、病理检测提供最佳的灵敏度和特异性.多模态成像技术将不同的成像模态集成到同一个成像系统,由于每一种成像模态(X光、超声、MRI和PET等)都有基于特定物质波和人体相互作用的规律,基于这些不同规律研制的成像技术和设备观测人体时得到的人体的信息也就不完全相同.可见,光声成像与多模态联合成像是目前生物医学成像的发展趋势.此外,光声成像反映的光吸收率,在理论上能与测量散射、荧光和偏振的光学成像技术相融合,可形成一套集组织结构和蛋白质分子功能成像于一体的活体高分辨深度层析成像系统,也有待进一步深入研究.
3光声成像技术在医学的应用
光声断层成像清晰地探测到活体小鼠脑血管分布,根据血容量、血流、血氧等参数反映了脑功能信息(图 5)[16-17],光声成像技术将为脑功能研究提供新的技术手段.基于光声成像反映光吸收的特性,研究者发展了多波长光声成像技术并且应用于肿瘤成像,获得高分辨率的肿瘤新生血管的形态学信息、由血氧饱和度反映的肿瘤代谢信息.光声成像技术为肿瘤的早期诊断与治疗监控提供了强大的技术支持.多波长光声成像在检测活体深层荧光蛋白表达以及基因活性方面取得令人振奋的效果,多波长内窥光声成像针对动脉粥样硬化斑块进行检测,通过光谱解析获得了动脉粥样硬化斑块组分信息,为光声内窥成像应用于心脑血管疾病检测奠定了实验基础[29](图 6).
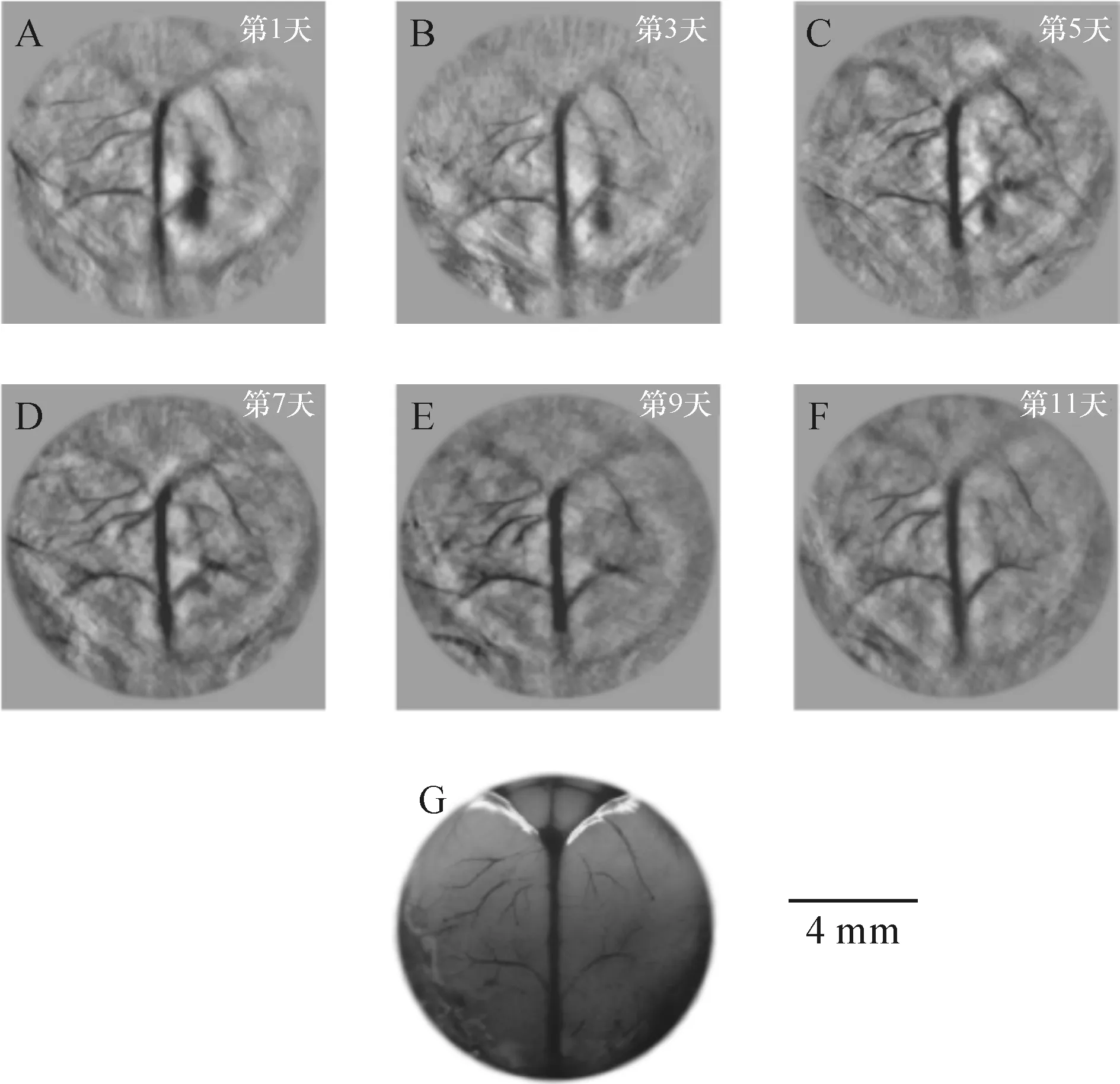
A~F分别为小鼠损伤后第1、3、5、7、9、11天的脑部皮层血管光声重建图像;G为损伤恢复后小鼠脑部解剖照片.
图5光声脑部损伤恢复过程的连续监控成像[16]3
Figure 5Continuous monitoring and imaging of the recovery process of photoacoustic brain injury[16]3

A,C,E和G 分别为0、5、10、15周的脂质相对浓度地图;B,D,F和H 为对应的油红O染色结果.
图6血管内光声断层成像监控动脉粥样硬化发展过程[29]386
Figure 6Developing process of lipid accumulating and arterial wall remodeling in relation to the duration of high-fat diet monitored by IVPAT and histology[29]386
随着光声显微镜的出现,光声成像发展到了一个新的阶段.光声显微镜将横向分辨率提高了一个数量级(达到45 μm).利用多波长光声显微成像技术不仅可以获得高分辨率黑色素瘤的实体和周围微血管的形态结构图像(图7),还可以得到活体动物的血氧饱和度信息.亚波长光学分辨率光声显微镜的出现将光声成像技术的分辨率提高到前所未有的高度(221 nm).光学分辨率的光声显微镜可以轻而易举地对黑色素瘤细胞和血红细胞进行单细胞成像.光声纳米探针的发展为光声成像增添了活力.基于外源光声纳米探针,研究者们发展了光声分子成像和光声治疗.光声分子成像实现了在磁环境中对在血液中循环的肿瘤细胞进行探测以确定肿瘤细胞是否转移,最后发展成了光声流式细胞仪.光声治疗利用光声纳米探针的光声效应来选择性杀死肿瘤细胞,开创了一种选择性好、无副作用的肿瘤治疗方法.
作为新一代的无损医学成像技术,光声成像可以无标记地对单个细胞成像、对血管形态的高分辨成像、对不同组织的成分进行解析和对血液参数高特异性的功能检测,实现了从细胞到组织结构的多尺度示踪及功能成像,可用于研究动物体脑功能、肿瘤细胞转移和肿瘤形态结构,生理、病理特征,血流异常、药物代谢功能、深层荧光蛋白表达、基因活性等方面的内容,并为生物医学应用领域提供了重要研究及监测手段,具有良好的发展前景和广泛的生物医学应用潜力.预测光声成像技术将会引起基础生命科学以及临床医学影像领域的变革.
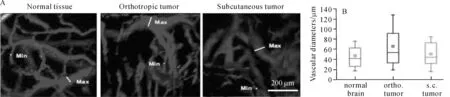
图7 血管光声图像(A)和血管直径统计比较(B)[42]
4展望
光声成像技术结合了光学成像高对比度特性和超声成像高穿透深度特性的优点,在生物医学中具有广阔的应用前景.目前光声成像已经显示了一个最重要的应用点:光声血管成像.光声血管成像可以应用到心脑血管疾病检测,如斑块组分的光声成像识别;脑功能成像以及肿瘤早期检测和治疗监控.在斑块组分识别方面,光声成像可望取代OCT,作为IVUS的有力补充.肿瘤早期检测方面,光声成像是乳腺X射线照相术有益的补充,前哨淋巴腺成像将是利用光声成像检测肿瘤转移较为合适的应用对象.光声成像还能够提供大脑的结构和功能成像,而且它们是廉价的、高分辨率、实时成像系统,甚至可以做成病床边的便携式仪器.此外作为光声成像的扩展,射频诱导的热声成像是一种能够实现更高成像深度的成像模式.光声成像与分子标记技术相结合,可靶向性定位重大疾病的特征分子,将有可能实现对重大疾病的早期特异性检测,具有良好的发展前景和广泛的生物医学应用潜力.
光声成像技术的发展虽然已日趋完善,但依然面临大量的难题.如:在光声显微成像方面,如何提高光声显微成像的成像速度使其更加适应临床诊断及检测,发展非接触式光声显微成像技术使其更加方便实际应用;在光声粘弹成像方面,如何提高粘弹成像的检测灵敏度及准确度,开发内窥式粘弹成像技术提供心血管疾病检测的新方法;在内窥成像方面,如何解决血管内血液对光声成像的影响问题及脉冲激光能量的控制与斑块破裂风险评估问题等等.随着技术的不断发展及研究的不断深入,这些问题都将能有所突破与改善.
参考文献:
[1]WANG X, PANG Y, KU G, et al. Noninvasive laser-induced photoacoustic tomography for structural and functional in vivo imaging of the brain[J].Nature Biotechnology, 2003, 21(7): 803-806.
[2]ZHANG H F, MASLOV K, STOICA G, et al. Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging[J]. Nature Biotechnology, 2006, 24(7): 848-851.
[3]BRECHT H P, SU R, FRONHEISER M, et al. Whole-body three-dimensional optoacoustic tomography system for small animals[J]. Journal of Biomedical Optics, 2009, 14(6): Art 064007,8pp.
[4]FRONHEISER M P, ERMILOV S A, BRECHT H P, et al. Real-time optoacoustic monitoring and three-dimensional mapping of a human arm vasculature[J]. Journal of Biomedical Optics, 2010, 15(2): Art 021305,7pp.
[5]TANG J, XI L, ZHOU J, et al. Noninvasive high-speed photoacoustic tomography of cerebral hemodynamics in awake-moving rats[J]. Journal of Cerebral Blood Flow & Metabolism, 2015, 35(8): 1224-1232.
[6]YUAN Z, JIANG H. Three-dimensional finite-element-based photoacoustic tomography:reconstruction algorithm and simulations[J]. Medical Physics, 2007, 34(2): 538-546.
[7]ZHANG E, LAUFER J, BEARD P. Backward-mode multiwavelength photoacoustic scanner using a planar Fabry-Perot polymer film ultrasound sensor for high-resolution three-dimensional imaging of biological tissues[J]. Applied Optics, 2008, 47(4): 561-577.[8]RAZANSKY D, DISTEL M, VINEGONI C, et al. Multispectral opto-acoustic tomography of deep-seated fluorescent proteins in vivo[J]. Nature Photonics, 2009, 3(7): 412-417.
[9]MA R, TARUTTIS A, NTZIACHRISTOS V, et al. Multispectral optoacoustic tomography (MSOT) scanner for whole-body small animal imaging[J]. Optics Express, 2009, 17(24): 21414-21426.
[10]TARUTTIS A, HERZOG E, RAZANSKY D, et al. Real-time imaging of cardiovascular dynamics and circulating gold nanorods with multispectral optoacoustic tomography[J]. Optics Express, 2010, 18(19): 19592-19602.
[11]RAZANSKY D, BUEHLER A, NTZIACHRISTOS V. Volumetric real-time multispectral optoacoustic tomography of biomarkers[J]. Nature Protocols, 2011, 6(8): 1121-1129.
[12]WANG Y, XING D, ZENG Y G, et al. Photoacoustic imaging with deconvolution algorithm[J]. Physics in Medicine and Biology, 2004, 49: 3117-3124.
[13]YANG D W, XING, D, GU H M,et al. Fast multielement phase-controlled photoacoustic imaging based on limited-field-filtered back-projection algorithm[J]. Applied Physics Letters, 2005, 87(19): Art 194101,3pp.
[14]YANG D W, XING D, YANG S H,et al. Fast full-view photoacoustic imaging by combined scanning with a linear transducer array[J]. Optics Express, 2007, 15(23): 15566-15575.
[15]YIN B Z, XING D, WANG Y, et al. Fast photoacoustic imaging system based on 320-element linear transducer array[J]. Physics in Medicine and Biology, 2004, 49(7): 1339.
[16]YANG S H, XING D, LAO Y Q, et al. Noninvasive monitoring of traumatic brain injury and post-traumatic rehabilitation with laser-induced photoacoustic imaging[J]. Applied Physics Letters, 2007, 90(24): Art 243902,3pp.
[17]YANG S H, XING D, ZHOU Q, et al. Functional imaging of cerebrovascular activities in small animals using high-resolution photoacoustic tomography[J]. Medical Physics, 2007, 34(8): 3294-3301.
[18]XIANG L Z, XING D, GU H M, et al. Real-time optoacoustic monitoring of vascular damage during photodynamic therapy treatment of tumor[J]. Journal of Biomedical Optics, 2007, 12(1): Art 014001,8pp.
[19]YIN G Z, XING D, YANG S H. Dynamic monitoring of blood oxygen saturation in vivo using double-ring photoacoustic sensor[J]. Journal of Applied Physics, 2009, 106(1): Art 013109,5pp.
[20]YUAN Y, YANG S H, XING D. Preclinical photoacoustic imaging endoscope based on acousto-optic coaxial system using ring transducer array[J]. Optics Letters, 2010, 35(13): 2266-2268.
[21]YUAN Y, YANG S H, XING D. Optical-resolution photoacoustic microscopy based on two-dimensional scanning galvanometer[J]. Applied Physics Letters, 2012, 100(2): Art 023702,3pp.
[22]GAO G D, YANG S H, XING D. Viscoelasticity imaging of biological tissues with phase-resolved photoacoustic measurement[J]. Optics Letters, 2011, 36(17): 3341-3343.
[23]ZHAO Y, YANG S H, CHEN C J, et al. Simultaneous optical absorption and viscoelasticity imaging based on photoacoustic lock-in measurement[J]. Optics Letters, 2014, 39(9): 2565-2568.
[24]XIANG L Z, YUAN Y, XING D, et al. Photoacoustic molecular imaging with antibody-functionalized single-walled carbon nanotubes for early diagnosis of tumor[J]. Journal of Biomedical Optics, 2009, 14(2): Art 021008,7pp.[25]HUANG G J, SI Z, YANG S H, et al. Dextran based pH-sensitive near-infrared nanoprobe for in vivo differential-absorption dual-wavelength photoacoustic imaging of tumors[J]. Journal of Materials Chemistry, 2012, 22(42): 22575-22581.
[26]ZHOU T, WU B Y, XING D. Bio-modified Fe3O4core/Au shell nanoparticles for targeting and multimodal imaging of cancer cells[J]. Journal of Materials Chemistry, 2012, 22(2): 470-477.
[27]YANG S H, YE F, XING D. Intracellular label-free gold nanorods imaging with photoacoustic microscopy[J]. Optics Express, 2012, 20(9): 10370-10375.
[28]QIN H, ZHOU T, YANG S H, et al. Gadolinium (III)-gold nanorods for MRI and photoacoustic imaging dual-modality detection of macrophages in atherosclerotic inflammation[J].Nanomedicine, 2013, 8(10): 1611-1624.
[29]ZHANG J, YANG S H, JI X R, et al. Characterization of lipid-rich aortic plaques by intravascular photoacoustic tomography: ex vivo and in vivo validation in a rabbit atherosclerosis model with histologic correlation[J]. Journal of the American College of Cardiology, 2014, 64(4): 385-390.
[30]TANG H, TANG Z, WU Y, et al. Differential photoacoustic microscopy technique[J]. Optics Letters, 2013, 38(9): 1503-1505.
[31]XU X H, LI H. Scanning photoacoustic mammography with a focused transducer featuring extended focal zone[J]. Acta Physica Sinica, 2008, 7: 109.
[32]SU Y, ZHANG F, XU K, et al. A photoacoustic tomography system for imaging of biological tissues[J]. Journal of Physics D: Applied Physics, 2005, 38(15): 2640.
[33]LI Y, FANG H. Photoacoustic pulse wave forming along the rotation axis of an ellipsoid droplet: a geometric calculation study[J]. Applied Optics, 2013, 52(34): 8258-8269.
[34]SHENG Z, SONG L, ZHENG J, et al. Protein-assisted fabrication of nano-reduced graphene oxide for combined in vivo photoacoustic imaging and photothermal therapy[J]. Biomaterials, 2013, 34(21): 5236-5243.
[35]MENG J, WANG L V, YING L, et al. Compressed-sensing photoacoustic computed tomography in vivo with partially known support[J]. Optics Express, 2012, 20(15): 16510-16523.
[36]CHEN Z J, YANG S H, XING D. In vivo detection of hemoglobin oxygen saturation and carboxyhemoglobin saturation with multiwavelength photoacoustic microscopy[J]. Optics Letters, 2012, 37: 3414-3416.
[37]ZHOU F F, WU S N, YUAN Y, et al. Mitochondria targeting photoacoustic therapy using single-walled carbon nanotubes[J].Small, 2012, 8(10): 1543-1550.
[38]ZHONG J P, YANG S H, ZHENG X H, et al. In vivo photoacoustic therapy with cancer-targeted indocyanine green-containing nanoparticles[J]. Nanomedicine, 2013, 8(6): 903-919.[39]CHEN Z J, YANG S H, WANG Y, et al. All-optically integrated photoacoustic microscopy and optical coherence tomography based on a single Michelson detector[J]. Optics Letters, 2015, 40:2838-2841.
[40]QIN H, ZHOU T, YANG S H, et al. GdIII-gold nanorods for MRI-IVPAI dual-modality detection of macrophages in atherosclerotic plaques[J]. Nanomedicine, 2013, 8(10): 1611-1624.
[41]HUANG G J, YANG S H, YUAN Y, et al. Combining x-ray and photoacoustics for in vivo tumor imaging with gold nanorods[J]. Applied Physics Letters,2011,99:Art 123701,3pp.
[42]HUANG C Y, QIN H, QIAN J,et al.Multi-parametric imaging of the invasiveness-permissive acidic microenvironment in human glioma xenografts[J].Rsc Advances, 2015, 5(69):55670.
【中文责编:庄晓琼 英文责编:肖菁】
Progress on Photoacoustic Imaging and Its Biomedical Application
ZENG Lizhang, YANG Sihua*, XING Da
(MOE Key Laboratory of Laser Life Science and Institute of Laser Life Science,College of Biophotonics, South China Normal University, Guangzhou 510631, China)
Abstract:Photoacoustic imaging (PAI) is a kind of nondestructive biomedical imaging technology with wide application prospect. It overcomes the optical diffusion limit and provides deeper tissue imaging with high spatial resolution by integrating high selectivity of optical imaging with deep penetrating of ultrasonic imaging. PAI has potential for clinical application. Recently, PAI technology is developed fastly in methodology and medical applications.The principle and development status of PAI are described in this paper. Finally, the advantages of the PAI are summarized, and the application prospects of PAI in biomedical field are discussed.
Key words:photoacoustic imaging; high spatial resolution; biomedical
收稿日期:2016-01-12《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
基金项目:国家科技部重点基础研究973计划项目(2011CB910402,2010CB732602);教育部“长江学者与创新团队发展计划”项目(IRT0829)
*通讯作者:杨思华,研究员,Email:yangsh@scnu.edu.cn.
中图分类号:O439
文献标志码:A
文章编号:1000-5463(2016)01-0009-07
