骨髓间充质细胞对大鼠急性脊髓损伤保护作用的机制探讨
2016-07-13张桂通刘佳张晓燕张志成李放孟繁星孙移坤孙天胜
张桂通 刘佳 张晓燕 张志成 李放 孟繁星 孙移坤 孙天胜
骨髓间充质细胞对大鼠急性脊髓损伤保护作用的机制探讨
张桂通 刘佳 张晓燕 张志成 李放 孟繁星 孙移坤 孙天胜
【摘要】目的 探讨骨髓间充质细胞对大鼠急性脊髓损伤(spinal cord injury,SCI)的保护作用及其可能机制。方法将60只雌性SD大鼠随机分为模型组(SCI组)、骨髓间充质细胞组(BMSCs组)和假手术组(Sham组),每组各20只。改良Allen's打击法打击SD大鼠后建立脊髓损伤模型,分别于术后1天起进行大鼠后肢运动功能(BBB评分)评估,并于术后14天行步态分析,脊髓损伤后6、12h酶联免疫吸附试验(ELISA)检测脊髓组织的髓过氧化物酶(MPO)、脂质过氧化物酶(MDA)和超氧化物歧化酶(SOD)活性,检测肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素10(IL-10)水平。HE染色观察病理变化情况。结果与SCI组相比,BMSCs组大鼠脊髓损伤后12h脊髓组织MPO含量由(149.7±28.4)nmol/mg降至(116.0±29.2)nmol/mg。MDA含量由(58.1±3.3)U/g降至(41.7±2.6)U/g。SOD水平由(194.6±14.3)U/mg升至(362.0±13.6)U/mg。脊髓损伤后6h的TNF-α水平由(439.8±12.8)pg/ml降至(314.6±17.6)pg/ml。IL-6 水平由(364.7±16.9)pg/ml降至(232.9±15.2)pg/ml。IL-10 水平由(291.3±9.8)pg/ml升至(377.9±17.9)pg/ml。光镜下脊髓组织损伤程度降低;脊髓损伤后14天BBB评分及Catwalk步态分析结果,差异有统计学意义(P<0.05)。结论BMSCs对脊髓损伤具有保护作用,改善其运动功能,可能是通过抑制炎症及氧化应激反应。
【关键词】间充质基质细胞;脊髓损伤;大鼠
脊髓损伤(spinal cord injury,SCI)是脊椎外科常见的急重症,致残率较高,治疗困难,是医学界的一大难题[1]。脊髓损伤后的病理生理机制相当复杂,其中继发反应是导致脊髓组织结构破坏及最终出现神经功能障碍的主要原因,如何调控继发反应一直是脊髓损伤治疗领域的研究热点[2-4]。目前,应用于脊髓损伤治疗一线药物是甲泼尼龙,但应用后并发症较多,因此是否作为脊髓损伤的常规药物仍存在争议[5-6]。基于上述原因,探寻更加安全有效的治疗手段迫在眉睫。
骨髓间充质细胞(bone marrow mesenchymal stromal cells,BMSCs)作为一种安全有效的炎症调节与免疫调节手段已经广受关注,并在部分炎症性疾病中取得了较好的疗效。在脊髓损伤的治疗领域,BMSCs 相关的研究一直集中在促进神经组织的修复和再生,也取得了一定的进展。多个研究团队的结果已经证实,BMSCs移植能够有效促进大鼠脊髓损伤后的轴突再生以及后肢运动功能恢复[7]。目前为止,关于BMSCs在脊髓损伤中的神经保护作用及相关机制的探讨较少。因此,本研究通过采用改良的Allen's打击法[8]建立大鼠脊T10节段髓损伤模型,观察BMSCs对脊髓损伤大鼠的保护作用和炎症反应及运动功能的影响,进一步揭示其作用机制。
材料与方法
一、实验动物及分组
2个月龄健康雌性SD大鼠60只,体质量220~260g,由北京海旺动物实验动物养殖有限公司提供[许可证号:SCXK(京)2009-017]。自由取水、进食,适应性饲养2周。按随机数字表,随机分为3组:模型组(SCI组)、BMSCs组和假手术组(Sham组),每组各20只。
二、红色荧光BMSCs的体外分离培养与鉴定
选择6~8周健康雄性C57小鼠6只,由清华大学医学院提供。脱臼处死,即刻在无菌条件取C57小鼠股骨,剔除附着的肌肉,用小鼠间充质干细胞专用培养液充分冲洗骨髓腔,将细胞用7号针头吹打成单个核细胞,调整细胞浓度为1×109L-1接种于10ml的培养皿中,置入37℃,饱和湿度的体积分数 5%的CO2培养箱中,2天首次用缓冲液 PBS洗净非贴壁细胞换液,以后每隔 2天换液1次,每次换液时洗净非贴壁细胞。待细胞汇合率达80%~90%再用PBS洗涤3次,用含EDTA的0.25%胰蛋白酶消化后,收集细胞悬液,以402×g,离心5min,弃上清液,计数,调节细胞密度为5×104/cm2接种,通过3代传代对细胞进行纯化。在倒置显微镜下观察BMSCs的形态学特征。流式细胞仪检细胞表面标志。
三、模型制备及干预
根据Gruner的改良的Allen's打击法制备脊髓损伤模型:10%水合氯醛0.3ml/100g腹腔内注射,腰背部备皮,取俯卧位固定于手术台,碘伏及酒精消毒皮肤后,待麻醉后,取T10部位行后正中2~3cm切口,咬处T10椎板,暴露相应节段脊髓,采用 250g相应节Now York University 打击器25mm高度打击,撞击区脊髓血肿,尾部出现摆动,躯体及双下肢呈现抽搐,痉挛表示造模成功。关闭伤口,单笼饲养。BMSCs组于术后即刻给予尾静脉注射BMSCs(5.0Cs单6/只)2ml。模型组于脊髓损伤后给予等量0.9%氯化钠溶液腹腔注射。空白对照组仅行T10椎板摘除,不行脊髓损伤。模型制作成功后,每日3次人工挤压膀胱排尿,直至膀胱反射恢复(约1周时间)。背部皮下注射青霉素(5kU/只),连续3天,预防感染。
四、大鼠后肢运动评分(BBB评分)及Catwalk系统步态分析
将各组大鼠于脊髓损伤前3天(每日16时),置于开放的平板适应环境,15min,减少实验动物的不适所导致的评分差异。分别于术后1、3、5、7、14天对大鼠进行运动评分(BBB评分,5只/组),评估大鼠后肢各关节功能活动、协调运动和尾部支配情况等。造模成功后14天3组分别接受Catwalk系统步态分析(5 只/组)。每只大鼠接受至少3次评估,每次必须连续的走完设定好的长度范围的分析平板,整个实验过程在暗室中进行。Catwalk系统在识别并标记出每一个脚印后,将自动产生一系列步态参数,包括:每个爪子各自的相对空间关系、爪子之间的相对空间关系、四肢间的协调性、时间参数等[9]。
五、组织学检测
造模成功后3天,每组各取5只大鼠,水合氯醛麻醉,经左心室灌注0.9%氯化钠约200ml,后以4%多聚甲醛200ml灌注,然后以损伤区为中心分离脊髓组织1cm,固定于4%多聚甲醛48h,蔗糖梯度脱水,OCT包埋剂包埋,行冰冻切片10剂包,HE染色,观察脊髓组织病理学改变。
六、化学比色法测定脊髓髓过氧化物酶(MPO)、脂质过氧化物酶(MDA)及超氧化物歧化酶(SOD)含量与酶联免疫吸附试验(ELISA)
检测脊髓TNF-α、IL-6、IL-10含量于各取材12h、3天,水合氯醛麻醉后处死大鼠,取损伤段脊髓组织,用0.9%氯化钠溶液配制成10%脊髓匀浆液,将匀浆液以有效离心半径5cm、4000r/min离心30min取上清液,参照试剂盒说明严格操作测试其浓度。
七、统计学分析
采用SPSS17.0软件进行处理,计算资料以x-±s表示。炎症因子水平及脊髓组织损伤评分的组间比较采用t检验。P<0.05为差异有统计学意义。
结 果
一、BMSCs培养后检测
BMSCs的形态学观察,贴壁细胞呈单个分散或成簇生长,细胞形态均匀,多呈长梭形、纺锤形。红光激发后CD29单克隆抗体显示绿色荧光,CD34单克隆抗体不显影。流式细胞仪检测到CD29阳性的细胞占全部细胞95%以上,CD34阳性的细胞为3%(图1)。
二、BBB 评分
与Sham组相比,脊髓损伤后大鼠后肢BBB评分明显降低(P<0.05);BMSCs 组大鼠术后 BBB 评分成增高趋势,并在14天明显高于SCI组(P<0.05)(图2)。术后14天Catwalk系统步态分析,脊髓损伤后大鼠四肢平均压力明显降低(P<0.05),但 BMSCs组大鼠明显高于 SCI 组(P<0.05)(图3,4)。

图2 3组大鼠的BBB评分对比Sham组(aP < 0.05);对比SCI组(bP < 0.05)Fig.2 BBB score of 3 groups of rats(aP < 0.05), vs. Sham group;(bP < 0.05), vs SCI group

图3 3组大鼠步态分析仪观察步态 BMSCs 组较 SCI 组的步态有明显改善Fig.3 Gait analysis was used to observe the gait of 3 groups of rats. Signifcant improvement, BMSCs group vs. SCI group
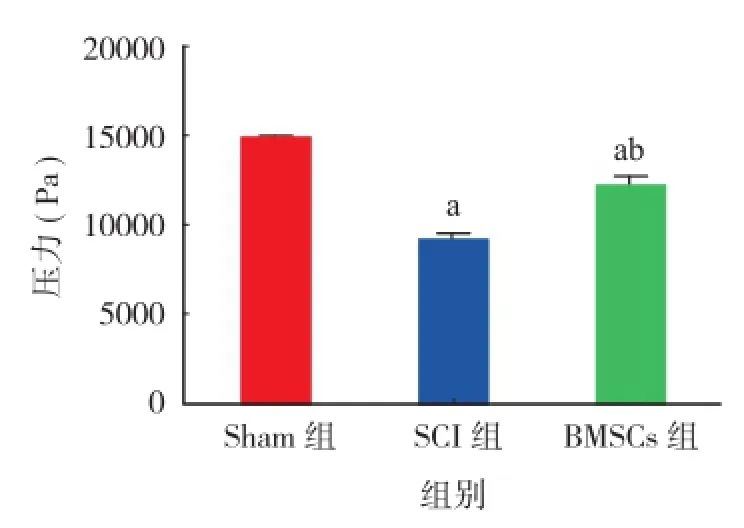
图4 3组大鼠四肢的平均压力对比 Sham 组(aP < 0.05);对比SCI 组(bP < 0.05)Fig.4 The mean pressure of the limbs of the 3 groups of rats(aP <0.05), vs. Sham group;(bP < 0.05), vs SCI group

图 1a:BMSCs 细胞形态(× 200);b:细胞 CD29 BMSCs(免疫荧光 × 200);c:细胞 CD34 BMSCs(免疫荧光 × 200)Fig.1 a: Morphology of BMSCs cells under light microscope; b: Cellular immune fuorescence BMSCs CD29(× 200); c: Cellular immune fuorescence BMSCs CD34(× 200)
三、脊髓病理形态
Sham 组大鼠脊髓灰白质交界清楚,没有出血及水肿灶,神经元丰富,核仁清晰,无核固缩及坏死现象;SCI 组可见散在的出血灶,间质水肿并有空腔形成,大量炎性细胞浸润,胶质细胞增生,正常的细胞形态严重破坏,细胞变性坏死严重,神经元大量丢失甚至缺如;BMSCs 组与 SCI 组相比,炎性细胞明显减少,胶质细胞增生不明显,细胞排列较为整齐和规则,变性坏死的细胞明显减少(图5)。
四、脊髓中 MPO、MDA、SOD 含量
SCI 组大鼠脊髓组织 MPO、MDA 含量较 Sham组明显升高,SOD 含量明显降低(P<0.05);BMSCs组大鼠脊髓组织 MPO、MDA 含量较 SCI 组降低(P<0.05),但高于 Sham 组;SOD 含量较 SCI 组升高(P<0.05),但仍低于 Sham 组水平;造模成功后 14 天,损伤组 MPO、MDA 含量逐渐降低,而BNSCs 组 SOD 含量逐步增高(图6,7,8)。
五、脊髓中 TNF-、IL-6、IL-10 水平变化
与 Sham 组相比,脊髓损伤后大鼠血清 TNF-清、IL-6 及 IL-10 水平明显升高(P<0.05);BMSCs 组 TNF-s、IL-6 水平较 SCI 组降低,IL-10 水平升高(P<0.05)(图9)。
讨 论
脊髓受损后,在错综复杂的继发反应过程中,炎症和氧化应激反应占据了核心地位,二者与其它机制相互作用,引起级联放大瀑布效应,进一步加重脊髓损伤程度[10-12]。目前应用最广泛的治疗药物为甲泼尼龙,其被认为可以阻滞脂质过氧化、减轻炎症反应、减少出血[5-6,13],但因该类药物作用带来的收益和风险的矛盾,其对于脊髓损伤预后的影响究竟如何尚未完全清楚。因此,多年来对于脊髓损伤患者是否应用MPO及其用量是一个备受争议的话题[14-15]。为此,学界一直在努力寻找更加行之有效的治疗手段,其中细胞治疗备受关注。

图6 3组大鼠脊髓组织的 MPO 检测对比 Sham 组(aP < 0.05);对比 SCI 组(bP < 0.05)Fig.6 Spinal cord tissue MPO of 3 group of rats(aP < 0.05), vs. Sham group;(bP < 0.05), vs SCI group

图7 3组大鼠脊髓组织的 MDA 检测对比 Sham 组(aP < 0.05);对比 SCI 组(bP < 0.05)Fig.7 Spinal cord tissue MDA of 3 group of rats determination(aP <0.05), vs. Sham group;(bP < 0.05), vs SCI group
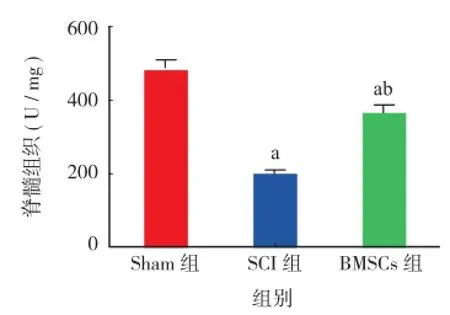
图8 3组大鼠脊髓组织的 SOD 检测对比 Sham 组(aP < 0.05);对比 SCI 组(bP < 0.05)Fig.8 Spinal cord tissue SOD of 3 group of rats(aP < 0.05), vs. Sham group;(bP < 0.05), vs SCI group

图5 大鼠脊髓病理切片 HE 染色 a:假手术组(HE × 400);b:SCI 组(HE × 400);c:BMSCs 组(HE × 400)Fig.5 HE staining of injured spinal cord in rats a: Sham group(HE × 400); b: SCI group(HE × 400); c: BMSCs group(HE × 400)
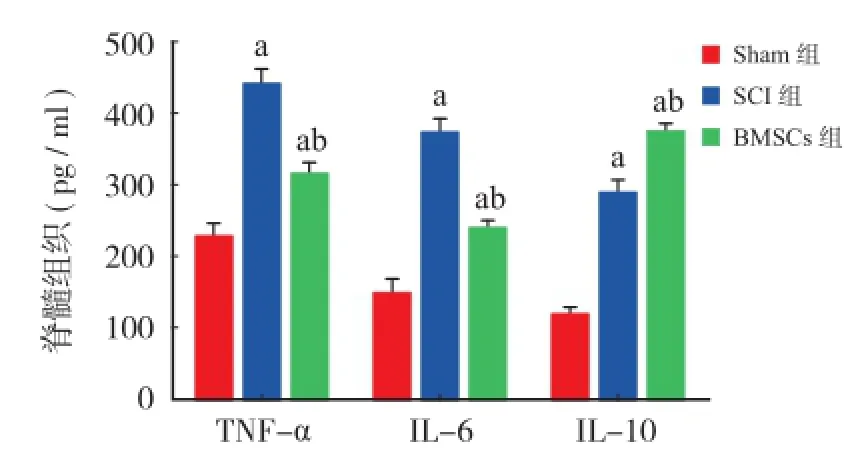
图9 脊髓组织的 TNF-α、IL-6、IL-10 检测对比 Sham 组(aP <0.05);对比 SCI 组(bP < 0.05)Fig.9 Spinal cord tissue TNF-α、IL-6、IL-10(aP < 0.05), vs. Sham group;(bP < 0.05), vs SCI group
BMSCs因其良好的增殖及多向分化能力,且便于取材,易于分离培养及低免疫源性等特性而成为细胞治疗领域研究的热点之一,在中枢神经系统损伤领域也得到广泛的应用[16-17]。近年来,BMSCs对免疫及炎症反应的调节能力逐渐成为人们关注的另一个焦点。有文章报道,在菌血症或烧伤模型中,BMSCs 可以有效减轻由炎症反应所导致的脏器损伤[18]。
基于上述原因,本研究拟探讨BMSCs在脊髓损伤后炎症调节作用以及对受损脊髓组织的保护作用。本实验采用BMSCs5.0Cs作6/只尾静脉注射作为实验用量。BMSCs 组大鼠造模成功后14天的BBB评分及步态分析结果均明显高于SCI组,说明 BMSCs可以促进脊髓损伤大鼠后肢运动功能的恢复。此外,笔者还对相关分子机制进行了探讨。
产生的大量氧自由基及轴突和髓鞘的损伤使细胞膜不饱和脂肪酸及磷脂过氧化反应增强,造成脊髓组织损伤,表现出产生大量MPO、MDA,SOD则会因大量消耗而下降[19-21]。MPO存在于中性粒细胞内,其活性高低反应脊髓组织内中性粒细胞的浸润程度。MDA又称脂质过氧化物酶,其含量高低可反应组织中自由基含量及过氧化物程度[10]。SOD作为体内清除自由基的特异酶,其活性的高低反映了机体清除氧自由基的能力[22]。本研究中,SCI组大鼠脊髓组织中MPO和MDA含量明显高于Sham组,SOD含量明显低于Sham组,说明其能够使反映脊髓组织中性粒细胞浸润程度的MPO和反映脊髓中自由基含量和脂质过氧化物程度的MDA水平降低,并且减少了反映体内抗氧化能力的SOD的消耗,提示BMSCs 在抗氧化的平衡中起到了重要作用。
根据之前的报道,浸润的中性粒细胞及局部激活的巨噬细胞共同释放各种类型炎症介质,导致TNF-α、IL-6和 IL-10在脊髓内浓度显著升高[23-27]。本研究在造模成功后的6h对各组动物脊髓组织中促炎因子 TNF-α、IL-6和抑炎因子IL-10的水平进行了检测,发现3种因子的水平均有所升高,与本实验室之前的研究结果相一致。本研究还发现经尾静脉注射BMSCs可以显著降低上述两种促炎因子的水平,而进一步提高IL-10的水平。提示BMSCs在炎症水平较高时可以发挥明显的抑制作用,这与以往学者在其它炎症类疾病中发现的BMSCs炎症调节特性相一致[28-33]。
本研究表明,BMSCs对于大鼠脊髓损伤具有一定的神经保护作用,并且改善损伤后的运动功能,其机制可能与调控炎症反应和清除自由基有关。但对于脊髓损伤治疗中的BMSCs的最佳浓度、时间窗及方式仍须进一步探讨研究。
参 考 文 献
[1]Forostyak S, Jendelova P, Sykova E. The role of mesenchymal stromal cells in spinal cord injury, regenerative medicine and possible clinical applications. Biochimie, 2013, 95(12):2257-2270.
[2]Lu M, Wang S, Han X, et al. Butein inhibits NF-kappaB activation and reduces infiltration of inflammatory cells and apoptosis after spinal cord injury in rats. Neurosci Lett, 2013,542(87-91.
[3]Hu J, Lang Y, CaoY, et al. The neuroprotective effect of tetramethylpyrazine against contusive spinal cord injury by activating PGC-1alpha in rats. Neurochem Res, 2015, 40(7):1393-1401.
[4]Han X, Lu M, Wang S, et al. Targeting IKK/NF-kappaB pathway reduces infltration of infammatory cells and apoptosis after spinal cord injury in rats. Neurosci Lett, 2012, 511(1):28-32.
[5]Harrop JS. Spinal cord injury: debating the effcacy of methylprednisolone. Neurosurgery, 2014, 61(Suppl 1):S30-31.
[6]Kong XY, Gao J, Yang Y, et al. Research advances inthe application of methylprednisolone in the treatment of acute spinal cordinjury. Zhongguo Yi Xue Ke Xue Yuan Xue Bao,2014, 36(6):680-685.
[7]Abrams MB, Dominguez C, Pernold K, et al. Multipotent mesenchymal stromal cells attenuate chronic infammation and injury-induced sensitivityto mechanical stimuli in experimental spinal cord injury. Restor Neurol Neurosci, 2009, 27(4):307-321.
[8]Gruner JA. A monitored contusion model of spinal cord injury in the rat. J Neurotrauma, 1992, 9(2):123-128.
[9]Neumann M, Wang Y, Kim S, et al. Assessing gait impairment following experimental traumatic brain injury in mice. J Neurosci Methods, 2009, 176(1):34-44.
[10]Kwon BK, Tetzlaff W, Grauer JN, et al. Pathophysiology andpharmacologic treatment of acute spinal cord injury. Spine,2004, 4(4):451-464.
[11]Silva NA, Sousa N, Reis RL, et al. From basics to clinical: a comprehensive review on spinal cord injury. Prog Neurobiol,2014, 114:25-57.
[12]Schwab JM, Chiang N, Arita M, et al. Resolvin E1 and protectin D1 activate inflammation-resolution programmes. Nature, 2007, 447(7146):869-874.
[13]Burns SM, Fisher C, Earven Tribble SS, et al. Multifactor clinical score and outcome of mechanical ventilation weaning trials: Burns Wean Assessment Program. Am J Crit Care, 2010,19(5):431-439.
[14]Breslin K, Agrawal D. The use of methylprednisolone in acute spinal cord injury: a review of the evidence, controversies,and recommendations. Pediatr Emerg Care, 2012, 28(11):1238-12345.
[15]Gupta R, Bathen ME, Smith JS, et al. Advances in the management of spinal cord injury. J Am Acad Orthop Surg,2010, 18(4):210-222.
[16]Cole SJ, Bradford D, Cooper HM. Neogenin: A multifunctional receptor regulating diverse developmental processes. Int J Biochem Cell Biol, 2007, 39(9):1569-1575.
[17]郭冕,郑永日,李青松,等.局部注射骨髓间充质干细胞治疗大鼠脊髓损伤: 运动功能有改善吗? 中国组织工程研究与临床康复, 2010,(14):2556-2559.
[18]Yagi H, Soto-Gutierrez A, Kitagawa Y, et al. Bone marrow mesenchymal stromal cells attenuate organ injury induced by LPS and burn. Cell Transplant, 2010, 19(6):823-830.
[19]Bradley PP, Priebat DA, Christensen RD, et al. Measurement of cutaneous infammation: estimation of neutrophil content with an enzyme marker. J Invest Dermatol, 1982, 78(3):206-209.
[20]Sun L, Guo RF, Newstead MW, et al. Effect of IL-10 on neutrophil recruitment and survival after Pseudomonas aeruginosa challenge. Am J Respir Cell Mol Biol, 2009, 41(1):76-84.
[21]Pincemail J, Deby C, Thirion A, et al. Human myeloperoxidase activity is inhibited in vitro by quercetin. Comparison with three related compounds. Experientia, 1988, 44(5):450-453.
[22]Ohta S, Iwashita Y, Takada H, et al. Neuroprotection and enhanced recovery with edaravone after acute spinal cord injury in rats. Spine, 2005, 30(10):1154-1158.
[23]Hao Z, Tiansheng S, Zhi L, et al. Hip fracture aggravates systemic infammation and lung injury in aged chronic cigarette smoke exposed rats. J Orthop Res, 2014, 32(1):24-30.
[24]Baëhl S, Garneau H, Le Page A, et al. Altered neutrophil functions in elderly patients during a 6-month follow-up period after a hip fracture. Exp Gerontol, 2015, 65:58-68.
[25]Zhang H, Sun T, Liu Z, et al. Systemic infammatory responses and lung injury following hip fracture surgery increases susceptibility to infection in aged rats. Mediators Inflamm,2013, 2013:536435.
[26]Wang C, Ge J, Ni S. Effect of interleukin-6 polymorphism on fracture risk. Int J Clin Exp Med, 2015, 8(6):9599-9602.
[27]den Uyl D, van Schoor NM, Bravenboer N, et al. Low grade inflammation is associated with lower velocity of sound and broadband ultrasound attenuation in older men, but not with bone loss or fracture risk in a longitudinal aging study. Bone,2015, 81:270-276.
[28]Sun Y, Yao Z, Lin P, et al. Bone marrow mesenchymal stem cells ameliorate inflammatory factor-induced dysfunction of INS-1 cells on chip. Cell Biol Int, 2014, 38(5):647-654.
[29]Zuo D, Tang Q, Fan H, et al. Modulation of nuclear factorkappaB-mediated pro-inflammatory response is associated with exogenous administration of bone marrow-derived mesenchymal stem cells for treatment of experimental colitis. Mol Med Rep, 2015, 11(4):2741-2748.
[30]Wang YW, Xu DP, Liu Y, et al. The effect of tumor necrosis factor-alpha at different concentrations on osteogenetic differentiation of bone marrow mesenchymal stem cells. J Craniofac Surg, 2015, 26(7):2081-2085.
[31]Sun T, Wang X, Liu Z, et al. Patterns of cytokine release and evolution of remote organs from proximal femur fracture in COPD rats. Injury, 2011, 42(8):825-832.
[32]Sun T, Wang X, Liu Z, et al. Plasma concentrations of pro- and anti-infammatory cytokines and outcome prediction in elderly hip fracture patients. Injury, 2011, 42(7):707-713.
[33]Yang J, Liu XX, Fan H, et al. Extracellular Vesicles Derived from Bone Marrow Mesenchymal Stem Cells Protect against Experimental Colitis via Attenuating Colon Inflammation,Oxidative Stress and Apoptosis. PLoS One, 2015, 10(10):e0140551.
(本文编辑:李贵存)
. 脊柱脊髓损伤 Spinal and spinal cord injuries .
DOI:10.3969/j.issn.2095-252X.2016.06.004中图分类号:R683.2
作者单位:100700 北京,陆军总医院骨科(张桂通、刘佳、张晓燕、张志成、李放、孟繁星、孙天胜);100853 北京,解放军医学院骨科教研室(张桂通、孙移坤)
通信作者:孙天胜,Email: suntiansheng-@163.com
收稿日期:(2016-02-16)
Protective effects of bone marrow mesenchymal stromal cells on spinal cord injury in rats and its mechanism
ZHANG Gui-tong, LIU Jia, ZHANG Xiao-yan, ZHANG Zhi-cheng, LI Fang, MENG Fan-xing, SUN Yi-kun, SUN Tiansheng.
Chinese People's Liberation Army Beijing Military Command General Hospital, Beijing, 100700, PRC
Corresponding author: SUN Tian-sheng, Email: suntiansheng-@163.com
【Abstract】Objective To investigate the protective effects of bone marrow mesenchymal stromal cells(BMSCs)on spinal cord injury(SCI)model of rats and its potential mechanism. Methods Totally 60 adult SD rats were randomly divided into 3 groups: sham group(n = 20), SCI group(n = 20)and BMSCs group(n = 20). Model of spinal cord injury was established by modifed Allen' s assay. From the frst day after injury, motor function of the rats' hind limb was evaluated by BBB(Basso Beattie and Bresnahan)scores and Catwalk gait analysis and detection at 14 d. Content of myeloperoxidase(MPO), malondialdehyde(MDA), superoxide dismutase(SOD)in spinal cord tissue and levels of tumor necrosis factor-α(TNF-α), interleukin-6(IL-6), interleukin-10(IL-10)in serum were determined by ELISA analysis. Pathological changes of spinal cord tissues were observed with HE staining. Results Compared with the model group, the content of MPO in injured spinal cord at 12h after injury in BMSCs group decreased from(149.7 ± 28.4)nmol/mg to(116.0 ± 29.2)nmol/mg, MDA levels decreased from(58.1 ± 3.3)U/g to(41.7 ± 2.6)U/g, at 6 h after injury TNF-α levels in serum decreased from(439.8 ± 12.8)pg/ml to(314.6 ± 17.6)pg/ml, IL-6 levels decreased from(364.7 ± 16.9)pg/ml to(232.9 ± 15.2)pg/ml while SOD activity increased from(194.6 ± 14.3)U/mg to(362.0 ± 13.6)U/mg, IL-10 levels increased from(291.3 ± 9.8)pg/ml to(377.9 ± 17.9)pg/ml(P < 0.05). Compared with the SCI group, BBB scores and catwalk gait analysis improved signifcantly at 14 d after injury in BMSCs group(P < 0.05). The pathological injury of spinal cord was relieved in BMSCs group. Conclusions BMSCs administration improves the motor function after spinal cordinjury. Its potential mechanism may be the inhibition of infammatory reaction and oxidative stress reaction.
【Key words】Mesenchymal stromal cells; Spinal cord injuries; Rats
