XPG Asp1104His基因多态性与中国人口结直肠癌易感性的关系
2016-07-13杜海娜朱陵君杜牧龙王美林束永前
杜海娜朱陵君杜牧龙王美林束永前
•论著•
XPG Asp1104His基因多态性与中国人口结直肠癌易感性的关系
杜海娜1朱陵君2杜牧龙3王美林3束永前2
【摘要】目的 已有研究报道着色性干皮病基因(XPG)Asp1104His多态性与结直肠癌易感性相关,但是结果尚不一致。本研究旨在调查XPG Asp1104His基因多态性是否与中国人口的大肠癌易感性相关。方法 应用TaqMan分析法检测878例肠癌患者和884例同期住院的非肠癌患者XPG基因的Asp1104His多态性,并分析其与肠癌遗传易感性的相关性。同时我们用荟萃分析验证这一结果。结果 我们发现XPG Asp1104His基因多态性与大肠癌遗传易感性显著相关(显性模型:His/His+Asp/His vs Asp/Asp,调整OR=1.39,95%CI=1.14~1.69),分层分析结果显示His/His+Asp/His基因型与中分化肠癌易感性相关。另外,我们的荟萃分析显示相似的结果:显性模型(OR=1.35,95%CI=1.20~1.51)在亚洲人口中与肠癌发病风险明显相关。结论 我们的结果表明:XPG Asp1104His基因多态性增加亚洲人罹患肠癌的风险。
【关键词】结直肠肿瘤; 疾病易感性; 多态性,单核苷酸; XPG
全球肠癌发病率在男性中居第三,女性中居第二。每年有120万新发病例和60万死亡病例[1]。肠癌的进展是一个有多种因素引起的复杂的过程,例如环境因素和基因变异[2]。诸多研究表明DNA损伤与癌症发生相关。另外,也有报道DNA修复能力与遗传因素相关。因此,伴有先天DNA修复能力缺损的个体更容易罹患癌症[3]。
证据表明,DNA损伤修复可以通过各种途径被激活,包括核苷酸切除修复、碱基切除修复、错配修复、双链破坏修复和直接修复。其中,核苷酸切除修复主要负责修复DNA损伤,例如:由于紫外线照射、化学诱变及化学药物引起的DNA损伤[4]。在核苷酸切除修复基因中,像ERCC1,XPA,XPB/ERCC3,XPG,XPD/ERCC2,XPE/DDB1,XPF/ERCC4和XPG/ERCC5已经确定,它们在DNA损伤修复及维持基因完整性起着重要作用。
着色性干皮病互补基因G(XPG),即ERCC5,位于13号染色体长臂2区2带-3区3带,包括15个外显子和14个内显子[5]。XPG是flap核苷酸内切酶1家族成员之一,编码1186个核苷酸。有报道称缺陷的XPG基因在肿瘤发生中起着重要作用,导致DNA修复能力和基因完整性的破坏以及基因转录失控[6-8]。直至目前,已经发现XPG基因中有六个单核苷酸多态性(SNP)。其中,Asp1104His多态性(rs17655 G/C,最小碱基频率=0.444),作为标签SNP,已经证实与多种肿瘤发生有关。最近,相关研究报道XPG的Asp1104His基因多态性与大肠癌的易感性相关。但是结果仍然不一致。因此,我们检测了XPG Asp1104His的基因多态性以及评估中国人口中此基因与肠癌易感性的关系。
资料与方法
一、一般资料
(一)研究对象
在南京医科大学第一附属医院招募从2010年9月至2013年10月的肠癌病人,所有的患者都经过病理学确诊。病理分期为Dukes A、B、C、D。肿瘤分化定义为高分化、中分化、低分化。健康对照组为同一医院随机抽取。抽取原则为无癌症病史、与病例组在年龄、性别相匹配。所有参加者在签署知情同意书后,完成一份调查问卷。然后抽取5 ml的静脉血作基因分析。
(二)伦理声明
本研究由南京医科大学第一附属医院伦理委员会批准,所有参加者都签署知情同意书,所有试验器材由南京医科大学第一附属医院伦理委员会批准。
二、方法
(一)基因分型
基因分型利用TaqMan分析法(Applied Biosystems)。基因序列前体和探针从公司购买。基因扩增条件为:在95℃扩增45循环后,在50℃维持2分钟,95℃维持10分钟。
(二)文献检索
为进一步验证XPG Asp1104His基因多态性与肠癌的关系,我们进行一项荟萃分析。以“XPG”,“ERCC5”,“viceversa Xeroderma Pigmentosum group G”,“excision repair cross-complementing group 5”,“polymorphism”,“colorectal cancer”以及它们的组合作为检索词检索“pubmed”外文数据库,截止时间为2014年3月。入选标准:(1)病例对照研究;(2)关于XPG Asp1104His与肠癌易感性的研究。总共有5篇文献入选。
(三)数据提取
两个独立研究者通过阅读文献标题和摘要进行初筛,然后通过阅读全文进行第二次筛选,最终根据纳入标准决定文献是否纳入,摘录内容包括:第一作者、发表年限、病例组和对照组的研究设计类型、样本大小和各种基因型的分布频数等。两名研究员独立进行完成,意见不同者通过讨论或第三方研究者协助解决。
三、统计学分析
应用卡方检验HWE平衡定律。用单因素和多因素回归分析计算OR值及95%CI,并评估发表偏倚。P<0.05认为差异有统计学意义。所有统计方法均采用SAS 9.1.3(SAS Institute,Cary,NC)软件分析。
对于荟萃分析,我们用Q-检验对各文献结果进行异质性检验,各研究结果无显著异质性(P>0.05),则采用固定效应模型对效应量进行加权合并,若各研究结果间存在异质性(P<0.05),则采用随机效应模型对效应量进行加权合并。以OR值和95%可信区间为指标测定每个基因型的效应(共显性模型:His/Asp vs Asp/Asp,His/His vs Asp/Asp;显性模型:His/His+Asp/His vs Asp/Asp;隐性模型:His/His vs Asp/His+Asp/Asp)。敏感性分析:如果异质性检验显示差异有统计学意义(P<0.05),则采用分层分析探讨异质性的来源。发表偏倚分析:绘制漏斗图,同时利用Eggerʹs线性回归来验证漏斗图的对称性,评估发表偏倚。应用Stata 11.0软件进行统计分析。
结 果
一、一般特征
研究中共包括878例肠癌患者和884例无癌症病史的同期就诊患者,基本信息见表1。肠癌患者中有肿瘤家族史与健康对照组对比有统计学意义(病例组/健康组=23.5%/9.8%,P<0.001)。其它一般特征中,例如:性别、年龄、吸烟和饮酒状况,差异无统计学意义(P=0.632、P=0.125、P=0.187和P=0.222)。在肠癌患者中,结肠癌患者约为52.3%,直肠癌约为47.7%。另外,低分化、中分化、高分化肠癌分别为7.1%,77.1%和15.8%。Dukes A、B、C、D分期的病人分别为7.0%,44.6%,36.6%和11.8%。基因型分布见表2,病例组的基因型分布分别为Asp/Asp=32.6%、Asp/His=52.3%、His/His=15.1%,与对照组有明显差异(40.2%、45.8%、14.0%)。另外,病例组中C(His)碱基频率为52.6%,对照组中仅为47.4%,差异有统计学意义(P=0.008)。对照组中基因型频率符合HWE定律(P=0.622)。对照组中XPG Asp1104His MAF为0.369,与HapMap-CHB数据库中一致(http://www. ncbi.nlm.nih.gov)。
二、XPG Asp1104His与大肠癌易感性的关系
利用多变量回归分析显示,与Asp/Asp基因型相比,携带His/His或Asp/His基因型的个体罹患肠癌风险增加(His/His vs Asp/Asp,调整OR=1.03,95%CI=1.06~1.11;Asp/His vs Asp/Asp,调整OR=1.41,95%CI=1.15~1.74)。除此之外,His/ His+Asp/His基因型增加肠癌易感性(调整OR=1.40,95%CI=1.15~1.70).在分层分析中,如表3,除了女性亚组,携带His/His+Asp/His基因型的亚组更易罹患肠癌。表4显示的是XPG Asp1104His多态性与临床特征的关系,His/His+Asp/His基因型与肿瘤部位和分期相关(P<0.05)。可是,在组织分化中,此基因型只增加中分化肠癌的患病风险(调整OR=1.44,95%CI=1.17~1.78)。

表1 患者一般特征表

表2 XPG Asp1104His基因多态性与肠癌发病风险的关系表
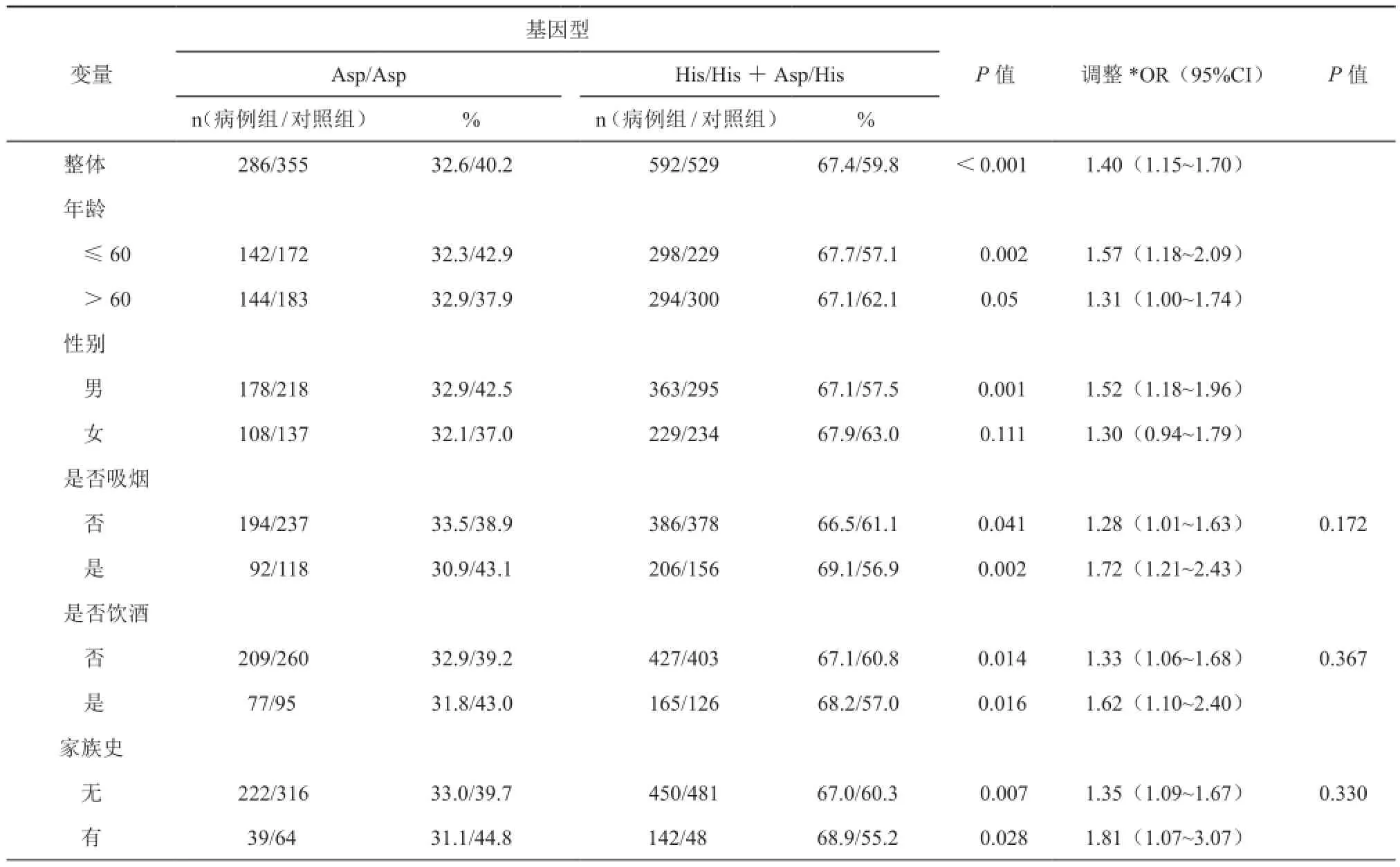
表3 XPG Asp1104His基因型和临床特征的关系表
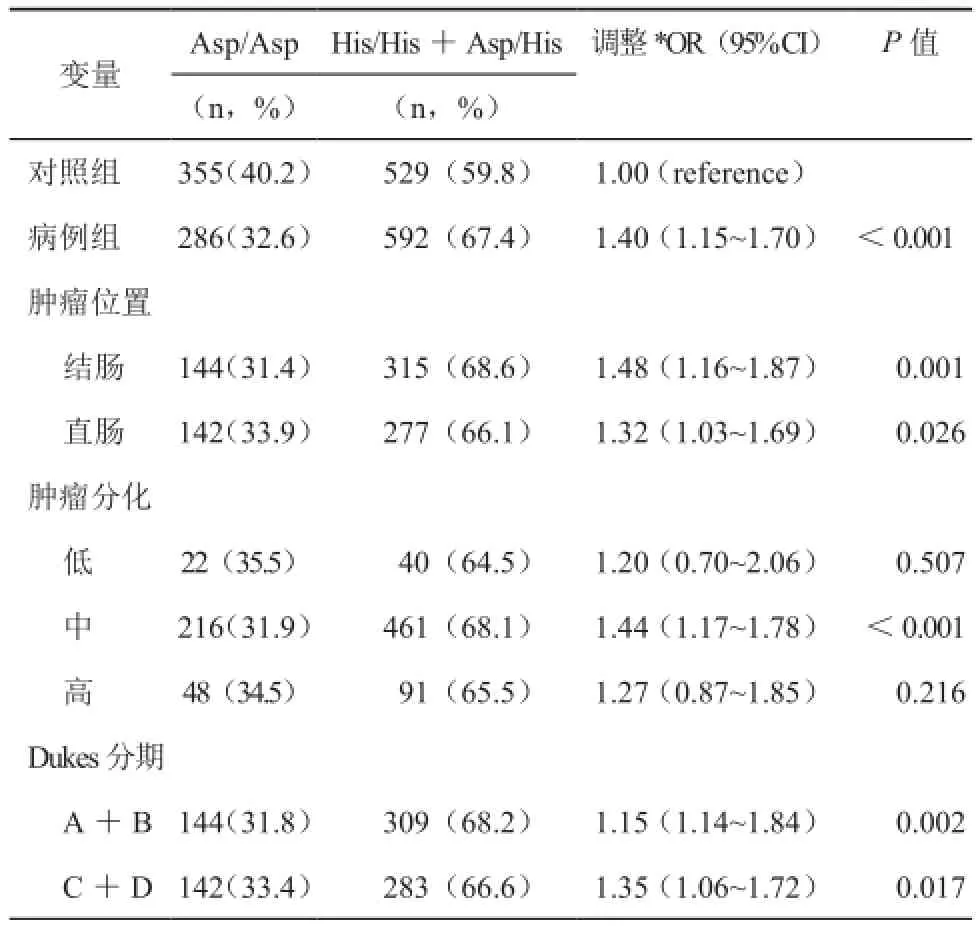
表4 XPG Asp1104His基因型和临床特征的关系表
三、荟萃分析的结果
共有5篇参考文献入选[2,10-12],包括2649肠癌病例组和2848例健康对照(表5)。荟萃分析发现在纯合子和显性模型下,XPG Asp1104His基因多态性与大肠癌发病风险相关(His/His vs Asp/Asp: OR=1.24,95% CI=1.03~1.47,P< 0.02,图 1a;His/His+Asp/His vs Asp/Asp:OR< 1.35,95%CI=1.20~1.51,P<0.001,图1b)。分层分析中,亚洲人口中发病风险增加:His/His vs Asp/Asp:OR=1.28,95%CI=1.05~1.55,P=0.012(图2a);Asp/His vs Asp/Asp:OR=1.49,95%CI=1.29~1.73,P<0.001(图2b);His/His+Asp/His vs Asp/Asp:OR=1.44,95%CI=1.25~1.65,P=0.001( 图2c)。 在荟萃分析中,未发现明显异质性(P=0.1;表6)。我们用Beggʹs检验和Eggerʹs检验发表偏倚,并没有明显发表偏倚存在(His/His vs Asp/Asp:Beggʹs检验:P=0.327,Eggerʹs检验:P=0.326,t=21.17,95%CI=23.020~1.394;His/His+Asp/His vs Asp/Asp:Beggʹs检 验:P=0.142,Eggerʹs检验:P=0.139,t=22.01,95%CI=24.394~0.997)(图3)。
讨 论
在碱基切除修复通路中,XPG切除损坏位点的DNA 3’端,非酶性参加5’端的切除,稳定DNA修复复合体[13]。在XPG基因编码区的SNP可能会影响XPG活性的改变,改变肿瘤易感性[14]。Berhane N等[15]认为天冬氨酸到组氨酸的改变可能会影响XPG蛋白结构的变化,继而影响蛋白质-蛋白质的转变和XPG C端的前体复合体的稳定性。目前,已经证实XPG SNPs与多种肿瘤相关,像肺癌[16]、乳腺癌[17]。这些证据提示XPG基因多态性与相关肿瘤发生发展相关。

表5 荟萃分析中入选文章基本信息表

图1 XPG Asp1104His多态性和肠癌的关系:a图是纯合子模型(His/His vs Asp/Asp);b图是显性模型(His/His +Asp/His vs Asp/Asp)

图2 XPG Asp1104His多态性与亚洲人口肠癌风险的关系。a图是His/His vs Asp/Asp;b图是Asp/His vs Asp/Asp;c图是His/His+Asp/His vs Asp/Asp
目前,诸多研究提示大肠癌与XPG Asp1104His基因多态性相关[2,10,18]。Liu等[10]发现XPG Asp1104His多态性增加肠癌的易感性,而且对于接受奥沙利铂的肠癌患者,往往伴随着较差的无进展生存期。可是,Mort R等[19]报道XPG Asp1104His基因型与肠癌发病风险无关。另外,关于XPG Asp1104His SNP与肠癌患者的一般特征和临床特征之间的关系少有研究报道。因此,我们进行以医院为基础的病例对照研究和荟萃分析,以全面评估XPG Asp1104His多态性与肠癌易感性的关系。
我们发现与对照组比较,病例组C碱基频率明显增加(病例组/对照组=0.526/0.474)。另外与Liu等[9]报道一致,本研究也得出XPG Asp1104His的显性模型和共显性模型增加肠癌易感性。亚组分析中,携带显性模型的男性更容易罹患肠癌,女性则没有类似发现(表3)。原因可能是女性有相对健康的生活习惯和特殊的生理机制,这些可能致使她们远离肠癌。再者,在临床特征的亚组分析中,观察到Asp/His+His/His基因型增加中分化肠癌的发病风险,可能与低分化和高分化肠癌患者数量太少造成的偏差有关。在肿瘤部位和肿瘤分期的分析中,类似的结果依然存在。这些发现表明XPG Asp1104His多态性有助于增加肠癌诊断的有效性。因为肠癌分期与预后相关,我们推断此多态性并不能够预测肠癌的进展。

表6 XPG Asp1104His多态性和肠癌的荟萃分析结果表

图3 发表偏倚(显性模型)
荟萃分析显示携带His/His和His/His+Asp/His基因型的个体更倾向于罹患肠癌,这与我们的结果相似。在亚组分析中,亚洲人口发病风险较高(His/His和Asp/ His),欧洲人口则没有类似发现。这可能由于种族差异和环境差异造成的。另外,样本数量偏小也可能造成结果误差[20]。
本研究也有不足之处。首先,仍有许多暴露因素未考虑在内,例如饮食习惯、患癌史和其他慢性病,这些可能影响结果的稳定性。因此需要更全面综合的研究来验证本研究的结果。其次,本研究样本过小。最后,我们的研究人口仅为中国人口,有待于扩大种族数量。
综上所述,本研究显示XPG Asp1104His多态性与肠癌易感性相关。但仍需大样本量的研究来验证结果。
参 考 文 献
[ 1 ] Jemal A, Bray F, Center MM, et al. Global cancer statistics. CA Cancer J Clin, 2011, 61(2):69-90.
[ 2 ] Canbay E, Cakmakoglu B, Zeybek U, et al. Association of APE1 and hOGG1 polymorphisms with colorectal cancer risk in a Turkish population. Curr Med Res Opin, 2011, 27(7): 1295-1302.
[ 3 ] Bernstein C, Bernstein H, Payne CM et al. DNA repair/pro-apoptotic dual-role proteins in five major DNA repair pathways: fail-safe protection against carcinogenesis. Mutat Res, 2002, 511(2): 145-178.
[ 4 ] Leibeling D, Laspe, P, Emmert S. Nucleotide excision repair and cancer. J Mol Histol, 2006, 37(5-7): 225-238.
[ 5 ] Emmert S, Schneider TD, Khan SG, et al. The human XPG gene:gene architecture, alternative splicing and single nucleotide polymorphisms. Nucleic Acids Res, 2001, 29(7): 1443-1452.
[ 6 ] Koeppel F, Poindessous V, Lazar V, et al. Irofulven cytotoxicity depends on transcription-coupled nucleotide excision repair and is correlated with XPG expression in solid tumor cells. Clin Cancer Res, 2004, 10(16): 5604-5613.
[ 7 ] Cheng L, Sturgis EM, Eicher SA et al. Expression of nucleotide excision repair genes and the risk for squamous cell carcinoma of the head and neck. Cancer, 2002, 94(2): 393-397.
[ 8 ] Bartolucci R, Wei J, Sanchez JJ, et al. XPG mRNA expression levels modulate prognosis in resected non-small-cell lung cancer in conjunction with BRCA1 and ERCC1 expression. Clin Lung Cancer,2009, 10(1): 47-52.
[ 9 ] Liu C, Yin Q, Hu J et al. Quantitative assessment of the association between XPG Asp1104His polymorphism and bladder cancer risk. Tumour Biol, 2014, 35(2): 1203-1209.
[ 10 ] Liu D, Wu HZ, Zhang YN et al. DNA repair genes XPC, XPG polymorphisms: relation to the risk of colorectal carcinoma and therapeutic outcome with Oxaliplatin-based adjuvant chemotherapy. Mol Carcinog, 2012, 51(Suppl 1): E83-93.
[ 11 ] Pardini B, Naccarati A, Novotny J, et al. DNA repair genetic polymorphisms and risk of colorectal cancer in the Czech Republic. Mutat Res, 2008, 638(1-2): 146-153.
[ 12 ] Gil J, Ramsey D, Stembalska A, et al. The C/A polymorphism in intron 11 of the XPC gene plays a crucial role in the modulation of an individualʹs susceptibility to sporadic colorectal cancer. Mol BiolRep, 2012, 39(1): 527-534.
[ 13 ] Zhao YL,Yang LB, Geng XL et al. The association of XPG and MMS19L polymorphisms response to chemotherapy in osteosarcoma. Pak J Med Sci, 2013, 29(5): 1225-1229.
[ 14 ] Kiyohara C, Yoshimasu K. Genetic polymorphisms in the nucleotide excision repair pathway and lung cancer risk: a meta-analysis. Int J Med Sci, 2007, 4(2): 59-71.
[ 15 ] Berhane N, Sobti RC, Mahdi SA. DNA repair genes polymorphism (XPG and XRCC1) and association of prostate cancer in a north Indian population.Mol Biol Rep, 2012, 39(3): 2471-2479.
[ 16 ] Yuli Y, Zhe S, Xia W,et al. XPG is a novel biomarker of clinical outcome in advanced non-small-cell lung cancer. Pak J Med Sci, 2013,29(3): 762-767.
[ 17 ] Peng Q, Lao X, Li R, et al. Methodological remarks concerning a recent meta-analysis on XPG Asp1104His and XPF Arg415Gln polymorphisms and breast cancer risk. Breast Cancer Res Treat,2013, 139(2): 617-618.
[ 18 ] Joshi AD, Corral R, Siegmund KD et al. Red meat and poultry intake, polymorphisms in the nucleotide excision repair and mismatch repair pathways and colorectal cancer risk. Carcinogenesis,2009, 30(3): 472-479.
[ 19 ] Mort R, Mo L, McEwan C, et al. Lack of involvement of nucleotide excision repair gene polymorphisms in colorectal cancer. Br J Cancer, 2003, 89(2): 333-337.
[ 20 ] Wacholder S, Chanock S, Garcia-Closas M, et al. Assessing the probability that a positive report is false: an approach for molecular epidemiology studies. J Natl Cancer Inst, 2004, 96(6): 434-442.
(本文编辑:杨明)
杜海娜, 朱陵君, 杜牧龙, 等. XPG Asp1104His基因多态性与中国人口结直肠癌易感性的关系[J/CD].中华结直肠疾病电子杂志, 2016, 5(1): 40-46.
The association between XPG Asp1104His polymorphism and colorectal cancer risk in the Chinese population
Du Haina1, Zhu Lingjun2, Du Mulong3, Wang Meilin3, Shu Yongqian2.1Department of Oncology,Nanjing Hospital of T. C. M, Nanjing 210000, China;2Department of Oncolog, The First Affiliated Hospital of Nanjing Medical University, Nanjing 210000, China;3School of Public Health Nanjing Medical University,Nanjing 210000, China
Corresponding author: Zhu Lingjun, Email: zhulingjun@njmu.edu.cn
【Abstract】Objective Some studies have reported that the Asp1104His polymorphism in Xeroderma Pigmentosum complementation group G (XPG) was significantly associated with the colorectal cancer (CRC) susceptibility, although the previous results were inconsistent. This study was aiming to investigate whether there existed an association between XPG Asp1104His polymorphism and CRC risk in an independent Chinese population. Methods A total of 878 CRC cases and 884 healthy controls were recruited in our analysis. We used the TaqMan assay to genotype XPG Asp1104His and evaluated its association with CRC susceptibility. A further meta-analysis was performed to consolidate the results. Results We found that XPG Asp1104His polymorphism was associated with a significantly increased CRC risk (dominant model: His/His+Asp/His vs. Asp/Asp, adjusted OR=1.39, 95%CI=1.14~1.69). Stratification analysis by clinical characteristics indicated that the His/His+Asp/His genotypes were associated with increased CRC susceptibility in patients with moderately differentiated grade (OR=1.44, 95%CI=1.17~1.78), but not in poorly and well differentiated grade. Furthermore, we identified that the meta-analysis reported a similar results in dominant model (OR=1.35; 95%CI=1.20~1.51). Especially, when stratified by ethnicity, an evidently increased risk was identified in the Asian population. Conclusions Our findings suggested that XPG Asp1104His polymorphism could increase the susceptibility of CRC in Asian populations.
【Key words】Colorectal neoplasms; Disease susceptibility; Polymorphism, single nucleotide; XPG
DOI:10.3877/cma.j.issn.2095-3224.2016.01.08
基金项目:国家自然科学基金(NSFC 81472634)
作者单位:210000,1南京市中医院肿瘤科;2南京医科大学第一附属医院肿瘤科;3南京医科大学公共卫生学院
通信作者:朱陵君,Email:zhulingjun@njmu.edu.cn
收稿日期:(2015-12-26)
