双氢青蒿素—羟丙基—β—环糊精包合物的制备工艺研究
2016-07-11周慧郑一敏胥秀英
周慧+郑一敏+胥秀英

[摘要] 目的 优选双氢青蒿素(DHA)-羟丙基-β-环糊精(HP-β-CD)包合物的制备工艺。 方法 采取正交实验法,以HP-β-CD∶DHA、乙醇浓度、HP-β-CD浓度为考察因素,包合物的载药量和得率为考察指标,优选包合物的制备工艺。 结果 DHA-HP-β-CD包合物的最佳制备条件为:主客分子比为4∶1,90%乙醇作溶媒,HP-β-CD浓度为15%。包合物载药量可达6.26%,得率达94.03%。 结论 优选出的工艺合理、可行,可作为DHA包合物的制备工艺。
[关键词] 双氢青蒿素;羟丙基-β-环糊精;包合物;正交试验
[中图分类号] R943 [文献标识码] A [文章编号] 1674-4721(2016)03(b)-0009-03
[Abstract] Objective To optimize the preparation technology of Dihydroartemisine(DHA)-hydroxypropyl-β-cyclodextrin(HP-β-CD) inclusion compound. Methods Orthogonal test was used.Molecular mole ratio of HP-β-CD and DHA,ethanol concentration and HP-β-CD concentration were used as investigate factors and drug loading capacity and yield of inclusion compound were used as investigate index to optimize the preparation technology of inclusion compound. Results The best preparation conditions of DHA-HP-β-CD inclusion compound were as follows,host-guest molecular ratio was 4∶1,90% ethanol as solvent,the concentration of HP-β-CD was 15%.The drug loading capacity of inclusion compound reached 6.26% and yield reached 94.03%. Conclusion The optimized preparation technology is reasonable and feasible,can be the preparation technology of double hydrogen artemisinin inclusion compound.
[Key words] Dihydroartemisine;Hydroxypropyl-β-cyclodextrin;Inclusion compound;Orthogonal test
青蒿素及其衍生物是一类高效、速效、低毒的抗疟药物。近几年的研究发现,青蒿素及其衍生物除具有抗疟作用外,还具有多种抗肿瘤作用[1-3]。双氢青蒿素(DHA)是青蒿素的一个重要衍生物,其对疟疾的治疗优于青蒿素,抗疟作用是青蒿素的4~8倍[4-5]。但DHA的水溶性较差,影响其生物利用度。本文应用羟丙基-β-环糊精(HP-β-CD)对DHA进行包合,制成包合物。包合物载药量和得率高于相关文献报道,能增强DHA的生物利用度。
1 仪器与试药
1.1 仪器
85-3恒温磁力搅拌器(上海精密仪器仪表有限公司);RX841Y型电热鼓风烘箱(荣欣烘箱制造厂);UV1800紫外分光光度计(上海精密仪器仪表有限公司);Waters高效液相色谱仪(Waters 1252二元泵,Waters 2847 UV检测器);Breeze HPLC工作站;JA2003AD电子天平(上海精天仪器有限公司);纯水自动三重纯水蒸馏器(北京瑞邦兴业科技有限公司);KQ-50型超声波清洗器(上海精密仪器仪表公司)。
1.2 试药
DHA标准品(中国药品生物制品检定所,100184-200805);DHA(重庆通和制药有限公司,批号20120201,纯度为99.2%);HP-β-CD(上海源叶生物,批号120805);所用试剂均为分析纯;试验用水为三蒸水(实验室自制)。
2 方法与结果
2.1 DHA-HP-β-CD包合物制备
称取适量的HP-β-CD、DHA于烧杯中,采用溶液-搅拌法,加入适量90%乙醇,磁力搅拌30 min,于40℃减压回收乙醇,浓缩产物用30 ml蒸馏水溶解,抽滤,分别收集滤液和沉淀,烘箱干燥(60℃),即得[6-9]。
2.2 DHA-HP-β-CD包合物制备工艺优化
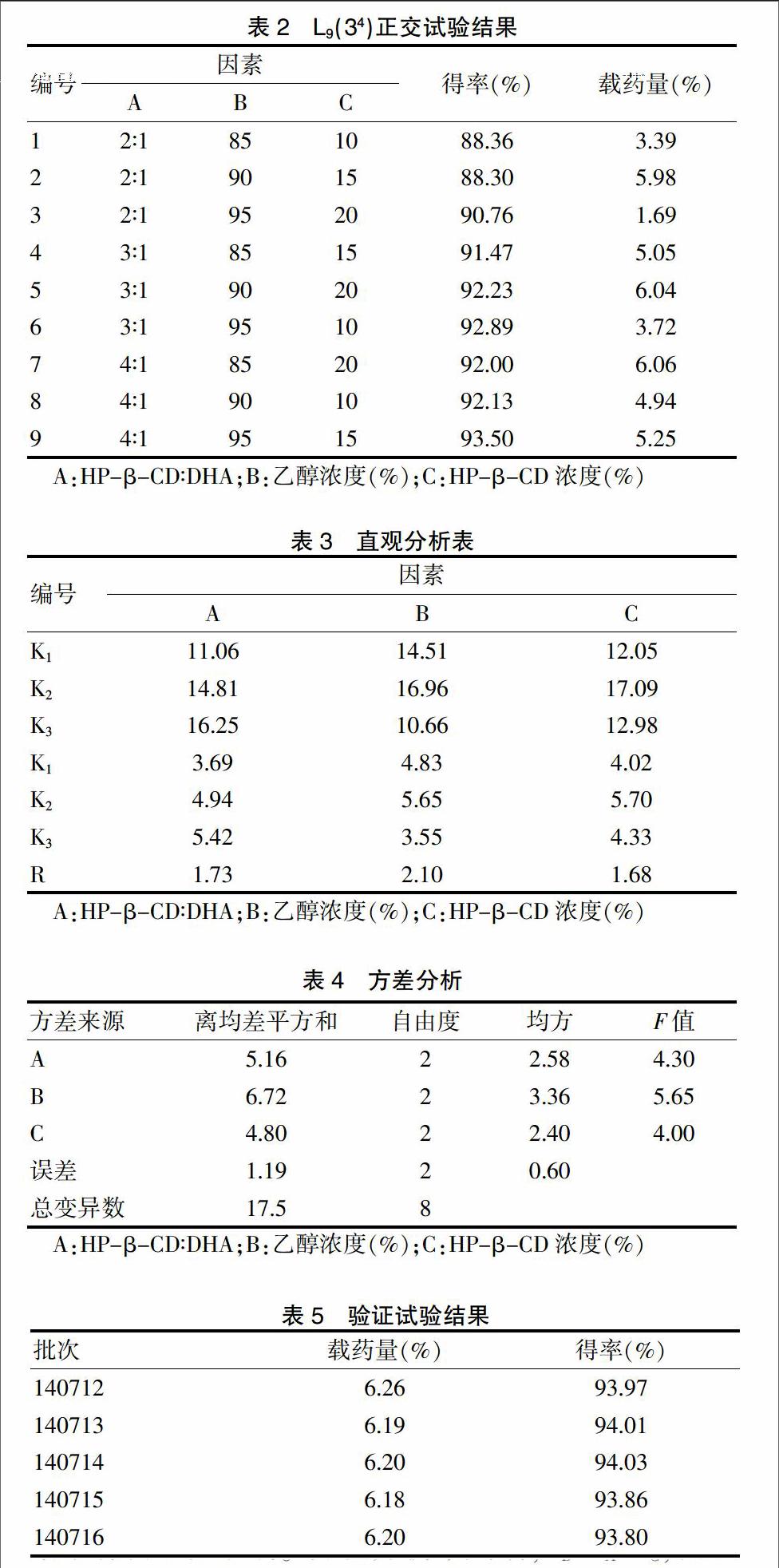
根据文献方法[10-15]及预实验结果,选择对包合作用影响较大的参数,即HP-β-CD和DHA的分子摩尔比、乙醇浓度、HP-β-CD浓度,每个因素3个水平,以包合物的载药量和收率作为考察指标,采用L9(34)正交表[16]进行实验,因素水平见表1。
2.3 包合物载药量及收率的测定
2.3.1 色谱条件[4,17-19] Hypersil C18柱(250 mm×4.0 mm,10 μm);流动相:乙腈-水(60∶40);流速为1.0 ml/min;柱温:20℃;检测波长:210 nm;进样量:10 μl。
2.3.2 标准曲线的制备[4] 精密称取DHA标准品适量,配制成1.0 mg/ml甲醇溶液作为对照品;在上述条件下分别进样2、6、8、10、20、40 μl,记录色谱峰面积。以峰面积对浓度进行回归,得回归方程:Y=5.4315×104X+4.72×102(r=0.999),线性范围2.0~40 μg。精密度试验:取同一份供试品溶液,按2.3.1所述方法,平行检测6次,结果RSD为0.39%,说明此法精密度良好。稳定性试验:供试品溶液避光存放,分别于0、2、4、8、12、24 h测定,考察供试品的稳定性,结果RSD为1.56%,表明在24 h内基本稳定。回收率试验:精密称取适量DHA标准品3份,加入HP-β-CD适量,超声溶解,测定DHA质量浓度,结果回收率分别为98.8%(RSD=0.86%)、97.8%(RSD=1.06%)、98.3%(RSD=0.96%)。
2.3.3 包合物包合率及得率的测定[4,20-21] 精密称取包合物150 mg,将其置于20 ml容量瓶中,加甲醇溶解定容,超声30 min,0.45 μm滤膜过滤,取滤液进行含量测定,根据峰面积计算包合物载药量及收率。
以DHA收率及包合物载药量为考察指标,直观分析和方差分析结果显示,DHA-HP-β-CD包合物的最佳工艺条件:主客分子比为4∶1,用90%乙醇作溶媒,HP-β-CD浓度为15%。根据极差R确定各因素对包合结果影响顺序:B>A>C。其中,A、B两个因素对结果有明显性影响。方差分析来判断,FB>FA>FC,提示乙醇浓度选择在包合物制备中具有显著统计学意义。
2.4 验证试验
根据正交优化结果,本研究选择A3B2C1处方进行试验,重复6次,以验证该处方的优越性,结果显示,6次验证试验包合物的载药量均高于正交表中9次试验结果,且稳定性和重现性好(表5)。
3 讨论
DHA是我国自主研制的抗疟疾药物,近年来研究发现,其除具有抗疟作用外,还具有抗炎、抗肿瘤、保肝和抗神经毒性等作用[1],具有很好的临床应用价值。但是其难溶于水,水溶性差,口服吸收差、生物利用度低,从而影响其疗效。HP-β-CD在改善难溶药物的水溶性、提高药物的生物利用度、增强药物稳定性、遮盖不良气味等方面具有广泛的应用。HP-β-CD具有表面活性低、不良反应少、包合容易、安全性高和包合可逆等特点,因此本研究选用HP-β-CD对DHA进行包合。
常用的包合物制备方法有超声波法、饱和水溶液法、溶液搅拌法等。笔者前期通过预实验对包合物制备方法进行了优选。HP-β-CD在水中的溶解度很大,故排除采用饱和水溶液法进行制备。超声波法和饱和水溶液法制备包合物的效果相差不大,但是由于超声波法噪声较大,影响身体健康,故选用溶液搅拌法进行包合物的制备。该方法包合效果好,操作简单,设备投资少,易于工业化生产。包合物干燥方法亦是影响饱和效果的重要因素,常用的干燥方法有真空减压干燥、冷冻干燥、喷雾干燥等方法,本文选用减压干燥法,先抽真空进行浓缩,再于烘箱60℃进行干燥,该方法成本低,操作简单。包合物制备最佳工艺优化:DHA在酒精中有一定的溶解度,故选用酒精作为溶媒进行包合。DHA溶于酒精后呈现不同的黏度,对包合效果有不同程度的影响,太黏不利于包合物的生成,而浓度太低又会降低包合物的得率,本文选用90%的酒精作为溶媒。HP-β-CD易溶于水,但是增加浓度黏度增大,不利于包合,故选择HP-β-CD浓度为15%。DHA和HP-β-CD的分子摩尔比是影响包合效果的重要因素,经过正交优化本研究选择:DHA∶HP-β-CD为4∶1;该法得到的包合物载药量可达6.26%,得率达94.03%,较文献报道的得率和载药量均大大提高[4,21]。该工艺操作简便、设备简单、包合物的载药量和得率高,适合DHA-HP-β-CD包合物的工业化生产。
DHA-HP-β-CD包合物增加了DHA的水溶性,提高了其稳定性和有效性,改善了生物利用度,具有很好的临床治疗意义。
[参考文献]
[1] 周慧,于海霞.青蒿素及其衍生物抗肿瘤作用研究进展[J].中国执业药师,2015,12(8):32-36.
[2] 何艺磊,李卫东.双氢青蒿素抗肿瘤作用机制的研究进展[J].中国医药指南,2014,12(24):64-66.
[3] 刘玉翠,杨阳,金嵩,等.双氢青蒿素抗肿瘤机制的研究进展[J].吉林医药学院学报,2014,35(3):216-218.
[4] 陈方伟,郭涛,李海燕,等.双氢青蒿素羟丙基-β-环糊精包合物的制备与表征[J].药学学报,2012,47(4):529-534.
[5] 谢红,陈利军,胡文亮.双氢青蒿素的抗肿瘤作用[J].中国药房,2007,18(3):218-220.
[6] 周慧,韩玉梅,郑一敏,等.芒果苷-羟丙基-β-环糊精包合物的制备[J].重庆工学院学报,2009,23(9):40-42.
[7] 许亚改,刘聚祥,刘静.甲砜霉素羟丙基-β-环糊精包合物的制备与鉴定[J].河北农业大学学报,2009,32(1):99-102.
[8] 徐春明,焦志亮,李丹,等.栀子黄色素β环糊精包合物制备及其稳定性研究[J].中国食品学报,2015,15(3):106-112.
[9] 安伟娟,锁然,李娜,等.白藜芦醇-羟丙基-β-环糊精包合物的制备及鉴定[J].河北农业大学学报,2009,32(1):103-106.
[10] 张春红,刘东,胡春勇,等.普拉格雷/β-环糊精包合物的制备工艺研究[J].中国药房,2015,26(7):979-981.
[11] 陈浩达,黄怀鹏.正交法优选淫羊藿苷-羟丙基β-环糊精包合物的制备工艺[J].天津中医药,2006,23(4):338-340.
[12] 周秋娜,尉小慧,王峥涛.黄芩素-羟丙基-γ-环糊精包合物制备工艺研究[J].上海中医药杂志,2013,47(8):82-85.
[13] 谢媛,王洛临,施之琪,等.小茴香挥发油纯胶包合物的制备工艺[J].中国实验方剂学杂志,2015,21(6):20-23.
[14] 周海波,张向荣,王岩.等.氟比洛芬-羟丙基-β-环糊精包合物的研制[J].中国医院药学杂志,2008,28(18):1539-1541.
[15] 何静,王章阳,刘松青.格列齐特-羟丙基-β-环糊精包合物的制备工艺优化[J].中国医药指南,2008,6(18):26-28.
[16] 吴珊,李小芳,舒予,等.正交优化-微波辅助提取山香圆叶总黄酮的工艺研究[J].成都中医药大学学报,2014, 37(2):15-17.
[17] 朱凯.HPLC法测定片剂中双氢青蒿素含量的不确定度评估[J].重庆工商大学学报(自然科学版),2013,30(1):81-85.
[18] 郭毅新,张元杰,丁涛,等.HPLC法测定双氢青蒿素哌喹片中的磷酸哌喹含量[J].药学研究,2014,33(6):332-334.
[19] 周琳.HPLC法测定双氢青蒿素哌喹片中双氢青蒿素的含量[J].中国药房,2015,26(24):3393-3395.
[20] 崔京浩,钱颖,缪文俊,等.含葛根素-羟丙基-β-环糊精包合物胃滞留制剂的制备与体外评价[J].中国中药杂志,2008,33(16):1960-1963.
[21] 邵伟,许伟,李爱国,等.槲皮素与羟丙基-β-环糊精包合物的药物动力学研究[J].中药材,2005,28(1):47-49.
