AD患者脑功能偏侧性改变的静息态fMRI研究
2016-07-10张乐乐赵小虎林起湘
张乐乐, 赵小虎, 林起湘, 席 芊
(1. 同济大学附属同济医院影像科,上海 200065; 2. 北京师范大学认知神经科学与学习国家重点实验室,北京 100875;3. 同济大学附属东方医院实验室,上海 200120)
AD患者脑功能偏侧性改变的静息态fMRI研究
张乐乐1, 赵小虎1, 林起湘2, 席 芊3
(1. 同济大学附属同济医院影像科,上海 200065; 2. 北京师范大学认知神经科学与学习国家重点实验室,北京 100875;3. 同济大学附属东方医院实验室,上海 200120)
目的 采用功能磁共振技术,探讨阿尔茨海默病(Alzheimer disease, AD)患者静息状态下的脑功能偏侧性的改变。方法 实验数据均来自ADNI(Alzheimer disease Neuroimaging Initiative)数据库,以17例右利手阿尔茨海默病患者为研究对象,19例右利手正常老年人作为对照。将全脑灰质随机划分为左右半球对称的256对种子区,基于功能连接分析法计算偏侧性指数(laterality index, LI),量化分析静息态下脑功能偏侧性程度;计算0<|LI|<0.2、0.2≤|LI|<0.4、0.4≤|LI|<0.8、|LI|≥0.8四段阈值下的左偏LI之和及右偏LI之和,探索AD患者较正常老年人静息状态下的脑功能偏侧性是否存在改变。结果 对照组在0<|LI|<0.2、0.2≤|LI|<0.4、0.4≤|LI|<0.8阈值内左右半球偏侧性未见明显不同,在|LI|≥0.8的阈值内表现出明显的差异,体现出显著的左侧优势(P=0.005);与对照组比较,AD患者在|LI|≥0.8阈值内左侧优势消失(P=0.06),在0.4≤|LI|<0.8阈值内出现显著的右侧优势(P=0.03)。结论 对照组静息态脑功能存在一定的偏侧性,该偏侧性主要体现在偏侧性较强范围内(|LI|≥0.8),表现为左侧优势;AD组在偏侧性较强的范围内(0.8≤|LI|)左侧优势消失,可能是其特征性改变;AD组在偏侧性较弱的范围内(0.4≤|LI|<0.8)表现出右侧优势,可能是与认知有关的脑功能代偿所致。
静息态功能磁共振; 功能连接; 阿尔茨海默病; 偏侧性指数
正常两大脑半球在解剖结构和功能上具有一定的偏侧性。脑功能的偏侧性对个体的生存具有重要意义,它为功能的形成提供了便利,使大脑能快速实现信息的处理加工。脑功能偏侧性是大脑半球内部功能特化的重要体现,它减少了半球间的联系,有利于信息高效传递[1]。研究表明,年龄的增长和某些疾病如抑郁、阿尔茨海默病(Alzheimer’s disease, AD)、恐慌症状态下大脑不对称性会改变[2]。目前基于磁共振成像技术的AD患者大脑偏侧性改变的研究大多集中在结构领域,功能偏侧性的改变研究甚少。本研究采用静息态功能磁共振(fMRI)技术,基于功能连接分析法,对19例正常老年人和17例阿尔茨海默病患者进行分析比较,旨在发现AD患者静息状态下脑功能偏侧性改变的趋势,为AD的发现诊断提供有效的影像学资料。
1 资料与方法
1.1 研究对象及数据参数
本研究39例数据均来自ADNI(Alzheimer disease Neuroimaging Initiative)数据库。脑结构和功能数据均由3.0T飞利浦磁共振机器采集。脑结构成像的序列为3D T1-MPRAGE(3D T1-weighted magnetization-prepared rapid gradient echo),成像参数: TR=6.8ms,TE=3.1ms,翻转角=9°,层厚=1.2mm,层数=170,矢状位成像,体素大小=1mm×1mm×1.2mm,矩阵大小=256×256。静息态脑功能成像的序列为EPI(echo-planar imaging sequence),成像参数: TR=3000ms,TE=30ms,翻转角=80°,层厚=3.3mm,层数=48,矩阵=64×64,空间分辨率=3mm×3mm×3mm,每例患者均采集140个时间点。经过预处理,去除掉3例头动较大的实验对象,余有36例右利手老年人纳入研究,其中对照组19例(男9例,女10例),平均年龄为(74.48±6.56)岁;AD组17例(男5例,女12例),平均年龄为(74.08±8.09)岁。
1.2 数据的预处理
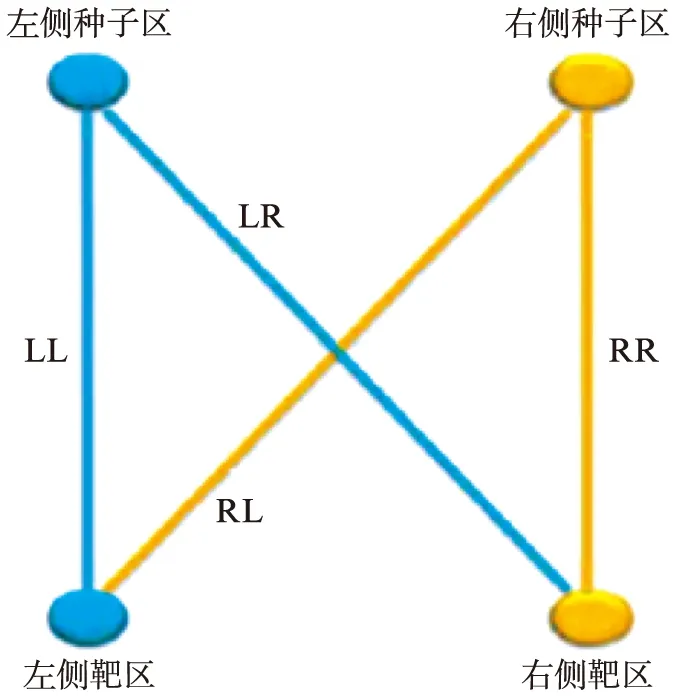
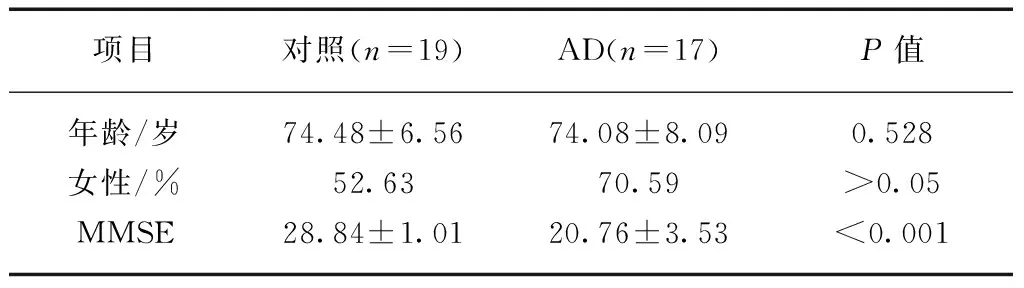
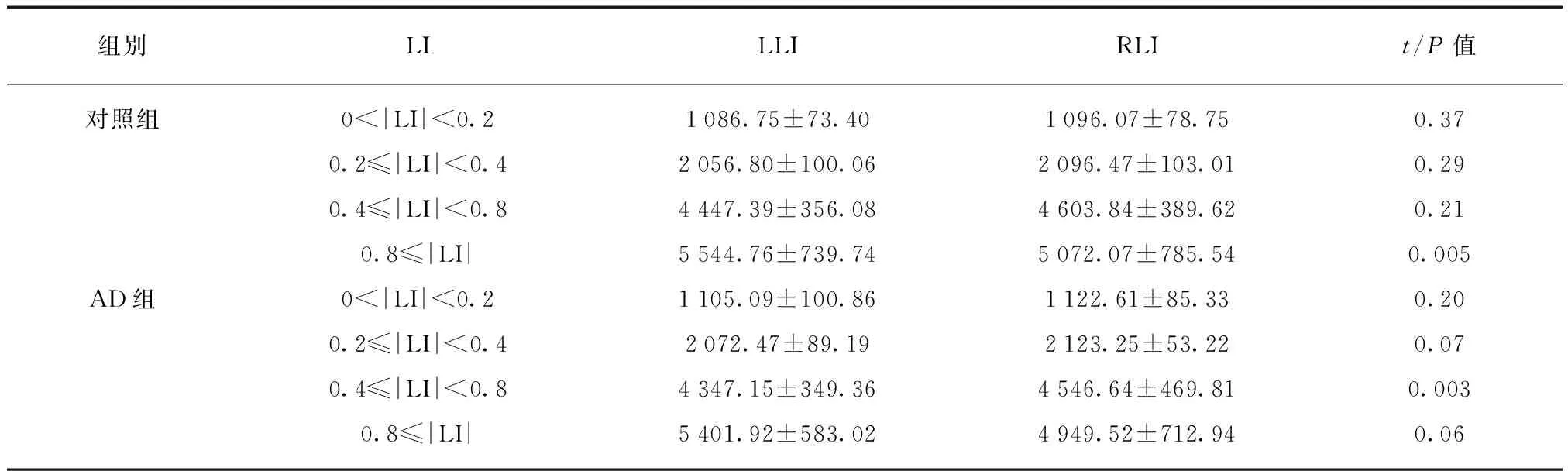
利用DPARSF软件对功能图像进行预处理,功能图像预处理过程包括: (1) 去除前5个时间点采集的图像数据;(2) 以48层为参考层进行时间层校正;(3) 头动校正;(4) 空间配准;(5) 空间平滑,高斯核半宽全高为6mm×6mm×6mm;(6) 去除线性漂移;(7) 低频滤波(0.01Hz 1.3 种子区域的确定 本实验基于全部大脑皮层进行研究分析,故将全部大脑皮层划分为左右对称的共计512个感兴趣区。首先从MNI-ICBM152对称模板的全脑灰质模板中去除小脑区域后,取大脑的左半球,将左半脑灰质区域随机划分成大小相近的256个感兴趣区[4],然后把划分好的左半球区域做镜面对称得到右半脑感兴趣区。这样得到一个左右对称,每个半脑各包含256个兴趣区的模板。每对兴趣区作为研究的种子点见图1。 图1 种子区域划分的示图Fig.1 Sample image of seedregionsA: 矢状位;B: 冠状位;C: 轴位 1.4 偏侧性指数计算 偏侧的性指数的计算方法参考文献[5],具体方法为: 在左半球选择一个种子区A作为左侧大脑半球的种子区,同时将其对称过去的右半球的A’区选择出来作为右侧大脑半球的种子区,在余下的255对脑区中任选一对作为左侧及右侧大脑半球的靶区,然后计算左侧种子区与左侧靶区、左侧种子与右侧靶区、右侧种子区与右侧靶区、右侧种子区与左侧靶区四个相应的功能连接值r,见图2,用Fisher-z转换将r值换为z值,将z值带入偏侧性指数(laterality index, LI)计算公式: 当分母≤0.2时将LI设为0,此外将seed对与自身的LI设为0,当LI=0时,没有偏侧性;当LI>0时,示该种子区为左偏优势;当LI<0时,示该种子区为右偏优势。|LI|越大,则表示偏侧性越强。每个实验对象共有65536个LI值。 1.5 偏侧性指数的处理分析 图2 功能连接强度计算方式Fig.2 Calculation of the strength of functional connectivityLL: 左半球种子区与左半球靶区的功能连接强度;LR: 左半球种子区与右半球靶区的功能连接强度;RR和RL代表对侧半球相应的功能连接强度 2.1 研究对象的人口统计学资料及MMSE评分差异 实验对象的人口统计学特点显示,对照组、AD组在年龄、性别构成方面均匹配。简易精神状态评价量表(mini-mental state examination, MMSE)评分: 对照组总分26~30分,平均(28.84±1.01)分;AD组总分12~27分,平均(20.76±3.53)分,差异有统计学意义(P<0.001),见表1。 2.2 对照组的功能偏侧性特征及AD患者静息态脑功能偏侧性的改变 组内配对样本t检验显示,对照组在0<|LI|<0.2、0.2≤|LI|<0.4及0.4≤|LI|<0.8区域内左、右大脑半球偏侧性指数和差异无统计学意义,但在|LI|≥0.8的阈值中表现出了明显的左侧优势(P=0.005)。与对照组相比,AD组在不同阈值下的左偏偏侧性指数和及右偏偏侧性指数和差异无统计学意义,但AD组在偏侧性较强(0.8≤|LI|)的区域内,左侧优势消失(P=0.06),在0.4≤|LI|<0.8时,AD组较NC组出现了明显的右侧优势(P=0.03),见表2。 表1 对照组、AD患者人口统计学特点 表2 不同LI阈值下各组配对样本t检验统计结果 组别LILLIRLIt/P值对照组0<|LI|<0.21086.75±73.401096.07±78.750.370.2≤|LI|<0.42056.80±100.062096.47±103.010.290.4≤|LI|<0.84447.39±356.084603.84±389.620.210.8≤|LI|5544.76±739.745072.07±785.540.005AD组0<|LI|<0.21105.09±100.861122.61±85.330.200.2≤|LI|<0.42072.47±89.192123.25±53.220.070.4≤|LI|<0.84347.15±349.364546.64±469.810.0030.8≤|LI|5401.92±583.024949.52±712.940.06 LI: 偏侧性指数;LLI: 左偏偏侧性指数和;RLI: 右偏偏侧性指数和 人类两大脑半球在功能和解剖结构上存在一定的不对称性。功能研究中,诸多以磁共振成像技术为基础的研究表明左侧大脑半球是语言形成的优势半球,该优势与用手习惯密切相关,右利手中约97%的人语言功能具有左侧优势,左利手中的语言功能左侧优势者较右利手大大降低,仅为70%[6];右侧大脑半球在视觉空间任务和对面部、声音的识别中体现出一定的偏侧性[7]。与语言功能相关的某些解剖结构具有一定的偏侧性,左侧颞横回灰质及白质的体积均较右侧大[8],左侧外侧裂走形较右侧外侧裂更为平直,顶点也较右侧低[6];与左右利手相关的解剖结构也具有一定的不对称性,右利手者的右侧中央沟较左侧深,左利手者的左侧中央沟较右侧深[9]。脑功能的偏侧性对个体的生存具有重要意义,它为功能的形成提供了便利,有利于大脑快速高效实现信息的处理加工。 本研究发现,对照组仅在|LI|≥0.8偏侧性较强的范围中呈现出明显的左侧优势(P=0.005),这一结果可能与语言功能的左偏特性密切相关。Steinmetz等[10]研究表明,左侧颞平面的体积是右侧相应部分体积的10倍,并且提出语言功能的不对称性或许是人脑功能不对称最显著的部分。本研究所涉及实验对象均为右利手,对照组在偏侧性较强的区域显示出明显的左侧优势,该研究结果与以往类似,提示这一结果与语言功能的左偏特性密切相关。 与正常老年人相比AD患者脑结构偏侧性发生明显改变。Barnes等[2]基于结构MRI图像在对AD患者进行纵向研究表明,随着疾病的进展,痴呆患者的海马区皮层厚度的不对称性减弱;Thompson等[11-12]指出,与右半球相比,AD对左半球脑皮层的损害发生的较早,进展的也更快,即随着AD病情的进展,会出现不对称的左半球严重于右半球的内侧颞叶以及内侧颞叶以外脑灰质的萎缩[13]。AD患者较正常老年人,功能的偏侧性也有显著的变化。本研究发现,较对照组,AD组在偏侧性较强(|LI|≥0.8)的范围内左侧优势消失(P=0.06)。Kim等[14]利用基于表面形态(surface based morphometry, SBM)分析方法发现,正常老年人左右大脑半球皮层厚度具有一定的偏侧性,从正常老年人到AD患者,脑皮层厚度的偏侧性模式仍然存在,但随着疾病的进展,这种偏侧性会逐渐减弱,其中以角回及海马旁回更为明显;与青年人相比,正常老年人边缘系统部分区域结构偏侧性较青年人会出现左右逆转,而AD患者明显缺乏这一特征[15]。本研究在偏侧性较强(|LI|≥0.8)的区域,AD组较对照组的左侧优势消失(P=0.06),这或许是AD患者特征性的改变。 此外,本研究中AD组在0.4≤|LI|<0.8范围内较对照组表现出显著的右侧优势,这可能是脑功能代偿的一种表现。从正常老年人到发展为AD过程中,多项脑功能受损,大脑会出现一定的代偿功能。Grady等[16]在任务态下对AD患者所激活的脑区进行研究表明,在与语义和情景记忆有关的活动下,AD患者所激活的脑区与正常老年人不同: 正常老年人的激活区主要在左侧大脑半球的网络区域,其中包括有前额叶、颞叶皮层,AD患者激活区与正常老年人大不相同,主要集中在双侧的前额叶的后外侧皮层及后部的一些脑皮层,这些脑区的活动程度与AD患者的语义和情景记忆的好坏明显相关,证实了活动区域的不同是脑功能代偿的表现[25]。Pariente等[17]在“人-名”识别对应的任务态下对AD患者激活的脑区研究表明,AD组较正常老年人双侧海马区的激活程度减弱,但双侧额叶及顶叶的活动增强。此研究所发现的区域与Grady等[25]的结果大致相似。AD患者双侧额叶及顶叶的活动增强是一种“软性的代偿”——不是大脑原本就存在的与认知有关的脑网络,而是在与认知功能有关的网络损害后由其他网络“代劳”[17]。与情景记忆功能有关的脑网络主要位于左侧半球,而AD患者则出现在双侧大脑半球,此外AD患者与认知有关的脑网络也出现了双侧额顶叶的代偿活动。这些代偿作用可能会使脑功能出现一定的右偏特性。 目前关于脑功能不对称性的研究大多集中在正常人中,本研究用功能磁共振成像技术,基于功能连接分析法探究了AD患者静息态脑功能整体偏侧性的改变,并指出对照组在偏侧性较强区域(|LI|≥0.8)内的左侧优势或许与语言功能的左偏特性密切相关;在偏侧性较强(|LI|≥0.8)的区域AD患者左侧优势消失,可能是AD患者特征性的改变;在偏侧性较弱(0.4≤|LI|<0.8)的区域,AD患者或许存在一定的代偿现象。本研究表明,静息态脑功能成像对AD的诊断有一定的影像学意义。 [1] Wang Danhong, Buckner RL, Liu Hesheng. Functional specialization in the human brain estimated by intrinsic hemispheric interaction[J]. J Neurosci, 2014,34(37): 12341-12352. [2] Barnes J, Scahill R, Schott J, et al. Does Alzheimer’s disease affect hippocampal asymmetry? Evidence from a cross-sectional and longitudinal volumetric MRI study[J]. Dement Geriatr Cogn Disord, 2005,19: 338-344. [3] Zeng LL, Wang D, Fox MD, et al. Neurobiological basis of head motion in brain imaging[J]. PNAS USA, 2014,111: 6058-6062. [4] Zalesky, Andrew, Fornito, et al. Whole-brain anatomical networks: Does the choice of nodes matter?[J]. Neuroimage, 2010,50(3): 970-983. [5] Liu H, Stufflebeam SM, Sepulcre J, et al. Evidence from intrinsic activity that asymmetry of the human brain is controlled by multiple factors[J]. PNAS USA, 2009,106: 20499-20503. [6] Toga AW, Thompson PM.Mapping brain asymmetry[J]. Neuroscience, 2003,4: 37-48. [7] Gainotti G. Laterality effects in normal subjects recognition of familiar faces,voices and names[J]. Neuropsychologia, 2013,51: 115-1160. [8] Dorsaint-Pierre R, Penhune VB, Watkins KE, et al. Asymmetries of the planum temporale and Heschl’s gyrus: relationship to language lateralization[J]. Brain, 2006,129(pt5): 1164-1176. [9] Davatzikos C, Bryan R. Morphometric analysis of cortical sulci using parametric ribbons: A study of the central sulcus[J]. J Comput Assist Tomogr, 2002,26: 298-307. [10] Steinmetz H. Structure, functional and cerebral asymmetry:invivomorphometry of the planum temporale[J]. Neurosci Biobehav Rev, 1996,20: 587- 591. [11] Thompson P, Hayashi K, Dutton R, et al. Tracking Alzheimer’s disease[J]. Ann NY Acad Sci, 2007,1097: 183-214. [12] Thompson PM, Hayashi KM, Zubicaray GD, et al. Dynamics of gray matter loss in Alzheimers’disease[J]. J Neurosci, 2003,23(3): 994-1005. [13] 成建明,赵小虎,门卫伟,等.轻度认知障碍进展为阿尔茨海默病过程中脑灰质体积特征改变的MRI研究[J].中国医学影像技术,2015,31: 19-23. [14] Kim JH, Lee JW, Kim GH, et al. Cortical asymmetries in normal, mild cognitive impairment, and Alzheimer’s disease[J]. Neurobiology of Aging, 2012,33: 1959-1966. [15] Long XJ, Zhang LJ, Liao WQ, et al. Distinct laterality alterations distinguish mild cognitive impairment and Alzheimer’s Disease from healthy aging: statistical parametric[J]. Human Brain Mapping, 2013,34: 3400-3410. [16] Grady CL, Mcintosh AR, Sania B, et al. Evidence from functional neuroimaging of a compensatory prefrontal network in Alzheimer’s disease[J]. J Neurosci, 2003,23(3): 986-993. [17] Pariente J, Cole S, Henson R, et al. Alzheimer’s patients engage an alternative network during a memory task[J]. Ann Neurol, 2005,58(6): 870-879. Detection of brain lateralization in Alzheimer’s disease using resting-state fMRI ZHANGLe-le1,ZHAOXiao-hu1,LINQi-xiang2,XIQian3 (1. Dept. of Radiology, Tongji Hospital, Tongji University, Shanghai 200065, China;2. Laboratory of Brain and Cognitive Science, Beijing Normal University, Beijing 100875, China;3. Dept. of clinical Laboratory East Hospital, Tongji University, Shanghai 200120, China) Objective To investigate the lateralization of resting-state brain function in Alzheimer’s disease(AD) using functional magnetic resonance(fMRI) technology. Methods Experimental data were downloaded from ADNI(Alzheimer disease Neuroimaging Initiative) database, with 17 right-handed Alzheimer’s disease(AD) patients as the research objects and 19 right-handed normal elderly people as controls. Whole cerebral gray matter was randomly divided into 256 pairs of seed regions and the patterns of division in left and right hemispheres were symmetrical. The Laterality Index(LI) was calculated base on the functional connectivity analysis method for quantitative analysis of lateralization of brain function under the resting state. The sum of left lateralized LI and right lateralized LI under 0<|LI|<0.2,0.2≤|LI|<0.4,0.4≤|LI|<0.8,|LI|≥0.8 four thresholds were calculated to explore whether there was any change in the lateralization of resting-state brain function in AD patients. Results In the threshold of 0<|LI|<0.2,0.2≤|LI|<0.4,0.4≤|LI|<0.8, there were no significant difference of lateralization between two hemispheres in the control group. In the threshold of |LI|≥0.8, the control group showed significant interhemispheric differences(P=0.005), reflecting left hemisphere dominance. Compared with control group, the difference in left dominance at threshold |LI|≥0.8 disappeared in AD patients(P=0.06) and in the threshold of 0.4≤|LI|<0.8,AD patients showed distinct right hemisphere dominance(P=0.03). Conclusion A left-lateralized dominance of resting-state brain function has been showed in the healthy subjects, mainly embodied in the relative more lateralized areas(|LI|≥0.8); the significant lateralization that showed in control group disappeared in AD patients, which maybe a characteristic change in AD patients; within the scope of relatively less lateralized(0.4≤|LI|<0.8). AD patients showed a right lateralized dominance which is likely to be associated with compensatory of brain cognitive function. resting-state functional magnetic resonance; functional connectivity; Alzheimer’s disease; laterality index 10.16118/j.1008-0392.2016.04.012 2016-01-20 国家自然科学基金(81271552,81301200) 张乐乐(1991—),女,硕士研究生.E-mail: zhangzixiaole@126.com 赵小虎.E-mail: xhzhao999@263.net xhzhao999@gmail.com R 445.2 A 1008-0392(2016)04-0060-05
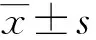
2 结 果
3 讨 论
