尿道狭窄术后复发的相关危险因素评估
2016-07-10刘昭辉罗华荣向振东吴登龙
刘昭辉, 洪 哲, 罗华荣, 向振东, 吴登龙
(同济大学附属同济医院泌尿外科,上海 200065)
尿道狭窄术后复发的相关危险因素评估
刘昭辉, 洪 哲, 罗华荣, 向振东, 吴登龙
(同济大学附属同济医院泌尿外科,上海 200065)
目的 评估尿道狭窄术后复发的相关危险因素。方法 回顾性分析2011年1月至2014年12月间,因尿道狭窄在同济大学附属同济医院行手术治疗233例患者临床资料及术后随访资料。结果 尿道狭窄术后再复发的平均时间及中位数时间分别是28.1个月(8~46个月)和27个月。COX比例风险回归分析显示手术方式、狭窄部位、围手术期感染、及随访时间是影响术后狭窄复发的重要因素(P<0.05)。结论 术前围手术期预防感染,选择合适的手术方式可降低术后狭窄复发的风险。
尿道狭窄; 术后复发; 危险因素
尿道狭窄的发生率在年长的成年男性人口中将近1%[1-2]。其治疗方法包括尿道扩张术、尿道镜内切开及尿道成形术等多种方式的治疗。不同的治疗方法术后随访其尿道狭窄复发率也不同。单纯的尿道扩张术及尿道镜内切开术的治疗效果往往不能持久,在长期的随访中复发率几乎100%[3-4]。尿道成形术中尿道狭窄段切除端端吻合的远期复发率从1.2%~14%不等,而尿道替代物成形术(包括颊黏膜代尿道、阴茎阴囊皮肤代尿道等)的远期复发率则上升为58%。尽管如此,尿道成形术仍然是治疗尿道狭窄的金标准。尿道狭窄术后复发的影响因素众多,文献报道的主要有手术方式、狭窄情况等因素。本研究从患者一般情况,围手术期是否感染、手术方式、狭窄情况等因素入手,研究其与术后狭窄复发的相关性。
1 资料与方法
1.1 研究对象
回顾性分析2011年1月至2014年12月间因尿道狭窄在同济大学附属同济医院行手术治疗的233位患者的临床资料。经病案检索,对全部患者采用电话及门诊进行随访。共233位患者获访,随访率91.7%,11例失访。5例随访时间<6个月。
1.2 临床资料
本组资料233例均为男性,年龄18岁~81岁,平均年龄(45.5±2.3)岁。狭窄原因包括外伤骨盆骨折尿道损伤致尿道狭窄103例,会阴部骑跨伤39例,尿道器械操作如经尿道前列腺电切术(transurethral resection of the prostate, TURP)等18例,导尿等医源性损伤17例,继发于尿道感染26例,继发于尿道下裂等先天性异常术后尿道狭窄16例,不明原因14例。
患者术前均行尿流率及尿道造影检查,以确定尿道是否狭窄,狭窄部位及长度。是否满足手术指征。其狭窄部位包括前部尿道(尿道球部之前)56例,尿道球部133例,尿道膜部36例及后尿道8例。狭窄长度1~2cm者125例;2~5cm者93例;>5cm 者15例。既往基础疾病包括糖尿病10例,高血压29例。手术方式的选择根据患者病情(包括年龄、狭窄部位、狭窄长度、入院是否伴有感染、全身身体情况等因素)综合考虑。手术主刀医生均为同一手术医生。手术方式包括尿道镜内切开108例,尿道成形术125例: 包括狭窄疤痕切除端端吻合70例;舌黏膜尿道成形及阴茎阴囊皮肤尿道成形术55例,见表1。
1.3 方法
术后尿道狭窄复发定义为患者主诉复发性症状,尿流率小于15ml/s,或需要干预治疗(包括尿扩,尿道镜内切开及尿道成形术)。术后复查频率一般为术后3个月、6个月及之后的每年复查一次。复查指标包括尿流率、尿道造影,必要时行膀胱镜检查。随访方式包括门诊随访及电话随访。

表1 频率分布情况
1.4 统计学处理
数据的统计分析使用SPSS 20.0统计软件进行。Cox比例风险回归分析、确定多变量预测狭窄复发的危险因素,α值设定在0.05及95%的置信区间。Kaplan-Meier分析尿道狭窄未复发率,P<0.05为差异有统计学意义。
2 结 果
本研究随访患者共233例,术后尿道狭窄复发有44例,复发率18.9%。基础疾病患有糖尿病的10例(4.3%),高血压29例(12%)。尿道狭窄术后再复发的平均时间及中位数时间分别是(28.1±1.8)个月和27个月。COX比例风险回归分析显示,手术方式是术后尿道狭窄复发的相关因素(P=0.049)。手术方式包括以下3种: 尿道狭窄内切开108例,术后复发32例,复发率为29.6%;尿道狭窄切除端端吻合术70例,术后复发5例,复发率为7.1%;尿道成形术(包括颊黏膜代尿道、阴茎阴囊皮肤代尿道)共55例,复发7例,复发率12.7%。术式中尿道狭窄内切开与尿道成形术比较,差异有统计学意义(P=0.034,OR=3.050)。而尿道狭窄切除端端吻合术与尿道成形术比较,差异无统计学意义(P=0.731)。
狭窄部位是术后尿道狭窄复发的相关因素(P=0.015)。狭窄部位中前部尿道狭窄与后尿道狭窄比较,差异有统计学意义(P=0.019,OR=8.78)。
围手术期感染的患者有78例,占总人数的33.5%。差异有统计学意义(P<0.005,OR值为0.113),见表2。
随着随访时间的延长,术后狭窄复发率逐渐增高,未发生尿道狭窄的患者数量呈现下降趋势,见图1。入院时伴感染的患者复发率明显高于未伴感染患者,见图2。
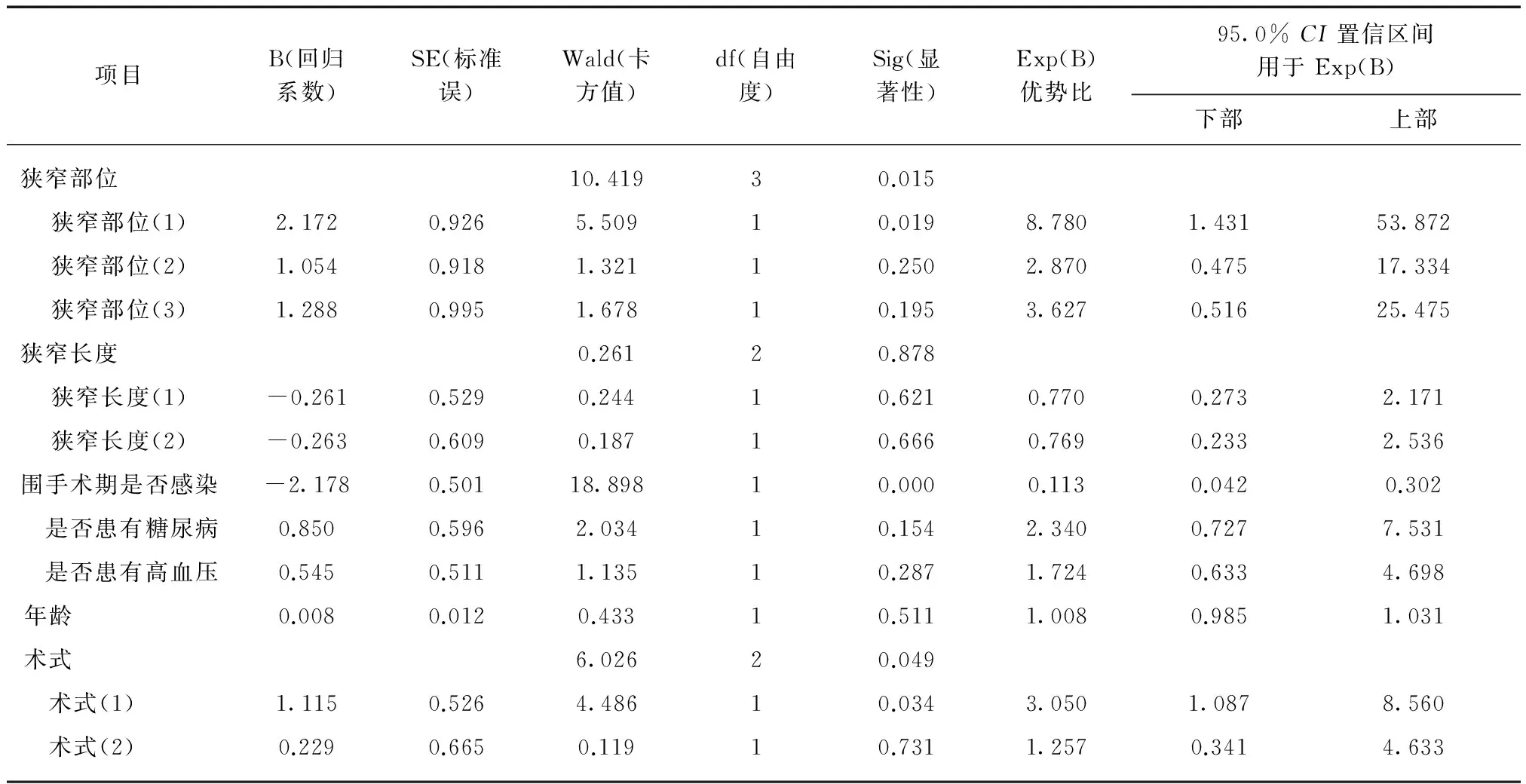
表2 数据分析结果Tab.2 Data analysis results
狭窄部位(1): 后尿道与前部尿道比较;狭窄部位(2): 前部尿道与尿道球部比较;狭窄部位(3): 尿道球部与尿道膜部比较;狭窄长度(1): >5cm组与1~2cm组比较;狭窄长度(2): 1~2cm组与2~5cm组比较;术式(1): 尿道成形术与尿道内切开比较;术式(2): 尿道内切开与尿道狭窄切除端端吻合比较

图1 时间-未复发率曲线Fig.1 Time-Recurrence free ratecurve
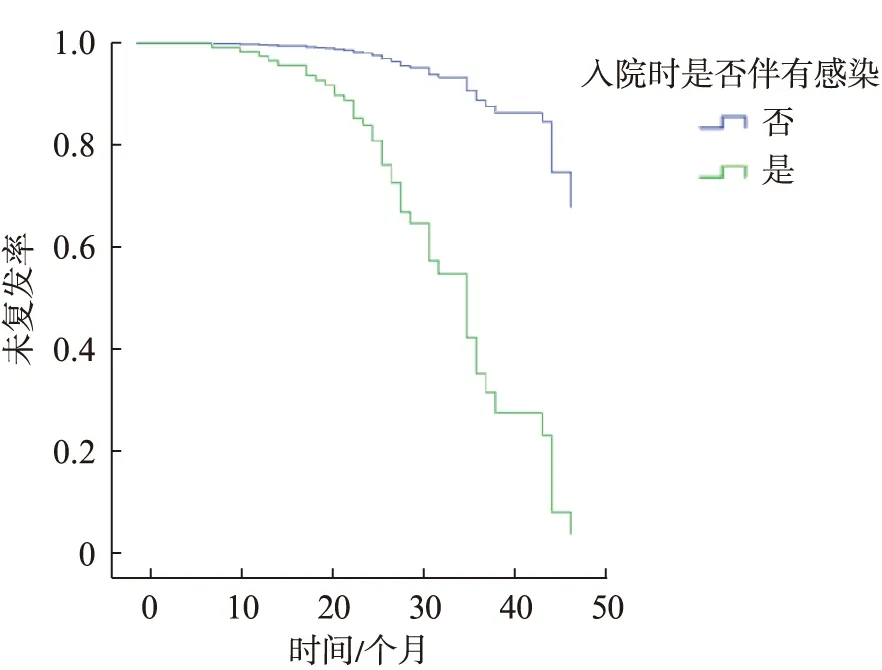
图2 围手术期感染因素对复发率的影响Fig.2 The influence of perioperative infection factors of the recurrence rate
3 讨 论
尿道狭窄是泌尿外科常见病,多见于男性。其发病原因有很多,常见的有外伤、炎症、医源性损伤以及先天性的发育异常[5]。尿道狭窄的治疗方式很多,包括尿道扩张术、手术等。手术治疗仍是公认的治疗尿道狭窄的主要方法。手术方式主要包括尿道镜内切开及尿道成形术等多种手术方式[6],但术后复发率仍较高,成为治疗尿道狭窄的难题[7]。本次研究对于尿道狭窄术后复发的可能因素进行COX比例风险回归分析。包括手术方式、狭窄长度、狭窄部位、年龄、基础疾病糖尿病、高血压,围手术期是否感染等因素。结果提示狭窄位置、手术方式及围手术期的感染情况是术后复发的危险因素。不同手术方式如尿道狭窄内切开与尿道成形术比较,差异有统计学意义(P=0.034,OR=3.050),可以认为尿道内切开术相对于尿道成形术术后尿道狭窄复发概率大。而尿道狭窄切除端端吻合与尿道成形术比较,差异无统计学意义 (P=0.731>0.05)。
狭窄部位位于前部尿道与位于后尿道组间比较,差异有统计学意义(P=0.019<0.05,OR=8.78),狭窄部位位于前部尿道相对于后尿道更易发生术后尿道狭窄。认为感染是尿道狭窄术后复发的危险因素(P<0.005,OR=0.113),未感染者复发率明显低于感染者。
本研究认为其余因素如年龄、是否患有高血压、是否患有糖尿病等不是尿道狭窄术后复发的危险因素。
尿道狭窄行尿道成型术后通常认为其有10%的成功率,但是在多项报道中差异较大[8-11]。在一项随访时间较长的研究中,Andrich等[12]报告称尿道狭窄切除端端吻合有较高的复发率,在随访的5、10、15年其复发率分别为12%、13%、14%。对于尿道成形术的成功率在报道中则有更大的差异。几项研究称颊黏膜代尿道术长期的成功率接近90%,但是其他代替物的成功率只有60%~70%[13-14]。Breyer等[15]发表了他们关于445位尿道成形术术后患者的数据分析,平均随访时间5.8年,尿道狭窄术后总体的复发率为21%。吸烟史、尿道内切开病史、尿道成形术史与复发相关。其他研究对于尿道狭窄的复发因素也有差异。Kinnaird等[16]研究认为狭窄长度、硬化性苔藓和医源性感染与狭窄复发有关,基础疾病、狭窄的位置、年龄、吸烟与复发无关[16]。最近的研究结果显示在狭窄复发中随访时间同样是显著的影响因素[17]。造成此差异可能是由于评判标准的不同,样本数量的差异及其他因素导致。
本研究是单一机构的回顾性研究,随访时间最长4年,相对较短。且术后对于尿道狭窄复发缺乏统一标准,如尿道造影、尿道镜等检查。尽管患者的主诉存在主观性,但在缺少统一的术后狭窄复发诊断的标准时,此法是临床上较适当的方法。相比较对于使用尿道造影及尿道镜检查后诊断术后尿道狭窄复发,患者主诉的敏感度及特异度分别高达87%和88%[18]。
本研究认为,术前预防感染、选择合适的手术方式可降低术后狭窄复发的风险,对提高患者生存质量有着重要的意义。
[1] 俞律峰,张兰新,邹德荣.口腔颊黏膜和结肠黏膜修复尿道狭窄的临床观察[J].同济大学学报: 医学版,2007,28(2): 68-70.
[2] Anger JT, Buckley JC, Santucci RA, et al. Urologic Diseases in America Project. Trends in stricture management among male Medicare beneficiaries: underuse of urethroplasty? [J].Urology, 2011,77: 481-485.
[3] Steenkamp JW, Heyns CF, de Kock ML. Internal urethrotomy versus dilation as treatment for male urethral strictures: a prospective, randomized comparison[J].Urol,1997,157: 98-101.
[4] Pansadoro V, Emiliozzi P. Internal urethrotomy in the management of anterior urethral strictures: long-term follow up[J]. Urol,1996,156: 73-75.
[5] 阮绪广,江伟航,程平瑞,等.食管气管联合导管用于困难气道的临床观察[J].临床麻醉学杂志,2012,28(1): 85-86.
[6] Bajwa SJ, Kaur J, Singh A, et al.Clinical and critical care concerns of cranio-facial trauma: A retrospective study in a tertiary care institute[J].Natil J Maxillofac Surg, 2012,3(2): 133-138.
[7] 刘平,李晚泉,胡蓉.气管插管和食管气管联合导管应用于院前急救中的对比分析[J].中国医药指南,2011,9(15): 28,98.
[8] Andrich DE, Mundy AR. What is the best technique for urethroplasty? [J].Eur Uro, 2008,54: 1031-1041.
[9] Micheli E, Ranieri A, Peracchia G,et al. End-to-end urethroplasty: longterm Results[J]. BJU Int, 2002,90: 68-71.
[10] Barbagli G, De Angelis M, Romano G,et al. Long-term followup of bulbar end-to-end anastomosis: a retrospective analysis of 153 patients in a single center experience[J]. J Urol, 2007,178: 2470-2473.
[11] Santucci RA, Mario LA, McAninch JW. Anastomotic urethroplasty for bulbar urethral stricture: analysis of 168 patients [J]. J Urol, 2002,167: 1715-1719.
[12] Andrich DE, Dunglison N, Greenwell TJ, et al. The long-term results of Urethroplasty[J]. J Urol, 2003,170: 90-92.
[13] Barbagli G, Morgia G, Lazzeri M. Dorsal onlay skin graft bulbar urethroplasty: long-term follow-up[J]. Eur Urol, 2008,53: 628-633.
[14] Elliott SP, Metro MJ, McAninch JW. Long-term follow up of the ventrally placed buccal mucosa onlay graft in bulbar urethral reconstruction[J]. Urology, 2003,169: 1754-1757.
[15] Breyer BN, McAninch JW, Whitson JM,et al. Multivariate analysis of risk factors for long-term urethroplasty outcome[J]. Urology, 2010,183: 613-617.
[16] Fichtner J, Filipas D, Fisch M, et al. Long-term outcome of ventral buccal mucosa onlay graft urethroplasty for urethral stricture repair[J].Urology, 2004,64: 648-650.
[17] Han JS, Liu J, Hofer MD,et al. Risk of urethral stricture recurrence increases over time after urethroplasty [J]. Int J Urol,2015,22(7),695-699.
[18] Erickson BA, Breyer BN, McAninch JW. The use of uroflowmetry to diagnose recurrent stricture after urethral reconstructive surgery[J]. Urology, 2010,184: 1386-1390.
Risk factors for postoperative recurrence of urethral stricture
LIUZhao-hui,HONGZhe,LUOHua-rong,XIANGZhen-dong,WUDeng-long
(Dept. of Urology, Tongji Hospital, Tongji University, Shanghai 200065, China)
Objective To assess the risk factors of postoperative recurrence of urethral stricture. Methods The clinical data of 233 patients, who underwent urological surgery in Tongji Hospital between January 2011 and December 2014 were retrospectively analyzed. Results The average and median time of urethral stricture recurrence after urological surgery was 28.1 months (8-46 months) and 27 months, respectively. COX proportional hazards regression analysis showed that surgical approach, stenosis, perioperative infection, and follow-up time were risk factors for postoperative stricture recurrence. (P<0.05). Conclusion Perioperative prevention of infection, select the appropriate surgical approach may reduce the risk of postoperative recurrence of urethral stricture.
urethral stricture; recurrence; risk factors
10.16118/j.1008-0392.2016.04.011
2015-09-24
国家自然科学基金项目(81172426);上海市教委创新重点项目(12ZZ034)
刘昭辉(1987—),男,硕士研究生.E-mail: hui3579lina@163.com
吴登龙.E-mail: wudenglong@163.com
R 695
A
1008-0392(2016)04-0055-05
