Blautia coccoides GA-1的传代培养及其同化H2/CO2产乙酸特征
2016-07-07刘崇李建政张亚非张玉鹏尤立剑刘冬梅哈尔滨工业大学市政环境工程学院黑龙江哈尔滨50090哈尔滨工业大学城市水资源与水环境国家重点实验室黑龙江哈尔滨50090黑龙江大庆市大同区环保监测站黑龙江大庆655
刘崇,李建政,,张亚非,张玉鹏,尤立剑,刘冬梅(哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 50090;哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 50090;黑龙江大庆市大同区环保监测站,黑龙江 大庆 655)
Blautia coccoides GA-1的传代培养及其同化H2/CO2产乙酸特征
刘崇1,李建政1,2,张亚非1,张玉鹏1,尤立剑3,刘冬梅1
(1哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨 150090;2哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090;3黑龙江大庆市大同区环保监测站,黑龙江 大庆 163515)
摘要:为了解同型产乙酸菌异养代谢与自养代谢的相互作用与机制,并为快速获得具有较强自养代谢能力的菌体细胞提供培养方法,以H2/CO2和(或)葡萄糖为碳源,考察了Blautia coccoides GA-1在连续传代培养中的代谢特征。结果表明,以H2/CO2作为唯一碳源进行连续传代培养时,菌株GA-1长势较弱,其子代的自养代谢能力也逐渐下降;在葡萄糖培养基中,菌株GA-1增殖旺盛,但高浓度的葡萄糖对其自养代谢能力有显著抑制作用,这种抑制作用可能是自养代谢和异养代谢对辅酶A和ATP的竞争、酸性环境造成的代谢抑制以及辅酶I的氧化还原平衡调节等综合作用的结果。以体积比为4:1的H2/CO2混合气为气相条件,用200 mg·L−1葡萄糖培养基对菌株GA-1进行传代培养,不仅可获得稳定的子代培养物,而且可以将其利用H2/CO2产乙酸的能力维持在2.16 g乙酸·(g干细胞)−1的水平。
关键词:同型产乙酸菌;发酵;代谢;氢;二氧化碳;乙酸
2015-12-11收到初稿,2016-01-22收到修改稿。
联系人:李建政。第一作者:刘崇(1984—),男,硕士研究生。
Received date: 2015-12-11.
Foundation item: supported by the National Natural Science Foundation of China (51178136).
引 言
同型产乙酸菌(homoacetogens)是一类能够通过Wood-Ljungdahl代谢途径(WLP)将CO2还原为乙酸的专性厌氧微生物,在生命起源、自然生态的碳循环、废水厌氧生物处理等方面均发挥着重要作用[1-4]。其利用CO2产生乙酸的自养代谢作用,也在节能减排、气候变化以及工业溶剂生成等领域受到高度重视[5-8]。同型产乙酸菌兼具自养代谢和异养代谢的能力,广泛分布于自然环境中[9-10]。由于异样代谢可以获得比自养代谢更多的能量,在物质组成复杂的生境中,同型产乙酸菌总是优先利用有机碳源进行异养代谢[11-12]。然而,有关同型产乙酸菌自养代谢和异样代谢相互影响的研究却少见报道[10]。
在前期研究中,分离获得了一株同型产乙酸菌Blautia coccoides GA-1[13]。该菌株能够利用H2/CO2自养生长并产生乙酸,也能发酵葡萄糖产生乙酸。为获得足够的供测试使用的菌体细胞,研究中采用葡萄糖培养基进行连续传代和扩大培养。但经过长期异养培养后,发现菌株的自养代谢能力减弱甚至消失。为探讨同型产乙酸菌在增殖过程中的异养代谢和自养代谢的相互作用机制,本文通过传代培养的方式,考察了B. coccoides GA-1异养代谢对其自养代谢能力的影响,并为获得具有较强自养代谢能力的菌体提供培养方法。
1 实验材料和方法
1.1菌源
同型产乙酸菌Blautia coccoides GA-1,是从一个处理制糖废水的连续流搅拌槽式反应器(CSTR)的活性污泥中分离获得,严格厌氧,G+,不产芽孢,最适生长温度35~40℃,最佳pH 7.5~8.0,以H2/CO2作为唯一碳源的产乙酸速率为8.92 mg·L−1·h−1[13]。
1.2培养基
基础培养基:Na2HPO4·12H2O 0.53 g,KH2PO40.41 g,NH4Cl 0.3 g,CaCl2·2H2O 0.11 g,MgCl2·6H2O 0.10 g,NaCl 0.3 g,NaHCO31 g,酵母粉0.5g,半胱氨酸0.5 g,微量元素液10 ml,维生素液10 ml,去离子水1000 ml,pH 7.2~7.5。
葡萄糖培养基:在基础培养基基础上,按照设定浓度添加不同剂量的葡萄糖。
微量元素液:ZnSO4·7H2O 0.18 g,CaCl2·2H2O 0.1 g,CuSO4·5H2O 0.01 g,MnSO4·H2O 0.5 g,CoSO4·7H2O 0.18 g,KAl(SO4)2·12H2O 0.02 g,NiCl2·6H2O 0.03 g,Na2SeO3·5H2O 0.3 mg,Na2MoO4·2H2O 0.01 g,H3BO30.01 g,去离子水1000 ml。
维生素液:生物素2 mg,烟酸 5 mg,VB610 mg,VB15 mg,VB25 mg,VB120.1 mg,对氨基苯甲酸 5 mg,硫辛酸 5 mg,叶酸 2 mg,去离子水1000 ml。
1.3接种与培养
以体积比为4:1的H2/CO2混合气为气相条件[14-15],用200 mg·L−1葡萄糖培养基对保存的Blautia coccoides GA-1进行培养,以其发酵混合液为接种物(记为G0),在不同营养条件下进行传代培养,并对子代培养物进行自养能力测试。所有培养均采用容积为140 ml的血清瓶,每个培养均设置3个平行。
以体积比为4:1的H2/CO2混合气为气相条件,采用不同葡萄糖浓度培养基对菌株GA-1母代培养物(G0)的自养代谢能力进行测试。即取G0培养物5 ml,接种于50 ml特定浓度的葡萄糖培养基中,连续充入H2/CO2混合气5 min后,胶塞封瓶,37℃、135 r·min−1下恒温振荡培养至系统不再有H2消耗现象为止。
以葡萄糖为唯一碳源对菌株GA-1进行连续传代培养时,接种和培养方法与G0培养物自养代谢能力测试相同,但气相条件为纯氮。由G0连续传代培养获得的培养物依次记为G1、G2、G3等。在传代培养过程中,以H2/CO2混合气为气相条件,采用基础培养基对各子代培养物进行自养能力测试。自养代谢培养以H2不再消耗为发酵终点;异养代谢培养以葡萄糖完全降解为发酵终点。
1.4分析项目及检测方法
培养液的葡萄糖浓度采用DNS法测定[16],pH和菌体干重均依照标准方法进行测定[17]。其中,pH 用DELTA-320型pH计(梅特勒-托利多)测定,菌体干重采用恒重法确定。
发酵液中的有机挥发酸浓度,采用SP-6890型气相色谱仪(FID检测器)(山东鲁南瑞虹)进行检测,发酵系统气相中的H2体积分数采用SP-6800A型气相色谱仪(TCD检测器)(山东鲁南瑞虹)测定[18]。
2 实验结果与讨论
2.1葡萄糖浓度对B. coccoides GA-1自养能力的影响
为研究菌株GA-1异养代谢对自养代谢的影响,在体积比为4:1的H2/CO2气相条件下,采用葡萄糖培养基对菌株G0培养物进行培养,测试其自养代谢能力。如图1所示的结果表明,在无葡萄糖的情况下,菌株GA-1利用H2/CO2可产生349 mg·L−1的乙酸,耗氢能力为0.47 mol·(g干细胞)−1。当液体培养基加入葡萄糖后,菌体增殖能力显著增强,培养物的生物量随着葡萄糖浓度的升高而增加。然而,其利用H2/CO2的自养代谢能力却受到显著抑制,并随着葡萄糖浓度的提升而降低。在葡萄糖浓度≤200 mg·L−1的情况下,菌株GA-1培养物的耗氢能力仍能保持在0.1 mol·(g干细胞)−1以上,当葡萄糖浓度达到400 mg·L−1以上时,其耗氢能力大幅降低到了0.05 mol·(g干细胞)−1以下。分析认为,高浓度葡萄糖对菌株GA-1自养代谢的抑制作用,可能与自养代谢途径和异养代谢途径对辅酶A(CoA)的竞争有关[19-20]。
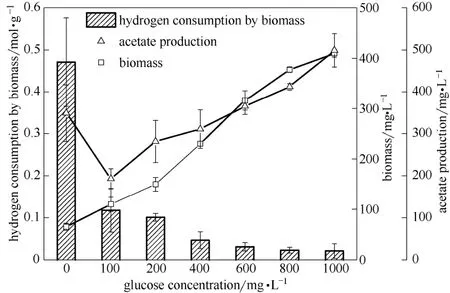
图1 混合营养条件下葡萄糖浓度对B. coccoides GA-1生长代谢的影响Fig.1 Effect of glucose on growth and metabolism of B. coccoides GA-1 in mixotrophic cultures
乙酸的产生和积累,导致菌株GA-1培养系统pH的下降。检测发现,葡萄糖浓度分别为0、100、200、400、600、800和1000 mg·L−1的混合营养体系(气相为H2/CO2),其发酵终点的pH分别为5.9、6.0、6.1、5.5、5.2、4.9和4.8。研究表明,同型产乙酸菌自养代谢所耐受的最低pH为5.5[10,20-21]。因此,异养代谢(葡萄糖发酵)产生的大量乙酸导致的低pH环境,可能是菌株GA-1自养代谢受到抑制的另一个重要原因。
2.2传代培养的稳定性
在自养和异养条件下对B. coccoides GA-1进行连续传代培养。如表1所示,在完全自养的条件下,菌株GA-1长势较弱,其生物量随着传代的次数增加而降低,培养到G6后已无法维续。在以葡萄糖为底物的异养条件下(气相为N2),菌株GA-1长势良好,其生物量随着葡萄糖浓度的升高而明显增加。在一定葡萄糖浓度下,经复壮的培养物G0,经过5次连续传代培养后,其生长和代谢特征基本稳定。菌株GA-1在G6后,在葡萄糖浓度为200 mg·L−1的培养基中可获得152 mg·L−1左右的干细胞和114 mg·L−1左右的乙酸产量,而在1000 mg·L−1的葡萄糖培养基中,则分别稳定在407 mg·L−1和357 mg·L−1左右。
研究表明,同型产乙酸菌利用H2/CO2合成乙酸的自养代谢途径,ATP产量很少,且主要用于CO2的同化,因此细胞增殖非常缓慢[22]。而一定浓度葡萄糖的存在,则可以为同型产乙酸菌的增殖提供必要的能量,因此可以有效促进细胞的增殖[1,10,22-23]。可见,ATP的产生与利用在同型产乙酸菌自养代谢和异养代谢的相互作用中发挥着重要作用。
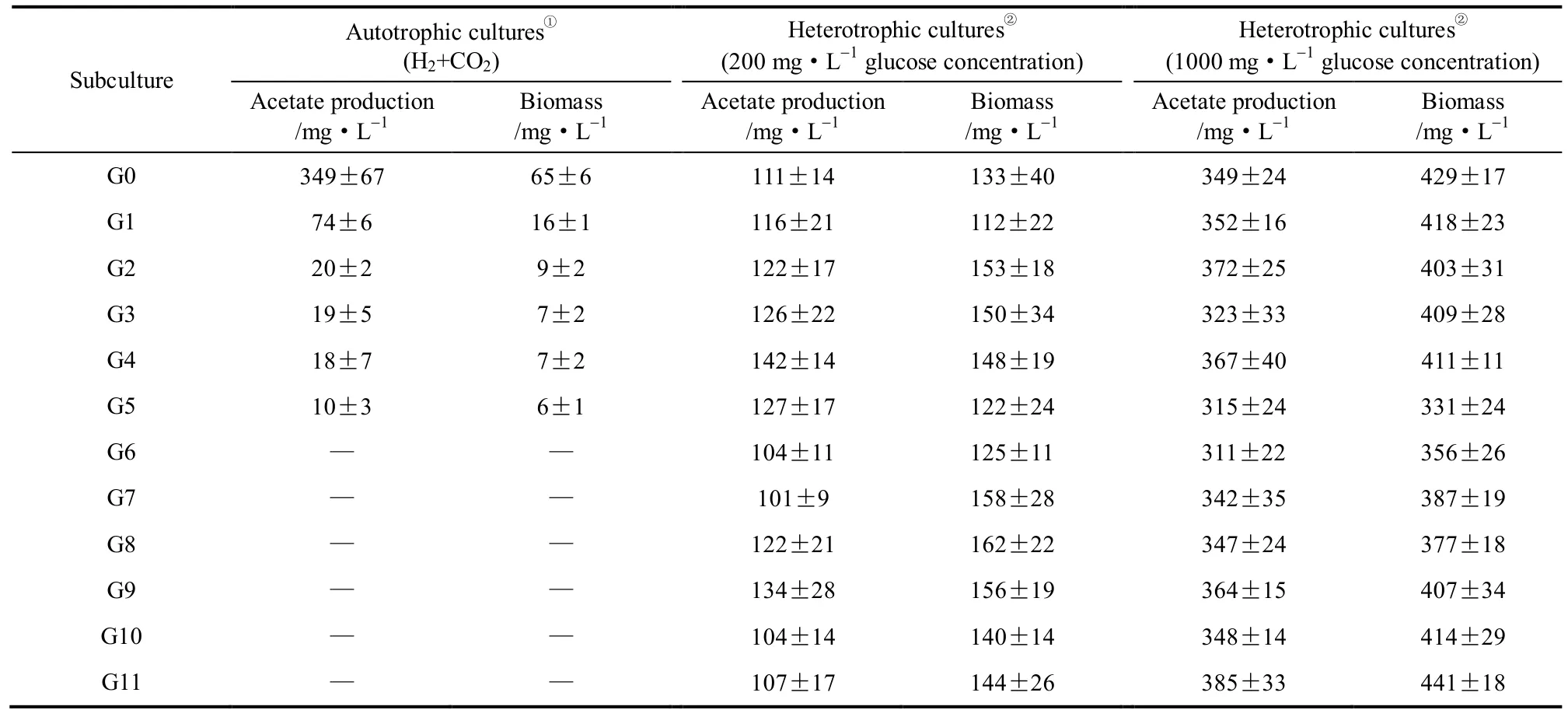
表1 B. coccoides GA-1在自养和异养条件下的连续传代培养Table 1 Subcultures of B. coccoides GA-1 in autotrophic and heterotrophic cultures
2.3传代培养物的自养代谢能力
对表1中3种培养条件下获得的子代培养物进行自养代谢能力测试。如图2所示的结果表明,Blautia coccoides GA-1在完全自养条件下连续传代培养,其G0的耗氢能力为0.59 mol·(g干细胞)−1。随着传代次数的增加,其耗氢能力迅速下降,在G4仅为0.13 mol·(g干细胞)−1,其产乙酸量也从G0 的5.35 g·(g干细胞)−1下降到了G4的1.558 g·(g干细胞)−1。由于自养代谢能力的下降,菌株GA-1的增殖能力受到了极大限制[10,23]。如图2所示,G0的生物量为65.23 mg·L−1,在G1即大幅下降为15.9 mg·L−1。生物量的严重不足,导致传代培养在G4后无法继续。
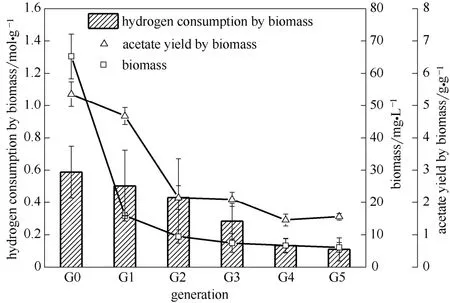
图2 B. coccoides GA-1在自养条件下的传代培养特征Fig.2 Performance of B. coccoides GA-1 in autotrophic culture following subculturing
以1000 mg·L−1葡萄糖培养基对菌株GA-1进行连续传代培养时,各子代的细胞增殖旺盛(表1),但其自养代谢能力随着传代次数的增加而迅速下降。如图3所示,G0的耗氢能力为0.068 mol·(g干细胞)−1,而在G3时仅有0.03 mol·(g干细胞)−1,产乙酸能力也从G0的0.80 g·(g干细胞)−1迅速下降至G3的0.30 g·(g干细胞)−1,至G7时其自养代谢能力几乎消失。可见,以有机碳源作为底物对菌株GA-1进行传代培养,虽然能够保证细胞的快速增殖,但其自养代谢能力却受到严重抑制。

图3 B. coccoides GA-1在1000 mg·L−1葡萄糖培养基中连续传代培养物的自养代谢能力Fig.3 Autotrophic metabolism of subcultures of B. coccoides GA-1 obtained in heterotrophic culture with 1000 mg·L−1glucose
以200 mg·L−1葡萄糖为底物,对同型产乙酸菌Blautia coccoides GA-1进行传代培养,并对其各子代自养代谢能力进行测试。如图4所示,在11次的传代培养中,菌株GA-1各子代培养物的生物量均能够维持在96.85 mg·L−1左右,其子代培养物的耗氢能力也基本维持在0.35 mol·(g干细胞)−1左右。其产乙酸能力虽然在前4代逐渐下降,但在G4代以后,基本稳定在了2.16 g·(g干细胞)−1左右。以上结果表明,以200 mg·L−1葡萄糖对菌株GA-1进行传代培养,不仅可以使菌体保持良好的增殖能力,也能将其自养代谢能力维持在较好水平。

图4 B. coccoides GA-1在200 mg·L−1葡萄糖培养基中连续传代培养物的自养代谢能力Fig.4 Autotrophic metabolism of subcultures of B. coccoides GA-1 obtained in heterotrophic culture with 200 mg·L−1glucose
由表1、图2、图3和图4所示的实验结果再次表明,高浓度的葡萄糖对菌株GA-1的自养代谢能力具有严重的抑制作用,这一抑制效应可能是CoA竞争、低pH抑制和ATP供应不足共同作用的结果[10,19-23]。
2.4自养代谢与异样代谢相互作用机制分析
同型产乙酸菌既能够通过自养代谢将H2/CO2同化为乙酸,又能进行异养代谢降解葡萄糖为乙酸[10]。如果不考虑细胞合成,1 mol葡萄糖可生产3 mol乙酸,其反应式为[1,20,22]
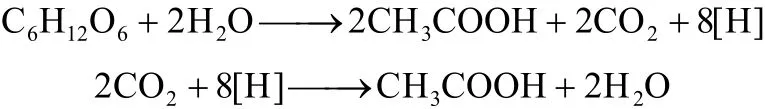
总反应
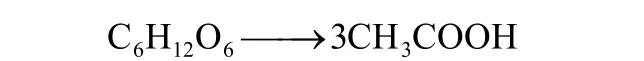
如图5所示,在无外源H2的情况下,葡萄糖经糖酵解(Embden-Meyerhof-Parnas,EMP)途径生成丙酮酸,在丙酮酸脱羧酶的催化下生成乙酰辅酶A(AcCoA),同时释放2 mol CO2和8 mol [H]。在葡萄糖发酵过程中产生的CO2和[H]则进入WLP通路合成乙酸[6,23]。可见,同型产乙酸菌对葡萄糖的降解和转化,耦合了异养代谢通路和自养代谢通路,而AcCoA是这两个代谢通路的共同中间产物。

图5 同型产乙酸菌的代谢途径(内源CO2和[H]为葡萄糖发酵产生)Fig.5 Metabolic pathway of homoacetogens (endogenic CO2and [H]are generated from glycolysis)1—formate dehydrogenase; 2—formyltetrahydrofolate synthetase; 3—formyltetrahydrofolate cyclohydolase; 4—methylenetetrahydofolate dehydrogenase; 5—methylenetetrahydofolate reductase; 6—methyltransferase; 7—CO dehydrogenase/acetyl-CoA synthase (CODH/ACS); 8—pyruvate dehydrogenase; 9—phosphotransacetylase; 10—acetate kinase; 11—[FeFe]-hydrogenase
如图1所示,在混合营养条件下,同型产乙酸菌B. coccoides GA-1的增殖能力随着培养基中葡萄糖浓度的升高而增强,但其自养代谢能力则随着葡萄糖浓度的增加而降低。以1000 mg·L−1葡萄糖对菌株GA-1进行传代培养时(表1),其子代的自养代谢能力随着传代次数的增加而迅速下降,至G7时,其同化H2/CO2的能力几近消失(图3)。以上结果均证明,异养代谢对自养代谢具有一定的抑制作用。分析认为,这种抑制现象的发生可能与以下方面有关:①在混合营养条件下,CoA在自养代谢通路与异养代谢通路耦合中发挥着关键作用,它不仅催化异养代谢通路中丙酮酸脱羧生成乙酸的反应,同时也催化自养代谢通路中的AcCoA的合成[19-20]。由于同型产乙酸菌可以发酵葡萄糖迅速增殖,细胞产生的绝大部分CoA被用于异养代谢途径的AcCoA合成,而自养代谢途径获得的AcCoA则相应减少,自养代谢能力因此受到一定程度的抑制[22-24]。②经EMP途径生成乙酸的过程中,1 mol葡萄糖可净产2 mol ATP。而H2/CO2经WLP途径生成乙酸的过程中,无ATP的净产出[1, 22-23]。理论上,在混合营养条件下,葡萄糖发酵产生的ATP应该可以强化WLP代谢通量[1,22]。但如图1所示的结果表明,葡萄糖的增加强化了菌株GA-1的细胞合成,其对ATP的快速消耗,使自养代谢作用因能量不足而难以为继。③如2.1节所述,在葡萄糖浓度低于400 mg·L−1时,菌株GA-1发酵体系的终点pH可维持在5.5以上,而大于400 mg·L−1时,系统的pH则会降低到5.5以下。已有研究证明,低于pH 5.5的酸性环境对同型产乙酸菌的代谢将产生显著抑制作用[10,20-21]。这可能是菌株GA-1在较高葡萄糖浓度下受到抑制的又一原因。(4)研究表明,在较低的pH环境条件下(pH<6.5),细菌为维持胞内的辅酶I的氧化还原平衡(NADH/NAD+平衡),胞内过多的H+会在膜结合氢化酶(membrane-bound hydrogenase)的催化下与NADH反应并以H2的形式释放到胞外[25-27]。这一生理代谢自我调节机制,无疑会抑制同型产乙酸菌在低pH下对外源H2的吸收和转化。因此,异养代谢产生的乙酸导致的低pH,还可能通过影响胞内NADH/NAD+平衡而对同型产乙酸菌的自养代谢作用产生抑制。
如表1所示,菌株GA-1在完全自养的条件下长势很弱,生物量随着传代的次数增加而降低。而在以葡萄糖为碳源的异养条件下,菌株GA-1可旺盛生长,在传代过程中也可获得稳定的培养物。但过高的葡萄糖浓度(1000 mg·L−1)会对菌株GA-1的自养代谢能力产生严重的抑制甚至消失(图3)。将葡萄糖浓度控制为200 mg·L−1时,不仅可以获得稳定的传代培养物,其子代也能保持一定的自养能力(图4)。这一结果表明,低浓度的葡萄糖,在有效刺激细菌生长的同时,能够保证CoA和ATP在自养代谢通路和异养代谢通路中的“合理”分配(图5),使自养代谢和异养代谢处于某种“平衡状态”,从而保持了菌株GA-1的自养代谢能力。
3 结 论
(1)B. coccoides GA-1的自养生长能力较弱,以H2/CO2作为唯一碳源进行连续传代培养时,因生物量逐代减少而最终无法持续。
(2)B. coccoides GA-1可发酵葡萄糖快速增殖,但高浓度的葡萄糖对其自养代谢能力有显著的抑制作用,经连续传代获得的培养物,其自养代谢能力逐渐下降,乃至消失。
(3)以体积比为4:1的H2/CO2混合气为气相条件,用200 mg·L−1葡萄糖培养基对B. coccoides GA-1进行传代培养,不仅可获得稳定的子代培养物,也能使其自养代谢能力保持在一定水平。
References
[1]DRAKE H L, GÖßNER A S, DANIEL S L. Old acetogens, new light [J]. Annals of the New York Academy of Sciences, 2008, 1125 (1): 100-128. DOI: 10.1196/annals.1419.016.
[2]SCHINK B. Energetics of syntrophic cooperation in methanogenic degradation [J]. Microbiology and Molecular Biology Reviews, 1997, 61 (2): 262-280. DOI: 1092-2172/97/$04.0010.
[3]BANKS C J, WANG Z. Development of a two phase anaerobic digester for the treatment of mixed abattoir wastes [J]. Water Science and Technology, 1999, 40 (1): 69-76. DOI: 10.1016/S0273-1223(99)00365-0.
[4]MCINERNEY M J, STRUCHTEMEYER C G, SIEBER J, et al. Physiology, ecology, phylogeny, and genomics of microorganisms capable of syntrophic metabolism [J]. Annals of the New York Academy of Sciences, 2008, 1125 (1): 58-72. DOI:10.1196/annals.1419.005.
[5]NI B J, LIU H, NIE Y Q, et al. Coupling glucose fermentation and homoacetogenesis for elevated acetate production: experimental and mathematical approaches [J]. Biotechnology and Bioengineering, 2011, 108 (2): 345-353. DOI: 10.1002/bit.22908.
雕塑作品语言由纯“手势”和“母材”的触性而抒写完成 ,主题是在探索历史时间长河中 :艺术的市俗化和艺术本质之间的纠缠,而思考一种能动的经典,在社会生活意识发展过程中的存在值或消亡感。同时,认知为生活必需所建立之物而具有真正的艺术审视观所可具有的观念价值和发展力。
[6]DANIELL J, KÖPKE M, SIMPSON S D. Commercial biomass syngas fermentation [J]. Energies, 2012, 5 (12): 5372-5417. DOI: 10.3390/en5125372.
[7]LATIF H, ZEIDAN A A, NIELSEN A T, et al. Trash to treasure: production of biofuels and commodity chemicals via syngas fermenting microorganisms [J]. Current Opinion in Biotechnology, 2014, 27: 79-87. DOI: 10.1016/j.copbio.2013.12.001.
[8]WIERINGA K T. The formation of acetic acid from carbon dioxide and hydrogen by anaerobic spore-forming bacteria [J]. Antonie van Leeuwenhoek, 1939, 6 (1): 251-262.
[9]DRAKE H L, KÜSEL K, MATTHIES C. Acetogenic prokaryotes [J]. Prokaryotes, 2006, (2): 354-420. DOI: 10.1007/0-387-30742-7_13.
[10]FAST A G, SCHMIDT E D, JONES S W, et al. Acetogenic mixotrophy: novel options for yield improvement in biofuels and biochemicals production [J]. Current Opinion in Biotechnology, 2015, 33: 60-72. DOI:10.1016/j.copbio.2014.11.014.
[11]PINDER R S, PATTERSON J A. Glucose and hydrogen utilization by an acetogenic bacterium isolated from ruminal contents [J]. Agricultural Food and Analytical Bacteriology, 2012, 2: 253-274.
[12]LIU C, LI J Z, ZHANG Y P, et al. Influence of glucose fermentation on CO2assimilation to acetate in homoacetogen Blautia coccoides GA-1 [J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42 (9): 1217-1224. DOI: 10.1007/s10295-015-1646-1.
[14]RIEU-LESME F, MORVAN B, COLLINS M D, et al. A new H2/CO2-using acetogenic bacterium from the rumen: description of Ruminococcus schinkii sp. nov [J]. FEMS Microbiology Letters, 1996, 140 (2/3): 281-286. DOI: 10.1111/j.1574-6968.1996.tb08350.x.
[15]GREENING R C, LEEDLE J A Z. Enrichment and isolation of Acetitomaculum ruminis, gen. nov., sp. nov.: acetogenic bacteria from the bovine rumen [J]. Archives of Microbiology, 1989, 151 (5): 399-406.
[16]国家环境保护部. 水和废水监测分析方法 [M]. 4版. 北京: 中国环境科学出版社, 2002. Ministry of Environmental Protection. Detection and Analysis Method of Water and Wastewater [M]. 4th ed. Beijing: China Environmental Science Press, 2002.
[17]FEDERATION W E. Standard Methods for the Examination of Water and Wastewater [M]. Washington, DC, USA: American Public Health Association (APHA), 2005.
[18]ZHU G F, LI J Z, WU P, et al. The performance and phase separated characteristics of an anaerobic baffled reactor treating soybean protein processing wastewater [J]. Bioresource Technology, 2008, 99 (17): 8027-8033. DOI:10.1016/j.biortech.2008.03.046.
[19]RAGSDALE S W, PIERCE E. Acetogenesis and the Wood-Ljungdahl pathway of CO2fixation [J]. Biochimica Biophysica Acta (BBA)-Proteins and Proteomics, 2008, 1784 (12): 1873-1898. DOI: 10.1016/ j.bbapap.2008.08.012.
[20]SAADY N M C. Homoacetogenesis during hydrogen production by mixed cultures dark fermentation: unresolved challenge [J]. International Journal of Hydrogen Energy, 2013, 38 (30): 13172-13191. DOI: 10.1016/j.ijhydene.2013.07.122.
[21]LUO G, KARAKASHEV D, XIE L, et al. Long-term effect of inoculum pretreatment on fermentative hydrogen production by repeated batch cultivations: homoacetogenesis and methanogenesis as competitors to hydrogen production [J]. Biotechnology and Bioengineering, 2011, 108 (8): 1816-1827. DOI: 10.1002/bit.23122.
[22]DIEKERT G, WOHLFARTH G. Metabolism of homoacetogens [J]. Antonie van Leeuwenhoek, 1994, 66 (1/2/3): 209-221.
[23]MÜLLER V. Energy conservation in acetogenic bacteria [J]. Applied and Environmental Microbiology, 2003, 69 (11): 6345-6353. DOI: 10.1128/AEM.69.11.6345-6353.2003.
[24]DIEKERT G. CO2reduction to acetate in anaerobic bacteria [J]. FEMS Microbiol. Rev., 1990, 87: 391-395. DOI: 10.1111/j.1574-6968.1990.tb04942.x.
[25]ADAMS M W W. The structure and mechanism of iron-hydrogenases [J]. Biochimica Biophysica Acta Bioenergetics, 1990, 1020 (2): 115-145. DOI: 10.1016/0005-2728(90)90044-5.
[26]PADAN E, SCHULDINER S. Intracellular pH regulation in bacterial cells [J]. Methods in Enzymology, 1985, 125: 337-352. DOI: 10.1016/S0076-6879(86)25029-6.
[27]TANISHO S, KAMIYA N, WAKAO N. Hydrogen evolution of Enterobacter aerogenes depending on culture pH: mechanism of hydrogen evolution from NADH by means of membrane-bound hydrogenase[J]. Biochimica Biophysica Acta (BBA)-Bioenergetics, 1989, 973 (1): 1-6. DOI: 10.1016/S0005-2728(89)80393-7.
Sub-culturing of novel Blautia coccoides GA-1 and acetate synthesis from H2/CO2in subcultures
LIU Chong1, LI Jianzheng1,2, ZHANG Yafei1, ZHANG Yupeng1, YOU Lijian3, LIU Dongmei1
(1School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, Heilongjiang, China;
2State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, Heilongjiang, China;3Environmental Monitoring Station of Datong District, Daqing 163515, Heilongjiang, China)
Abstract:Though homoacetogens have been defined as autotrophic anaerobes using acetyl-CoA Wood-Ljungdahl carbon fixation pathway (WLP) for energy conservation, acetate production and biomass formation from CO2, these anaerobes can also utilize organic compounds heterotrophically to produce acetate and form biomass by Embden-Meyerhof-Parnas (EMP) glycolysis. A better understanding of the interrelationship between autotrophy and heterotrophy in homoacetogens will be helpful for acetate biosynthesis from exhaust rich in CO2. However, interaction of the two metabolisms has not been well understood though both of which have been extensively investigated respectively. Blautia coccoides GA-1, a novel homoacetogen strain obtained in a previous study, was introduced to the present research and the interrelationship between autotrophy and heterotrophy in the strain was investigated by sub-culturing with glucose and (or) H2/CO2(vol, 4:1) as carbon source (s). The results showed that the cell production of strain GA-1 in H2/CO2cultures was too low to be sub-cultured after the 5th generation due to the energy produced was very limited in WLP. On the contrary, the strain could grow very well in glucose cultures and could be sub-cultured steadily. However, the autotrophic capability of the subcultures decreased bygenerations, even lost since the 7th generation in 1000 mg·L−1glucose cultures. This may be resulted in: (1) the competition for Coenzyme A (CoA) between the autotrophic WLP and the heterotrophic EMP glycolysis, (2) ATP produced in the strain used up for biosynthesis rather for acetate synthesis from H2/CO2, (3) inhibition of lower pH less than 5.5 to the activity of hydrogenase, (4) negative effect of the lower pH on intracellular balance of NADH/NAD+. In mixotrophic cultures with H2/CO2and 200 mg·L−1glucose as co-carbon sources, strain GA-1 could not only be sub-cultured steadily but also keep autotrophic activity well in the generations with a specific acetate production of about 2.16 g·(g dry cell)−1from H2/CO2.
Key words:homoacetogens; fermentation; metabolism; hydrogen; carbon dioxide; acetate
中图分类号:X 172
文献标志码:A
文章编号:0438—1157(2016)06—2591—07
DOI:10.11949/j.issn.0438-1157.20151884
基金项目:国家自然科学基金项目(51178136)。
Corresponding author:Prof. LI Jianzheng, jianzhengli@hit.edu.cn
