毛蕊花糖苷通过激活PI3K/AKT通路促进成年小鼠神经干细胞增殖
2016-07-07林慧敏段伟兵韩立峰高秀梅
林慧敏,段伟兵,邵 瑞,韩立峰,朱 彦,高秀梅,王 彧
(1.天津中医药大学,天津市现代中药重点实验室,天津 300193;2. 天津国际生物医药联合研究院中药新药研发中心,天津 300457)
毛蕊花糖苷通过激活PI3K/AKT通路促进成年小鼠神经干细胞增殖
林慧敏1,2,段伟兵1,2,邵瑞1,2,韩立峰1,朱彦1,2,高秀梅1,王彧1,2
(1.天津中医药大学,天津市现代中药重点实验室,天津300193;2. 天津国际生物医药联合研究院中药新药研发中心,天津300457)
摘要:目的观察毛蕊花糖苷对原代成年小鼠神经干细胞增殖的影响,并探讨其可能的作用机制。方法从成年C57BL/6小鼠脑室下区分离、培养原代神经干细胞,并通过神经干细胞标志蛋白Nestin免疫荧光染色,对分离得到的神经干细胞进行鉴定。不同浓度毛蕊花糖苷(5、10、20、40 μmol·L-1)在无有丝分裂原(EGF/bFGF)的条件下处理细胞24 h。采用CCK-8法检测细胞活力,免疫组化法计数BrdU阳性细胞率,检测细胞增殖能力,Western blot方法检测给药后神经干细胞Akt的磷酸化水平。结果毛蕊花糖苷在无有丝分裂原存在的条件下,能明显促进神经干细胞的增殖,并明显提高p-Akt的表达。而在加入PI3K/AKT信号通路阻断剂LY294002后,这一作用被明显抑制。结论毛蕊花糖苷对体外培养的神经干细胞具有明显促增殖作用,该作用机制可能与化合物激活Akt通路有关。
关键词:毛蕊花糖苷;成年小鼠;神经干细胞;脑室下区;增殖;Akt通路
神经干细胞(neural stem cells,NSCs) 是能自我更新,并具有分化为神经元、星形胶质细胞及少突胶质细胞能力的细胞[1-2]。成年动物NSCs在正常情况下处于静止状态,主要分布在海马齿状回颗粒下层(SGZ)和脑室管膜下区(SVZ)区域。在正常生理条件下,NSCs主要产生神经元,而神经损伤后,NSCs开始增生和迁移到损伤部位,SVZ来源的NSCs也能产生星形胶质细胞和少突胶质细胞。相比SGZ区域,SVZ中产生的新的神经元能够更快地迁移,并且能够迁移至更远的损伤部位,因此更受关注[3-4]。
毛蕊花糖苷为苯乙醇苷类化合物,最先在毛蕊花属植物中被发现,但在其他科属植物中也有发现和报道,如马鞭草科臭牡丹、列当科肉苁蓉等植物。毛蕊花糖苷具有很多对人类健康有益的药理活性,包括抗炎、抗氧化以及抗肿瘤作用[5]。目前,越来越多的研究表明,毛蕊花糖苷还具有神经保护作用。毛蕊花糖苷能够缓解MPP+和谷氨酸在PC12细胞诱导产生的神经毒性造成的神经损伤[6-7];毛蕊花糖苷对MPP+诱导的SH-SY5Y神经元细胞以及小脑颗粒神经元的凋亡具有明显抑制作用[8-9];毛蕊花糖苷可以改善小鼠由莨菪碱诱导产生的记忆障碍[10]等,提示毛蕊花糖苷可能在治疗神经系统性疾病方面具有潜在的应用价值。
本实验利用成年小鼠SVZ区分离培养的原代NSCs,观察毛蕊花糖苷对其增殖的影响,并初步探讨其可能的作用机制。
1材料与方法
1.1材料
C57BL/6小鼠,6~8周,购于北京军事医学科学院实验动物中心,许可证编号SCXK-(军)2012-0004;毛蕊花糖苷(acteoside)标准品(相对分子质量624.59,含量≥98%),购于中国食品药品检定研究院;DMEM/F12培养基、B27 supplement(50×)和0.25% Trypsin-EDTA均购于Gibco公司;表皮生长因子(epidermal growth factor,EGF)、碱性成纤维生长因子(fibroblast growth factor,bFGF)、聚-L-赖氨酸(poly-L-Lysine)和BrdU均购于Sigma公司;胰岛素-转铁蛋白-亚硒酸钠培养基添加剂(insulin-transferrin-sodium selenite supplement,ITSS)、Laminin购于美国 Roche 公司;CCK-8试剂盒(日本同仁化学研究所);BCA 蛋白定量试剂盒、Triton X-100、4%多聚甲醛(北京索莱宝公司);兔抗小鼠Akt、兔抗小鼠p-Akt抗体、LY294002、Hoechst 33342(美国Cell signaling 公司);β-actin单克隆抗体,辣根过氧化物酶标记的山羊抗兔/山羊抗鼠 IgG (北京中杉金桥生物公司);PVDF膜(美国 Millipore 公司);Super Signal West Pico化学发光底物(美国 Thermo scientific 公司);羊抗鼠BrdU多克隆抗体,FITC标记驴抗小鼠IgG(美国 Abcam 公司)。
1.2主要仪器
CO2细胞培养箱(上海施都凯仪器设备有限公司);蛋白垂直电泳装置(美国 Bio-Rad 公司);酶标仪(美国Molecular science公司);台式高速冷冻离心机(德国Sigma公司)。
1.3方法
1.3.1NSCs的分离培养参照Walker等[11]的方法并稍加改进。将8周龄C57BL/6小鼠脱颈处死,分离出SVZ,用0.25% Trypsin-EDTA在37 ℃条件下消化10 min,每间隔3 min轻摇1次,4 ℃ 500×g离心10 min后弃去上清液,加含有20 μg·L-1bFGF、20 μg·L-1EGF、10 mg·L-1ITSS和2% B27的神经干细胞培养液重悬,接种于12孔板中,每孔1.5 ml,放入5% CO2,37 ℃环境中培养,隔2~3 d传代1次。2~3代后将生长状态良好的悬浮培养的NSCs涂于poly-L-lysine、laminin预先包被的细胞培养皿上,加入NSCs培养液,放入5% CO2,37 ℃培养箱中贴壁培养,用于后续研究。
1.3.2NSCs的鉴定将NSCs单细胞悬液以每毫升1×105个细胞的密度涂于预先包被的细胞玻片上,待细胞贴壁良好使用4%多聚甲醛固定30 min,室温下用0.5% Triton X-100处理细胞15 min,1×PBS漂洗,1% BSA封闭30 min,加入Nestin一抗(1 ∶500),4 ℃孵育过夜。次日1×PBS漂洗后,加入FITC标记驴抗小鼠IgG(1 ∶250),室温孵育1 h,1×PBS漂洗,再用Hoechst 33342染核15 min,1×PBS漂洗,采用抗荧光淬灭封片。置于倒置荧光显微镜下观察,拍照。细胞克隆球的鉴定同上。
1.3.3CCK-8法检测NSCs的细胞增殖将NSCs制成单细胞悬液,以每孔7×103个细胞的浓度接种于96孔白板,加入不同浓度的毛蕊花糖苷(5、10、20、40 μmol·L-1)处理24 h,每组3个复孔。加入CCK-8试剂,继续在细胞培养箱中孵育3 h,于酶标仪的450 nm波长处测定各孔的吸光度(OD) 值。
1.3.4NSCs的BrdU染色将NSCs制成每毫升1×105个细胞的细胞悬液,接种于预先置有Poly-L-Lysine,Laminin包被的细胞玻片的24孔板中,贴壁后加入10 μmol·L-1的毛蕊花糖苷作用24 h,在毛蕊花糖苷作用18 h时加入BrdU。经4%多聚甲醛固定后,用盐酸变性,硼酸中和,然后以正常血清封闭。滴加BrdU多克隆抗体(1 ∶250),进行免疫组织化学染色,具体操作过程按照实验说明进行。光学显微镜下观察、拍照。随机抽取5张玻片,每张玻片200倍视野下随机选取4个视野, 计数阳性细胞总数(阳性率/%=阳性细胞数/总细胞数×100%)。1.3.5Western blot检测实验分为空白对照组、毛蕊花糖苷组和抑制剂组。其中,空白对照组加入0.1%的DMSO,毛蕊花糖苷组加入10 μmol·L-1毛蕊花糖苷,抑制剂组先加入10 μmol·L-1LY294002 阻断剂作用细胞 30 min后,再加入10 μmol·L-1毛蕊花糖苷。24 h后PBS(4 ℃)洗涤细胞3次(×5 min),加入细胞裂解液 150 μL于冰上裂解30 min,反复吹打使其充分裂解后移入1.5 mL EP管,10 000×g4 ℃离心5 min,收集上清液,BCA法测定蛋白浓度。每组取 25 μg的总蛋白,10% SDS-PAGE分离蛋白,用电转移法将蛋白质转移至PVDF膜, 5% BSA室温封闭2 h,分别加入兔抗小鼠Akt、p-Akt一抗(1 ∶1 000稀释),β-actin(1 ∶3 000稀释)4 ℃过夜;TBST洗涤3次(×5 min),加入HRP标记的羊抗鼠、羊抗兔二抗,37 ℃孵育2 h,洗膜3次(×5 min),化学发光法ECL显影。
1.4数据分析
以上实验均重复3 次,采用单因素方差分析(ANOVA)进行各组均数间的比较,并采用Dunnett Multiple Comparisons Test 判断差别。结果采用Graph Pad 5.0软件实施分析。图像利用Image J软件处理。
2结果
2.1NSCs的培养及鉴定
nestin,又称巢蛋白,属于第Ⅳ类中间丝蛋白,仅在胚胎早期神经上皮表达,出生后停止表达。在神经前体细胞最先表达的是nestin,一旦神经前体细胞朝向终末方向分化成神经元和胶质细胞后,nestin便停止表达,因此nestin被广泛用于NSCs的鉴定[12]。传代细胞克隆球或消化吹散成的单细胞经免疫荧光化学染色后结果显示(Fig 1),我们从成年C57BL6小鼠SVZ区分离培养的原代NSCs中nestin阳性细胞率达0.95,具有NSCs表型。
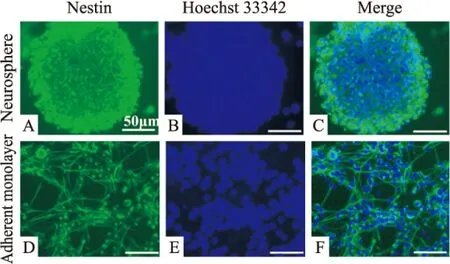
Fig 1 Identification of NSCs
The cultured cells were Nestin-positive(green). The nuclei were counterstained with Hoechst 33342(blue). The amount of Hoechst-stained cells represented the total cell number. A-C: Neurosphere was identified by the representative marker Nestin (green). D-F: Neural stem cells were identified by the representative marker Nestin (green) as adherent monolayer culture. Scale bar:50 μm.
2.2毛蕊花糖苷促进NSCs增殖
2.2.1在无有丝分裂原的情况下,不同浓度的毛蕊花糖苷均能促进NSCs增殖目前普遍认为,EGF和bFGF等有丝分裂原信号在神经干细胞的增殖和分化中起重要作用,均可以维持神经干细胞的自我更新能力[13]。为了明确毛蕊花糖苷对NSCs增殖的影响,我们撤除培养基中的有丝分裂原。CCK-8结果显示,与对照组相比,有丝分裂原组(含EGF和bFGF)和毛蕊花糖苷组的NSCs增殖活性均明显升高(P<0.01),说明有丝分裂原和毛蕊花糖苷均能促进NSCs的增殖。并且10 μmol·L-1的毛蕊花糖苷处理NSCs 24 h后其增殖活性明显高于有丝分裂原组(P<0.01),而5、20、40 μmol·L-1的毛蕊花糖苷处理组与有丝分裂原组相比差异无统计学意义(P>0.05),见Fig 2。提示,在有丝分裂原缺失的条件下,不同浓度的毛蕊花糖苷仍可促进NSCs的增殖。
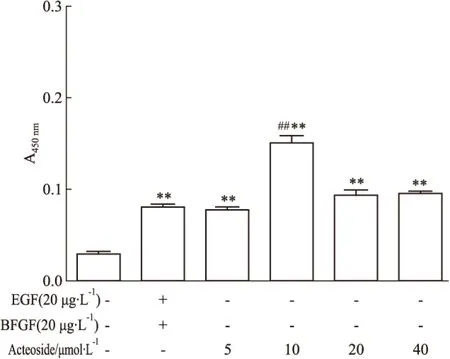
Fig 2 Effects of different concentrations of acteoside on NSCs proliferation in absence of mitogen for 24 h
**P<0.01vscontrol;##P<0.01vspositive control
2.2.2毛蕊花糖苷组BrdU阳性NSCs我们对NSCs进行 BrdU标记,进行免疫细胞化学染色,如Fig 3中箭头所示,细胞核呈黄棕色染色的细胞为BrdU阳性细胞。与对照组相比,毛蕊花糖苷组BrdU阳性细胞明显增多(P<0.01,Fig 3)。
2.3毛蕊花糖苷对Akt磷酸化的影响
Western blot结果表明,毛蕊花糖苷可以明显上调NSCs中p-Akt的表达(P<0.01)。然而,加入Akt通路抑制剂LY294002后,毛蕊花糖苷对p-Akt表达的上调作用可被阻断(Fig 4)。
3讨论
成年脑内的NSCs处于静止状态,在神经系统损伤或者某些因素刺激后,内源性NSCs被激活,大量增殖并在某些趋化因子作用下迁移至病损部位,因此可应用于帕金森病、脊髓损伤、脑血管疾病等的治疗[14]。NSCs疗法包括外源性干细胞移植和内源性干细胞诱导两种。近年来国内外有很多用NSCs移植治疗神经系统疾病的动物模型,虽然可有效地改善患者的症状,但成体NSCs难以获得,并且对其分化和功能修复机制还不清楚,移植后的细胞能否与体内损伤细胞相整合,建立起正常的神经系统突触联系还需进一步研究。另外,NSCs的诱导分化及其移植是否存在社会学和伦理学方面的问题还有待考证。因此,用药物诱导内源性NSCs,即通过药物来调节自身的NSCs增殖与定向分化潜能,以重建受损的功能细胞,恢复其生物学功能,成为当今治疗神经系统疾病的首选[15]。

Fig 3 Effect of acteoside on BrdU positive cells
**P<0.01vscontrol
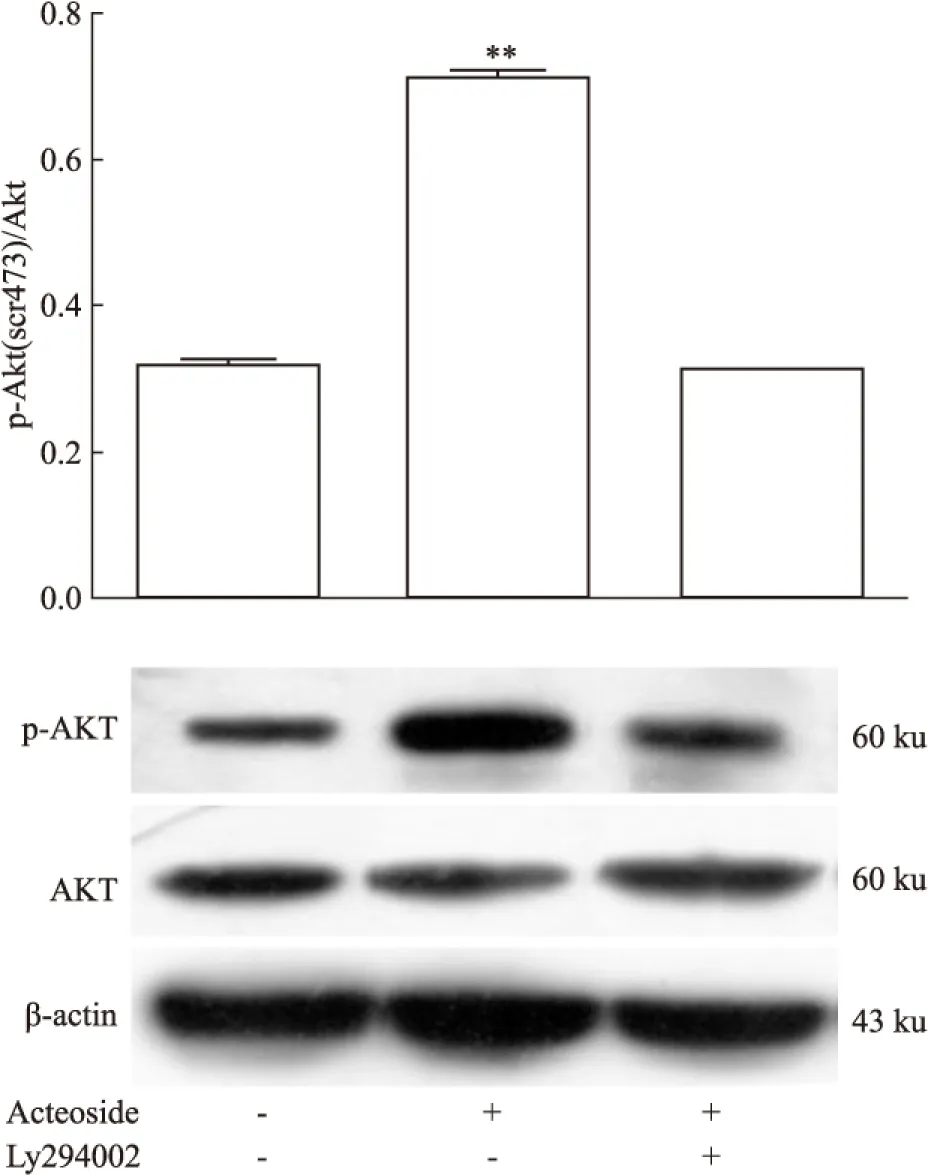
Fig 4 Western blot analysis of p-AKT
EGF和bFGF等有丝分裂原信号在神经干细胞的增殖和分化中起重要作用。成年啮齿动物脑内灌注EGF或bFGF均能引起SVZ区域细胞的增殖,但是对细胞的分化有不同的影响。EGF灌注刺激胶质细胞的产生,但神经元的产生很少,而bFGF灌注可增加神经元数量[13]。本实验利用成年小鼠SVZ区分离培养的原代NSCs,观察毛蕊花糖苷对其增殖的影响,结果表明在无EGF和bFGF的情况下,毛蕊花糖苷能促进体外培养的NSCs增殖,并且毛蕊花糖苷对NSCs增殖的影响具有浓度依赖性,并随毛蕊花糖苷浓度的升高对NSCs增殖的作用不明显,且促进NSCs增殖的作用浓度为10 μmol·L-1。但是,由于有丝分裂原组bFGF、EGF 所用浓度为20 μg·L-1,而药物有效的浓度是10 μmol·L-1,因此并不能简单的从药物剂量上来进行分析。毛蕊花糖苷对于NSCs分化的影响还有待于进一步的研究。
PI3K/Akt通路是经典的与细胞增殖和存活密切相关的信号通路,它对于NSCs的活动也具有重要作用。PI3K/Akt通路能够调控内源性NSCs的增殖、分化和迁移[16]。研究表明,NSCs中Akt的过表达能够增强细胞增殖而减少细胞分化。在成年NSCs中,Akt也能够通过与其他生长因子或配体如bFGF、shh结合被激活[17]。因此,我们进一步考察了毛蕊花糖苷对PI3K/Akt 信号通路的作用。结果显示,毛蕊花糖苷能明显提高p-Akt的表达,而在加入 PI3K/Akt信号通路阻断剂LY294002后,这一作用被阻断。
本研究首次从毛蕊花糖苷促进原代NSCs增殖的角度阐释其类似神经营养因子活性,为毛蕊花糖苷在临床治疗神经系统疾病的应用提供实验依据。
(致谢:本实验在天津国际生物医药联合研究院,中药新药研发中心完成。感谢王彧、邵瑞、韩立峰、朱彦、高秀梅、韩静、段伟兵等在实验上提供的支持与帮助。)
参考文献:
[1]Gustafsson E,Andsberg G,Darsalia V,et al.Anterograde delivery of brain-derived neurotrophic factor to striatum via nigral transduction of recombinant adeno-associated virus increases neuronal death but promotes neurogenic response following stroke[J].EurJNeurosci,2003,17(12):2667-78.
[2]张喻,肇玉明,王晓良,彭英. 干细胞治疗阿尔茨海默病的研究进展及挑战[J]. 中国药理学通报,2015,31(7):889-94.
[2]Zhang Y,Zhao Y M,Wang X L,Peng Y. Advance and challenges in stem cell therapy for Alzheimer’s disease[J].ChinPharmacolBull,2015,31(7):889-94.
[3]Ming G L,Song H. Adult neurogenesis in the mammalian brain:significant answers and significant questions[J].Neuron,2011,70(4):687-702.
[4]柴丽娟,钟佩茹,周志焕,等.黄芪甲苷对体外神经干细胞增殖作用影响的研究[J]. 中国药理学通报,2010,26(5):670-3.
[4]Chai L J,Zhong P R,Zhou Z H,et al. Proliferation effects of astragaloside on neural stem cellsinvitro[J].ChinPharmacolBull,2010,26(5):670-3.
[5]Alipieva K,Korkina L,Orhan I E,Georgiev M I. Verbascoside-a review of its occurrence,(bio)synthesis and pharmacological significance[J].BiotechnolAdv,2014,32(6):1065-76.
[6]Sheng G Q,Zhang J R,Pu X P,et al. Protective effect of verbascoside on 1-methyl-4-phenylpyridinium ion-induced neurotoxicity in PC12 cells[J].EurJPharmacol,2002,451(2):119-24.
[7]Koo K A,Sung S H,Park J H,et al.Invitroneuroprotective activities of phenylethanoid glycosides from Callicarpa dichotoma[J].PlantaMed,2005,71(8):778-80.
[8]邓敏,鞠晓东,樊东升,等.毛蕊花苷对MPP+诱导的SHSY5Y细胞凋亡的保护作用[J]. 中国药理学通报,2008,24(10):1297-302.
[8]Deng M,Ju X D,Fan D S,et al.Verbascoside rescues the SHSY5Y neuronal cells from MPP+-induced apoptosis[J].ChinPharmacolBull,2008,24(10):1297-302.
[9]Pu X,Song Z,Li Y,et al. Acteoside from Cistanche salsa inhibits apoptosis by 1-methyl-4-phenylpyridinium ion in cerebellar granule neurons[J].PlantaMed,2003,69(1):65-6.
[10]Lee K Y,Jeong E J,Lee H S,Kim Y C. Acteoside of Callicarpa dichotoma attenuates scopolamine-induced memory impairments[J].BiolPharmBull,2006,29(1):71-4.
[11]Walker T L,Kempermann G. One mouse,two cultures:Isolation and culture of adult neural stem cells from the two neurogenic zones of individual mice[J].JVisExp,2014,(84):e51225.
[12]Rietze R L,Valcanis H,Brooker G F,et al. Purification of a pluripotent neural stem cell from the adult mouse brain[J].Nature,2001,412(6848):736-9.
[13]Kuhn H G,Winkler J,Kempermann G,et al. Epidermal growth factor and fibroblast growth factor-2 have different effects on neural progenitors in the adult rat brain[J].JNeurosci,1997,17(15):5820-9.
[14]成薇,沈长波,王莉,等. 白藜芦醇预处理对氧糖剥夺/再复氧损伤大鼠皮质神经干细胞增殖的影响[J].中国药理学通报,2015,31(1):113-8.
[14]Cheng W,Shen C B,Wang L,et al. Effect of resveratrol pretreatment on proliferation of cortical neural stem cells after oxygen-glucose deprivation/reoxygenation injury in rats[J].ChinPharmacolBull,2015,31(1):113-8.
[15]Aboody K S,Najbauer J,Metz M Z,et al.Neural stem cell-mediated enzyme/prodrug therapy for glioma:preclinical studies[J].SciTranslMed,2013,5(184):184ra59.
[16]Koh S H,Lo E H. The role of the PI3K pathway in the regeneration of the damaged brain by neural stem cells after cerebral infarction[J].JClinNeurol,2015,11(4):297-304.
[17]Rafalski V A,Brunet A. Energy metabolism in adult neural stem cell fate[J].ProgNeurobiol,2011,93(2):182-203.
Acteoside promotes proliferation of neural stem cells from adult mice by activating PI3K/AKT pathway
LIN Hui-min1,2,DUAN Wei-bing1,2,SHAO Rui1,2,HAN Li-feng1,ZHU Yan1,2,GAO Xiu-mei1,WANG Yu1,2
(1.TianjinKeyLaboratoryofModernChineseMedicine,TianjinUniversityofTraditionalChineseMedicine,Tianjin300193,China;2.ResearchandDevelopmentCenterofChineseMedicine,TianjinInternationalJointAcademyofBiotechnologyandMedicine,Tianjin300457,China)
Abstract:AimTo clarify the effect of acteoside on proliferation of neural stem cells(NSCs) from adult mice,as well as the involved signaling pathway.MethodsNSCs were isolated from the subventricular zone(SVZ) of adult C57BL/6 mice,then identified by immunofluorescence staining with Nestin,the marker of NSCs. NSCs were exposed to acteoside(5,10,20,40 μmol·L-1)in absence of mitogen(EGF/bFGF)for 24 h. We employed CCK8 assay to detect NSCs viability and BrdU staining to identify NSCs proliferation. We performed Western blot to quantify the expression level of p-Akt induced by acteoside on NSCs.ResultsWithout mitogen,acteoside increased NSCs proliferation by activating p-Akt,which can be blocked by LY294002,the inhibitor of PI3K/AKT signaling pathway.ConclusionActeoside promotes the proliferation of NSCs from adult mice by activating PI3K/AKT pathway.Key words:acteoside;adult mice;neural stem cells(NSCs);the subventricular zone(SVZ);proliferation;Akt pathway
收稿日期:2016-01-29,修回日期:2016-03-02
基金项目:天津市应用基础与前沿技术研究计划一般项目(No 14JCYBJC42900)
作者简介:林慧敏(1992-),女,硕士,研究方向:神经干细胞增殖与分化,E-mail:272996204@qq.com;
doi:10.3969/j.issn.1001-1978.2016.06.019
文献标志码:A
文章编号:1001-1978(2016)06-0836-05
中国图书分类号:R-332;R284.1;R322.81;R329.24
网络出版时间:2016-5-25 15:39网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160525.1539.038.html
王彧(1981-),女,博士,副教授,硕士生导师,研究方向:神经干细胞增殖与分化,通讯作者,E-mail:wangyu@tjutcm.edu.cn
