食管癌放化疗中循环肿瘤细胞的变化及其临床意义
2016-06-30许刚王燕王承伟吴朝阳
许刚 王燕 王承伟 吴朝阳
食管癌放化疗中循环肿瘤细胞的变化及其临床意义
许刚王燕王承伟吴朝阳
摘要目的:探讨局部晚期食管癌放化疗中循环肿瘤细胞(circulating tumor cells,CTCs)的动态变化,以及CTCs与食管癌临床特征和预后的相关性分析。方法:利用免疫磁珠富集联合免疫荧光检测2011年5月至2013年5月江苏大学附属人民医院48例局部晚期食管癌患者放化疗前后的循环血肿瘤细胞,对比分析放化疗前后的动态变化,并分析循环肿瘤细胞与患者临床特征及2年生存率的关系。结果:循环血肿瘤细胞与肿瘤侵犯程度、淋巴结转移状态及临床分期均显著相关(P<0.05),治疗前循环血肿瘤细胞阳性率为52.1%(25/48),治疗结束后为20.8%(10/48),差异具有统计学意义(P<0.01)。放化疗前后的循环肿瘤细胞均与患者的2年生存率密切相关(P<0.05),Cox回归分析提示临床分期及放化疗后循环血肿瘤细胞水平是食管癌患者的独立预后因子。结论:循环肿瘤细胞可以反映局部晚期食管癌患者的疾病进展程度,并且可以作为判断预后的指标。
关键词食管鳞癌同步放化疗循环肿瘤细胞预后分析
作者单位:江苏大学附属人民医院肿瘤放疗科(江苏省镇江市212002)
循环肿瘤细胞(circulating tumor cells,CTCs)被认为是肿瘤转移的重要因素之一,在许多恶性肿瘤的诊断以及预后中具有重要价值[1-2]。有报道显示食管鳞癌患者放疗后CTCs阳性率较治疗前下降并与预后密切相关[3],但食管癌的非手术治疗方式主要为同步放化疗,有关同步放化疗前后的CTCs的动态变化仍鲜见报道。本研究采用免疫磁珠负性富集和免疫荧光染色技术检测食管鳞癌患者外周血CTCs,测定其放化疗过程中的动态变化,对CTCs与食管鳞癌患者的预后进行相关性分析。
1 材料与方法
1.1 临床资料
选取2011年5月至2013年5月江苏大学附属人民医院48例初治食管鳞癌患者的临床资料,其中男性31例,女性17例,年龄46~72岁,中位年龄58岁。入组标准:局部晚期(除T1N0M0和M1b,AJCC2009);ECOG评分0~2分;预期生存期>3个月;明确的食管鳞癌病理诊断;无严重内科疾病。排除标准:食管穿孔;恶病质;远处转移;病理为非鳞癌。
1.2 方法
1.2.1 治疗方案放疗设备为西门子医用直线加速器,均采用三维适形放疗技术,处方剂量为1.8~2 Gy/次,5次/周,总剂量61.2~62 Gy。同步化疗方案采用顺铂联合氟尿嘧啶,具体为氟尿嘧啶1 800 mg/m2静脉泵入维持72 h,顺铂25 mg/m2(第1~3天),每4周1个疗程,共化疗4周期。
1.2.2 CTC的检测于放化疗前1天、放化疗开始后2、4、6周以及放化疗结束后1天分别采集入组食管鳞癌患者清晨空腹外周静脉血10 mL。用红细胞裂解液去除红细胞,用Militenyi免疫磁珠去除白细胞,富集上皮来源的稀有细胞,利用免疫荧光染色技术鉴定CTCs。CTCs判定标准:1)细胞体积:大于周围白细胞;2)细胞核:DAPI染色明亮、核较大或小,核浆比例较大,核分裂增多及病理性核分裂,多核巨细胞;3)标记物免疫荧光染色:胞浆抗CK8/18/19(+)、CD45 (-)。选定CTCs>3个作为评价标准[4-5]。患者标本的使用经伦理委员会认可。
1.2.3 随访48例患者均完成随访,无失访患者。在治疗结束后2年内每3个月随访1次,随访内容包括食管钡餐、胸部CT及腹部B超,每6个月复查胃镜及上腹部CT。末次随访时间为2016年1月20日,中位随访时间26个月。随访方式包括门诊复诊与电话随访。观察近期疗效及远期生存,随访率100%。
1.3 统计学分析
采用SPSS15软件进行统计分析。计量资料采用χ2检验,生存率采用Kaplan-Meier方法,Log rank检验差别显著性。Cox回归分析评估参考数的预后意义,P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料与CTCs的相关性分析
T、N分期及临床分期与CTCs有明显的相关性,其中T1+T2及T3+T4的阳性率分别为31.8%(7/22)、69.2%(18/26),N0+N1及N2+N3的阳性率分别为23.8% (5/21)、74.1%(20/27)。Ⅱ及Ⅲ期的阳性率分别为34.7%(8/23)、68%(17/25),结果显示T、N分期及临床分期越高,CTCs阳性率越高,差异具有统计学意义(P<0.05),而性别、年龄、发病部位均与CTCs无相关性(表1)。
2.2 同步放化疗过程中的CTCs的动态变化
同步放化疗开始前有25例患者的CTCs检测呈阳性,同步放化疗过程中CTCs阳性率逐步下降,放化疗结束后仍有10例患者呈阳性。具体为同步放化疗前CTCs阳性率为52.1%(25/48),放化疗2周为47.9% (23/48)、4周为31.3%(15/48)、6周为22.9%(11/48),放化疗后为20.8%(10/48),从放化疗4周开始差异具有统计学意义(表2)。

表1 患者一般资料与CTCs的相关性分析比较Table 1 Correlation analysis between clinical characteristics and CTCs
2.3 CTCs阳性率与预后的分析
随访两年后所有患者的2年生存率为62.5%,放化疗前CTCs阳性患者的2年生存率为52.0%,CTCs阴性患者生存率73.9%(χ2=5.694,P=0.017);放化疗后CTCs阳性患者的2年生存率仅为30.0%,而CTCs阴性患者则为71.1%(χ2=6.295,P=0.012)。放化疗前后CTCs阳性与CTCs阴性的患者2年生存率相比差异具有统计学意义(均P<0.05,图1,2)。进一步行Cox回归分析提示临床分期及放化疗后循环血肿瘤细胞水平是食管癌患者的独立预后因子(表3)。

表2 同步放化疗前后CTCs阳性率的变化Table 2 Positive rates of CTCs before and after chemoradiotherapy

表2 同步放化疗前后CTCs阳性率的变化(续表2)Table 2 Positive rates of CTCs before and after chemoradiotherapy

图1 放化疗前CTCs阳性与生存率的关系Figure 1 Correlation between CTCs and overall survival before chemoradiotherapy
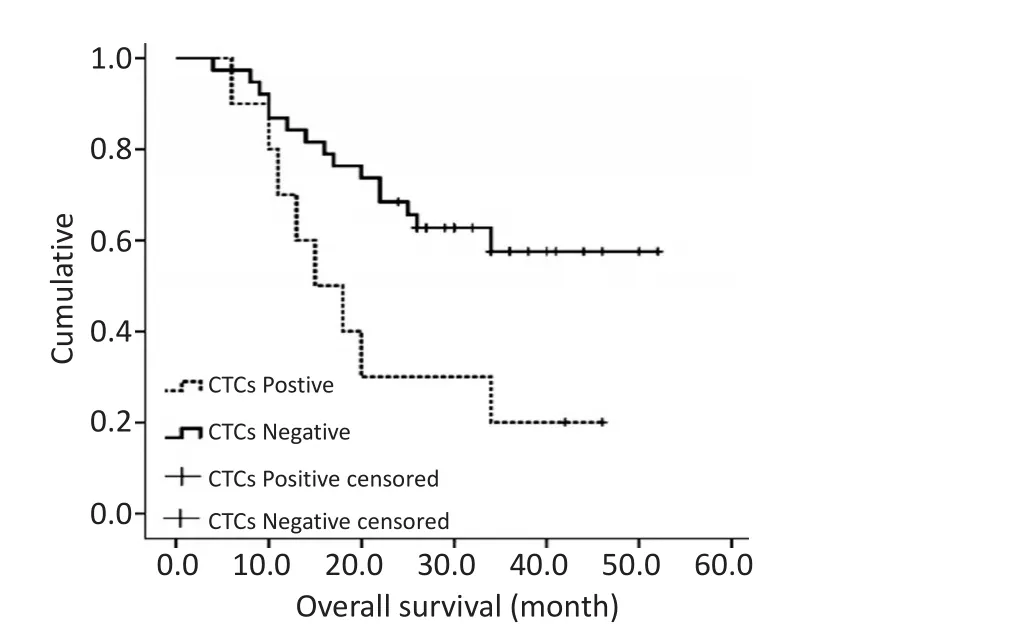
图2 放化疗后CTCs阳性与生存率的关系Figure 2 Correlation between CTCs and overall survival after chemoradiotherapy

表3 食管癌患者2年生存率的Cox回归分析Table 3 Cox regression analysis of two-year survival rate of patients with esophageal cancer
3 讨论
目前同步放化疗已成为食管癌非手术治疗的标准治疗方案,2015年第三版NCCN指南中食管癌根治性同步放化疗的放疗剂量为50~50.4 Gy,国内常用剂量为60 Gy,但是局控仍不令人满意,有文献报道在食管癌的同步放化疗中,放疗剂量的增加与局控呈正相关[6],剂量>60 Gy则局控更佳[7]。故本研究中采用的剂量为61.2~62 Gy。
目前CTCs常被用于评价肿瘤患者复发转移的风险及预后分析。但血液循环中肿瘤细胞数量极少,检测困难,尚无标准的CTCs检测方法。常用的CTCs检测主要包括细胞计数法及核酸检测法[8-9],前者是免疫细胞化学及流式细胞术,后者主要包括聚合酶链反应技术和逆转录聚合酶链式反应。核酸检测法检测的是DNA或mRNA,不能进行形态学观察;由于取样时污染、假基因干扰等因素均可造成假阳性。与核酸检测技术相比,基于细胞学的免疫富集方法,既可分离肿瘤细胞,又可进一步分析细胞表型。故本研究采用细胞计数法进行CTCs检测。放化疗前总体检出率为52.1%,与文献报道一致[10]。
有报道显示食管癌患者治疗前CTCs水平与TNM分期相关,但是结论并不完全一致,李军等[11]的研究显示CTCs阳性水平与肿瘤与细胞分化程度、淋巴结转移及临床分期密切相关,与T分期无明显相关性。袁东红等[12]的研究显示CTCs水平与肿瘤细胞的分化程度、T分期、淋巴结转移及临床分期均明显相关。国外Matsushita等[13]的研究显示CTCs水平仅与远处转移及临床分期相关,与T分期及淋巴结均无明显相关。本研究显示CTCs与T分期、淋巴结转移及临床分期均明显相关,与年龄、性别及发病部位无明显相关。结果不一致与CTCs检测方法不同以及样本量不同有关,但总体反映了CTCs阳性水平与肿瘤的恶性程度相关。
CTCs在食管癌治疗前后的改变亦有文献报道,手术李军等[11]报道显示食管癌患者术后CTCs总体水平较术前下降,但有5例患者术前阴性而术后转为阳性,考虑与肿瘤大小及手术操作有关,有报道显示手术可能会引起CTCs入血[14]。食管癌放疗后亦可引起CTCs水平下降,Yin等[3]报道CTCs水平由放疗前的69.4%降到放疗后的55.5%。本研究显示同步放化疗前的CTCs阳性率为52.1%,同步放化疗后为20.8%,显示同步放化疗较单纯放疗CTCs水平下降明显,分析原因认为首先是化疗的介入起到了放疗增敏的作用,提高了原发病灶的局控,另一方面是化疗直接杀死了部分CTCs。另有文献报道CTCs阳性水平与食管癌预后亦密切相关,CTCs水平越高患者预后越差,尤其是治疗结束后的CTCs水平[14-16]。本研究结果显示治疗前后的CTCs阳性患者2年生存率均较CTCs阴性的患者明显下降,与文献报道一致,进一步的Cox回归分析表明临床分期及放疗后CTCs是食管癌同步放化疗的独立预后因子,所以CTCs水平可以作为食管癌患者预后监测指标。
综上所述,本研究显示CTCs水平可以反映食管癌的恶性程度,与肿瘤的TNM分期密切相关。同步放化疗后CTCs水平较前明显下降,而且放化疗后的低CTCs水平患者预后更好。这一结果显示监测CTCs水平在食管癌的诊断、治疗及预后分析中均占有重要的地位。由于目前CTCs检测技术水平有限,仍有假阳性及假阴性结果存在,影响了这一技术在临床上的应用,未来的发展方向是提高CTCs检测的技术水平,这将会在食管癌的个体化治疗中发挥重要作用。
参考文献
[1]Masuda T,Hayashi N,Iguchi T,et al.Clinical and biological significance of circulating tumor cells in cancer[J].Mol Oncol,2016,10 (3):408-417.
[2]Joosse SA,Gorges TM,Pantel K.Biology,detection,and clinical implications of circulating tumor cells[J].EMBO Mol Med,2014,7(1): 1-11.
[3]Yin XD,Yuan X,Xue JJ,et al.Clinical significance of carcinoembryonic antigen-,cytokeratin 19-,or survivin-positive circulating tumor cells in the peripheral blood of esophageal squamous cell carcinoma patients treated with radiotherapy[J].Dis Esophagus,2012,25 (8):750-756.
[4]Mavroudis D.Circulating cancer cells[J].Ann Oncol,2010,21(Suppl7):vii95-100.
[5]CraigMiller M,Doyle GV,Temtappen LW.Significance of circulating tumor cells detected by the cellsearch system in patients witlI metastatie breast cotorectat and prostate cancer[J].J Oncol,2010,2010:617421.
[6]Zhang Z,Liao Z,Jin J,et al.Dose-response relationship in locorgional control for patients with stage II-III esophageal cancer treated with concurrent chemotherapy and radiotheraphy[J].Int J Radiat Oncol Biol Phys,2005,61(3):656-664.
[7]Suh YG,Lee IJ,Koom WS,et al.High-dose versus standard-dose radiotherapy with concurrent chemotherapy in stages II-III esophageal cancer[J].Jpn J Clin Oncol,2014,44(6):534-540.
[8]Ferreira MM,Ramani VC,Jeffrey SS.Circulating tumor cell technologies[J].Mol Oncol,2016,10(3):374-394.
[9]Song YJ,Ji L,Yang L.Advances in techniques for Detecting circulating tumor cells[J].Chin J Clin Oncol,2012,39(22):1859-1863.[宋英健,纪玲,杨林.循环肿瘤细胞检测技术的研究进展[J].中国肿瘤临床,2012,39(22):1859-1863.]
[10]Bobek V,Matkowsk R,Gürlich R,et al.Cultivation of circulating tumor cells in esophageal cancer[J].Folia Histochem Cytobiol,2014,52(3):171-177.
[11]Li J,Wang W,Qiao YY,et al.Detection of circulating tumor cells from peripheral blood in patients with esophageal squamous cell carcinoma and its clinical significance[J].Chin J Thorac Cardiovasc Surg,2012,28(3):157-160.[李军,王伟,乔媛媛,等.食管鳞癌患者外周血循环肿瘤细胞检测及临床意义[J].中华胸心血管外科杂志,2012,28(3):157-160.]
[12]Yuan DH,Wang F,Chen XM.Detection of circulating tumor cells in peripheral blood of patients with esophageal squamous cell carcinoma and its clinical significance[J].Pract J Cancer,2015,30(4):494-496.[袁东红,王芳,陈雪梅.食管鳞癌外周血循环肿瘤细胞检测及其临床意义[J].实用癌症杂志,2015,30(4):494-496.]
[13]Matsushita D,Uenosono Y,Arigami T,et al.Clinical significance of circulating tumor cells in peripheral blood of patients with esophageal squamous cell carcinoma[J].Ann Surg Oncol,2015,22(11): 3674-3680.
[14]Godfrey TE,Raja S,Finkelstein SD,et al.Prognostic value of quantitative reverse transcription- polymerase chain reaction in lymph nodenegative esophageal cancer patients[J].Clin Cancer Res,2001,7(12): 4041-4048.
[15]Reeh M,Effenberger KE,Koenig AM.Circulating tumor cells as a biomarker for preoperative prognostic staging in patients with esophageal cancer[J].Ann Surg,2015,261(6): 1124-1130.
[16]De Mattos-Arruda L,Olmos D,Tabernero J.Prognostic and predictive roles for circulating biomarkers in gastrointestinal cancer[J].Future Oncol,2011,7(12):1385-1397.
(2016-03-07收稿)
(2016-04-17修回)
(编辑:武斌校对:张亻抿)

Changes of circulating tumor cells in locally advanced esophageal squamous cell carcinoma patients treated with concurrent chemoradiotherapy
Gang XU,Yan WANG,Chengwei WANG,Chaoyang WU
Correspondence to: Chaoyang WU;E-mail: wuchaoyang9@163.com
Department of Radiation Oncology,Jiangsu University Affiliated People's Hospital,Zhenjiang 212002,China
AbstractObjective: To investigate the changes of circulating tumor cells in locally advanced esophageal squamous cell carcinoma patients treated with concurrent chemoradiotherapy.The effect of these alterations on the patients'prognosis was also analyzed.Methods: Circulating tumor cells were detected by immunomagnetic enrichment and fluorescence in 48 cases of locally advanced esophageal carcinoma patients treated with concurrent chemoradiotherapy.The dynamic changes of circulating tumor cells were compared between pre- and post-chemoradiotherapy.Moreover,the association of these changes with the clinical characteristics and two-year survival rate were analyzed.Results: The positive rate of circulating tumor cells was closely associated with the T stage,lymph node metastasis,and clinical stage(P<0.05),and the positive rates in pre- and post-chemoradiotherapy were 52.1%(25/48)and 20.8%(10/ 48),respectively.The difference was statistically significant(P<0.05).Kaplan-Meier analysis showed that the positive rate of circulating tumor cells predicted an adverse two-year survival rate in both pre- and post-chemoradiotherapy(P<0.05).Cox regression analysis showed that the clinical stage and circulating tumor cells after concurrent chemoradiotherapy were independent prognostic factors in the patients with esophageal carcinoma.Conclusion: Circulating tumor cells can reflect the disease progression in patients with locally advanced esophageal cancer.These cells can also predict the prognosis of esophageal cancer patients treated with concurrent chemoradiotherapy.
Keywords:esophageal squamous cell carcinoma,concurrent chemoradiotherapy,circulating tumor cells,prognosis analysis
doi:10.3969/j.issn.1000-8179.2016.09.251
通信作者:吴朝阳wuchaoyang9@163.com
作者简介
许刚专业方向为食管癌的放射治疗及预后分析。
E-mail:xugang1981@126.com
·MDT论坛·
