三七黑斑病病原菌的复核鉴定
2016-06-27黄宏强范小燕陶亚群鲁红学邓建新
黄宏强,范小燕,陶亚群,鲁红学,邓建新
(长江大学农学院,湖北,荆州 434025)
三七黑斑病病原菌的复核鉴定
黄宏强,范小燕,陶亚群,鲁红学,邓建新
(长江大学农学院,湖北,荆州 434025)
[摘要]利用单孢分离法,从云南文山三七(Panax notoginseng)叶片上分离获得黑斑病病原链格孢菌。对所获得的供试菌株进行形态学鉴定,同时利用ITS、Alt a1、gpd、BT2和RPB2等5个基因的序列进行系统发育分析研究。结果表明,三七黑斑病病原菌为Alternaria panacis Whetzel。
[关键词]三七(Panax notoginseng);链格孢菌;形态鉴定;系统发育分析
三七(Panaxnotoginseng(Burk.) F.H.Chen)又称田七,是一种五加科(Araliaceae)名贵药用植物,主产于我国云南。黑斑病是中国三七主产区的主要病害之一,危害植株的各个部分,受害叶片常形成圆形或不规则水浸状褐色病斑,受害叶柄、茎秆产生黑褐色病斑,常造成落叶、干花、不能结实、植株折垂而枯死,一般发病率为25%~35%,严重时可达90%以上,导致减产[1~3]。基于形态学研究发现,所有已报道的五加科植物(包括三七、人参、西洋参、鹅掌柴、八角金盘、刺五加、黄漆木、辽东楤木等)黑斑病病原菌均为链格孢菌大孢子种人参链格孢(AltemariapanaxWhetzel)[4~6]。
人参链格孢的分生孢子形态容易受到培养基质、培养条件(温度、湿度和光照等)及孢子成熟度影响而发生改变[7,8],该菌分类鉴定仅依据孢子形态不是很可信的,必须综合形态学、分子系统学、生物化学及生理学等相关信息来进行分析[9]。Deng等[10]对多种五加科植物的链格孢菌进行形态学及分子系统学比较研究后,发现五加科植物黑斑病病原链格孢菌存在3个种类:Alternariaaraliae、A.dendropanacis和A.panacis。但这些研究中并未包含分离自三七黑斑病的菌株。为此,本研究从形态学和分子系统学2个方面对三七黑斑病病原链格孢菌进行复核鉴定,旨在进一步明确其分类地位。
1材料与方法
1.1试验材料1.1.1菌种来源
将2015年4月采自云南文山的新鲜三七黑斑病病叶保湿培养后,通过无菌玻璃针进行单孢分离,将分离获得的菌种保存于长江大学植物病理实验室,菌株编号为YZU 151074。
1.2.1培养基
马铃薯葡萄糖培养基(potato dextrose agar,PDA):马铃薯葡萄糖汤粉(potato dextrose broth,Difco,美国)24g,琼脂20g,水1000mL。
马铃薯胡萝卜培养基(potato carrot agar,PCA):马铃薯20g,胡萝卜20g,琼脂20g,水1000mL。
1.2试验方法1.2.1形态观察
菌落形态:从PDA培养基上培养3~5d的菌落边缘取菌龄一致的菌饼(直径6mm),接种于含PDA培养基的90mm培养皿上,在无光照的条件下,置于25℃培养。培养7d后,观察菌落形态、有无色素分泌,并测量菌落大小(直径)。
孢子形态:将病原菌菌丝接种于PCA培养基中,在光照为8h/d、温度为22℃的条件下培养[5]。培养7d后,观察产孢方式、分生孢子形态,随机测量50个分生孢子的大小。
1.2.2分子系统发育分析
从PDA培养基上培养5~7d的菌落上刮取菌丝团块,冷冻干燥后,低温保存备用。DNA的提取主要参考Park等[11]的方法。PCR扩增和测序所用引物为:ITS5和ITS4[12]、Bt2a和Bt2b[13]、gpd1和gpd2[14]、Alt a1-for和Alt a1-rev[15]、RPB2-6F和RPB2-7cR[16],均由南京金斯瑞生物科技有限公司提供。利用体积为20μL的2×Taq预混PCR反应体系(Genstar,北京康润诚业生物科技有限公司),反应条件参考文献[8]。扩增产物用2%的琼脂糖凝胶、0.5倍TBE的缓冲液进行电泳,利用新型核酸染料(GoldenView,北京博迈德基因技术有限公司)进行结果检测,并对已扩增好的产物利用Cyle-Pure Kit(200)纯化试剂盒(E.Z.N.A.,Omega Bio-tek,美国)进行纯化。纯化产物直接送到南京金斯瑞生物技术有限公司,用正反2个引物在ABI3730测序仪上进行测序。
利用正反两向序列互补连接后的完整序列,在GenBank中进行同源序列查找,尽可能选择模式菌株或权威菌株,确保所构建系统发育树的可靠性。对所要分析的核苷酸序列输入到Mega V5.03软件后,应用ClustalW程序对单个基因序列进行校排(alignment),随后将构建系统发育树的多个基因序列逐个进行连接合并,使每个菌株的多个基因序列形成一条核苷酸链。用Mega V5.03软件中的ML(Maximum Likelihood)方法生成系统发育树,对所构建的系统发育树进行重复1000次的自举分析(bootstrap)来估算分支的支持率,并将Stemphyliumlycopersici设为组外对照。
2结果与分析
2.1形态学
菌落形态:在PDA培养基上,生长7d的病原菌菌落呈圆形,平铺,白色至浅灰色,菌丝质地柔和似棉花状,菌落背面由边缘浅灰色渐变至中间深褐色,菌落大小为52~56mm(图1A)。
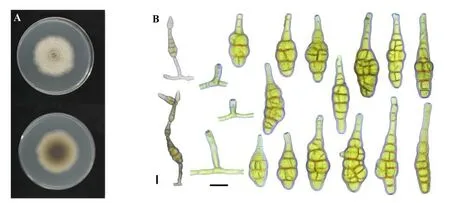
图1 三七黑斑病病原菌在PDA培养基上的菌落特征(A)和在PCA培养基上的产孢方式、分生孢子梗及分生孢子形态(B)
孢子形态:在PCA培养基上,培养7d后,分生孢子梗单生,直立或略弯曲,褐色,长度变化大,一般为15~50μm×5~7μm,有0~3个横隔。分生孢子单生或串生(常见2~6个分生孢子)于分孢子梗上,呈倒棍棒状,黄褐色至褐色,孢身25~70μm×10~25μm,有1~8个横隔,横隔间常见0~3个纵膈或斜隔,隔膜处常隘缩,表面光滑,成熟的分生孢子表面常有小的疣状突起,孢身上部逐渐延伸成为长短不等的喙,呈柱状或锥状,长约15~40μm(图1B)。
综合菌落和分生孢子的形态,将供试菌株YZU 151074与已报道的五加科植物黑斑病病原链格孢菌比较,确定为三七黑斑病病原菌,种名应为Alternariapanacis(表1)。

表1 三七黑斑病病原菌与已报道的五加科植物链格孢菌的形态学比较
2.2分子系统学
供试菌株YZU 151074的ITS、BT2、gpd、Alt a1和RPB2基因序列分别约500、290、530、450bp和750bp。将测定的序列提交GenBank,其登陆号见表2。序列分析发现供试菌株的ITS基因序列(KU881907)与已报道的五加科植物链格孢菌的100%相同,因此选用4个基因序列(BT2、gpd、Alt a1和RPB2)组合起来,共1957bp,以7个相似种的12链格孢菌株为参照,构建系统发育树(图2),系统发育分析表明,供试菌株三七黑斑病病原菌为Alternariapanacis。
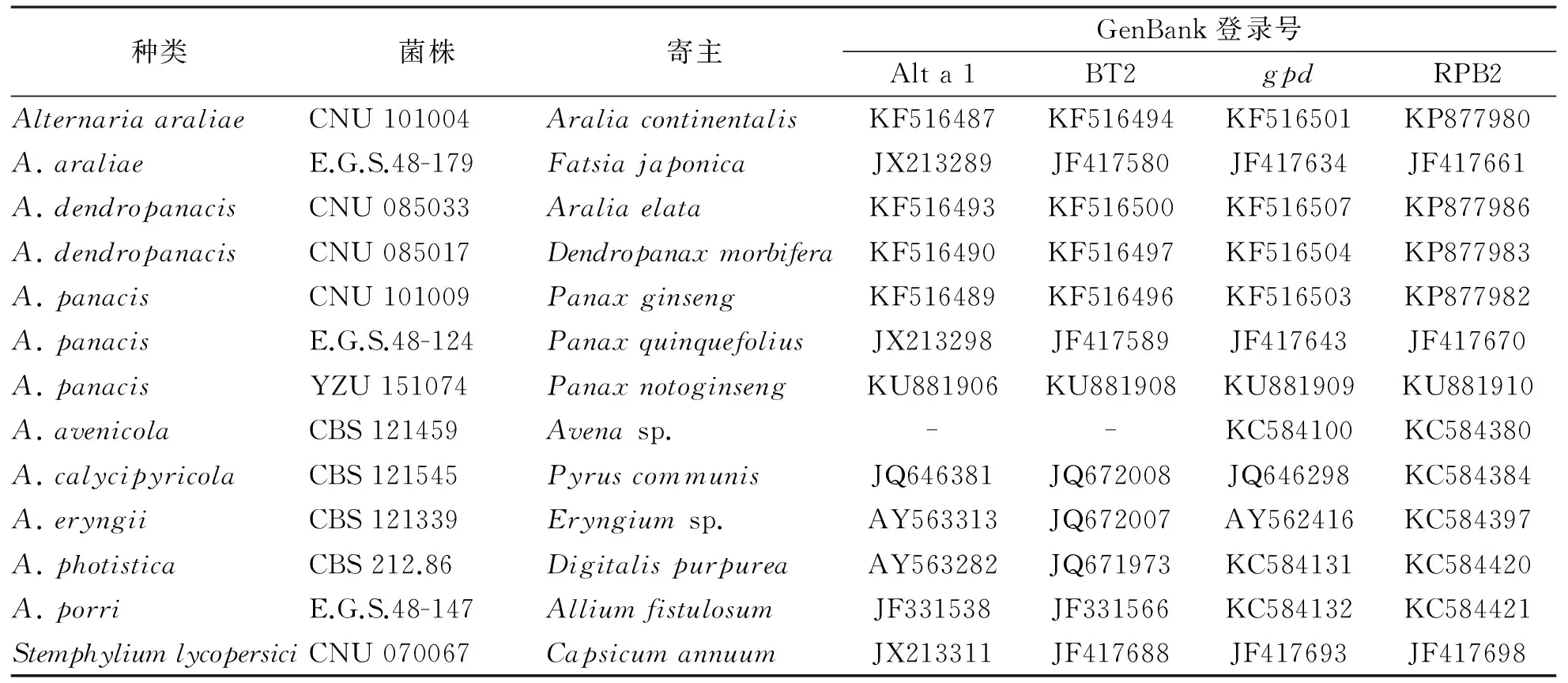
表2 构建系统发育树所有菌株的种类、寄主及GenBank登录号
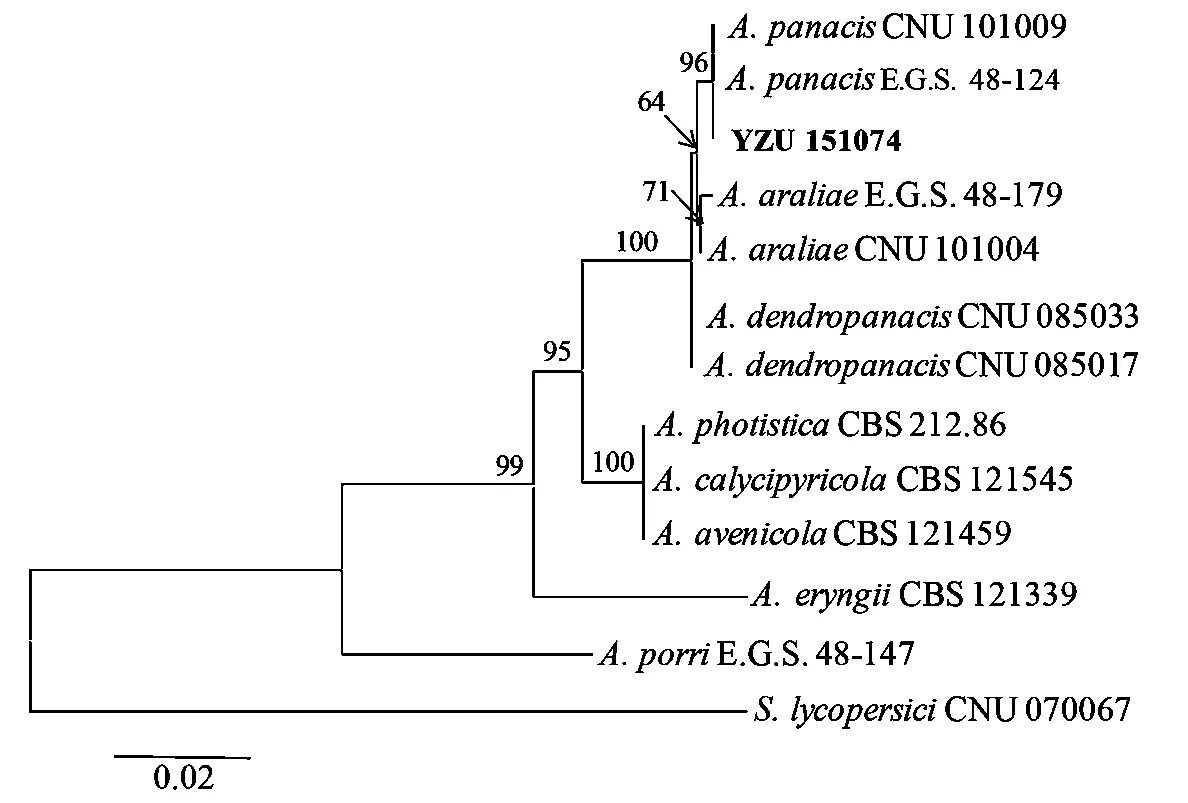
图2 基于BT2、gpd、Alt a1和RPB2基因序列构建的ML(maximum likelihood)系统发育树
3结论与讨论
通过形态学检测和分子系统发育分析,本研究结果表明三七黑斑病病原应为链格孢菌属的Alternariapanacis,与人参、西洋参的黑斑病病原菌同属于一个种。与Deng等[10]的结果相类似,并发现三七黑斑病的病原链格孢菌A.panacis与其他2个从五加科植物上分离的种类(A.araliae和A.dendropanacis)不同,在PDA培养基上不分泌有色色素,在PCA培养基上产生相对较小的分生孢子,串生的分生孢子链较长(2~6个),并且可以通过基因序列分析进行分子鉴定,例如单个基因RPB2。
传统链格孢菌的分类主要依据形态学的方法,Simmon等[5]对分离自五加科植物上的链格孢菌进行系统的形态学分类研究后,认为五加链格孢(A.araliaeGreene)和鹅掌藤链格孢(A.actinophyllaJ.W.Miller)与分离自人参和西洋参的人参链格孢(A.panax)形态学特征上相同,同属人参链格孢。影响该观点成立的主要原因是不同五加科植物链格孢菌的分生孢子在形态上存在交互重叠的现象,且其形态易受菌龄及培养条件影响。直至2007年,Simmon等[5]的链格孢菌专著里也持同样的观点。随着分子生物学技术在链格孢菌分类研究上的广泛应用,Deng等[8]利用分子学方法研究发现分离自10种五加科植物的58个链格孢菌菌株,被分成2个聚类组,且形态上存在明显差异。随后在2015年,Deng等[10]利用形态学和分子学方法,证明五加科(Araliaceae)植物链格孢菌共存在3个种类,而非仅一个种类。本研究用相似的分类学研究方法,对三七黑斑病病原链格孢菌进行复核鉴定,明确了其分类地位,这为该病害的防治研究提供一定的科学依据。
[参考文献]
[1]蒋妮,覃柳燕,叶云峰.三七病害研究进展[J].南方农业学报,2011,42(9):1070~1074.
[2]王淑琴,于洪军,陈仙华.三七黑斑病的综合防治研究[J].植病物理学报,1981,11(2):45~52.
[3]Wang W,Zhao C,Chen Z,etal.Studies on the isolation,identification andinvitrogrowth rates of three pathogenic fungi fromPanaxnotoginsengcultivated in Wenshan eparchy[J].Agricultural Science & Technology,2015,16:1165~1171,1258.
[4]张天宇.中国真菌志 (第16卷) 链格孢属[M].北京:科学出版社,2003.
[5]Simmons E G.ALTERNARIA:an identification manual[M].Netherlands:CBS Fungal Biodiversity Centre Utrecht,2007.
[6]Deng J X,Kim C S,Oh E S,etal.First report of foliar blight caused byAlternariapanaxonDendropanaxmorbifera[J].Mycobiology,2010,38:316~320.
[7]Uchida J Y,Aragaki M,Yoshimura M A.Alternaria leaf spots ofBrassaiaactinophylla,Dizygothecaelegantissima,andTupidanthuscalyptratus[J].Plant Disease,1984,68:447~449.
[8]Deng J X,Paul N C,Park M S,etal.Molecular characterization,morphology,and pathogenicity ofAlternariapanaxfrom araliaceous plants in Korea[J].Mycological Progress,2013,12:383~396.
[9]Quayyum H A,Dobinson K F,Traquair J A.Conidial morphology,virulence,molecular characterisation,and host-parasite interactions of selectedAlternariapanaxisolates on American ginseng[J].Canadian Journal of Botany,2005,83:1133~1143.
[10]Deng J X,Li M J,Paul N C.etal.Alternariaspecies associated with araliaceous plants in Korea[J].Mycological Progress,2015,14:31.
[11]Park M S,Seo G S,Bae,K S,etal.Characterization ofTrichodermaspp.associated with green mold oyster mushroom by PCR~RFLP and sequence analysis of ITS regions of rDNA[J].Plant Pathol J,2005,21:229~236.
[12]White T J,Bruns T,Lee S,etal.Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[A].Innis M A,Gelfand D H,Sninsky J J,etal.PCR protocols:a guide to methods and applications[C].New York:Academic Press,1990.
[13]Glass N L,Donaldson G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J].Appl Environ Microbiol,1995,61:1323~1330.
[14]Berbee M L,Pirseyedi M,Hubbard S.Cochliobolusphylogenetics and the origin of known,highly virulent pathogens,inferred from ITS and glyceraldehydes-3-phosphate dehydrogenase gene sequences[J].Mycologia,1999,91:964~977.
[15]Hong S G,Cramer R A,Lawrence C B,etal.Alt a 1 allergen homologs fromAlternariaand related taxa:analysis of phylogenetic content and secondary structure[J].Fungal Genet and Biol,2005,42:119~129.
[16]Liu Y J,Whelen S,Hall B D.Phylogenetic relationships among ascomycetes:evidence from an RNA Polymerse II Subunit[J].Mol Biol Evol,1999,16:1799~1808.
[17]Simmons E G.Alternaria: Themes and Variations (7-10)[J].Mycotaxon,1982,14:17~43.
[收稿日期]2016-03-08
[基金项目]国家自然科学基金项目(31400014);长江大学青年人才基金项目(2015cqr17)。
[作者简介]黄宏强(1993-),男,现从事植物保护学研究。通信作者:邓建新,djxin555@hotmail.com。
[中图分类号]S432.4
[文献标识码]A
[文章编号]1673-1409(2016)15-0006-04
[引著格式]黄宏强,范小燕,陶亚群,等.三七黑斑病病原菌的复核鉴定[J].长江大学学报(自科版) ,2016,13(15):6~9.
