猪ESD真核表达质粒的构建及其抑制口蹄疫病毒复制的研究
2016-06-27李伟伟朱紫祥曹伟军张克山刘湘涛郑海学
李伟伟,朱紫祥,曹伟军,杨 帆,李 丹,张克山,刘湘涛,郑海学
(中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,国家口蹄疫参考实验室,甘肃兰州 730046)
猪ESD真核表达质粒的构建及其抑制口蹄疫病毒复制的研究
李伟伟,朱紫祥,曹伟军,杨 帆,李 丹,张克山,刘湘涛,郑海学*
(中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,国家口蹄疫参考实验室,甘肃兰州 730046)
摘要[目的]探究猪ESD蛋白的抗病毒功能,通过构建猪ESD真核表达质粒,研究其是否能够抑制口蹄疫病毒在PK-15细胞中的复制。[方法]从PK-15细胞中提取总RNA,反转录为cDNA,PCR扩增出猪的ESD基因,构建到pcDNATM3.1/Myc-His A真核表达载体上。通过Western blotting和实时定量PCR检测ESD蛋白的表达情况及其抗病毒功能。[结果]获得了猪ESD真核表达载体,转染后能够正常表达。FMDV感染PK-15细胞后,ESD转录水平显著上调;过表达ESD蛋白显著抑制FMDV的复制;下调表达ESD蛋白显著促进FMDV的复制。[结论]猪ESD蛋白能够抑制FMDV在PK-15细胞中的复制。
关键词口蹄疫病毒;酯酶D;抗病毒功能
口蹄疫(Foot and Mouth Disease,FMD)是由口蹄疫病毒(Foot and Mouth Disease Virus,FMDV)引起的偶蹄动物感染并发病的一种急性、烈性传染病,易感动物为牛、猪、羊、骆驼和鹿等偶蹄类动物[1]。FMDV属于小RNA病毒科(Picornaviridae)口蹄疫病毒属(Aphthovirus),为单股正链无囊膜的RNA病毒[2-3]。截至目前,已发现7个血清型,分别为A、O、C、AsiaI、SAT1、SAT2、SAT3,且每个血清型又可分为多个亚型,各血清型之间无交叉保护现象,同型内的亚型之间仅有部分交叉保护[4]。口蹄疫病毒颗粒由外壳蛋白和RNA组成,外壳蛋白由4种结构蛋白各60个分子构成(VP1、VP2、VP3和VP4);RNA包含约8 500个核苷酸,主要包括5′非编码区(5′-Untraslated Region,5′-UTR),一个大的开放阅读框架(Open Reading Frame,ORF),3′非编码区(3′-Untraslated Region,3′-UTR)[5-7]。5′非编码区包含由病毒自身所编码的VPg蛋白、S片段、poly(C)、PKs、CRE和内部核糖体进入位点(IRES)等,且无帽子结构;3′非编码区有poly(A)尾巴;开放阅读框编码一个多聚蛋白,经自身编码的蛋白酶(L、2A、3C)及少数宿主因子裂解后最终形成4个结构蛋白(VP1、VP2、VP3和VP4)和8个非结构蛋白(L、2A、2B、2C、3A、3B、3C、3D)[8]。
酯酶D(Esterase D,ESD)是一个谷胱甘肽巯酯酶,分子量约32 ku,具有丝氨酸水解酶活性,并在甲醛的解毒反应中发挥至关重要的作用[9]。该蛋白在机体内多个组织中均有分布,尤其在胎盘、肾脏、肝脏和红细胞中的活性较高[10]。酯酶D基因图谱与视网膜瘤基因高度同源,可作为检测视网膜瘤细胞的分子遗传标记。研究表明,在肝硬化、威尔森氏病、肥胖症和孤独症等疾病中,酯酶D活性明显受到抑制[11]。与此同时,酯酶D活性的降低能够显著提高人肺癌的发生率。酯酶D还与白塞氏病和小柳原田病的炎症过程密切相关[12]。尽管酯酶D能够参与很多生理学或病理学过程,但对其结构和功能知之甚少。
根据前期转录组分析发现,感染FMDV的PK-15细胞与未感染FMDV的PK-15细胞相比,ESD的转录水平显著上调,这表明ESD可能在FMDV的感染中发挥某种特定的功能。笔者通过构建猪ESD真核表达质粒,研究其是否能够抑制口蹄疫病毒在PK-15细胞中的复制,旨在探究ESD蛋白的表达与FMDV的感染具有何种相关性,以及是否参与调控FMDV在PK-15细胞中的复制。
1材料与方法
1.1材料pcDNATM3.1/Myc-His A载体由兰州兽医研究所口蹄疫流行病学团队保存;口蹄疫毒株O/BY/CHA/2010和猪肾细胞系(PK-15)由兰州兽医研究所口蹄疫流行病学团队保存;兔抗ESD多抗购于Abcam公司;鼠抗c-Myc单抗、鼠抗β-actin单抗、HRP标记山羊抗鼠IgG二抗和HRP标记山羊抗兔IgG二抗购于Santa Cruz公司;抗FMDV全血清由兰州兽医研究所口蹄疫流行病学团队制备,Western blotting检测可显示出VP0和VP3蛋白条带。
大肠杆菌DH5α感受态、LATaqDNA聚合酶、限制性核酸内切酶EcoRI和HindIII、T4 DNA连接酶、Trizol试剂、反转录酶M-MLV、RNA酶抑制剂(RRI)、Oligo(dT)引物、随机引物、脱氧核糖核苷三磷酸(dNTP)、SYBR Permix ExTaqII和蛋白预染Marker均购于宝生物工程大连有限公司;Lipofectamine 2 000转染试剂购于Invitrogen公司;DMEM培养液、Opti-MEM、0.25% EDTA胰酶、新生牛血清(FBS)购于Gibco公司。
1.2方法
1.2.1质粒的构建。
1.2.1.1引物设计。 调取Genebank中PorcineESD的序列,利用Oligo 7.0软件设计引物:Forward 5’-AACAAGTGCTTTGGAGGATTG-3’,Reverse 5’-CAGTTTCTGCCTTTGGTGGTA-3’。
1.2.1.2RNA的提取及反转录。采用Trizol裂解法提取总RNA,并进行反转录。反转录体系20.0 μL:4.0 μL 5×First buffer,2.0 μL 0.1 mol/L DTT,1.0 μL Oligo(dT),0.5 μL Radom primers,1.0 μL RNA酶抑制剂RRI,1.0 μL M-MLV反转录酶,1.0 μL dATP,4.5 μL RNA模板。反应程序:25 ℃ 10 min,37 ℃ 60 min,72 ℃ 15 min。
1.2.1.3PCR扩增猪的ESD片段。PCR扩增反应体系50.0 μL:Prime STAR 0.5 μL,5×Prime STAR buffer 10.0 μL,dNTP 4.0 μL,Porcine ESD上下游引物各1.0 μL,cDNA 模板8.0 μL,加水补至50.0 μL。反应程序:98 ℃预变性5 min;98 ℃变性10 s,56 ℃退火30 s,72 ℃延伸1 min,共34个循环;72 ℃延伸10 min。
1.2.1.4片段及载体的酶切与连接。将胶回收ESD片段和pcDNA3.1载体分别酶切消化,体系置于37 ℃恒温箱中作用2 h,然后将酶切产物琼脂糖凝胶电泳,通过凝胶成像仪确认酶切完成。按照以上胶回收步骤回收酶切后的ESD片段和载体片段。ESD片段30.0 μL:10×M Buffer 3.0 μL,EcoRI 1.0 μL,HindIII 1.0 μL,ESD25.0 μL。载体版20.0 μL:10×M Buffer 2.0 μL,EcoRI 1.0 μL,Hind Ⅲ 1.0 μL,载体6.0 μL,ddH2O 10.0 μL。
将酶切片段和载体按适当比例混合,在T4连接酶的作用下,16 ℃连接过夜。具体连接体系:ESD片段6 μL,载体2 μL,T4连接酶1 μL,T4连接酶Buffer 1 μL,10 μL连接体系。
1.2.1.5 转化、质粒的提取及阳性克隆的鉴定。取10.0 μL连接产物,转化大肠杆菌DH5α感受态细胞,挑斑摇菌,并提取质粒。将上述提取的重组质粒进行酶切,酶切产物经琼脂糖凝胶电泳鉴定,如果出现大小合适的条带,则表明重组质粒构建成功,即为阳性质粒。将阳性质粒送北京金唯智生物公司测序,以确认重组质粒构建正确。
1.2.1.6细胞的转染和接毒。将细胞消化后铺于细胞板中,置于37 ℃、5%CO2培养箱中进行培养,待细胞密度达80%~90%时进行转染;将质粒和Lipofectamine 2 000转染试剂(两者比例为1 μg:2 μL)分别加至Opti-MEM中,室温静置5 min;然后将二者混合,再静置20 min;用无血清的DMEM清洗细胞2次,将Opti-MEM混合物加至细胞中;将细胞重新置于37 ℃、5%CO2培养箱中进行培养;孵育4~6 h后,将Opti-MEM换成10%FBS DMEM培养液,继续培养若干小时。
铺皿,待细胞密度达80%~90%时开始接毒;用无血清的DMEM将毒液稀释至适当浓度;用无血清的DMEM清洗细胞2次,以除去细胞中残留的血清;将稀释好的毒液按适当体积加入到细胞中,37 ℃、5%CO2培养箱孵育1 h后,弃除毒液,换成1% FBS DMEM维持液,继续培养。
1.2.2FMDM感染试验。将PK-15细胞铺六孔板,待细胞密度达80%~90%时,以MOI=0.5剂量的口蹄疫毒株O/BY/CHA/2010感染PK-15细胞,分别在感染后0、4、8和12 h收取细胞样品。同时设置对照组,即未感染口蹄疫病毒组,分别在相同时间点收取细胞样品。Trizol法提取总RNA,反转录为cDNA,实时定量PCR分别检测ESD和FMDV转录水平的变化,并以GAPDH作为内参。
1.2.3ESD蛋白过表达试验。铺皿,待细胞密度达80%~90%时,分别转染0、1和2 μg ESD重组质粒,转染过程中加入pcDNA3.1空载体以确保相同数量的细胞接受等量的质粒。转染后24 h,感染相同剂量的FMDV,感染后12 h收取细胞样品,Western blotting检测Myc-ESD和FMDV蛋白水平的变化。
1.2.4ESD siRNA干扰试验。ESD siRNA干扰试剂由上海吉玛制药技术有限公司合成,同时NC siRNA被合成作为阳性对照。铺皿,待细胞密度达80%~90%时,分别转染NC siRNA和ESD siRNA,转染后36 h,感染相同剂量的FMDV,分别在感染后0和12 h时收取细胞样品,分别检测ESD和FMDV蛋白水平的变化。
1.2.5Western blotting 检测。蛋白样品制备:收集细胞,弃去培养液,用1×PBS漂洗细胞2次,去除细胞碎片;加入1×SDS Loading buffer(已加β-巯基乙醇),充分裂解细胞,收集样品至EP管中;100 ℃金属浴煮样15 min,12 000 r/min离心5 min。
SDS-PAGE蛋白胶制备:取适量蛋白样品上样,进行蛋白电泳,同时加入蛋白预染Marker作为大小指示,电泳电压先调80 V跑30 min,待蛋白样品进入分离胶后,将电压调至120 V,直至电泳结束;然后通过湿转法进行蛋白转印,转膜条件为200 mA,2 h(转印电流和时间可根据目的蛋白分子量大小做适当调整);利用5%脱脂奶粉对转印膜室温封闭2 h;孵育一抗,室温孵育2 h或4 ℃过夜(一抗可回收利用);TBST洗膜3次,每次5 min;孵育二抗,室温孵育2 h;TBST洗膜4次,每次5 min;然后曝光;观察目的条带,扫描胶片并保存结果。
1.2.6荧光定量PCR(SYBR®Green法)检测。收集细胞样品,提取总RNA,反转录为cDNA,按照SYBR® Premix ExTaqTM(TaKaRa)试剂盒操作说明书配制反应体系,并根据Mx3000P操作流程进行荧光定量PCR反应,利用GAPDH作为内参进行不同基因转录的相对定量。反应体系20.0 μL:10.0 μL SYBR Permix ExTaqII,0.4 μL上游引物,0.4 μL下游引物,8.2 μL DEPC水和1.0 μL cDNA。反应程序:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火加延伸30 s,共34个循环。扩增引物ESD:Forward 5’-AACAAGTGCTTTGGAGGATTG-3’,Reverse 5’-CAGTTTCTGCCTTTGGTGGTA-3’;FMDV:Forward 5’-CACTGGTGACAGGCTAAGG-3’,Reverse 5’-CCCTTCTCAGATTCCGAGT-3’;GAPDH:Forward 5’-ACATGGCCTCCAAGGAGTAAGA-3’,Reverse 5’-GATCGAGTTGGGGCTGTGACT-3’。
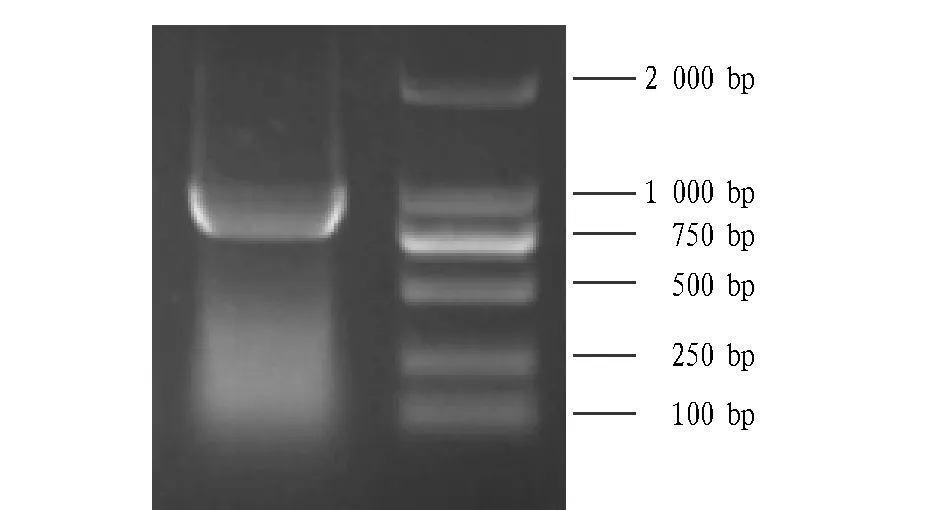
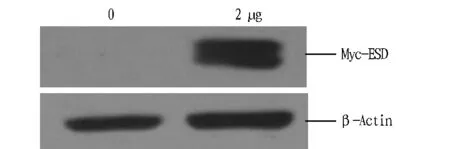
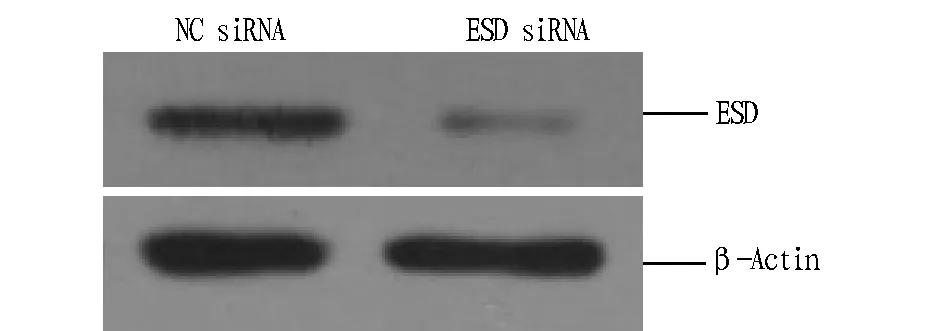
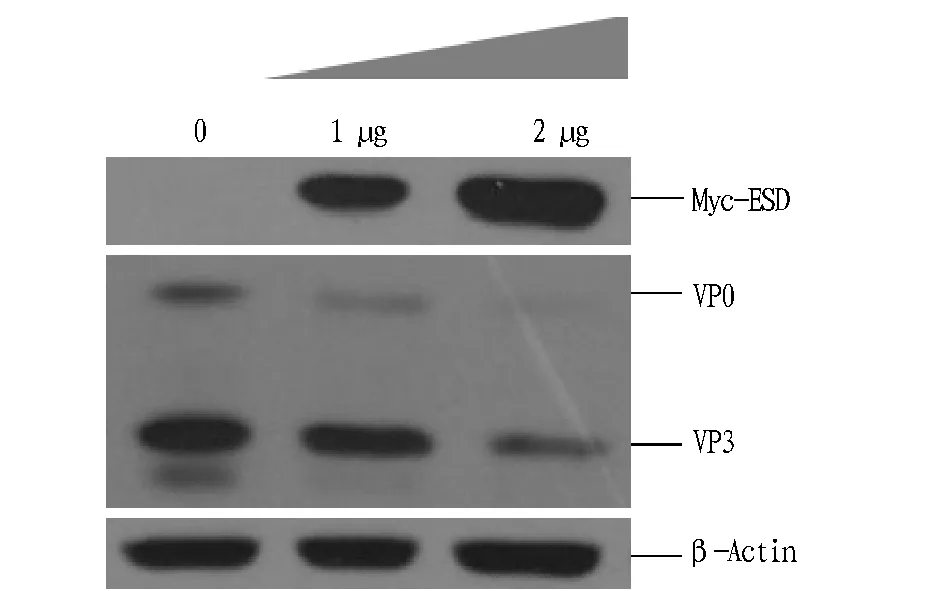
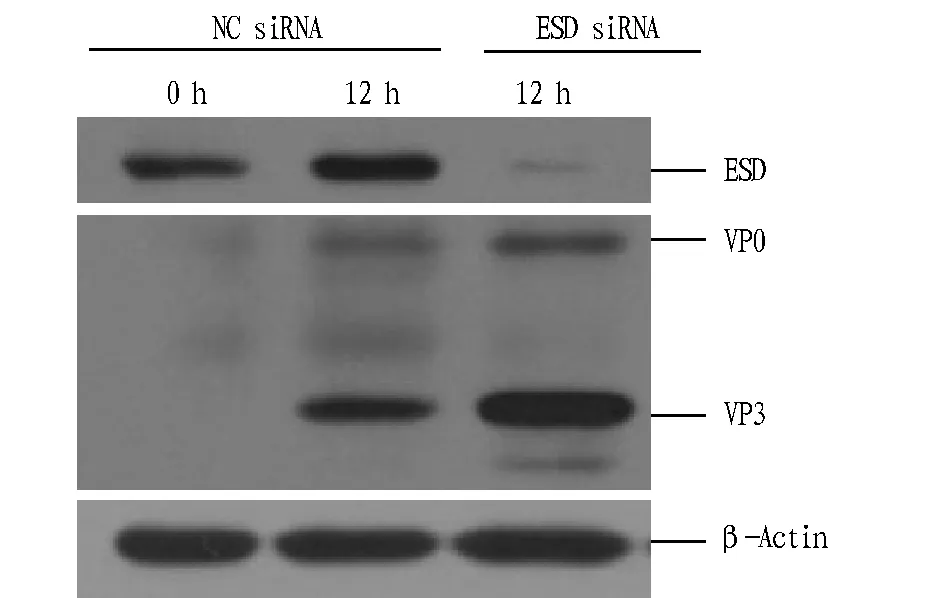
1.3数据分析所有试验数据均采用统计学分析,分析结果:0.01 2结果与分析 2.1Myc-ESD重组质粒的构建及其验证表达用两端含有EcoRI和HindIII酶切位点的引物对,以PK-15细胞的cDNA为模板,PCR扩增得到与预期大小相一致的PorcineESD片段(图1)。Myc-ESD重组质粒双酶切鉴定结果与预期结果一致(图2)。将初步鉴定连接成功的阳性质粒送北京金唯智生物公司进行测序,序列比对后,重组质粒中的ESD序列与PorcineESD序列完全一致。 图1 猪ESD基因的PCR扩增Fig.1 PCR amplification of porcine ESD gene 图2 Myc-ESD重组质粒的酶切鉴定Fig.2 Identification of the Myc-ESD recombinant plasmid 2.2猪ESD真核质粒的表达验证 将重组质粒转染PK-15细胞,转染后24 h,收取细胞样品,Western blotting可明显检测到与ESD蛋白大小一致的特异性目的条带,且表达量较高(图3)。 图3 Western blotting验证ESD蛋白的表达Fig.3 Verification of ESD protein expression by Western blotting 2.3ESD siRNA干扰效果借助siRNA干扰技术,分别转染NC siRNA和ESD siNRA干扰试剂,转染后收取细胞样品,Western blotting检测干扰效果。通过对ESD siRNA的转染剂量和转染时间进行优化,最终确定ESD siRNA最适转染浓度为150 pmol/mL,最佳干扰时间为转染后36 h,且与NC siRNA组相比,ESD siRNA组的ESD蛋白表达水平显著减弱,表明其干扰效果较好(图4)。 图4 Western blotting检测ESD siRNA的干扰效率Fig.4 Detection of the efficiency of ESD siRNA in PK-15 cells by Western blotting 2.4FMDV感染后ESD 转录水平的变化由图5可知,FMDV感染PK-15细胞后,随着FMDV的复制,ESD的转录水平呈逐渐上调趋势,且在感染后12 h达到最高,而未感染FMDV的PK-15细胞中ESD变化不明显。 注:A.实时定量PCR检测感染后ESD转录水平的变化,B.实时定量PCR检测感染后FMDV转录水平的变化,C.实时定量PCR检测未感染FMDV ESD转录水平的变化。Note:A.Transcripts of ESD in PK-15 cells were detected by qPCR after infection of FMDV,B.Transcripts of FMDV in PK-15 cells were detected by qPCR,C.Transcripts of ESD in PK-15 cells were detected by qPCR without infection of FMDV. 图5 FMDV感染后ESD 转录水平的变化Fig.5 The variation of ESD expression after infection of FMDV 2.5过表达ESD蛋白后FMDV复制水平的变化由图6可知,过表达ESD后,口蹄疫病毒蛋白的表达显著下降,且呈剂量依赖性,即过表达ESD蛋白显著抑制FMDV在PK-15细胞中的复制。 图6 过表达ESD蛋白后FMDV复制水平的变化Fig.6 The variation of FMDV replication after inhibition of ESD overexpression 2.6下调表达ESD蛋白后FMDV复制水平的变化由图7可知,下调表达ESD后,口蹄疫病毒蛋白的表达水平显著上升,即下调表达ESD蛋白显著促进FMDV在PK-15细胞中的复制。 图7 下调表达ESD蛋白后FMDV复制水平的变化Fig.7 The variation of FMDV replication promoted by down-regulation of ESD 3讨论 该研究发现FMDV感染PK-15细胞后,ESD的转录水平出现上调。过表达ESD蛋白能够显著抑制FMDV的复制,下调表达ESD蛋白能够显著促进FMDV的复制,这表明ESD蛋白能够抑制FMDV的复制。FMDV感染后能够介导转录起始因子eIF4G发生降解,从而阻断细胞内蛋白质的合成,以利于病毒自身的复制。当细胞受到病毒侵染时,细胞通过启动自身的一系列应答反应来阻止病毒的入侵或者抑制病毒的复制,从而维持细胞自身的稳态。FMDV感染PK-15细胞后,ESD转录水平的上调可能是细胞抑制病毒复制的一个应答反应。ESD不仅在维持细胞稳态中发挥特定功能,而且在抗病毒应答反应中也起着至关重要的作用。 目前对ESD蛋白结构与功能方面的研究很少,仅了解其能够参与多种生理学及病理学过程,其酶活性与很多疾病的发生密切相关,在参与维持细胞稳态中发挥至关重要的作用。该研究证实了ESD蛋白能够抑制FMDV在PK-15细胞中的复制,但其是否通过参与调控I型干扰素信号转导来发挥抗病毒作用,目前尚不明确,因此,深入探究ESD蛋白的抗病毒机制将有助于对ESD蛋白结构和功能等方面进行更加全面和深入的了解。 4结论 该研究成功构建了猪ESD真核表达质粒,并验证了其能够正常表达。通过接毒试验发现,随着FMDV在PK-15细胞中的复制,ESD的转录水平显著上调。过表达ESD蛋白显著抑制FMDV在PK-15细胞中的复制。下调表达ESD蛋白显著促进FMDV在PK-15细胞中的复制。 该研究首次揭示了ESD蛋白能够发挥抗病毒作用。通过过表达和干扰试验,从转录水平和蛋白水平2个层面进一步证实了ESD蛋白能够抑制FMDV在PK-15细胞中的复制。 参考文献 [1] 谢庆阁.口蹄疫[M].北京:中国农业出版社,2004:174-181. [2] 周锦萍,葛杰,鞠龚讷.口蹄疫的流行概况及防控策略[J].畜牧兽医科技信息,2009(4):5-7. [3] 白兴文.A型口蹄疫病毒XJ1株全长感染性 cDNA的构建[D].北京:中国农业科学院,2005. [4] MASON P W,GRUBMAN M J,BAXT B,et al.Molecular basis of pathogenesis of FMDV[J].Virus research,2003,91(1):9-32. [5] ELIAS C B,JARDIN B,KAMEN A.Recombinant protein production in large-scale agitated bioreactors using the baculovirus expression vector system[J].Methods in molecular biology,2007,388:225-245. [6] BAO H F,LI D,SUN P,et al.The infectivity and pathogenicity of a foot-and-mouth disease virus persistent infection strain from oesophageal-pharyngeal fluid of a Chinese cattle in 2010[J].Virol J,2011,8:536. [7] ALEXANDERSEN S,ZHANG Z D,DONALDSON A I,et al.The pathogenesis and diagnosis of foot-and-mouth disease[J].Journal of comparative pathology,2003,129(1):1-36. [8] AGGARWAL N,ZHANG Z,COX S,et al Experimental studies with foot-and-mouth disease virus,strain O,responsible for the 2001 epidemic in the United Kingdom[J].Vaccine,2002,20(19):2508-2515. [9] EIBERG H,MOHR J.Identity of the polymorphisms for esterase D and S-formylglutathione hydrolase in red blood cells[J].Hum Genet,1986,74:174-175. [10] UOTILA L,KOIVUSALO M.Purification and properties of S-formylglutathione hydrolase from human liver[J].J Biol Chem,1974,249:7664-7672. [11] DE VRIES G E,HARMS N,MAURER K,et al.Physiological regulation of Paracoccus denitrificans methanol dehydrogenase synthesis and activity[J].J Bacteriol,1988,170:3731-3737. [12] ITO K,TAKAHASHI M,YOSHIMOTO T,et al.Cloning and high-level expression of the glutathione-independent formaldehyde dehydrogenase gene from Pseudomonas putida[J].J Bacteriol,1994,176:2483-2491. Construction of PorcineESDEukaryotic Expression Plasmid and Its Function to Suppress the Replication of Foot and Mouth Disease Virus LI Wei-wei, ZHU Zi-xiang, CAO Wei-jun, ZHENG Hai-xue*et al (National Foot and Mouth Disease Reference Laboratory, State Key Laboratory of Veterinary Research Institute, Lanzhou Veterinary Institute, CAAS, Lanzhou, Gansu 730046) Abstract[Objective] To explore the antiviral effect of ESD protein, we constructed porcine ESD eukaryotic expression plasmid to investigate whether ESD protein to suppress the replication of foot and mouth disease virus in PK-15 cells. [Method] We extracted porcine cellular RNA from PK-15 cells, then porcine ESD gene was obtained by reverse transcription of cDNA and PCR amplification and constructed to pcDNATM3.1/Myc-His A eukaryotic expression vector, of which expression and antiviral function were detected by western blotting and real-time quantitative PCR. [Result] The porcine ESD eukaryotic expression plasmid was constructed and ESD was successfully expressed. The mRNA level of ESD in PK-15 cells was up-regulated after FMDV infection. Overexpression of ESD significantly suppresses the replication of FMDV. Down-expression of ESD significantly promotes the replication of FMDV. [Conclusion] Porcine ESD protein significantly suppresses the replication of FMDV in PK-15 cells. Key wordsFoot and mouth disease virus; Esterase D; Antiviral effect 基金项目国家自然科学基金项目(31502042,31302118);科技支撑计划项目(2015BAD12B04);甘肃省杰出青年基金项目(145RJDA328);农业部948项目(2015-Z6)。 作者简介李伟伟(1990- ),男,河南三门峡人,硕士研究生,研究方向:分子病毒学。*通讯作者,研究员,博士,硕士生导师,从事口蹄疫病毒致病机制的研究。 收稿日期2016-04-13 中图分类号S 852.65+1 文献标识码A 文章编号0517-6611(2016)12-117-04