肠道内分泌与营养素感应系统
2016-06-27慕春龙余凯凡朱伟云
高 侃 慕春龙 余凯凡 朱伟云
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物研究室,南京210095)
肠道内分泌与营养素感应系统
高侃慕春龙余凯凡朱伟云*
(江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物研究室,南京210095)
摘要:动物肠道内消化代谢产生的各种营养素或其他化学物质,能够通过肠道内分泌和营养素感应系统发挥生理效应。作为肠道内分泌和营养素感应系统重要的组成部分,肠道内分泌细胞通过表面的感应受体(氨基酸感应受体、脂肪酸感应受体和葡萄糖感应受体等),识别感应肠道内各类营养素,不仅调节营养素吸收和代谢,同时能够分泌脑肠肽(胰高血糖素样肽-1、酪酪肽、胆囊收缩素等)。脑肠肽通过由中枢神经系统、自主神经系统以及肠神经系统构成的脑肠神经网络,参与调控机体摄食行为及其他生理功能。本文就动物肠道内分泌系统、脑肠轴以及营养素感应受体等方面研究进展进行综述。
关键词:肠道营养感应;肠道内分泌系统;脑肠轴;营养素感应受体
动物通过肠道内分泌和营养素感应系统识别感应肠腔内各类营养素。肠道内分泌和营养素感应系统主要由肠道内分泌系统、脑肠轴(gut-brain axis)以及营养素感应受体组成[1]。动物肠道通过感应受体识别肠腔内各类营养素,如蛋白质、脂类、糖类,促进肠道内分泌细胞(enteroendocrine cells,EECs)分泌脑肠肽。脑肠肽经脑肠轴调控机体摄食行为、营养吸收与能量代谢,以及调节肠道蠕动、排空、渗透性等生理功能[2]。此外,动物肠道内分泌和营养素感应系统功能的缺失往往与动物疾病的发生密切相关,如EECs的缺失导致小鼠脂肪代谢紊乱和葡萄糖稳态失调,发生吸收不良性腹泻,死亡率升高[3]。因此,肠道内分泌和营养素感应系统在调控机体营养吸收和能量代谢等方面具有重要作用。
1肠道内分泌系统
动物肠道内分泌系统能够通过感应受体识别营养素,介导分泌多种脑肠肽,参与调控机体各项生理功能,包括食欲、摄食行为以及营养吸收和代谢等[4]。肠道内分泌系统由多种EECs组成,包括L细胞、K细胞、I细胞和肠嗜铬细胞等。EECs分散于肠道上皮细胞(intestinal epithelial cells,IECs)中,尽管EECs的比例只占IECs总量的1%,但是EECs通过特异性识别营养素可分泌20多种脑肠肽,包括胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)、酪酪肽(peptide YY,PYY)、胆囊收缩素(cholecystokinin,CCK)、葡萄糖依赖性胰岛素释放肽(glucose-dependent insulinotropic polypeptide,GIP)、5-羟色胺(5-hydroxytryptamine,5-HT)以及胃饥饿素等[1]。由EECs基底侧分泌的各类脑肠肽,既可被肠道中的迷走神经纤维、脊神经纤维上的特异性受体识别,通过神经分泌途径调节机体生理机能,又可进入血管循环以内分泌的形式作用相应靶器官,如GLP-1通过血液循环到达胰腺,与胰腺表面GLP-1受体(GLP-1R)结合,激活β细胞分泌胰岛素[5]。另外,EECs释放的脑肠肽还能以旁分泌的形式激活细胞周围IECs,促进IECs营养素的吸收或代谢产物的释放等(图1)[4]。EECs的类型、分布和功能主要与脑肠肽分泌种类、物种亲缘性等密切相关,如K细胞分泌GIP,L细胞分泌GLP-1和PYY,I细胞分泌CCK,肠嗜铬细胞分泌5-HT等[4]。不同物种间EECs的分布具有差异性。小鼠肠道L细胞主要分布于远端回肠和结肠表面,而猪肠道L细胞主要分布于十二指肠表面[6]。此外,EECs分布和功能的差异性还受饲粮调控。最新研究发现,高脂饲粮连续饲喂小鼠2周后,小鼠小肠K细胞和结肠L细胞数量均显著减少;饲喂高脂饲粮16周后,小鼠结肠L细胞营养素感应相关转录因子基因表达量显著下降,GLP-1分泌量显著减少[7]。
近年来随着显微技术的发展,人们进一步加深了对EECs结构的认知。Bohórquez等[8]利用串行块面扫描电子显微镜技术,首次发现小鼠远端回肠EECs具有神经突触样结构,EECs基底侧具有分泌小泡引导脑肠肽的胞吐作用,同时研究发现EECs与肠神经胶质细胞(enteric glia cells,EGCs)相连接。EGCs主要调控肠神经系统(enteric nervous system,ENS)的发育和IECs的增殖[9],因此研究推测EGCs对于EECs功能具有调控作用。这些研究结果为揭示动物ENS参与调控EECs分泌脑肠肽的互作机制提供了重要科学依据。
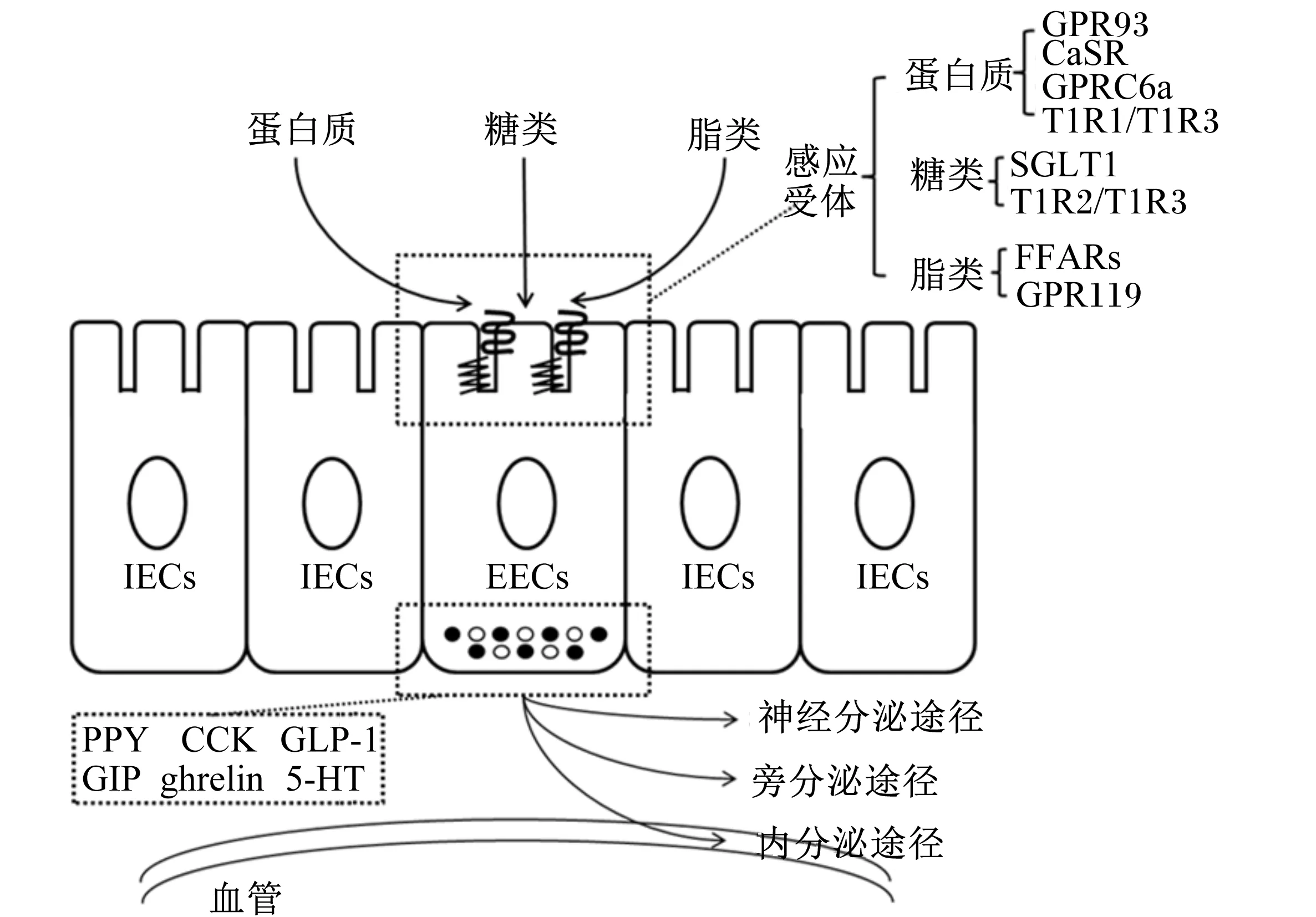
GPR93:G蛋白偶联受体93 G protein coupled receptor 93;CaSR:钙敏感受体 calcium sensing receptor;GPRC6a:G蛋白偶联受体C家族6组a亚型受体 G protein coupled receptor family C group 6 subtype a;T1R1/T1R3:1型味觉受体1/3 type 1 taste receptor 1/3;SGLT1:钠依赖性葡萄糖转运载体1 sodium-glucose transporter 1;T1R2/T1R3:1型味觉受体2/3 type 1 taste receptor 2/3;FFAR1:游离脂肪酸受体1 free fatty acid receptor 1;GPR119:G蛋白偶联受体119 G protein coupled receptor 119;ghrelin:胃饥饿素。
图1肠道内分泌细胞营养素感应受体示意图
Fig.1Schematic diagram of nutrients sensing receptors in enteroendocrine cells[1]
2脑肠轴
动物肠道内分泌系统感应肠腔中的营养素后,通过脑肠轴作用于中枢神经系统(central nervous system,CNS),调节机体各项生理功能[10]。脑肠轴是由中枢神经系统CNS、自主神经系统以及ENS共同构成的神经网络[2]。该神经网络由大量神经纤维组成,这些神经纤维包括交感神经纤维和迷走神经纤维,广泛分布于动物肠道中。其中,迷走神经纤维占肠道神经纤维总量的80%,可通过特异性受体识别肠道中的脑肠肽(GLP-1、PYY等)[4]。最新研究通过隔下迷走神经切断手术证实,迷走神经主要通过分布于其末端的GLP-1R识别肠腔中的GLP-1[11]。脑肠肽激活受体后转化为神经信号,继而经迷走神经传递至CNS,使机体做出相应的应答反应,如食欲和摄食行为的改变[2]。Bogdanova等[12]研究发现,激活大鼠消化道阿片受体(mu-opioid receptor),食欲抑制信号可经迷走神经传递到CNS使机体采食量下降、能量消耗降低。肠道内分泌系统不仅参与机体食欲和能量代谢调控,同时其还可通过脑肠轴介导肠道各项生理功能,包括肠肌反射、肠道免疫、肠道渗透性,以及肠道内分泌调控等[2]。研究利用PYY基因敲除小鼠发现,结肠L细胞通过分泌PYY激活分布于迷走神经末端的PYY受体(Y2R),PYY信号经脑肠轴传递至CNS。CNS通过分布于结肠的神经纤维抑制结肠平滑肌收缩,减慢肠道蠕动频率,延缓结肠内容物的排空[13]。因此,动物肠道内分泌系统与CNS的互作,在调节机体肠道营养吸收与能量代谢、生理功能等方面具有重要意义。
3肠道营养素感应受体
动物肠道对营养素的感应主要依靠分布于EECs表面的各类营养素感应受体,如氨基酸感应受体、脂肪酸感应受体和葡萄糖感应受体[10]。这些感应受体通过特异性识别肠腔内的蛋白质、脂类和糖类等营养素,激活细胞下游信号通路,促进脑肠肽分泌,进而通过脑肠轴调控机体对营养素的吸收与代谢,维持机体能量稳态(图1)[4]。
3.1蛋白质感应受体
蛋白胨是肠道内蛋白质初步消化后的产物,能够被分布于肠道表面的各类蛋白胨感应受体所结合。目前,已报道的蛋白胨感应受体主要有小肽转运蛋白(peptide transporter 1,PepT1)和溶血磷脂酸受体5(lysophosphatidic acid receptor 5,LPAR5)等。其中,PepT1广泛分布于小肠和结肠L细胞表面,可识别肠腔内的蛋白胨促进GLP-1的分泌[14]。与PepT1功能相类似,LPAR5同样能够感应肠道中的蛋白胨,其主要分布于肠道I细胞表面[14]。Choi等[15]在小鼠EECs细胞系STC-1研究中发现蛋白胨可显著升高细胞LPAR5表达量,激活细胞下游细胞外信号调节激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)和蛋白激酶A(protein kinase A,PKA)信号通路,促进CCK的分泌。此外,有研究发现小鼠肠道L细胞表面的钙敏感受体(calcium sensing receptor,CaSR)也可结合蛋白胨,其通过激活瞬时受体电位离子通道(transient receptor potential channel,TRPC)和电压依赖性钙离子通道(voltage-dependent Ca2+channel,VDCC),使胞内钙离子浓度上升,促进GLP-1的分泌[16]。Diakogiannaki等[14]研究发现,蛋白胨能够同时激活小鼠L细胞PepT1和CaSR信号通路促进细胞分泌GLP-1,因此推测,PepT1和CaSR受体间在蛋白胨感应方面存在协同机制,共同调节EECs脑肠肽的分泌。
蛋白质在肠道中被消化成氨基酸后,可被分布于肠道表面的各类氨基酸感应受体所识别。CaSR不仅能够结合蛋白胨[16],还可感应L-氨基酸,尤其对L-芳香族氨基酸敏感[4]。Mace等[17]研究发现大鼠小肠L细胞和K细胞可通过CaSR受体识别L-氨基酸,调节GLP-1、PYY和GIP等脑肠肽的分泌。同时,研究进一步发现CaSR受体介导脑肠肽的分泌需要钙离子的参与。Zhou等[18]利用小鼠STC-1细胞系对CaSR介导的脑肠肽分泌机制做了更深入的研究。研究表明,CaSR通过激活磷脂酶C(phospholipase C,PLC)和三磷酸肌醇(inositol triphosphate,IP3)信号通路,引起内质网钙离子释放;同时,胞膜TRPC和L型VDCC被激活,引导胞外钙离子进入胞内;胞内钙离子浓度的升高,促进胞内CCK和GLP-1的胞吐作用[18]。以上研究表明,L-氨基酸结合CaSR受体后,激活下游信号通路和离子通道,引起胞内钙离子浓度上升,进而调节脑肠肽分泌。
G蛋白偶联受体C家族6组a亚型受体(G protein coupled receptor family C group 6 subtype a,GPRC6a)可识别肠腔内L-精氨酸、L-赖氨酸和L-鸟氨酸,与CaSR不同的是对L-芳香族氨基酸不敏感,其基因在动物空肠和结肠中表达量最高[19]。GPRC6a通过识别感应L-氨基酸,促进细胞脑肠肽的表达和分泌。Oya等[20]在小鼠L细胞系GLUTag研究中发现,L-鸟氨酸可显著增加细胞胞内钙离子浓度,同时伴随GLP-1分泌量增加。而利用小RNA干扰阻断细胞GPRC6a基因表达后发现,胞内钙离子浓度显著下降,同时GLP-1分泌量显著减少。因此,研究推测GPRC6a感应氨基酸需要钙离子的参与。此外,有研究报道表明GPRC6a能够介导机体能量代谢。Clemmensen等[21]研究发现,在饲喂高脂饲粮下,与正常小鼠相比,GPRC6a基因敲除小鼠采食量与体增重显著升高,同时伴随葡萄糖代谢紊乱。然而最新研究发现肠道GPRC6a并不介导高蛋白质饲粮饲喂小鼠的采食、饱感和体增重的调控[22]。因此,肠道GPRC6a感应氨基酸介导机体能量代谢的机制还不明确,需要进一步的研究。
鲜味受体——1型味觉受体1/3(type 1 taste receptor 1/3,T1R1/T1R3)能够识别L-脂肪族氨基酸,尤其对L-谷氨酰胺和L-天冬酰胺敏感,其主要分布于肠道I细胞、K细胞和L细胞表面[1]。Daly等[23]在小鼠STC-1细胞系的研究中发现,L-苯丙氨酸、L-色氨酸、L-赖氨酸都能够显著增强细胞T1R1/T1R3表达,促进CCK的分泌。目前T1R1/T1R3在肠道中感应氨基酸的机制还未明晰,而在胰腺β细胞中的氨基酸感应有较深入的研究。Wauson等[24]研究发现,胰腺β细胞上的T1R1/T1R3结合L-氨基酸后,可通过激活细胞下游ERK1/2和哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)信号通路,介导胰岛素的分泌,维持机体葡萄糖稳态。此外,有研究发现T1R3缺失会引起β细胞细胞自噬(细胞自我保护机制),并促进其他氨基酸感应转运载体的表达,提示机体氨基酸感应转运存在补偿机制,以应对T1R1/T1R3的功能缺失[25]。
根据氨基酸感应受体在肠道中的分布和对氨基酸敏感性的差异,研究推测肠道氨基酸感应受体之间存在交互作用,协同识别感应肠道内各类氨基酸[4]。然而目前有关氨基酸感应受体协同机制的研究较少,因此深入了解肠道各类氨基酸感应受体间信号传导网络,将有助于阐明EECs氨基酸感应的机理。
3.2脂类感应受体
来自饲粮的脂肪在肠道被水解后产生中链和长链脂肪酸,这些脂肪酸可被EECs表面的游离脂肪酸受体(free fatty acid receptor,FFAR)1和FFAR4所识别[4]。研究表明,激活EECs表面的FFAR1和FFAR4,能够促进GLP-1、PYY和GIP等脑肠肽的分泌。Hauge等[26]研究发现肠道L细胞表面FFAR1结合α-亚麻酸(ALA)和二十二碳六烯酸(DHA)后,通过PLC和IP3信号通路,引起内质网钙离子释放,同时经VDCC引导胞外钙离子进入胞内,促进GLP-1和GIP胞吐作用。Iwasaki等[27]研究发现,激活小鼠肠道FFAR4受体后,肠道K细胞GIP分泌量显著上升;而抑制FFAR4激活后,小鼠肠道K细胞GIP表达量显著下降。此外,FFAR4还与机体的能量代谢调控有关。在高脂饲粮饲喂下,与正常小鼠相比,FFAR4基因敲除小鼠体增重、肝脏脂肪含量显著增加,胰岛素敏感性和葡萄糖耐受性显著下降[28]。Tsukahara等[29]利用小鼠L细胞对FFAR1和FFAR4的互作机制做了深入的研究,研究发现当FFAR1受体激活后,FFAR4受体主要通过环磷酸腺苷(cyclic Adenosine monophosphate,cAMP)-PKA信号通路抑制由FFAR1介导的脑肠肽的分泌。因此,研究表明肠道L细胞FFAR1和FFAR4受体间在脂肪酸感应方面存在拮抗效应,共同调控肠道中长链脂肪酸感应。
动物肠道中尤其是大肠还存在大量短链脂肪酸(short-chain fatty acids,SCFA),包括乙酸、丙酸和丁酸等,其主要由微生物发酵小肠不消化碳水化合物(寡糖、抗性淀粉等)产生。SCFA可被分布于小肠和结肠EECs表面的FFAR2和FFAR3所识别[4]。FFAR2和FFAR3结合SCFA的亲和力取决于SCFA碳链长度,其中FFAR2优先识别乙酸和丙酸,而FFAR3主要感应丙酸、丁酸,以及其他SCFA[2]。有研究表明,激活EECs表面FFAR2和FFAR3受体,可促进脑肠肽的分泌。Psichas等[30]研究发现,小鼠结肠L细胞FFAR2能够有效识别丙酸,促进细胞PYY和GLP-1的分泌量显著上升,同时引起小鼠采食量和体增重显著增加。此外,丙酸还可被小鼠肠道FFAR3受体所识别,经脑肠轴调控机体糖异生,维持葡萄糖稳态[31]。然而目前对于FFAR2和FFAR3在肠道SCFA感应中的协同机制的研究较少[1],需要对2类受体间的交互机制做进一步的研究。
G蛋白偶联受体119(G group coupled receptor 119,GPR119)作为另一类脂类感应受体,主要识别脂肪酸酰胺,如油酰乙醇胺(OEA)、2-单油酸甘油酯(2-OG)以及油酰多巴胺(ODA),促进GLP-1、PYY和GIP等脑肠肽的分泌,其主要分布于胰腺β细胞、肠道K细胞和L细胞表面[4]。Moss等[32]在GPR119基因敲除小鼠研究中发现,与正常小鼠相比较,由OEA和2-OG诱导GPR119基因敲除小鼠结肠L细胞引起的GLP-1分泌量显著下降。研究进一步发现GPR119感应脂类后主要通过激活cAMP和PKA信号通路,促进GLP-1的胞吐作用。此外,Patel等[33]在肥胖小鼠研究中发现,激活结肠GPR119还可显著改善小鼠葡萄糖耐受性,调控机体能量代谢。目前,已有多种GPR119特异性激动剂能够显著降低动物摄食量和体增重[4]。因此,GPR119可作为Ⅱ型糖尿病、肥胖等代谢疾病的潜在治疗靶点,调节机体脂代谢和能量摄取。
3.3糖类感应受体
甜味受体——1型味觉受体2/3(type 1 taste receptor 2/3,T1R2/T1R3),其主要分布于肠道K细胞和L细胞表面,可识别感应动物肠腔内多糖、单糖等糖类物质,促进GLP-1、CCK和GIP等脑肠肽的分泌[4]。Geraedts等[34]研究发现小鼠结肠EECs表面T1R2/T1R3受体结合糖类物质后,抑制ATP敏感钾离子(ATP-sensitive K+,KATP)通道,引起胞内钾离子浓度上升,促进GLP-1的分泌。同时,有研究表明T1R2/T1R3受体介导机体葡萄糖代谢。Murovets等[35]研究发现,与正常小鼠相比,T1R3基因敲除小鼠的胰岛素敏感性和葡萄糖耐受性均显著下降,引起葡萄糖稳态失调。
肠道中的葡萄糖,还可被钠依赖性葡萄糖转运载体1(sodium-glucose transporter 1,SGLT1)和葡萄糖转运载体2(glucose transporter 2,GLUT2)所识别[2]。动物小肠SGLT1和GLUT2结合葡萄糖后,可促进PYY、GLP-1和GIP等脑肠肽的分泌,介导机体葡萄糖稳态[17]。Kuhre等[36]对大鼠小肠L细胞SGLT1和GLUT2葡萄糖感应机制做了深入的研究,发现SGLT1和GLUT2主要通过抑制胞膜KATP通道,同时激活L型VDCC,引起胞内钾离子和钙离子浓度上升,使细胞去极化,从而促进GLP-1的分泌。与此同时,SGLT1还可激活胞膜钠离子通道,间接介导GLP-1的胞吐作用。以上研究表明SGLT1和GLUT2共同感应转运肠道内的葡萄糖,而与GLUT2的功能相比较,SGLT1在介导机体肠道葡萄糖感应中发挥更加重要的作用。
此外,研究显示当肠道内葡萄糖浓度上升,EECs甜味受体T1R2/T1R3还可通过PLC-蛋白激酶C信号通路激活细胞SGLT1和GLUT2的表达,共同感应肠道内的葡萄糖,进一步促进葡萄糖转运,同时介导GLP-1、PYY等脑肠肽的分泌[37]。因此,研究表明机体肠道葡萄糖感应受体T1R2/T1R3、SGLT1与GLUT2之间存在交互机制,协同介导肠道葡萄糖感应,维持机体葡萄糖稳态。
4肠道内分泌与营养感应系统调控作用
肠道内分泌系统、脑肠轴以及营养素感应受体三者协同调控机体采食量和摄食行为[2]。Bogdanova等[12]研究发现,肽和氨基酸能够激活大鼠消化道EECs表面阿片受体,促使肠道内分泌系统分泌GLP-1和PYY等脑肠肽,通过脑肠轴将信号作用于CNS,显著抑制大鼠摄食行为,从而降低大鼠采食量。高脂诱导肥胖型小鼠可通过肠道氨基酸感应受体GPRC6a引起肠道内分泌系统产生脑肠肽,负反馈信号经脑肠轴作用于小鼠下丘脑,调控小鼠采食量以及活动量[21]。
肠道内分泌与营养感应系统还可介导营养素的吸收与转运,维持机体能量稳态。Mellitzer等[3]发现,与正常小鼠相比,肠道内分泌系统缺失型小鼠(Ngn3Δintmice)的肠道脂类吸收被抑制,机体脂肪合成功能受损,体重显著下降,能量代谢紊乱。有研究表明,肠道内分泌于营养感应系统主要调控机体葡萄糖代谢平衡。De Vadder等[31]发现,小鼠肠道脂肪酸感应受体FFAR3识别SCFA后,促进肠道内分泌系统分泌GLP-1等脑肠肽,通过脑肠轴作用于CNS,从而调节机体葡萄糖代谢过程,维持葡萄糖稳态。此外,Clemmensen等[21]研究发现,与高脂诱导肥胖型小鼠相比,GPRC6a基因敲除小鼠的葡萄糖和胰岛素水平显著上升,葡萄糖耐受性和胰岛素敏感性显著下降,机体葡萄糖代谢紊乱。
目前,有关肠道内分泌与营养感应系统的研究主要集中于啮齿动物和体外EEC模型,而在哺乳动物(人、猪等)中研究较少,因此该系统对哺乳动物肠道营养吸收与能量代谢的影响还有待深入挖掘。
5小结
动物肠道是机体的感应器官,肠道表面的EECs通过特异性营养素感应受体识别各类营养素,包括蛋白质、脂类和糖类等,激活下游信号通路,促进分泌脑肠肽,如GLP-1、PYY和CCK。脑肠肽可通过脑肠轴,不仅调控肠道营养素的吸收和代谢,同时介导机体摄食行为、食欲,以及其他生理功能。肠道内分泌和营养素感应系统在机体营养吸收和代谢功能的调控中发挥重要作用,然而肠道营养素感应信号通路、感应受体之间的协同机制还未明晰。因此,对动物肠道内分泌和营养素感应系统的作用及机制的深入研究,将有助于阐明动物对营养素的吸收和代谢机理,同时为提高动物饲粮利用、预防与治疗代谢疾病等方面提供科学依据。
参考文献:
[1]MACE O J,TEHAN B,MARSHALL F.Pharmacology and physiology of gastrointestinal enteroendocrine cells[J].Pharmacology Research & Perspectives,2015,3(4):e00155.
[2]EFEYAN A,COMB W C,SABATINI D M.Nutrient-sensing mechanisms and pathways[J].Nature,2015,517(7534):302-310.
[3]MELLITZER G,BEUCHER A,LOBSTEIN V,et al.Loss of enteroendocrine cells in mice alters lipid absorption and glucose homeostasis and impairs postnatal survival[J].The Journal of Clinical Investigation,2010,120(5):1708-1721.
[4]PSICHAS A,REIMANN F,GRIBBLE F M.Gut chemosensing mechanisms[J].The Journal of Clinical Investigation,2015,125(3):908-917.
[5]SMITH E P,AN Z B,WAGNER C,et al.The role of β cell glucagon-like peptide-1 signaling in glucose regulation and response to diabetes drugs[J].Cell Metabolism,2014,19(6):1050-1057.
[6]CHO H J,KOSARI S,HUNNE B,et al.Differences in hormone localisation patterns of K and L type enteroendocrine cells in the mouse and pig small intestine and colon[J].Cell and Tissue Research,2015,359(2):693-698.
[7]RICHARDS P,PAIS R,HABIB A M,et al.High fat diet impairs the function of glucagon-like peptide-1 producing L-cells[J].Peptides,2016,77:21-27.
[9]BOESMANS W,LASRADO R,VANDEN BERGHE P,et al.Heterogeneity and phenotypic plasticity of glial cells in the mammalian enteric nervous system[J].Glia,2015,63(2):229-241.
[10]朱伟云,余凯凡,慕春龙,等.猪的肠道微生物与宿主营养代谢[J].动物营养学报,2014,26(10):3046-3051.
[11]RIPKEN D,VAN DER WIELEN N,VAN DER MEULEN J,et al.Cholecystokinin regulates satiation independently of the abdominal vagal nerve in a pig model of total subdiaphragmatic vagotomy[J].Physiology & Behavior,2015,139:167-176.
[12]BOGDANOVA N G,KOLPAKOV A A,SUDAKOV S K.Effect of peptide agonists of peripheral opioid receptors on operant feeding behavior and food motivation in rats[J].Bulletin of Experimental Biology and Medicine,2015,158(5):589-591.
[13]WU T Z,RAYNER C K,YOUNG R L,et al.Gut motility and enteroendocrine secretion[J].Current Opinion in Pharmacology,2013,13(6):928-934.
[14]DIAKOGIANNAKI E,PAIS R,TOLHURST G,et al.Oligopeptides stimulate glucagon-like peptide-1 secretion in mice through proton-coupled uptake and the calcium-sensing receptor[J].Diabetologia,2013,56(12):2688-2696.
[15]CHOI S,LEE M,SHIU A L,et al.GPR93 activation by protein hydrolysate induces CCK transcription and secretion in STC-1 cells[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2007,292(5):G1366-G1375.
[16]PAIS R,GRIBBLE F M,REIMANN F.Signalling pathways involved in the detection of peptones by murine small intestinal enteroendocrine L-cells[J].Peptides,2016,77:9-15.
[17]MACE O J,SCHINDLER M,PATEL S.The regulation of K-and L-cell activity by GLUT2 and the calcium-sensing receptor CasR in rat small intestine[J].The Journal of Physiology,2012,590(Pt 12):2917-2936.
[18]ZHOU H R,PESTKA J J.Deoxynivalenol (vomitoxin)-induced cholecystokinin and glucagon-like peptide-1 release in the STC-1 enteroendocrine cell model is mediated by calcium-sensing receptor and transient receptor potential ankyrin-1 channel[J].Toxicological Sciences,2015,145(2):407-417.
[19]CLEMMENSEN C,SMAJILOVIC S,WELLENDORPH P,et al.The GPCR,class C,group 6,subtype A (GPRC6A) receptor:from cloning to physiological function[J].British Journal of Pharmacology,2014,171(5):1129-1141.
[20]OYA M,KITAGUCHI T,PAIS R,et al.The G protein-coupled receptor family C group 6 subtype A (GPRC6A) receptor is involved in amino acid-induced glucagon-like peptide-1 secretion from GLUTag cells[J].The Journal of Biological Chemistry,2013,288(7):4513-4521.
[21]CLEMMENSEN C,SMAJILOVIC S,MADSEN A N,et al.Increased susceptibility to diet-induced obesity in GPRC6A receptor knockout mice[J].Journal of Endocrinology,2013,217(2):151-160.
[22]KINSEY-JONES J S,ALAMSHAH A,MCGAVIGAN A K,et al.GPRC6a is not required for the effects of a high-protein diet on body weight in mice[J].Obesity,2015,23(6):1194-1200.
[23]DALY K,AL-RAMMAHI M,MORAN A,et al.Sensing of amino acids by the gut-expressed taste receptor T1R1-T1R3 stimulates CCK secretion[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2013,304(3):G271-G282.
[24]WAUSON E M,GUERRA M L,DYACHOK J,et al.Differential regulation of ERK1/2 and mTORC1 through T1R1/T1R3 in MIN6 cells[J].Molecular Endocrinology,2015,29(8):1114-1122.
[25]WAUSON E M,ZAGANJOR E,LEE A Y,et al.The G protein-coupled taste receptor T1R1/T1R3 regulates mTORC1 and autophagy[J].Molecular Cell,2012,47(6):851-862.
[26]HAUGE M,VESTMAR M A,HUSTED A S,et al.GPR40 (FFAR1)-combined Gs and Gq signalinginvitrois associated with robust incretin secretagogue actionexvivoandinvivo[J].Molecular Metabolism,2015,4(1):3-14.
[27]IWASAKI K,HARADA N,SASAKI K,et al.Free fatty acid receptor GPR120 is highly expressed in enteroendocrine K cells of the upper small intestine and has a critical role in GIP secretion after fat ingestion[J].Endocrinology,2015,156(3):837-846.
[28]ICHIMURA A,HARA T,HIRASAWA A.Regulation of energy homeostasis via GPR120[J].Frontiers in Endocrinology (Lausanne),2014,5:111.
[29]TSUKAHARA T,WATANABE K,WATANABE T,et al.Tumor necrosis factor α decreases glucagon-like peptide-2 expression by up-regulating G-protein-coupled receptor 120 in Crohn disease[J].The American Journal of Pathology,2015,185(1):185-196.
[30]PSICHAS A,SLEETH M L,MURPHY K G,et al.The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents[J].International Journal of Obesity,2015,39(3):424-429.
[31]DE VADDER F,KOVATCHEVA-DATCHARY P,GONCALVES D,et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell,2014,156(1/2):84-96.
[32]MOSS C E,GLASS L L,DIAKOGIANNAKI E,et al.Lipid derivatives activate GPR119 and trigger GLP-1 secretion in primary murine L-cells[J].Peptides,2016,77:16-20.
[33]PATEL S,MACE O J,TOUGH I R,et al.Gastrointestinal hormonal responses on GPR119 activation in lean and diseased rodent models of type 2 diabetes[J].International Journal of Obesity,2014,38(10):1365-1373.
[34]GERAEDTS M C P,TAKAHASHI T,VIGUES S,et al.Transformation of postingestive glucose responses after deletion of sweet taste receptor subunits or gastric bypass surgery[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2012,303(4):E464-E474.
[35]MUROVETS V O,BACHMANOV A A,ZOLOTAREV V A.Impaired glucose metabolism in mice lacking theTas1r3 taste receptor gene[J].PLoS One,2015,10(6):e0130997.
[36]KUHRE R E,FROST C R,SVENDSEN B,et al.Molecular mechanisms of glucose-stimulated GLP-1 secretion from perfused rat small intestine[J].Diabetes,2015,64(2):370-382.
[37]WELCOME M O,MASTORAKIS N E,PEREVERZEV V A.Sweet taste receptor signaling network:possible implication for cognitive functioning[J].Neurology Research International,2015,2015:606479.
(责任编辑王智航)
Enteroendocrine and Nutrient Sensing System
GAO KanMU ChunlongYU KaifanZHU Weiyun*
(Jiangsu Key Laboratory of Gastrointestinal Nutrition and Animal Health, Laboratory of Gastrointestinal Microbiology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract:A variety of nutrients and chemicals in the gastrointestinal (GI) tract exert physiologic effects via enteroendocrine and nutrient sensing system. As a part of enteroendocrine and nutrient sensing system, enteroendocrine cells can detect luminal nutrients via nutrient sensing receptors (amino acids sensing receptors, fatty acids sensing receptors, glucose sensing receptors, etc.). Enteroendocrine cells not only can regulate nutrient absorption and metabolism, but also can secret kinds of gut-brain peptides (glucagon-like peptide-1, peptide YY and cholecystokinin, etc.). Gut-brain peptides through the gut-brain axis, which is composed of central neuron system, automatic nervous system and enteric nervous system, regulate host feeding behaviors and other physiologic functions. This review summarized recent advances on animal enteroendocrine system, gut-brain axis and nutrient sensing receptors.[Chinese Journal of Animal Nutrition, 2016, 28(6):1633-1640]
Key words:nutrient sensing; enteroendocrine system; gut-brain axis; sensing receptor
doi:10.3969/j.issn.1006-267x.2016.06.001
收稿日期:2015-12-29
基金项目:国家重点基础研究发展计划项目(973项目)(2013CB127300);江苏省自然科学基金(BK20130058);教育部博士点基金项目(20130097130005)
作者简介:高侃(1989—),男,浙江湖州人,博士研究生,从事猪消化道微生物与营养代谢互作机制研究。E-mail: kevingogh911@hotmail.com *通信作者:朱伟云,教授,博士生导师,E-mail: zhuweiyun@njau.edu.cn
中图分类号:S852.2
文献标识码:A
文章编号:1006-267X(2016)06-1633-08
*Corresponding author, professor, E-mail: zhuweiyun@njau.edu.cn
