猪流行性腹泻病毒N蛋白杆状病毒表达与间接ELISA方法建立
2016-06-27杨嘉玉朱珊珊李子璇
杨嘉玉,韦 莉,王 菁,侯 磊,全 荣,朱珊珊,阎 旭,李子璇,刘 超,刘 爵
(1.北京农学院动物科技学院,北京昌平102206;2.北京市农林科学院畜牧兽医研究所,北京海淀100097)
YANG Jia-yu1,2,WEI Li2,WANG Jing2,HOU Lei2,QUAN Rong2,ZHU Shan-shan2,YAN Xu2,LI Zi-xuan2,LIU Chao1,2,LIU Jue2(1.Animal Science and Techolagy College,Beijing University Of Agriculture,Beijing 102206,China;2.Institute of Animal Husbandry and Veterinary Medicine,Beijing Academy of Agriculture and Forestry Sciences,Beijing 100097,China)
猪流行性腹泻病毒N蛋白杆状病毒表达与间接ELISA方法建立
杨嘉玉1,2,韦莉2,王菁2,侯磊2,全荣2,朱珊珊2,阎旭2,李子璇2,刘超1,2,刘爵2
(1.北京农学院动物科技学院,北京昌平102206;2.北京市农林科学院畜牧兽医研究所,北京海淀100097)
摘要:为了检测猪群中猪流行性腹泻(PED)抗体水平,用Bac-to-Bac杆状病毒表达系统,构建含有PEDV N基因的重组杆状病毒rBac-PEDV N并在昆虫细胞中获得表达。用纯化的重组N蛋白作为包被抗原,建立了检测PEDV抗体的间接酶联免疫吸附试验(ELISA)方法。与Western Blot的符合率为91.3%,说明该方法适用于PED的临床诊断。
关键词:猪流行性腹泻病毒;N蛋白;Bac-to-Bac杆状病毒表达;间接ELISA
猪流行性腹泻(porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(PEDV)引起的一种急性高度接触性猪肠道传染病,主要临床特征表现为水样腹泻、脱水、呕吐和哺乳仔猪高度致死。由于变异毒株的出现,使得流行强度增大,病情更为复杂,引起了业界的广泛关注,但目前尚无商品化病毒血清检测试剂盒。PEDV编码的N蛋白在PEDV的结构蛋白中所占比例最大,而且在同种病毒之间具有高度的保守性[1]。同时,N蛋白还具有较强的抗原性,可以诱导宿主的细胞免疫和体液免疫,在病毒感染早期,猪体能迅速产生抗N蛋白抗体。鉴于N蛋白的特点,本研究利用杆状病毒表达系统表达PEDV N蛋白,并用纯化的N蛋白作为包被抗原,建立检测血清样品的PEDV间接ELISA方法,用于PEDV急性或感染早期的快速诊断具有很好的应用前景[2-4]。
1 材料与方法
1.1主要材料猪流行性腹泻粪样、PEDV阳性及阴性血清、大肠杆菌宿主菌DH10Bac、Sf9昆虫细胞和载体pFastBacHTA由本实验室保存;限制性内切酶BamH I、Xhol I、T4 DNA连接酶,购自NEB公司;RNeasy Mini Kit、Gel Extraction Kit、Plas⁃mid Mini Kit,购自QIAGEN公司;CellfectinⅡRe⁃agent和ProBond Purification System试剂盒,购自Invitrogen公司;HRP标记的兔抗鼠及兔抗猪IgG、FITC标记的兔抗鼠IgG,购自Sigma公司。
1.2重组N蛋白的表达与纯化用RT-PCR方法扩增PEDV N基因与pFastBacHTA载体连接,获得杆状病毒转移载体pFastBacHTA-PEDVN。随后,将其转化至DH10Bac感受态细胞中,获得杆状病毒重组质粒Bacmid-PEDVN。将其转染昆虫细胞Sf9,通过IFA鉴定,获得表达N蛋白的重组杆状病毒并命名为rBac-PEDVN。将rBac-PEDVN连续感染昆虫细胞并纯化重组N蛋白,随后经SDSPAGE和Western Blot对纯化蛋白进行分析。
1.3间接ELISA方法反应条件的优化及cut-off值的确定以纯化的N蛋白作为包被抗原,用棋盘法确定蛋白最佳包被浓度和阴、阳性血清最佳稀释度,同时对包被条件、封闭条件、血清作用时间、酶标二抗工作条件及底物作用时间进行逐一优化,确定最佳反应条件。按最佳反应条件,对50份PEDV阴性血清进行检测,测得A450值。根据统计学分析,计算平均数(X)和标准差(SD),确定cut-off值。
1.4特异性试验用建立的方法,对PRRSV、PCV2、CSFV、PRV、TGEV阳性血清进行检测,确定包被抗原与其他常见猪传染病的阳性血清是否发生交叉反应。
1.5敏感性试验将10份PEDV阳性血清从1∶200开始进行倍比稀释至1∶3 200进行检测,根据判断标准,对各A450值进行判断。
1.6重复性试验取8份阳性血清和2份阴性血清,用同一批次纯化的N蛋白包被ELISA板进行检测,再用不同批次纯化的N蛋白包被ELISA板进行检测,计算批内批间变异系数。
1.7比较性试验取PEDV阳性血清32份和阴性血清48份,同时用已建立的间接ELISA方法和Western Blot方法进行检测,计算该间接ELISA方法的符合率。
1.8临床应用用建立的间接ELISA方法对采集的586份临床血清样品进行快速检测。
2 结果
2.1重组N蛋白的表达与纯化通过杆状病毒表达系统成功获得在Sf9昆虫细胞中表达N蛋白的重组杆状病毒,利用anti-His-tag单克隆抗体进行间接免疫荧光检测,结果显示,rBac-PEDVN感染的Sf9细胞内出现特异性绿色荧光(见中插彩版图1-a),而对照Sf9细胞内无特异性绿色荧光出现(见中插彩版图1-b),将纯化的目的蛋白经SDS-PAGE和Western Blot分析,结果显示,在分子量61 kD处出现单一条带且与预期目的条带大小相符(图2),同时,利用anti-His-tag单克隆抗体和PEDV阳性血清进行Western Blot检测,在目的位置均出现特异性的条带(图3 A1,B2),而阴性对照无条带显现(图3 A2,B1)。
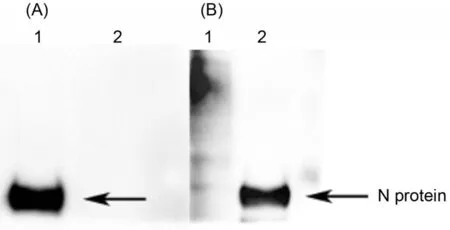
图3 Western Blot检测纯化的目的蛋白
2.2PEDV N蛋白间接ELISA方法相关条件的确定最佳条件判断标准为:阳性血清A450值接近于1,阴性血清A450值较小,且阳性与阴性A450的P/N值最大的孔所对应的反应条件。通过棋盘法获得以80 ng/孔纯化的N蛋白包被酶标板4℃过夜;PBST缓冲液洗涤3次,3 min/次;5%脱脂奶封闭1 h;洗涤后,血清样本1∶200稀释作用1 h;洗涤后,二抗1∶5 000稀释作用30 min;洗涤后,TMB显色液作用10 min,读取A450数值为ELISA方法反应的最佳条件。50份PEDV阴性血清样品经间接ELISA方法测定后,计算得阴性血清A450的平均值X为0.1096,标准差SD为0.0255,则cut-off值为0.186。因此,当样本A450值大于或等于0.186时,判为阳性,反之阴性。
2.3特异性试验结果用间接ELISA方法对5种常见猪传染病的阳性血清进行检测,A450值均小于0.186,呈阴性反应(图4),表明PEDV N蛋白不与其他猪传染病阳性血清发生交叉反应,具有较好的特异性。

图4 特异性试验结果
2.4敏感性试验结果检测10份稀释的阳性血清,当血清稀释至1 600时,A450值均大于0.186,呈阳性反应(图5),证明所建立的间接ELISA方法具有较好的敏感性。

图5 敏感性试验结果
2.5重复性试验结果批内重复性试验和批间重复性试验结果表明,批内变异系数为2.18%~4.276%,批间变异系数为1.35%~6.41%,均小于10%,表明所建立的ELISA方法变异系数均在可接受的范围内,试验具有可重复性。
2.6比较性试验结果用建立的间接ELISA方法与Western Blot方法分别平行测定32份PEDV阳性血清和48份阴性血清,对检测结果进行比较,结果显示间接ELISA方法和Western Blot方法的符合率为91.3%(表1)。
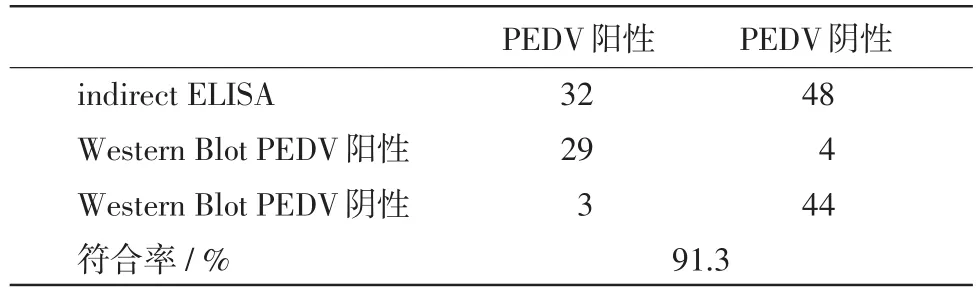
表1 两种生物学方法敏感性和特异性的比较
2.7临床血清样品的检测用已建立的ELISA方法检测从不同地方采集的586份猪血清,结果血清阳性率在47%~100%之间,总体阳性率为92%。
3 讨论
鉴于PEDV给养猪业带来重大的经济损失,建立快速、准确的诊断方法颇为急需。Hofmann 和Wyler[5]首次应用全病毒包被的ELISA方法对PEDV感染情况进行了血清学调查。然而,该病毒适应细胞难不利大量制备诊断抗原,并且细胞毒中细胞成分会对抗体检测产生非特异性干扰,影响检测的特异性[6]。Hou等[7]利用原核表达系统表达了PEDVN蛋白,并用重组的N蛋白建立了检测PEDV血清抗体的ELISA方法。本试验所采用的杆状病毒表达系统可对外源基因产物进行各种翻译后修饰,较原核表达系统更容易获得具有正确结构和修饰的活性蛋白[8-10]。所以,利用该系统表达的重组PEDV N蛋白更接近天然蛋白。
间接ELISA方法成功的关键在于抗原的纯度,为纯化出高纯度的蛋白,我们通过确定最佳接毒剂量、接毒时间、增加洗涤次数、改变洗脱液的pH值等方法来解决。通过一系列的条件优化确定了ELISA的反应条件并初步成功应用于临床血清样品的检测,为PEDV的诊断研究奠定了基础。
参考文献:
[1] Kocherhans R,Bridgen A,Ackermann M,et al . Completion of the porcine epidemic diarrhoea coronavirus(PEDV)genome se⁃quence[J].Virus genes,2001,23(2):137-144.
[2] Cologna R,Spagnolo J F,Hogue B G.Identification of nucleocap⁃sid binding sites within coronavirus-defective genomes[J] .Virolo⁃gy,2000,277(2):235-249.
[3] Rodak L,Valicek L,Smid B,et al.An ELISA optimized for por⁃cine epidemic diarrhoea virus detection in faeces[J] . Veterinary microbiology,2005,105(1):9-17.
[4] Song D,Park B.Porcine epidemic diarrhoea virus:a comprehen⁃sive review of molecular epidemiology,diagnosis,and vaccines [J].Virus genes,2012,44(2):167-175.
[5] J萨姆布鲁克,E F弗里奇,T曼尼阿蒂斯.分子克隆实验指南[M].金冬雁,黎孟枫,等译.北京:科学出版社,1993.
[6] Hofmann M,Wyler R . Enzyme-linked immunosorbent assay for the detection of porcine epidemic diarrhea coronavirus antibodies in swine sera[J].Veterinary microbiology,1990,21(3):263-273.
[7] Hou X L,Yu L Y,Liu . Development and evaluation of enzymelinked immunosorbent assay based on recombinant nucleocapsid protein for detection of porcine epidemic diarrhea(PEDV)anti⁃bodies[J].Veterinary microbiology,2007,123(1-3):86-92.
[8] Miller L K . Baculoviruses for foreign gene expression in insect cells[J].Biotechnology(Reading Mass),1988,10:457-465.
[9] Ailor E,Betenbaugh M J . Modifying secretion and post-transla⁃tional processing in insect cells[J].Current opinion in biotechnolo⁃gy,1999,10(2):142-145.
[10] Hitchman R B,Possee R D,King L A . Baculovirus expression systems for recombinant protein production in insect cells[J] . Re⁃cent patents on biotechnology,2009,3(1):46-54.
Development of an indirect ELSA based on recombinant porcineepidemic diarrhea virus nucleocapsid protein by Bac-to-Bac baculovirus expression system
YANG Jia-yu1,2,WEI Li2,WANG Jing2,HOU Lei2,QUAN Rong2,ZHU Shan-shan2,YAN Xu2,LI Zi-xuan2,LIU Chao1,2,LIU Jue2
(1.Animal Science and Techolagy College,Beijing University Of Agriculture,Beijing 102206,China;2.Institute of Animal Husbandry and Veterinary Medicine,Beijing Academy of Agriculture and Forestry Sciences,Beijing 100097,China)
Abstract:To determine the level of antibody against PEDV in swine,the recombinant baculovirus rBac-N containing PEDV N gene was constructed and the expressed N protein in insect cell was obtained by Bac-to-Bac baculovirus expression system .An indirect ELISA method was developed to detect anti-PEDV antibody using the purified N protein as coating antigen .The coinci⁃dence rate was 91.3% when comparing with Western blot,and it could be used for PEDV epidemiological surveys and diagnosis.
Key words:PEDV;nucleocapsid(N)protein;Bac-to-Bac baculovirus expression;ELISA Corresponding author:LIU Jue
中图分类号:S852.65+1
文献标志码:A
文章编号:0529-6005(2016)05-0021-03
收稿日期:2016-01-08
基金项目:北京市农林科学院科技创新能力建设专项(KJCX-20161503)
作者简介:杨嘉玉(1990-),女,硕士生,主要从事畜禽疾病诊断与防治,E-mail:yangjiayu1211@163.com
通讯作者:刘爵,E-mail:liujue@263.net
