AB-8大孔树脂对蓝莓花青素的纯化研究
2016-06-24孙浩然孟庆彬郭兴
孙浩然,孟庆彬,郭兴
(1.伊春林业管理局,黑龙江伊春153000;2.伊春林业科学院,黑龙江 伊春153000)
AB-8大孔树脂对蓝莓花青素的纯化研究
孙浩然1,孟庆彬2,郭兴2
(1.伊春林业管理局,黑龙江伊春153000;2.伊春林业科学院,黑龙江 伊春153000)
摘要:通过试验优化得出AB-8树脂纯化蓝莓花青素的最佳条件参数为:树脂吸附花青素在140min即可吸附均衡,样液pH在2.0,浓度为8g/L,速度在1.0mL/min,时吸附效果最好;洗脱液乙醇浓度为60%,流速在1.0mL/min时洗脱效果最好,在此条件下的纯化效果最好。
关键词:大孔树脂;蓝莓;花青素;纯化
蓝莓学名越橘(Vacciniumspp.),俗称蓝浆果,属杜鹃花科(Ericaceae)越橘属(Vaccinium)植物,为多年生小浆果灌木果树,果实多呈蓝、暗蓝、亮蓝,英文名为Blueberry。越橘属植物资源丰富,全世界约400多种,我国约有92个种,28个变种。常用越橘属植物有北美蓝莓,包括矮丛蓝莓(V.angustifolium)、半高丛蓝莓、北高丛蓝莓(V.corymbosum)、南高丛蓝莓(V.tenellum)、兔眼蓝莓(V.ashei);笃斯越橘(V.uliginosumL.);红豆越橘(V.vitis-idaeaL.);欧洲越橘(V.mytillusL.)、蔓越橘(V.microcarpon)等。蓝莓富含花青素,已被用作为一种天然食用色素即食品添加剂,具有一定营养和药理作用(抗氧化、抗突变、抗肥胖、抗炎症等),在食品、化妆、医药等方面有着巨大的应用潜力。因此,开发和应用天然色素已成为世界食用色素发展的总趋势[1]。
1 材料与方法
1.1 材料与仪器
试验所用蓝莓为北陆;盐酸、氢氧化钠、乙醇、乙酸、甲醇等均为分析纯;DS-1高速组织捣碎机:上海标本模型厂;JYD-650L超声波细胞破碎仪:上海之信仪器有限公司。
1.2 粗花青素的提取
称北陆鲜果5g,机械粉碎2min,再加100mL 50%乙醇溶液,200W超声波处理20min[1],后进行10min离心,沉淀再提取2次,将3次上清液合并,在真空压为-0.08MPa、50℃旋转浓缩提取液,最后获得浓缩液。
1.3分离纯化研究
1.3.1时间与吸附效果的关系[2]。取一定量的吸光度为0.967的粗提液, 倒入盛有1.00g AB-8树脂的容器中,再将该容器放到摇床中30℃、140r/min进行震荡,开始按下列时间依次检测吸光度,0、5、10、15、20、40、60、80、100、120、140、160、180min。
1.3.2pH值与吸附效果的关系[3]。精确称取4份0.50g树脂,依次加入到盛有pH为1.0、2.0、3.0、4.0的粗提液容器中,并测得初始吸光度A1,在30℃、140r/min的摇床中振荡24h。然后过滤测得吸光度A2,通过计算得到吸附率。
吸附率=(A1-A2)/A1×100%
1.3.3乙醇浓度与洗脱量的关系[4]。在装有等量已经吸附饱和树脂的容器中,加入浓度分别为50%、60%、70%、80%、90%的一定量乙醇溶液,摇床中振荡24h,140r/min,30℃,然后测洗脱液的吸光度。
1.3.4样液速度与吸附量的关系[5-6]。用pH=2.0的缓冲液配制一定浓度的花青素溶液,分别以流速0.5、1.0、1.5、2.0mL/min上样,直至树脂吸附花青素达到饱和,计算吸附交换量。
1.3.5样液浓度与吸附量的关系[6]。用pH=2.0的缓冲液分别配制浓度为4、6、8、10g/L的花青素溶液,样液速度在lmL/min,直至树脂吸附花青素达到饱和,计算吸附交换量。
1.3.6乙醇流速与洗脱量的关系[7]。用浓度为60%的乙醇溶液,分别以流速0.5、1.0、1.5、2.0mL/min进行洗脱,用自动收集器每5mL收集一次,测吸光度。
1.4花青素含量检测
1.4.1缓冲液的配置
pH1缓冲液:0.2mol/LKCl-0.2mol/LHCl(25∶67)
pH4.5缓冲液:1mol/LNaAc-1mol/LHCl-H2O(100∶60∶90)
1.4.2检测波长的确定
在pH1和pH4.5的缓冲液中花青素最大吸收峰在520nm处,因此检测波长为520nm。
1.4.3检测方法
吸取1mL浓缩液加入25mL容量瓶中,再以上述两种缓冲液定容至刻度。
C(mg/g)=(A1-A2)×V×n×M/(ε×m)(湿重)
式中:A1—是pH1时520nm处花青素的吸光度值;A2—是pH4.5时520nm处花青素的吸光度值;V—提取液总体积,mL;n—稀释倍数;M—矢车菊-3-葡萄糖苷的分子量(449);ε—矢车菊-3-葡萄糖苷的消光系数(29600);m—样品的质量,g。
2 结果
2.1时间与吸附效果的关系
由图1可知,在0~20min时吸附率变化较快,表现出吸附率随着时间的延长而增大,在20~180min时吸附率逐渐趋于平稳,140min时吸附率达到最大值44.5%。
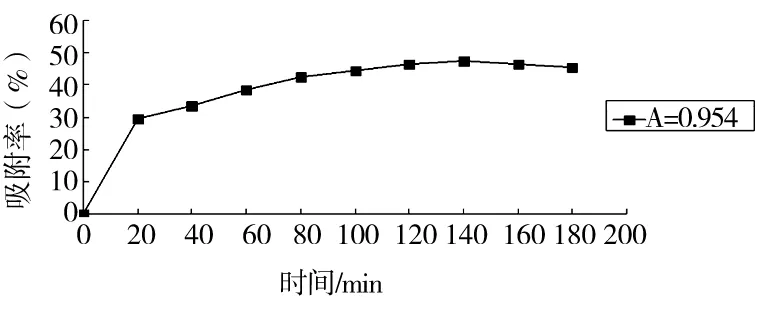
图1 吸附动力学曲线
2.2pH值与吸附效果的关系
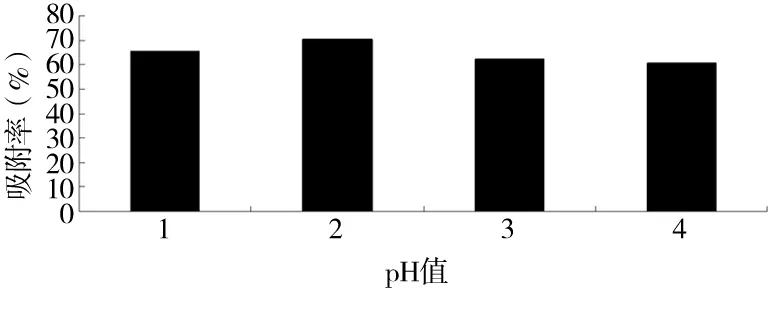
图2 pH值与吸附效果的关系
由图2可知,当pH为2.0时吸附率达到最大值为70.4%,在pH为2.0~3.0时吸附率有所降低。因此pH值为2.0时对吸附效果最好。
2.3乙醇浓度与洗脱量的关系
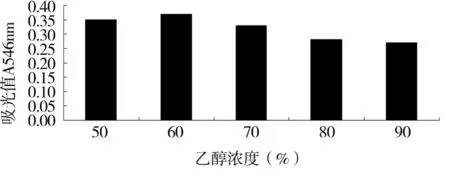
图3 乙醉浓度与洗脱量的关系
由图3可知,洗脱液的吸光度逐渐降低,60%的乙醇溶液洗脱量最大,因此60%的乙醇作为洗脱液效果最好。
2.4样液速度与吸附量的关系
由表1可知,大孔树脂吸附分离纯化蓝莓花青素,流速过快,不利于花青素分子与树脂间接触、吸附;反之,速度慢导致效率低。综合分析,速度为1.0mL/min最好。
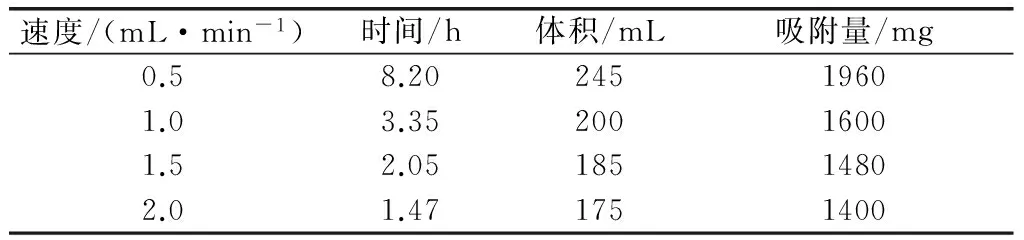
表1 样液速度与吸附量的关系
2.5样液浓度与吸附量的关系
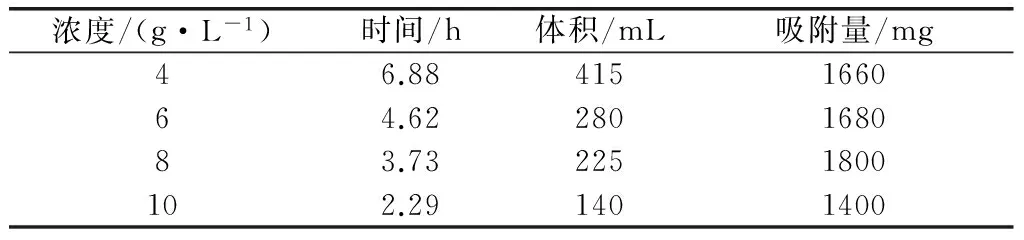
表2 样液浓度与吸附量的关系
由表2可知,样液浓度为8g/L时对吸附量最大。当吸附质以相同流速、吸附树脂相同质量下,原液浓度越高,达到总吸附交换量的时间越短,总吸附交换量越高。
2.6乙醇流速与洗脱量的关系
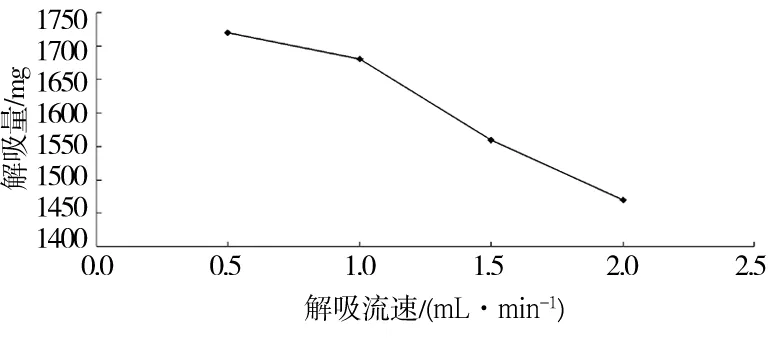
图4 乙醇流速与洗脱量的关系
由图4可知,在流速较低时,乙醇与树脂接触充分,可以充分洗脱,但是洗脱时间过长,洗脱量增大,不利于滤液的收集和下一步的浓缩。反之,流速较高时,导致乙醇来不及将大孔树脂上的花青素洗下。因此,本试验选择1.0mL/min进行洗脱。
3 结论
通过试验优化得出AB-8树脂纯化蓝莓花青素的最佳条件参数为:树脂吸附花青素在140min即可吸附均衡,样液pH在2.0,浓度为8g/L,速度在1.0mL/min,时吸附效果最好;洗脱液乙醇浓度为60%,流速在1.0mL/min时洗脱效果最好,在此条件下的纯化效果最好。
参考文献
[1]常徽.葡萄籽原花青素抗辐射损伤作用的实验研究[D].上海:中国科学院上海冶金研究所,2000.
[2] 李佳春,梁华正.大孔树脂分离纯化桅子兰色素的研究[J].食品科技,2005,(7):50-53.
[3] 陈效兰,周方钦.大孔吸附树脂浓缩分离紫菜蔓色素的研究[J].食品科学,2001,22(9):27-30.
[4] 王振宇,田福.大孔树脂吸附纯化蓝靛果红色素的研究[J].食品研究与开发,2008,29(8):184-187.
[5] 党蕊叶,权清转.大孔吸附树脂纯化矮牵牛花红色素[J].西北农业学报,2005,14(3):145-147.
[6] 朱洪梅,韩永斌.大孔树脂对紫甘薯色素的吸附与解吸特性研究[J].农业工程学报,2006,22(5):153-156.
[7] 麻明友,麻成金,等.大孔树脂吸附分离番茄红色素的研究[J].食品研究与开发,2006,127(6):189-191.
AB-8 Macroporous Resin for the Purification of Anthocyanins from Blueberry
Sun Haoran1,Meng Qingbin2,Guo Xing2
(1. Forestry Administration Bureau.Yichun,Heilongjiang 153000;2.Academy of Forestry. Yichun, Heilongjiang 153000)
Abstract:Are optimized through experiment that AB-8 resin to purify the optimum condition parameters of blueberry anthocyanins: resin adsorption anthocyanins in 140 min equilibrium adsorption, pH of sample in 2.0 concentration was 8g / L, speed in 1.0 mL / min, the adsorption effect is best; eluent ethanol concentration was 60%, flow rate at 1.0 mL / min, the elution effect is the best, under these conditions, the best purification effect.
Key words:Macroporous resin;Blueberry;Anthocyanin;Purification
收稿日期:2016-01-21
基金项目:黑龙江省森林工业总局应用研究项目(sgzjY2011020)
作者简介:孙浩然(1963-),男,硕士,高级工程师,E-mail:guoheike@163.com。
中图分类号:TS264.4
文献标识码:A
DOI.:10.13268/j.cnki.fbsic.2016.03.007
