噻吩磺隆降解菌Bacillus subtilis LXL-7的分离与应用
2016-06-23李晓楼
李晓楼
(四川职业技术学院建筑与环境工程系,遂宁 629000)
噻吩磺隆降解菌Bacillus subtilis LXL-7的分离与应用
李晓楼
(四川职业技术学院建筑与环境工程系,遂宁 629000)
从土壤中分离到一株能高效降解噻吩磺隆的细菌LXL-7,经鉴定LXL-7为枯草芽孢杆菌(Bacillus subtilis)。在含100 mg/L噻吩磺隆的培养基中,菌株LXL-7降解噻吩磺隆的72 h降解率可达99.6%以上。菌株LXL-7的最适pH为7.5,适宜温度为30-35℃,该菌还对噻吩磺隆和盐有很好的耐受性,至少能耐受400 mg/L的噻吩磺隆和4.0%的NaCl。另外,还通过在商品化的土壤微生物改良剂中添加菌株LXL-7开发了多功能微生物制剂,新制剂除原有功能外还增加了降解噻吩磺隆的新功能,故认为菌株LXL-7能够被用于噻吩磺隆污染的处理以及相关微生物制剂的开发。
噻吩磺隆;枯草芽孢杆菌;生物降解;微生物制剂
噻吩磺隆(thifensulfuron-methyl)属于磺酰脲类除草剂,商品名为阔叶散,化学名称为3-(4-甲氧基-6-甲基-1,3,5-三嗪-2-基)-1-(2-甲氧基甲酰基噻吩-3-基)-磺酰脲。它是一种内吸传导型选择性除草剂,作用靶标为植物体内的乙酰乳酸合成酶(ALS),可有效抑制支链氨基酸的合成导致敏感植物停止生长并死亡,能用于防治大多数阔叶杂草,对禾本科杂草也有一定的抑制效果。噻吩磺隆在农林业及相关领域的广泛应用在提高生产效率等方面发挥了重要作用,但噻吩磺隆或其代谢物的残留也对生态环境、农产品质量安全及人类健康带来了许多危害,还会对敏感农作物产生药害或伤及一些有益植物,有时甚至会严重影响到下茬作物的正常生长[1-3]。
已有的研究资料表明,磺酰脲类除草剂的降解主要包括光解、化学水解和微生物降解等多种途径。Braschi等[4]的研究结果表明,在中性pH的天然介质中磺酰脲类除草剂的降解以微生物降解为主,而在较低pH的酸性介质中化学水解则是最重要的途径;由于自然环境下的土壤或水体多在pH6-8的中性条件下,故认为在自然条件下微生物的降解作用是磺酰脲类除草剂的主要降解途径。例如,Andersen等[5]的实验证实,在深层土壤中磺酰脲类除草剂的降解量很小,显著低于表层土壤,并认为这是由于表层土壤相对于深层土壤含有更丰富的微生物所致;另外,表层能进行光解可能也是其原因之一。Jean等[6]发现在灭菌土壤中噻吩磺隆的降解速率很慢,而在未灭菌的土壤中则能快速降解,故认为土壤中的微生物对噻吩磺隆的降解起到了关键作用。截止目前,研究人员已经分离到20株以上的噻吩磺隆降解菌株,例如,Hugh等[7]报道了7种可降解噻吩磺隆的细菌和放线菌,并对其降解性能进行了比较;Geraldine等[8]从土壤中分离到一株能快速降解噻吩磺隆的伯克霍尔德氏菌(Burkholderia cepacia)。但当前国内外关于微生物降解噻吩磺隆的研究工作还仅局限于一些降解菌株的分离以及相关降解特性的测试,还没有将降解菌株用于噻吩磺隆污染治理的实践应用。本研究以分离噻吩磺隆高效降解菌为基础,系统研究所分离菌株的生理生化特征及应用性能,并将其用于开发多功能的微生物活菌制剂,以期将新制剂用于清除土壤中残留的噻吩磺隆。
1 材料与方法
1.1 材料
1.1.1 试剂 噻吩磺隆标准品购自Sigma-Aldrich公司(美国),噻吩磺隆(≥98.5%)购自上海市农药研究所,本实验中所用其它化学试剂均为分析纯或以上级别。
1.1.2 培养基 无机盐培养基:KH2PO40.5 g,K2HPO41.5 g,NH4NO31.0 g,MgSO4·7H2O 0.2 g,NaCl 0.5 g,蒸馏水1.0 L,pH7.0。添加噻吩磺隆的无机盐培养基即为噻吩磺隆分离培养基。
富集培养基:蛋白胨10.0 g,牛肉浸出粉4.0 g,酵母浸出粉3.0 g,NaCl 5.0 g,蒸馏水1.0 L,pH7.0。制作培养平板或者斜面时,需加入2.0%的琼脂。
1.2 方法
1.2.1 噻吩磺隆降解菌的分离与鉴定 土壤样品取自中国四川省遂宁市农田,取土耕地使用磺酰脲类除草剂已有5年以上历史。加2.0 g土样于 100 mL噻吩磺隆无机盐培养基(噻吩磺隆浓度为50 mg/L)中,在35℃下振荡培养(150 r/min),每隔24 h测定降解效果,取3 d时降解率大于30%的培养液5 mL转接到相同浓度的噻吩磺隆富集培养基中,并连续转接5次以上。再次验证降解效果后,在噻吩磺隆无机盐培养基平板上涂布上述富集培养液,在35℃下倒置培养,挑取生长旺盛的菌落在培养平板上反复划线分离以得到纯培养物。菌种的生理生化分析参照《常见细菌系统鉴定手册》和《Bergey,s Manual of Determinative Bacteriology》[9,10];菌种的鉴定采用BiologTM微生物鉴定系统和16S rRNA序列分析两种方法进行。
1.2.2 培养基及土壤中噻吩磺隆的测定 噻吩磺隆的测定参照农业行业标准方法——土壤中13种磺酰脲类除草剂残留量的测定/液相色谱串联质谱法,方法经适当改进[11]。
样品前处理流程:(1)取10.0 mL液体样品(或固态土壤样品10.0 g)于100 mL具塞三角瓶中,加入40 mL提取液,加塞后于摇床上振荡50 min(120 r/min),超声萃取5 min,布氏漏斗抽滤,滤液转移到50 mL容量瓶中,用提取液清洗、转移并定容至50 mL。取20 mL上述溶液在40℃水浴中减压浓缩至10 mL,再加10 mL pH2.0的磷酸盐缓冲液并调节终点pH为2.0-3.0,待净化(提取液:pH7.8的磷酸盐缓冲液与甲醇等体积混合)。
(2)依次用5 mL甲醇→5 mL水→5 mL提取液预淋洗固相萃取柱(Oasis HLB:200 mg,6 mL),然后将上述待净化液上柱,抽干。再用6 mL乙腈洗脱,收集到试管中,40℃下氮气吹干,用2.0 mL流动相进行溶解,过0.45 μm滤膜,待测。
液质联用相关参数:处理好的样液用高效液相色谱—三重四级杆串联质谱仪进行分析,外标法定量。流动相:[A相(0.1%甲酸+3 mmol/L甲酸铵),B相(甲醇),50%+50%等度洗脱],质谱采集参数:[母离子388,子离子141/167,Fragmentor电压125 V,碰撞气能量10 V/10 V]。
1.2.3 降解菌接种体的准备 在营养肉汤中培养筛选出的噻吩磺隆降解菌株,采用离心的方式收集菌体(5 000 r/min离心10 min),收集到的菌体用无菌生理盐水洗涤两遍后再用无菌水重悬至OD600=1.5,该悬浮液作为后续降解实验的接种体。
1.2.4 温度对菌株LXL-7降解噻吩磺隆的影响 在含噻吩磺隆的无机盐培养基(噻吩磺隆浓度100 mg/L,pH7.5)中接种3%的上述接种体,然后置于不同温度下(25℃-45℃)振荡培养,每隔12 h以无菌操作方式取样测定噻吩磺隆残留浓度及OD600值。
1.2.5 pH对菌株LXL-7降解噻吩磺隆的影响 调节无机盐培养基(含有100 mg/L噻吩磺隆)的pH至6.0、6.5、7.0、7.5和8.0,然后分别接种3%的接种体,并在35℃下振荡培养,定时取样测定噻吩磺隆降解量及OD600值。
1.2.6 菌株LXL-7对噻吩磺隆的耐受性 在无机盐培养基中添加噻吩磺隆,使其浓度分别为100、200、400、800和1 600 mg/L,再分别接入菌株LXL-7,然后在35℃下振荡培养,定时取样测试OD600,用以评价菌株LXL-7对噻吩磺隆的耐受性。
1.2.7 菌株LXL-7对NaCl的耐受性 配制含有不同浓度NaCl的无机盐培养基(含有100 mg/L噻吩磺隆),使其中的NaCl含量分别为0.5%、1.0%、2.0%、4.0%、8.0%和16.0%,然后在各培养基中接种等量的菌株LXL-7接种体,在35℃下振荡培养,定时取样测OD600观测其生长状态,评价菌株LXL-7对NaCl的耐受性。
1.2.8 应用菌株LXL-7降解土壤中的噻吩磺隆 土壤样品取自四川省遂宁市农田,分4组,a组:灭菌土壤(121℃下灭菌30 min);b组:新鲜土壤;c组:灭菌土壤中添加菌株LXL-7;d组:新鲜土壤中添加菌株LXL-7;另外,各组中噻吩磺隆浓度均为100 mg/kg。最后将其置于35℃培养箱中培养,每隔24 h取样测定噻吩磺隆的浓度。
1.2.9 应用菌株LXL-7配制农用微生物制剂 应用菌株LXL-7改良已有的微生物制剂,使其兼有降解噻吩磺隆的新功能。制备含菌株LXL-7的微生物制剂的过程如下:按照体积比1/10将准备好的接种体与灭菌的营养肉汤培养基混合,然后在35℃下以120 r/min的转速振荡培养30 h。最后,以HaotianTM微生物制剂(一种商品土壤改良剂)作为载体,在每200 g载体中混入50 mL之前预先制备的混合液和20 g秸秆粉,混合均匀后,将混合物放在25℃培养箱中培养12 h(培养期间需适度翻动),再将其放入无菌玻璃瓶中0℃下保存。
应用包含菌株LXL-7的微生物制剂降解土壤中的噻吩磺隆:添加噻吩磺隆到新鲜土壤中,使噻吩磺隆的浓度为100 mg/kg,然后将土壤分装在20 cm×30 cm的盒子中,装土深度为10 cm,并使每个盒子所装土壤的重量基本一致。15盒土壤被分成3组;a组,添加HaotianTM微生物制剂到土壤中(1 g微生物制剂与30 mL无菌水混合,然后将其全部洒入到一盒土壤中);b组,包含菌株LXL-7的微生物制剂被添加到土壤中(添加方式同a组);c组作为对照组(每盒土壤中加30 mL无菌水)。最后将3组土壤置于25℃培养箱中培养,每间隔6 h翻动一次,并适度补水,每隔24 h取样测定噻吩磺隆浓度。
2 结果
2.1 噻吩磺隆降解菌株的鉴定及特性
从农田土壤中分离到一株能以噻吩磺隆为唯一碳源和能源的菌株,将其命名为LXL-7。该菌为略有弯曲的杆状菌,大小为(0.7-0.8)×(2.0-3.0)μm,无荚膜,周生鞭毛,能运动。革兰氏阳性菌,芽孢(0.6-0.9)×(1.0-1.5)μm,椭圆或柱状,位于菌体中央或稍偏,芽孢形成后菌体不膨大。好氧生活,在营养肉汤平板上形成表面粗糙不透明菌落,呈微黄色。淀粉水解、接触酶、明胶液化实验及V.P.实验均呈阳性,而吲哚实验呈阴性。经BiologTM微生物鉴定系统鉴定菌株LXL-7为枯草芽孢杆菌Bacillus subtilis(与枯草芽孢杆菌的相似度为99%),鉴定结果与按照16S分析方法所得到的结果一致(菌株LXL-7的16S分析委托上海生工公司完成,GenBank登录号KP125319)。
2.2 温度和pH对于菌株LXL-7生长及降解噻吩磺隆的影响
菌株LXL-7在30-35℃温度条件下的生长状况要优于其它温度条件,在30℃或35℃下培养1-2 d的OD600值显著高于其它实验温度下的测试值(P<0.05);若温度为25℃或40℃,菌株LXL-7也能维持较高水平的生长,但45℃时会导致该菌株生长缓慢甚至停止生长(图1)。在30-40℃温度范围内,菌株LXL-7降解噻吩磺隆的降解速率变化不显著(P>0.05),培养3 d后噻吩磺隆(起始浓度100 mg/L)降解率均能达到99.5%以上;若温度降至25℃,其起始阶段的降解速率会显著降低,但3 d降解率仍可达到99.5%(图2)。
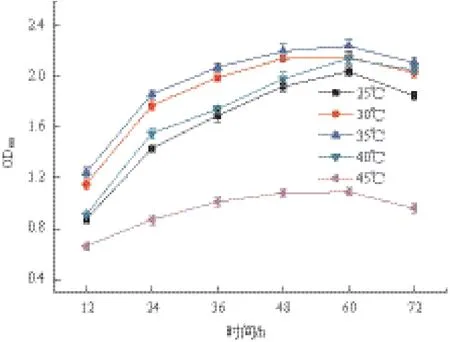
图1 温度对菌株LXL-7生长的影响
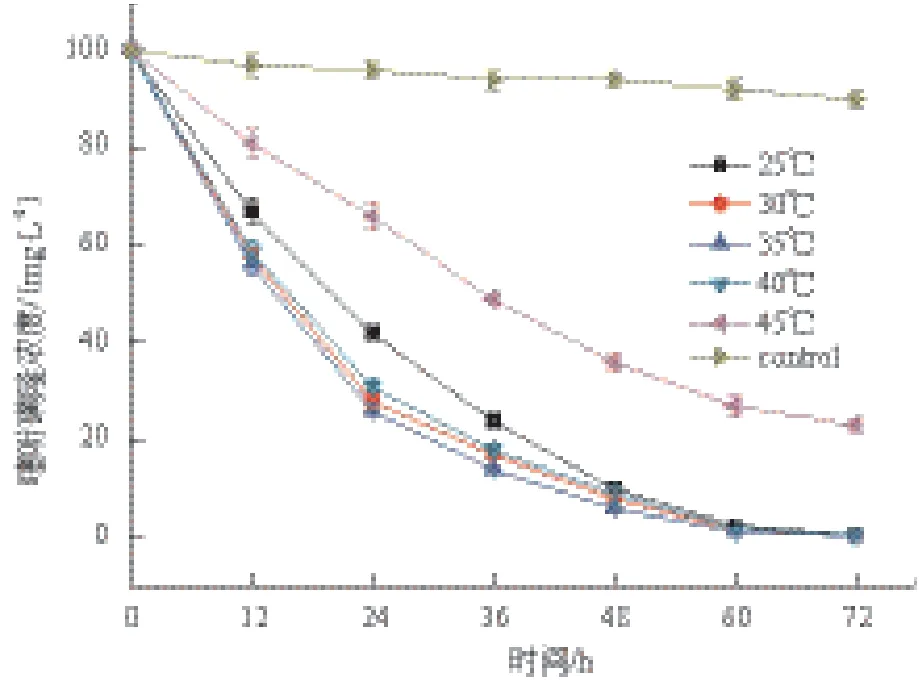
图2 温度对菌株LXL-7降解噻吩磺隆的影响
微生物的生长状况及降解能力等通常会受到pH值的影响,因此在不同pH值的培养基中测试了菌株LXL-7的噻吩磺隆降解能力,结果表明,pH值为7.5时,菌株LXL-7的生长量大于其它pH条件下的生长量(图3);而适宜于菌株LXL-7降解噻吩磺隆的pH值为7.0-8.0,当pH值为6.0或6.5时,其降解起始速率有较明显的降低,但其3 d降解率并未下降,达到99.6%(图4)。另外,在5种不同的供试pH条件下,菌株LXL-7降解噻吩磺隆的3 d降解率都可达到99.6%以上(图4)。

图3 pH对菌株LXL-7生长的影响
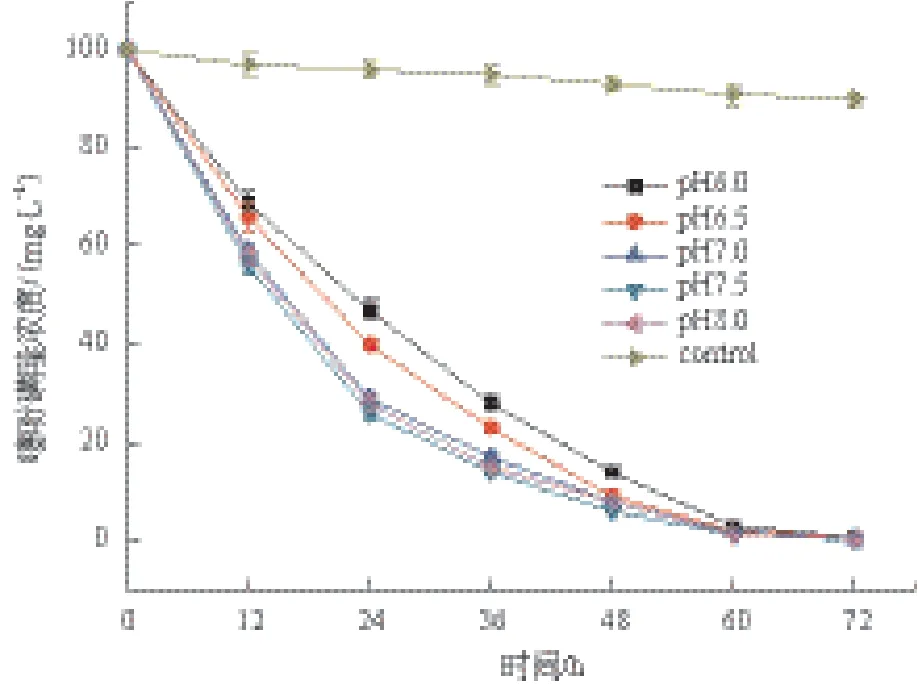
图4 pH对菌株LXL-7降解噻吩磺隆的影响
2.3 噻吩磺隆浓度对菌株LXL-7生长的影响
我国粮食作物主要为水稻、小麦、玉米、大豆等,因而近红外光谱技术在这些农产品中的应用较为广泛。本文主要对小麦和水稻在检测中应用近红外光谱技术进行研究分析。
当噻吩磺隆浓度从100 mg/L升高至400 mg/L时,所测得的OD600值有降低的趋势,但统计表明其差异不显著(P>0.05);若浓度提高至800 mg/L或1 600 mg/L时,OD600值会显著下降,菌株的生长受到明显抑制,但仍然可以生长。初步判定菌株LXL-7在实验条件下至少能耐受浓度为400 mg/L的噻吩磺隆,在这一浓度下,菌株LXL-7的生长不会受到显著影响。
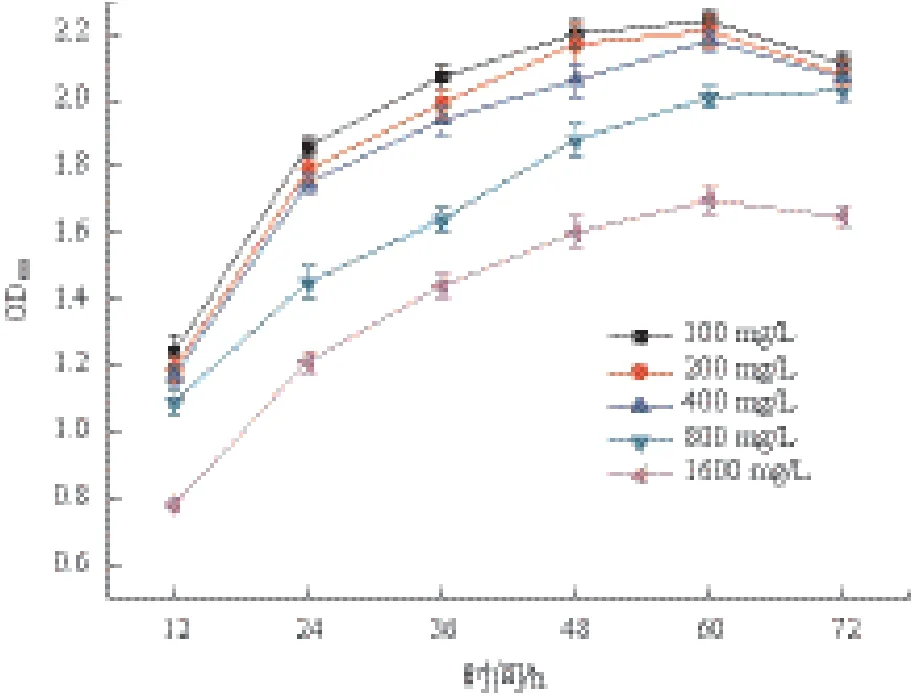
图5 噻吩磺隆浓度对菌株LXL-7生长的影响
2.4 NaCl浓度对菌株LXL-7生长的影响
培养基中NaCl浓度从0.5%提高到4.0%,菌株LXL-7的OD600值未出现显著变化(差异不显著,P>0.05)(图6),NaCl浓度进一步升高至8.0%时,菌株LXL-7的生长受到了一定影响,但OD600值仍维持在较高水平,菌株仍然能较好的生长,这表明菌株LXL-7至少能耐受4.0%的NaCl。另外,即使NaCl浓度提高至16.0%,菌株LXL-7仍可维持低水平的生长。
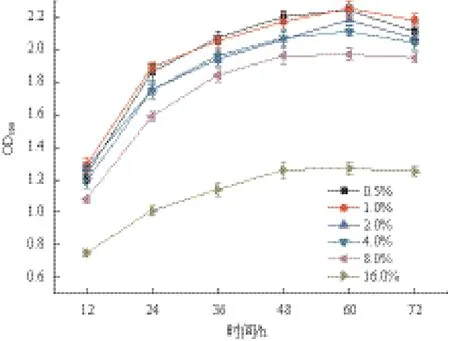
图6 NaCl浓度对菌株LXL-7生长的影响
2.5 土壤中噻吩磺隆的降解
图7结果表明,直接应用菌株LXL-7降解土壤中的噻吩磺隆是可行的,在含有噻吩磺隆的土壤中添加菌株LXL-7能显著提高噻吩磺隆的降解率,施用了菌株LXL-7的土壤中噻吩磺隆(浓度为100 mg/kg)的7 d降解率可达到98%以上。然而,在未添加菌株LXL-7的土壤中其7 d降解率仅为21%和11%。另外,新鲜土壤中噻吩磺隆的降解率要稍高于其在灭菌土壤中的降解率,存在于新鲜土壤中的某些拥有噻吩磺隆降解能力的天然微生物可能是导致这一现象的原因,部分天然微生物还可能会以共代谢的方式参与噻吩磺隆的降解。在灭菌土壤中,经历7 d后其噻吩磺隆的含量也下降了11%(图7),这一现象可能是由水解和光解作用所造成。

图7 经不同方式处理的土壤中噻吩磺隆的降解曲线
2.6 含菌株LXL-7的微生物制剂对土壤中噻吩磺隆的降解

图8 应用微生物制剂降解土壤中噻吩磺隆的降解曲线
3 讨论
3.1 噻吩磺隆降解菌株的鉴定
分离到的噻吩磺隆降解菌株LXL-7经Biolog微生物鉴定系统鉴定为枯草芽孢杆菌(Bacillus subtilis),另外通过16S rRNA分析也表明菌株LXL-7与枯草芽孢杆菌高度同源(99%),因为基于两种不同的菌种鉴定原理的结果都指向了枯草芽孢杆菌,故认为菌株LXL-7应是枯草芽孢杆菌。
3.2 温度和pH对菌株LXL-7的影响
图1、图2以及相关数据表明了温度能影响到菌株LXL-7的生长及其降解噻吩磺隆的速率;温度除了通过影响微生物的生长而导致降解能力变化,也能直接影响相关降解酶的活性,温度升高一般会导致酶促降解反应速度加快,但过高的温度又会导致降解酶以及其它酶类失活;另外,除去生物降解作用,温度也会直接影响磺酰脲类除草剂的化学水解作用[12,13]。根据已有的实验数据可初步判定菌株LXL-7生长及降解噻吩磺隆的适宜温度是30-35℃,该菌株不能耐受45℃的温度。
图3和图4的结果表明pH会在一定程度上影响菌株LXL-7的生长和噻吩磺隆的生物降解,但其3 d降解率的数据也表明pH对于菌株LXL-7降解噻吩磺隆的影响在降解后期并不十分显著,在5种不同的pH值条件下,菌株LXL-7降解噻吩磺隆的3 d降解率都可达到99.6%以上,这暗示了菌株LXL-7拥有极强的噻吩磺隆降解能力。已有的研究成果表明,噻吩磺隆在pH中性时较稳定,在pH为酸性时则有利于噻吩磺隆的水解,但在本实验中并未观察到这一现象,故可推测这里的降解行为主要是菌株LXL-7的生物降解作用[14-16]。
3.3 菌株LXL-7对噻吩磺隆和NaCl的耐受性
依据图5可初步判定菌株LXL-7在实验条件下至少能耐受浓度为400 mg/L的噻吩磺隆,在这一浓度下,菌株LXL-7的生长不会受到显著影响。参照文献资料,在推荐的剂量下使用噻吩磺隆这类磺酰脲类除草剂,其在土壤或农作物中的残留浓度大约在0-15 mg/kg,在超剂量使用除草剂等特殊条件下一般也不会超过100 mg/kg[3,17,18]。据此可认为菌株LXL-7不仅可以用于治理农业生产中应用噻吩磺隆所致的环境污染,还可望用于治理在除草剂的生产及储运等环节中可能会出现的高浓度污染。LXL-7所拥有的噻吩磺隆降解能力可能与分离该菌株的农田土壤长期使用噻吩磺隆农药密切相关,按照记录,相关农田已经有使用噻吩磺隆5年以上的历史。一般来说,土壤微生物长期持续接触某种异源的人工有机物可能会诱导出降解该有机物的能力,这些具备了新的降解特性的微生物可能与相关土壤中农药的快速失活密切相关[19]。
菌株LXL-7至少能耐受4.0%的NaCl,并且在高盐压力下仍可保持对噻吩磺隆的降解能力;即使NaCl浓度提高至16.0%,菌株LXL-7仍可维持低水平的生长,因此认为该菌株的耐盐程度为中等以上。菌株LXL-7的耐盐性可能与采样地点的盐碱化土壤有一定关系,微生物持续处于渗透压胁迫环境下,可诱导产生耐盐性能,这一般通过渗透调节或蛋白质调节这两种方式实现[20]。
3.4 菌株LXL-7及其含菌株LXL-7的微生物制剂对土壤中噻吩磺隆的降解
菌株LXL-7可直接应用于土壤中噻吩磺隆的降解,施用了菌株LXL-7的土壤中噻吩磺隆(浓度为100 mg/kg)的7 d降解率可达到98%以上;但在天然土壤中,微生物降解噻吩磺隆会受到多种因素的影响,一些存在于土壤中的拥有噻吩磺隆降解能力的天然微生物也会参与其中,另外,化学水解和光解作用也会造成噻吩磺隆降解,因此,在将降解菌株用于处理土壤中噻吩磺隆时需要关注这一系列因素。Andersen和战力等[21-23]的研究表明,噻吩磺隆等磺酰脲类除草剂的降解行为受多种因素影响,如温度、pH、光、微生物、土壤类型以及施用的肥料等,一般来说,高温以及酸性环境会导致其分解速度加快。
为了便于储运和应用,利用菌株LXL-7在已有活菌制剂的基础上开发了一种多功能活菌制剂,新的制剂在原有功能的基础上增加了降解噻吩磺隆的新功能。应用实验的结果表明,其在农业应用过程中未显现不利影响,原有功能也得到了有效保留,这些可能归因于菌株LXL-7的土壤学来源。另外,在微生物制剂中降解菌株与原有菌株之间的相互作用和合适配比还有待于进一步研究,特别是它们之间复杂的相互作用应该被关注。另外,诸如基质的物理化学特征、营养状况、pH、温度以及生物因子等环境因素都会对生物修复过程造成影响[24,25];已有的研究结果也表明了pH、温度以及农药浓度等因素都会在一定程度上影响菌株LXL-7对噻吩磺隆的生物降解,因此,在应用研究中还需关注其具体的应用环境条件。
4 结论
本实验分离到一株能高效降解噻吩磺隆的枯草芽孢杆菌LXL-7(Bacillus subtilis)。菌株LXL-7降解噻吩磺隆的适宜pH值为7.0-8.0,适宜温度为30-35℃,该菌株还对噻吩磺隆和NaCl有很好的耐受性。菌株LXL-7能被直接应用于被噻吩磺隆污染的土壤,并在其中发挥降解噻吩磺隆的作用,施用了菌株LXL-7的土壤中噻吩磺隆(浓度为100 mg/kg)的7 d降解率可达到98%以上。另外,利用菌株LXL-7和已有的活菌制剂开发了一种多功能活菌制剂,新的制剂在原有功能的基础上增加了降解噻吩磺隆的新功能。
[1]李影. 微生物降解磺酰脲类除草剂的研究进展[J]. 农药科学与管理, 2013, 34(2):19-23.
[2]李新安, 赵华, 李广领, 等. 噻吩磺隆在不同类型土壤中的降解行为[J]. 农药, 2012, 51(1):55-57.
[3]熊兴明, 黎理, 刘春来, 等. 噻吩磺隆在小麦和土壤中的残留降解动态研究[J]. 湖南农业大学学报:自然科学版, 2009, 35(1):104-106, 110.
[4]Brashi I, Calamai L, Cremonini MA, et al. Kinetic and hydrolysis mechanism of triasulfuron[J]. J Agri Food Chem, 1997, 45(11):4495-4499.
[5]Andersen SM, Hertz PB, Holst T. Mineralisation studies of14C-labelled metsulfuron-methyl, tribenuron-methyl, chlorsulfuron and thifensulfuron-methyl in one Danish soil and groundwater sediment profile[J]. Chemosphere, 2001, 45:775-782.
[6]Jean P, Cambon JB. Mechanism of thifensulfuron-methyl transformation in soil[J]. J Agric Food Chem, 1998, 46(3):1210-1216.
[7]Hugh M, Brown M. Degradation of thifensulfuron-methyl in soil:role of microbial carboxy esterase activity[J]. J Agric Food Chem, 1997, 45(5):995-961.
[8]Geraldine P, Danielle V, Jean B. Microbial hydrolysis of methyl aromatic esters by Burkholderia cepacia isolated from soil[J]. FEMS Microbiology Ecology, 2001, 37:251-258.
[9]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[10]Holt JG. Bergey’s manual of determinative bacteriology[M]. 9th Edition. Lippincott Williams & Wilkins, 1993.
[11]NY/T 2067-2011. 土壤中13种磺酰脲类除草剂残留量的测定/液相色谱串联质谱法[S].
[12]Singles SK, Dean GM, Kirkpatrick DM. Fate and behavior of flupyrsulfuron-methyl in soil and aquatic systems[J]. Pestic Sci, 1999, 55:288- 300.
[13]Dinelli G, Vicari A, Bonetti A, Catizone P. Hydrolytic dissipation of four sulfonylurea herbicides[J]. Journal of Agricultural and FoodChemistry, 1997, 4(45):1940-1945.
[14]邹月利, 陶波. 磺酰脲类除草剂的降解机制及代谢产物的研究进展[J]. 农药科学与管理, 2011, 32(10):24-31.
[15]Cambon JP, Bastide J. Hydrolysis kinetics of thifensulfuron methyl in aqueous buffer solutions[J]. J Agric Food Chem, 1996, 44:333-337.
[16]刘春来. 噻吩磺隆在小麦上的残留分析方法及残留动态研究[D]. 长沙:湖南农业大学, 2006.
[17]崔昕, 张微, 魏昌贵. 噻吩磺隆的残留分析及其在玉米田的残留规律研究[J]. 农药学学报, 2007, 9(3):291-296.
[18]叶发兵, 王建明, 欧阳天贽. 磺酰脲类除草剂在土壤中的残留研究动态和趋势[J]. 湖北农业科学, 2002, 5:88-90.
[19]Felsot A, Maddox JV, Bruce W. Enhanced microbial degradation of carbofuran in soils with histories of carbofuran use[J]. Bull Environ Contam Toxicol, 1989, 26:781-788.
[20]艾海新. 耐盐硝基苯降解菌特性分析及其部分基因克隆[D].大连:大连理工大学, 2008.
[21]Andersen SM, Hertz PB, Holst T, et al. Mineralisation studies of14C-labelled metsulfuron-methyl, tribenuron-methyl, chlorsulfuron and thifensulfuron-methyl in one danish soil and groundwater sediment profile[J]. Chesphere, 2001, 45:775-782.
[22]Menne HJ, Berger BM. Influence of straw management, nitrogen fertilization and dosage rates on the dissipation of five sulfonylureas in soil[J]. Weed Res, 2001, 41:229-244.
[23]战力. 噻吩磺隆在水体中降解的影响因素研究[J]. 湖南农业科学, 2013(11):33-36.
[24]肖艳松, 谭琳, 陈桂华. 磺酰脲类除草剂的微生物降解[J].农药研究与应用, 2007, 11(3):15-19.
[25]Ajit KS, Jean S. Hydrolysis of sulfonylurea herbicides in soils and aqueous solutions:a review[J]. J Agric Food Chem, 2002, 50(22):6253-6265.
(责任编辑 马鑫)
Isolation and Utilization of a Thifensulfuron-methyl-degrading Bacterium,Bacillus subtilis LXL-7
LI Xiao-lou
(Department of Architecture and Environmental Engineering Department,Sichuan Vocational and Technological College,Suining 629000)
A strain LXL-7 isolated from soil highly degrades thifensulfuron-methyl,and was identified as Bacillus subtilis. The degradation rate by LXL-7 reached 99.6% in mineral salt medium of thifensulfuron-methyl(100 mg/L)after 72 h. The optimal pH value and temperature were 7.5 and 30-35℃. The strain tolerated well to thifensulfuron-methyl and salt,at least to 400 mg/L of thifensulfuron-methyl and 4.0% NaCl. In addition,adding strain LXL-7 in the commercial preparation for soil amendment,a new multiple-function microbial preparation was developed,and it had an additional new function of degrading thifensulfuron-methyl residue in soil except original functions. Therefore,the strain LXL-7 could be considered for bioremediation of thifensulfuron-methyl pollution and development of microbial preparation.
thifensulfuron-methyl;Bacillus subtilis;biodegradation;microbial preparation
10.13560/j.cnki.biotech.bull.1985.2016.05.023
2015-09-14
四川省教育厅重点项目(13ZA0036)
李晓楼,男,硕士,副教授,研究方向:环境微生物及微生物应用;E-mail:3141024328@qq.com
