猪圆环病毒衣壳蛋白在枯草芽孢杆菌中的表达研究
2016-06-23陈灵艳陈先进蒋烨吕暾
陈灵艳陈先进蒋烨吕暾
(1. 福州大学生物科学与工程学院,福州 350108;2. 福州大北农生物科技有限公司,福州 350014)
猪圆环病毒衣壳蛋白在枯草芽孢杆菌中的表达研究
陈灵艳1陈先进2蒋烨1吕暾1
(1. 福州大学生物科学与工程学院,福州 350108;2. 福州大北农生物科技有限公司,福州 350014)
研究猪圆病毒衣壳蛋白在枯草芽孢杆菌中的表达情况。以3个不同的质粒为基础,构建不同类型的猪圆环病毒衣壳蛋白基因(PCV2-ORF2)重组表达载体,并分别转化进入枯草芽孢杆菌168和WB800中。利用SDS-PAGE和Western blot检测目的蛋白的表达,并通过实时荧光定量PCR检测目的基因的转录水平上的表达情况。结果显示,ORF2基因原序列在枯草芽孢杆菌中难以表达,经过密码子优化后,构建的截短ORF2基因表达载体在枯草芽孢杆菌内表达系统中成功表达目的蛋白。密码子优化促进了目的基因的表达。
猪圆环病毒衣壳蛋白;枯草芽孢杆菌;实时定量PCR;密码子优化
20世纪70年代首次发现猪圆环病毒(Porcine circovirus,PCV), 在 传 代 培 养PK15细 胞 中,Tischer鉴定出一种细小的病毒样粒子。8年之后,Tischer等[1]对病毒样的纯化核酸样品进行核酸敏感性分析、沉降分析、电子显微镜观察之后得以证明,该病毒的基因组是由一个大小为1.76 kb闭环单链DNA(ssDNA)构成,并命名为猪圆环病毒。PCV有两个基因型,PCV1为非致病性病毒,PCV2为致病性病毒。PCV2是养猪业的危害性比较大的病毒病原体,该病毒能引起多系统衰竭综合征(PMWS)和猪皮炎和肾病综合症(PDNS),给我国养猪业带来重大损失[2]。
通常通过注射疫苗来预防猪圆环病毒引起的相关疾病。亚单位疫苗是指采用微生物某种表面结构成分(如抗原)制成的不含核酸,且能有效激发机体产生抗体,纯品可以直接注射使用的疫苗[3]。以亚单位疫苗为代表的新一代疫苗,其安全性远远大于传统疫苗。采用基因工程方法,人们能通过克隆得到编码病毒保护性抗原的基因,并且在体外对其进行改造或者修饰,再将其重新转移至异源生物宿主体内或者培养细胞中,以获得病毒蛋白的大量表达。基因工程亚单位疫苗是在原核或真核细胞中表达抗原基因,再将此生物合成的基因产物制成疫苗[4]。
Cap蛋白是PCV2病毒的衣壳蛋白和主要免疫原性蛋白。Cap蛋白基因编码蛋白的N端1-41位氨基酸为高度保守且富含碱性氨基酸的核定位序列(NLS),第12-18和34-41位氨基酸对Cap蛋白在细胞核中的定位起了决定作用,但该核定位序列不含主要的抗原位点[5],该序列中含有大量串联的稀有密码子,稀有密码子会制约翻译的速率与效率。对于难于表达的外源基因可通过优化密码子实现高水平或者增量表达。2009年,Marcekova和Bumba[6]首先报道了一个优化序列(GenBank EU376523),使得ORF2蛋白在大肠杆菌BL21中获得了10 mg/L的表达量。2012年,Wu和Huang等[7]报道了一个优化的序列(GenBank AY885225),也获得了全长蛋白的成功表达。
枯草芽孢杆菌(Bacillus subtilis)隶属芽孢杆菌属,是单细胞的原核生物,细胞壁不含有内毒素,为好氧型的革兰氏阳性菌。枯草芽孢杆菌自身不产毒素和致热致敏蛋白质,也不具致病性,而且只有单层的细胞膜,能直接分泌大量蛋白至培养基中,使其成为一些重要工业酶制剂的生产菌株[8]。自20世纪60年代以来,国内外研究者就深入研究了枯草芽孢杆菌的生理、生化、分子生物学及遗传特性,将其作为革兰氏阳性细菌的典型代表[9]。枯草芽孢杆菌表达系统一个限制因素是胞外蛋白酶,枯草芽孢杆菌中应用最为广泛的宿主B. subtilis 168,生长到对数末期时会分泌表达大量多种蛋白酶,导致一些特别是蛋白酶敏感的目的蛋白降解,大大降低了蛋白产率。Wu等[10]利用基因失活的突变方法,成功构建一株枯草杆菌蛋白酶、金属蛋白酶、中性蛋白酶A、中性蛋白酶B、芽孢杆菌肽酶F和胞外蛋白酶等基因缺失的菌株WB800,胞外蛋白酶的活力只有野生型的0.32%,用此菌株表达的β-半乳糖苷酶,表达量提高了16倍。
本研究通过将不同长度和优化前后的PCV2-ORF2基因构建到不同启动子的表达载体上,通过SDS-PAGE和Western blot检测目的蛋白的表达,并通过RT-qPCR检测目的基因的转录水平上的表达情况。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 猪圆环病毒2型DBN-SX07毒株由福州大北农生物技术有限公司提供;质粒pHT43、pXYL,枯草芽孢杆菌168、WB800由本实验室保存。
1.1.2 主要试剂和培养基 各种DNA限制性内切酶、T4 DNA连接酶、DL2000 DNA Ladder Marker、Protein Molecular Weight Marker等购自TaKaRa公司;DEPC、Total RNA Extractor(Trizol)、RNase free-DNase I、琼脂糖M、IPTG、Tris饱和酚、SanPrep柱式胶回收试剂盒、氨苄青霉素钠、氯霉素等均购自生工生物工程(上海)有限公司;PCR Mix、Goldview等购自于北京鼎国生物有限公司;无液氮RNA样品储存液购于百泰克;M-MLV First Strand kid购于Invitrogen;Top Green qPCR SuperMix TMB、HRP标记抗体购于全式金;DAB底物显色液试剂盒购于康为世纪;酵母提取物Yeast extract、胰蛋白胨Tryptone购自Oxoid公司;其它试剂均采用进口分装或国产分析纯。
LB液体培养基:1.0% Tryptone、0.5% Yeast Extract、1.0% NaCl,pH7.0。
LB固体培养基:在上述LB液体培养基中加1.5%的琼脂。
1.2 方法
1.2.1 重组质粒构建 提取DBN-SX07毒株的基因组,根据NCBI公布的DBN-SX07毒株的ORF2基因序列(HM641752.1),设计全长基因ORF2及截短基因ORF2'的上下游引物,扩增全长702 bp及去除N端123个碱基核定位序列的579 bp的目的片段,分别克隆至IPTG诱导的表达载体pHT43及木糖诱导的表达载体pXYL的相应位点,构建枯草芽孢杆菌表达载体,即pHT43-ORF2、pHT43-ORF2'、pXYL-ORF2及pXYL-ORF2'。将载体质粒pHT43的信号肽去除,构建一个枯草芽孢杆菌胞内的表达载体pHT43-A。克隆ORF2基因的全长及截短基因至该表达载体上,分别构建表达载体pHT43-A-ORF2及 pHT43-A-ORF2',也将优化ORF2基因后的全长及截短基因克隆至此表达载体中得到O-pHT43-A-ORF2及O-pHT43-A-ORF2'。在本次实验中涉及的基因与质粒,见于表1。

表1 本次实验中涉及的基因与质粒
1.2.2 目的蛋白的表达和检测 将构建成功的表达载体通过Spizizen法制备枯草芽胞杆菌感受态细胞,将重组质粒转化进入枯草芽胞杆菌;通过菌液PCR验证转化子,挑选阳性克隆;转接阳性克隆至新鲜LB培养基中继续培养,当OD600达到0.5时,加IPTG(终浓度1 mmol/L)或者木糖诱导表达目的蛋白,以不诱导的菌株作为对照,通过SDS-PAGE和Western blot验证目的蛋白的表达。
1.2.3 RT-qPCR检测目的基因的转录水平 挑取阳性转化子,转接至新鲜LB液体培养基中,当OD600达到0.5时,加IPTG(终浓度1 mmol/L)或者木糖诱导表达目的蛋白,以不诱导的菌株作为对照,诱导6 h以后,离心收集菌体,利用Trizol提取实验组和对照组样本的RNA,利用逆转录试剂盒(TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix,购自全式金生物技术有限公司)将RNA逆转录为cDNA,以cDNA 为模板,以L7Ae作为内参基因,进行qPCR,每组3个重复,将Ct值通过比较Ct值法转化为相对表达量,计算基因的在转录水平上的相对表达量。
2 结果
2.1 重组质粒构建结果
利用双酶切将目的基因构建到表达载体上,形成重组质粒,通过热激法制备大肠杆菌感受态细胞,将重组质粒转化进入大肠杆菌,菌液PCR后进行琼脂糖凝胶电泳,有目的条带产生(数据未给出),将阳性克隆送去生工生物有限公司测序,经序列比对,无突变位点。构建的重组质粒图谱,如图1。
2.2 目的蛋白检测
将构建好的表达载体pHT43-ORF2、pHT43-ORF2'及pXYL-ORF2、pXYL-ORF2'分别转化至枯草芽孢杆菌宿主菌168及WB800中,诱导表达后,裂解细胞,获得菌体蛋白,然后经SDS-PAGE及Western blot,都未出现目的条带(数据未给出),说明以上4个分泌表达重组质粒未能在枯草芽孢杆菌中成功表达。载体pHT43-A-ORF2及pHT43-AORF2'转化至枯草芽孢杆菌168及WB800,诱导后检测后也没有目的蛋白表达(数据未给出)。因几个重组质粒均不能成功表达目的蛋白,故对全长和截短基因进行稀有密码子的优化,以使目的基因能够在枯草芽孢杆菌系统中成功表达。优化全长和截短基因重组质粒O-pHT43-A-ORF2及O-pHT43-A-ORF2'也被转化至枯草芽孢杆菌168和WB800,诱导表达,经SDS-PAGE和Western blot检测(图2),优化的全长基因未能表达,但是优化的截短基因却能成功表达。
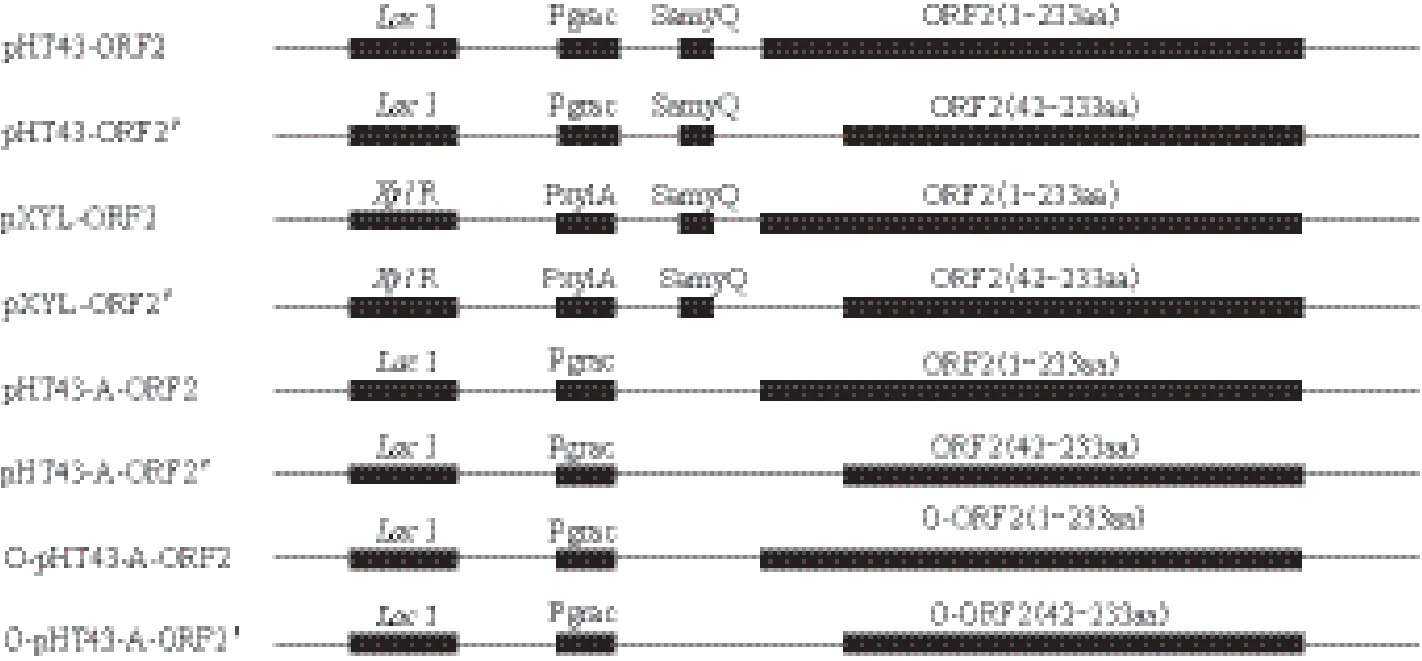
图1 表达载体的构建

图2 Western blot检测枯草芽孢杆菌中重组Cap蛋白的表达
2.3 目的基因转录水平检测结果
将转化有表达载体pHT43-ORF2及pHT43-ORF2'的枯草芽孢杆菌168分别命名为B.subtilis 168(pHT43-ORF2) 及 B. subtilis 168(pHT43-ORF2'),采用B.subtilis 168的核糖体蛋白L7Ae作为内参,以未诱导的表达菌体作为对照组,以诱导的表达菌株作为实验组,进行RT-qPCR。根据目的基因及参考基因的扩增曲线图及熔解曲线图分析数据的可靠性,由比较Ct值法即2-△△Ct,其中ΔΔ Ct=(Ct目的基因- Ct参考基因)实验组-(Ct目的基因- Ct参考基因)对照组计算,得到B. subtilis 168(pHT43 -ORF2)中诱导ORF2基因相对内参基因L7Ae转录表达量为278.2041,B. subtilis 168(pHT43-ORF2')中诱导ORF2截短基因相对内参基因L7Ae转录表达量为60.72,所得结果如图3所示,图3说明了全长与短截的目的基因都有转录至mRNA,且全长基因的mRNA表达量是截短基因的4.5倍左右。
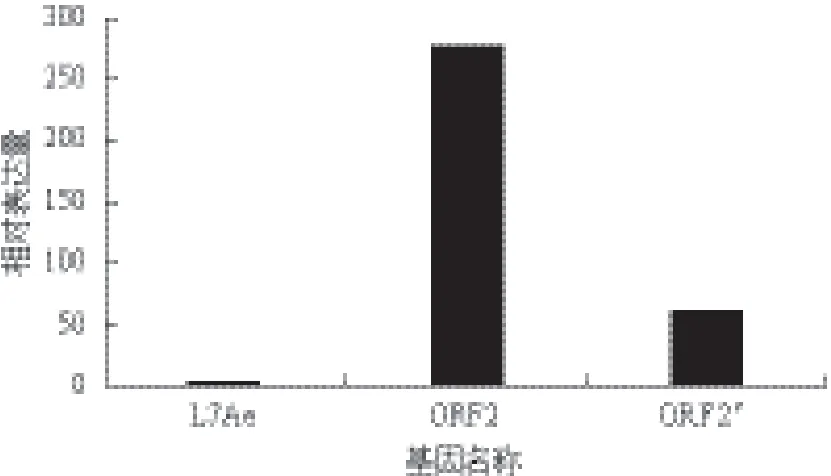
图3 B.subtilis 168(pHT43-ORF2)中ORF2全长基因以及B.subtilis 168(pHT43-ORF2')中ORF2截短基因的mRNA相对表达量
将转化有表达载体pHT43-A-ORF2'及O-pHT43-A-ORF2'的枯草芽孢杆菌168分别命名为B.subtilis 168(pHT43-A-ORF2')及B.subtilis 168(O-pHT43-AORF2'),采用B.subtilis168的核糖体蛋白L7Ae作为内参,以诱导的未优化截短基因的表达菌体作为对照组,以诱导的优化截短基因的表达菌株作为实验组,进行RT-qPCR。根据目的基因及参考基因的扩增曲线图及熔解曲线图分析数据的可靠性,由比较Ct值法计算,得到B.subtilis 168(pHT43-A-ORF2')中ORF2基因相对于内参基因L7Ae的相对表达量为37.96(图4-A);B.subtilis 168(O-pHT43-A-ORF2')中ORF2基因相对内参基因L7Ae的相对表达量为10.31(图4-A);B.subtilis 168(O-pHT43-A-ORF2')中ORF2基因相对B.subtilis 168(pHT43-A-ORF2')中ORF2基因的转录表达量为0.27(图4-B)。
从图4可以看出,优化后的短截基因的mRNA的表达水平低于未优化的短截基因,说明优化的截短基因的转录水平有所降低。
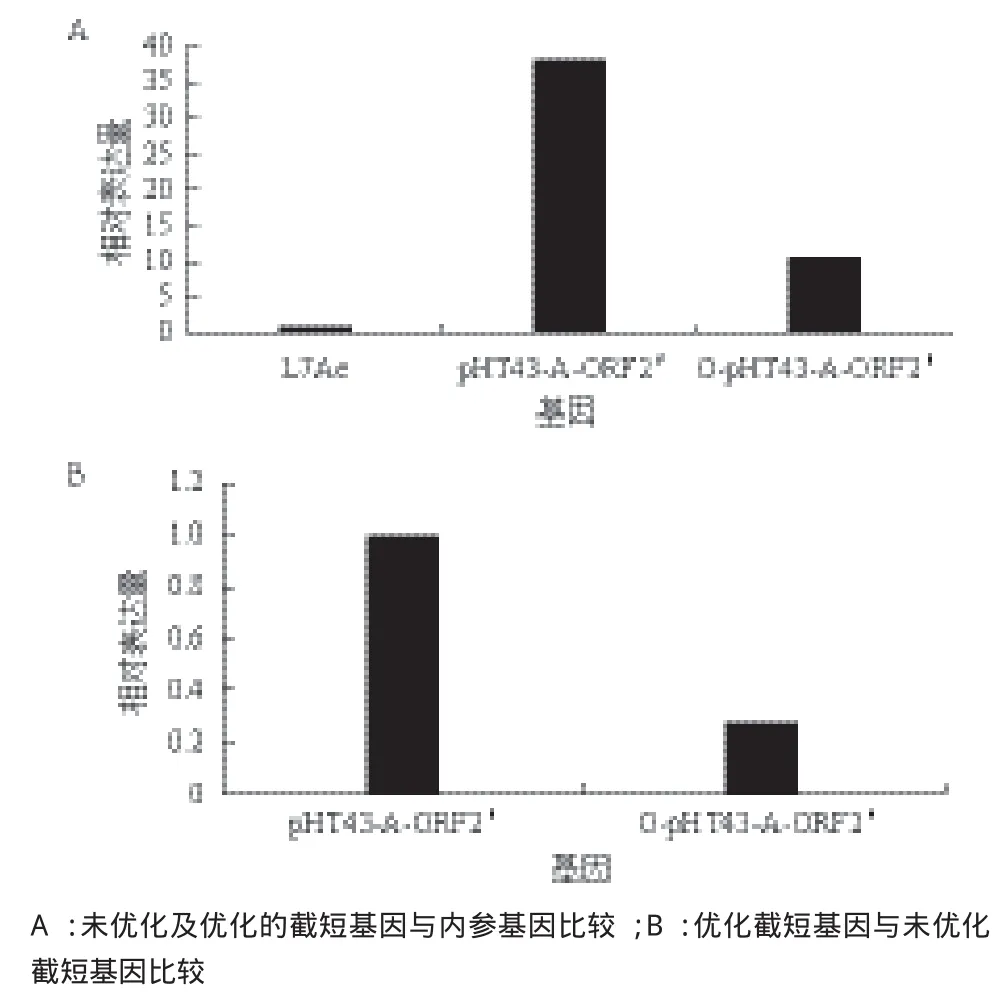
图4 优化前后截短ORF2基因的相对表达量
将转化有表达载体pHT43-A-ORF2及O-pHT43-A-ORF2的枯草芽孢杆菌168分别命名为B.subtilis 168(pHT43-A-ORF2)及B.subtilis 168(O-pHT43-AORF2),采用B.subtilis 168的核糖体蛋白L7Ae作为内参,以诱导的未优化截短基因的表达菌体作为对照组,以诱导的优化截短基因的表达菌株作为实验组,进行RT-qPCR。根据目的基因及参考基因的扩增曲线图及熔解曲线图分析数据的可靠性,由比较Ct值法计算,得到B.subtilis 168(pHT43-A-ORF2)中ORF2基因相对于内参基因L7Ae的相对表达量为11.37(图5-A);B.subtilis 168(O-pHT43-A-ORF2)中ORF2基因相对内参基因L7Ae的相对表达量为10.77(图5-A);B.subtilis 168(O-pHT43-A-ORF2)中ORF2基因相对B.subtilis 168(pHT43-A-ORF2)中ORF2基因的转录表达量为0.94(图5-B)。
从图5可以看出,优化后的全长基因的mRNA的表达量低于未优化的全长基因,说明全长基因被优化后转录水平降低了。
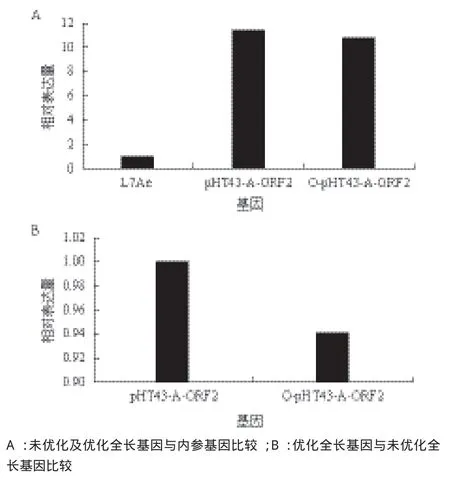
图5 优化前后全长ORF2基因的相对表达量
3 讨论
本研究根据枯草芽孢杆菌的表达系统特点,优化PCV2的稀有密码子,成功表达了不含NLS序列的Cap蛋白,但Western blot检测到目的条带,说明此优化策略对于蛋白表达是有效的,要提高蛋白表达量需进一步优化培养条件、诱导条件或者增加分子伴侣。
在枯草芽孢杆菌内分泌表达系统中,目的基因密码子优化之后,不论是全长基因还是截短基因的转录水平均要低于优化之前,说明优化目的基因在转录水平能够表达,但目的基因优化后转录水平上有所降低;经过优化后的全长和截短基因在内表达系统中经过诱导后,只检测到截短的基因有所表达,全长基因未表达。按照合理的推论,优化后的全长和截短基因都能在正常表达,这与实验结果是矛盾的,分析原因可能是全长基因N端的信号肽中仍然含有优化不到或者无法优化的密码子,或者一种尚未被发现的细胞机制在起着作用,致使全长的基因翻译过程受到阻碍。
优化后的截短基因分别转化入枯草芽孢杆菌168菌株和WB800菌株,诱导表达之后都有检测到目的蛋白,且表达量相差较小。由于WB800是在枯草芽孢杆菌168菌株基础上缺失8个胞外蛋白酶基因,截短ORF2基因在两株菌中的表达量没有明显差异,表明胞外蛋白酶基因对目的蛋白的表达影响较小。
本实验中用到了两种不同的启动子Pxyl和Pgrac,其中Pgrac启动子所在的重组质粒实现了目的蛋白的表达,但是木糖启动子(Pxyl)所在的重组质粒没有实现表达,可能是由于不同的启动子识别的σ因子有所不同,实验所用的菌株刚好不适合用木糖启动子。同时,本实验采用了不同的诱导基因,主要是木糖诱导基因(XylR)和IPTG诱导基因(lacI),木糖诱导时没有实现目的蛋白的表达,IPTG 诱导实现了目的蛋白的表达,目前木糖诱导基因在枯草芽孢杆菌中的报道比较少,Gartner等[5]研究发现,木糖操纵子是一负操纵子,其调节作用由一阻遏蛋白执行,可能本实验所使用的宿主中这一蛋白没有表达或者表达量不足以激起该操纵子的作用。
4 结论
本研究通过密码子优化,利用内分泌系统,成功地在枯草芽孢杆菌中表达了猪圆环病毒ORF2截短基因。分别在转录与翻译的水平上分析猪圆环病毒ORF2基因的表达情况,已经可以确定该基因不能在枯草芽孢杆菌中较好地表达的原因主要是翻译过程出现了问题。
[1]TuYB, WangYQ, Wang G, et al. High-level expression and immunogenicity of a porcine circovirus type 2 capsid protein through codon optimization in Pichia pastoris[J]. Applied Microbiology & Biotechnology, 2012, 97(7):2867-2875.
[2]吴瑗. 金华地区猪圆环病毒病流行病学调查[D]. 南京:南京农业大学, 2010.
[3]Nawagitgul P, Morozov I, Bolin SR, et al. Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J]. Journal of General Virology, 2000, 81(3):2281-2287.
[4]Beach NM, Meng XJ. Efficacy and future prospects of commercially available and experimental vaccines against porcine circovirus type 2(PCV2)[J]. Virus Research, 2012, 164(1-2):33-42.
[5]Liu QG, Tikoo SK, Babiuk LA. Nuclear localization of the ORF2 protein encoded by porcine circovirus type 2[J]. Virology, 2001, 285(1):91-99.
[6]Marcekova Z, Psikal I, Kosinova E, et al. Heterologous expression of full-length capsid protein of porcine circovirus 2 in Escherichia coli and its potential use for detection of antibodies[J]. Journal of Virological Methods, 2009, 162(1-2):133-141.
[7]Wu PC, Lin WL, Wu CM, et al. Characterization of porcine circovirus type 2(PCV2)capsid particle assembly and its application to virus-like particle vaccine development[J]. Applied Microbiology & Biotechnology, 2012, 95(6):1501-1507.
[8]Spizizen J. Transformation of biochemically deficient strains of Bacillus Subtilis by deoxyribonucleate[J]. Proceedings of the National Academy of Sciences, 1958, 44(10):1072-1078.
[9]惠明, 窦丽娜, 田青, 等. 枯草芽孢杆菌的应用研究进展[J].安徽农业科学, 2008, 36(27):11623-11624, 11627.
[10]Bolhuis A, Tjalsrna H, Smith HE, et al. Evaluation of bottlenecks in the late stages of protein secretion in Bacillus subtilis[J]. Applied & Environmental Microbiology, 1999, 65(7):2934-2941.
(责任编辑 李楠)
Research on the Expression of Porcine Circovirus Capsid Protein in the Bacillus subtilis
CHEN Ling-yan1CHEN Xian-jin2JIANG Ye1LÜ Tun1
(1. College of Biology Science and Technology,Fuzhou University,Fuzhou 350108;2. Fuzhou Dabeinong Biotech Co.,Ltd. Fuzhou 350014)
The objective is to study the expression of porcine circovirus capsid protein in the Bacillus subtilis. Based on 3 different plasmids,different types of recombinant vectors for porcine circovirus capsid protein gene(PCV2-ORF2)were constructed,and they were transformed into strain 168 and WB800 of B. subtilis. The expression of the target protein was detected by SDS-PAGE and Western blot,and the mRNA expression of the target gene in B. subtilis was detected through RT-qPCR. The original ORF2 was difficult to be translated in B. subtilis expression system. After the codon optimization,truncated ORF2 gene was successfully expressed as target protein in intracellular expression system of B. subtilis. Thus,the optimization of the codons promoted the expression of the target gene.
porcine circovirus capsid protein;Bacillus subtilis;RT-qPCR;codon optimization.
10.13560/j.cnki.biotech.bull.1985.2016.05.018
2015-08-03
2013年福建省产学研重大专项(2012G106)
陈灵艳,女,硕士研究生,研究方向:生物化学与分子生物学;E-mail:871804232@qq.com
吕暾,男,研究员,研究方向:生物化学与分子生物学;E-mail:lvtun@yahoo.com
