HTS硝酸熔盐体系的高温热分解动力学行为
2016-06-22乔建江陈施晨
谢 枝, 乔建江, 陈施晨
(华东理工大学安全工程咨询中心,上海 200237)
HTS硝酸熔盐体系的高温热分解动力学行为
谢枝,乔建江,陈施晨
(华东理工大学安全工程咨询中心,上海 200237)
摘要:研究了HTS硝酸熔盐体系高温热分解的动力学行为,采用分光光度法测定HTS中硝酸根和亚硝酸根的含量,并研究其各自的热分解动力学参数。结果表明:在813~893 K的温度区间,HTS中硝酸根的分解主要受温度影响,其分解速率系数随温度呈指数型增大,主导硝酸根分解的反应为Ⅰ型反应,反应的表观活化能为189.8 kJ/mol,指前因子为7.48×105 s-1;亚硝酸根表现出更为复杂的动力学行为,亚硝酸根分解结果受温度与硝酸根分解反应共同影响。在813~873 K的温度区间,亚硝酸根的分解速率系数近似稳定在0.12×10-5~0.13×10-5s-1,当温度升至893 K时,亚硝酸根的分解速率系数减小为0.005 8×10-5s-1;HTS中硝酸根分解的表观活化能大于单组分硝酸盐分解活化能,三元混合盐的高温热稳定性高于单组分硝酸盐的高温热稳定性。
关键词:HTS; 分光光度法; 速率系数; 动力学行为
随着科技创新以及工业进步,硝酸熔盐因具有价格低廉、低熔点、腐蚀性小等优点被太阳能工业领域认可为最具前景的传热储热介质之一[1-4],也在废热利用、石油化工和金属及其合金制造[5],以及新能源领域得到广泛应用[6]。由于硝酸熔盐的广泛应用,其在工业应用中的高温热稳定性引起学者们的广泛关注。
硝酸熔盐高温易分解,可发生复杂的化学反应,其在高运行温度下发生的反应与熔盐种类、运行温度、气氛以及同类熔盐不同组成成分等有关。为了更好地研究硝酸熔盐高运行温度下的反应情况以及热稳定性,多数学者研究了单组分硝酸熔盐分解的化学动力学参数。Kramer等[7]采用变速率热分析得出硝酸钠、硝酸钾、亚硝酸钠和亚硝酸钾分解的表观活化能分别为137、143、122、139 kJ/mol;该学者还通过等温热分析[8]得出硝酸钠和硝酸钾分解的表观活化能分别为153 kJ/mol和146 kJ/mol,而亚硝酸钠分解的表观活化能为134 kJ/mol;Rajendran等[9]研究利用热重-差示扫描量热法(TG-DSC)曲线得出在798~1 016 K内,采用Kissinger方法计算得出硝酸钾的分解活化能为153.2 kJ/mol,指前因子为2.0×105s-1,采用Coats-Refern方法计算得出硝酸钾的分解活化能为152.2 kJ/mol,指前因子为2.98×105s-1。Bond等[10]研究发现温度为843~1 033 K,硝酸钠主要发生两步分解反应:(1)硝酸钠分解为亚硝酸钠,分解活化能为168.7 kJ/mol,指前因子为3.56×105s-1;(2)分解产生的亚硝酸钠继续分解为氧化钠,分解活化能为179.2 kJ/mol,指前因子为7.80×105s-1。
综上可以发现,多数学者对硝酸熔盐分解的动力学参数的研究多以单组分熔盐为研究对象。而在实际的工业应用中,多采用三元混合硝酸熔盐作为传热载体以及储热介质。由于混合熔盐中同时存在亚硝酸根与硝酸根,且亚硝酸根的稳定性弱于硝酸根,二者的转化情况不仅受温度影响,还受彼此分解程度制约,其热分解过程比单组分熔盐更复杂,采用传统的以热重分析为核心的热分析法无法确定其中硝酸根与亚硝酸根各自的高温热行为。因此,目前还鲜有对混合熔盐的动力学参数的研究。本文不仅研究了由硝酸钾、亚硝酸钠和硝酸钠以53∶40∶7的质量比例组成的混合硝酸盐体系(HTS体系)中硝酸根与亚硝酸根的高温热行为,还对其化学动力学参数进行了拟合。硝酸根与亚硝酸根的分解反应速率系数体现熔盐体系中硝酸盐与亚硝酸盐分解的速度,表观活化能体现分解的难易程度,通过测定二者的数值来判定在实际工业中熔盐体系的稳定性,区别于过去仅以上限使用温度作为熔盐稳定性的判定依据。本文将温度、反应时间以及载气条件等集于一体,更贴近实际工业熔盐的应用条件。因此对其化学动力学参数的研究可在一定温度范围内获悉熔盐分解程度的规律,以指导实际工业熔盐损耗的补给。
本文以工业应用中最常见的HTS为研究对象,选取其上限使用温度段813~893 K为研究区间(不同学者对上限使用温度有不同结论[11-13]),以氮气为载气,采用管式马弗炉加热并以定时保温的方式进行实验。研究中改进了国家标准中锅炉用水冷却水硝酸盐和亚硝酸盐的测定方法[14-15],该方法可同时测定硝酸熔盐中硝酸根与亚硝酸根的含量,从而确定HTS中硝酸根与亚硝酸根各自的动力学参数。
1实验部分
1.1实验方法
以管式马弗炉为主体加热设备;以气体钢瓶配合大管径耐高温且密封性能良好的石英管-不锈钢法兰组合作为载气通路,石英管内的样品槽为带盖的刚玉方舟(盖上配有气体逸散气孔,既保证了样品不因沸腾损失又可以使产生的气体及时逸散);以压力表、气体流量计、冷凝管以及安全阀等为安全配件,防止气体超压与过热。具体实验装置见图1。
HTS受热后组成成分含量发生改变,将受热后的HTS溶于去离子水,采用分光光度法检测受热后熔盐中硝酸根和亚硝酸根的剩余含量。
在219 nm波长处,硝酸盐和亚硝酸盐的摩尔吸光系数相等;而在样品中加入氨基磺酸可破坏亚硝酸根在此波长处的吸光度,同时氨基磺酸的加入不会影响硝酸根在此波长处的吸光度。根据朗伯比尔定律,将此波长处硝酸根与亚硝酸根各自的吸光度加以分析计算,便可得出剩余含量。
1.2实验仪器及药品
实验仪器主要包括日本岛津公司UV-2550型分光光度计;上海微行炉业有限公司MXG1200-60型管式马弗炉;梅特勒·托利多AL104型电子天平。其他实验仪器还有电热鼓风干燥箱、氧化铝坩埚、瓷坩埚和研钵等。
实验药品包括硝酸钾(GR,国药集团化学试剂有限公司);亚硝酸钠(GR,永华化学科技(江苏)有限公司);硝酸钠(AR,上海振欣试剂厂);氨基磺酸(AR,上海凌峰化学试剂有限公司)。
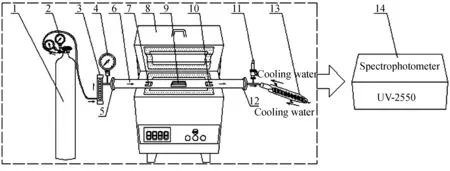
1—Steel cylinder;2—Reducing valve;3—Rotor flow meter;4—Pressure gage;5,12—Flange;6—Quartz tube;7,10—Heat insulation plug;8—Tubular resistance box;9—Corundum ark;11—Safety valve;13—Annular condenser pipe;14—Spectrophotometer
图1实验装置图
Fig.1Experimental setup
1.3实验步骤
样品制备:将硝酸钾、亚硝酸钠与硝酸钠按53∶40∶7的质量比称量后添加进研钵中,研磨充分均匀后,放入瓷坩埚中,烘干备用。
样品中硝酸根与亚硝酸根含量测定:(1)制作标线。硝酸根与亚硝酸根的标线制作步骤具体参照国标GB/T 6912-2008[13]和GB/T 6912.1-2006[14]操作;(2)样品测定。称取混合盐5 g,经管式炉加热至设定温度,保温特定时间后待冷却至室温,称重,溶于去离子水中,并用1 000 mL容量瓶定容,记为A;从A中取0.5 mL溶液于100 mL容量瓶中,做3组平行样,分别记为B1、B2、B3;再从A中取0.5 mL溶液于100 mL容量瓶中,做3组平行样,分别记为C1、C2、C3;称取2.5 g氨基磺酸溶于去离子水中,定容于250 mL容量瓶,记为D;分别在C1、C2、C3中加入50 mL的D;按照分光光度计UV-2550操作说明以及国标GB/T 6912-2008[13]和GB/T 6912.1-2006[14],测定硝酸根与亚硝酸根在此波长处的吸光度,并记录;将所得吸光度带入标线计算可得硝酸根与亚硝酸根的含量。
2结果与讨论
2.1温度对HTS热分解行为的影响
2.1.1概述实验研究了在不同温度下HTS中硝酸根和亚硝酸根的分解变化情况。实验设置813、833、853、873、893 K 5个温度梯度,研究在不同温度、不同保温时间下HTS中硝酸根与亚硝酸根含量的变化规律。
2.1.2受热温度对HTS中硝酸根分解的影响为了探究受热温度对HTS中硝酸根分解的影响,在不同保温温度下设置了不同的保温时长,首先以升温至该保温温度的HTS中的硝酸根含量作为起始硝酸根含量,再测定该温度下不同保温时长HTS中硝酸根的含量,并计算其相对失重百分比,即可得出不同温度下HTS中硝酸根的变化情况。具体结果见图2。

图失重图
从图2可知,随着保温时间的增加,硝酸根的损失逐渐增大;在不同温度下硝酸根的分解速率不同,随着温度的增加,硝酸根的分解速率增大。

从图3可直观得出硝酸根的相对损失量与保温时间具有良好的线性相关性,具体拟合参数与结果见表1。
从表1可知,随着温度增加,硝酸根的分解速率系数逐渐增加,温度每升高20 K,分解速率系数约为原来的两倍。说明在813~893 K温度区间,温度对硝酸根的分解速率系数具有重要影响,是诱导硝酸熔盐劣化的重要因素。

图相对失重拟合图
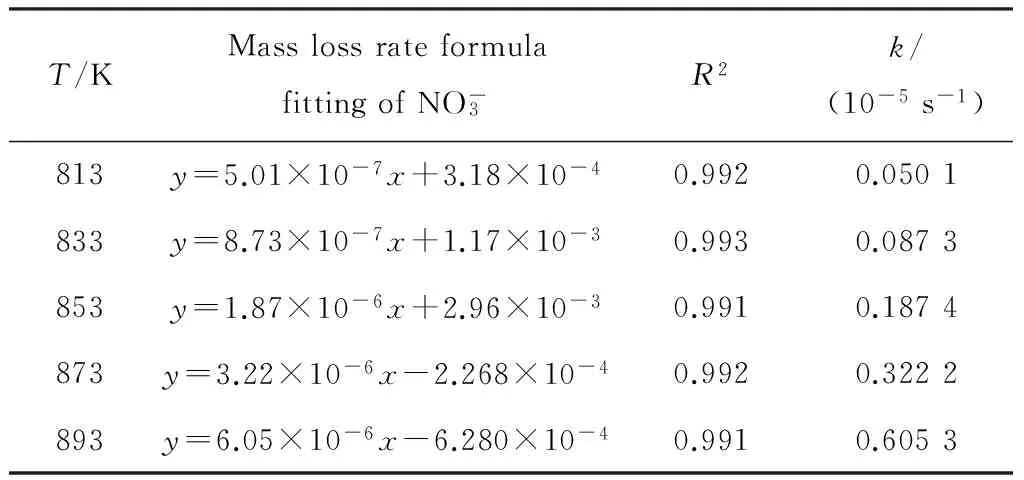
T/KMasslossrateformulafittingofNO-3R2k/(10-5s-1)813y=5.01×10-7x+3.18×10-40.9920.0501833y=8.73×10-7x+1.17×10-30.9930.0873853y=1.87×10-6x+2.96×10-30.9910.1874873y=3.22×10-6x-2.268×10-40.9920.3222893y=6.05×10-6x-6.280×10-40.9910.6053
R2—Square of the correlation coefficient;k—Decomposition rate coefficient;x—Holding time;y—Relative mass loss
2.1.3受热温度对HTS中亚硝酸根分解的影响实验在不同保温温度下设置了不同的保温时长,首先以升温至该保温温度的HTS中的亚硝酸根含量作为起始亚硝酸根含量,再测定该温度下不同保温时长HTS中亚硝酸根的含量,并计算其相对失重百分比,可得出不同温度下HTS中亚硝酸根的变化情况。具体结果见图4。
从图4可知,随着保温时间的增加,亚硝酸根的损失逐渐增大;温度为873、853、833、813 K时,亚硝酸根的分解速率差别不大,然而,温度为893 K时,亚硝酸根的分解速率明显小于其他4个温度点的分解速率。
为了更直观、深入地探究温度对亚硝酸根的分解速率系数的影响,将不同温度下亚硝酸根的相对损失量对保温时间进行线性拟合。拟合后的线性关系见图5。

图失重图
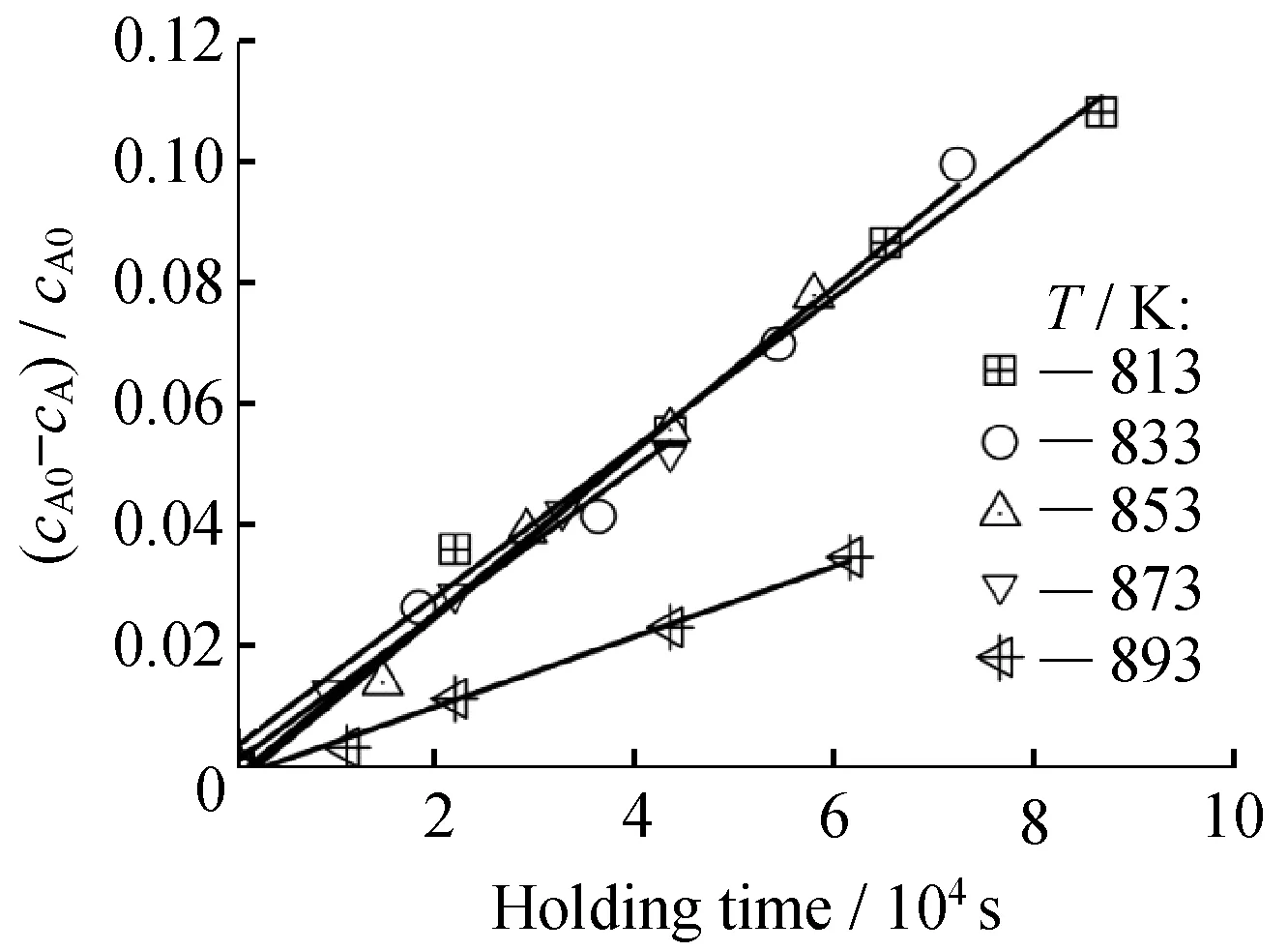
图相对失重拟合图
从图5可直观得出亚硝酸根的相对损失量与保温时间具有良好的线性相关性,具体拟合参数与结果见表2。

表相对失重线性拟合参数及结果
R2—Square of the correlation coefficient;k—Decomposition rate coefficient;x—Holding time;y—Relative mass loss
从表2可知,在813~873 K温度区间,温度对亚硝酸根的分解速率系数影响不大(稳定在0.12~0.13),在893 K亚硝酸根的分解速率系数变小为0.005 8。
2.2HTS动力学参数拟合
2.2.1HTS中的硝酸根分解动力学参数拟合讨论根据化学动力学温度对反应速率的影响理论,在一定温度范围内,温度是影响化学反应的十分敏感的因素,它的主要作用是改变速率系数。温度与速率系数满足阿仑尼乌斯方程[16]:
k=Ae-Ea/RT
式中:A为指前因子(s-1);Ea为活化能(kJ/mol);R为摩尔气体常量(J/(mol·K-1));T为温度(K)。
由硝酸根在不同温度下的k值,温度每上升20 K,k值将近为原来两倍,以lnk对1/T作图(图6)。
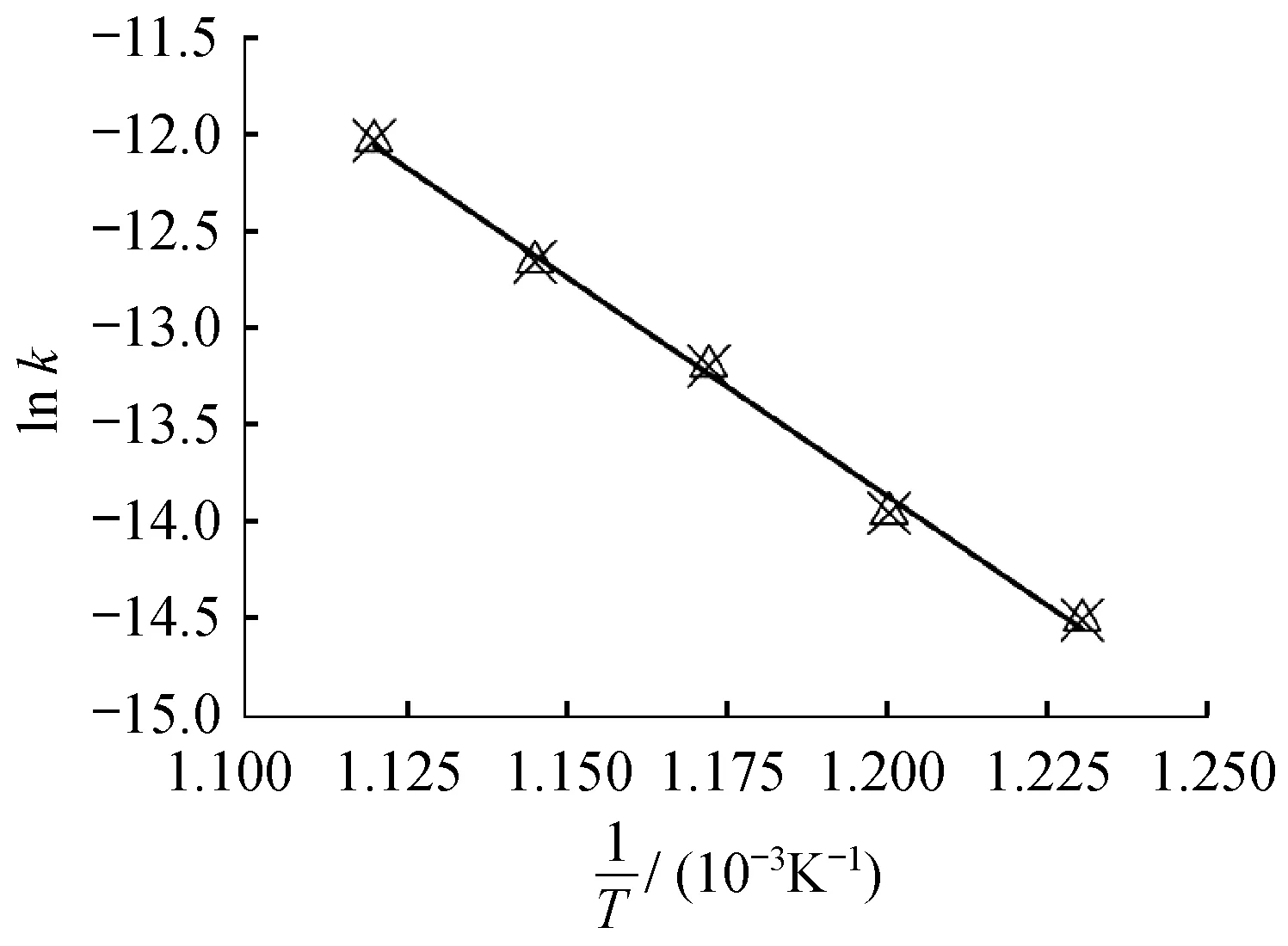
图损失的ln k -1/T图
由图6可知,硝酸根的lnk对1/T具有线性相关性,拟合公式为
计算得出阿仑尼乌斯活化能Ea为189.761 8 kJ/mol;指前因子A为747 881.6 s-1。
活化能表示物质反应所需能量,活化能越高,反应越难进行。单组分硝酸熔盐的分解表观活化能可参考文献值,具体数值见表3。由本文所得HTS中硝酸根分解表观活化能与单组分硝酸熔盐的分解表观活化能对比可知,HTS中硝酸根分解的表观活化能高于单组分熔盐分解的表观活化能,说明HTS的高温热稳定性大于单组分熔盐。

表3 单组分熔盐的动力学参数
由硝酸根分解的表观活化能与指前因子可得硝酸根分解的阿仑尼乌斯表达式:
k=747 881.6e-189.761 8(RT)-1
由硝酸根分解速率表达式可得硝酸根分解速率函数(图7),硝酸根反应速率随温度升高呈指数关系增大,主导硝酸根的反应属于Ⅰ型反应[16],说明在此区间,温度对主导硝酸根分解的反应具有重要影响。
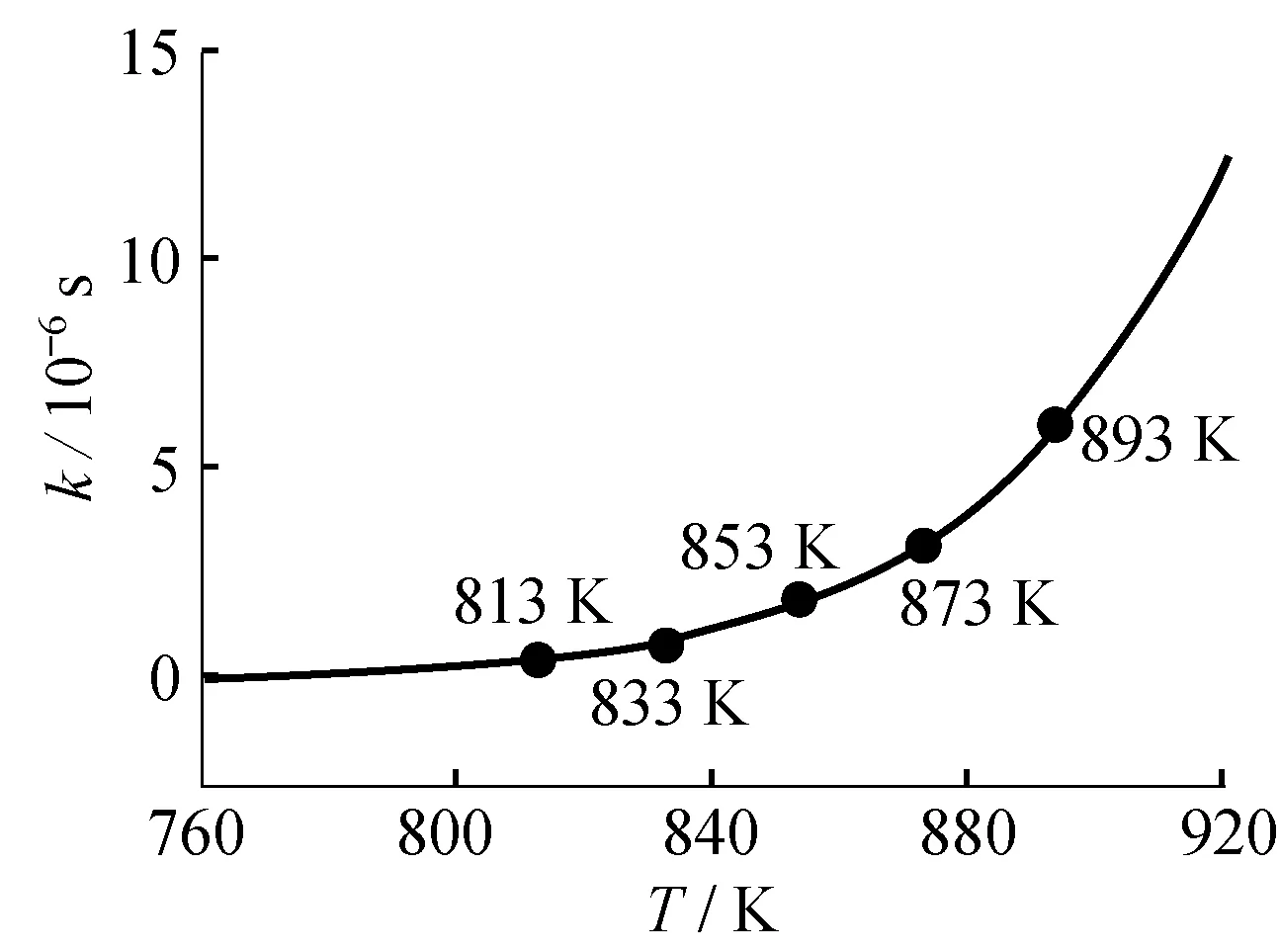
图分解速率函数
2.2.2HTS中的亚硝酸根分解动力学参数拟合讨论由亚硝酸根在不同温度的k值,以lnk对1/T作图(图8)。
由图8可知,亚硝酸根的lnk与1/T无线性相关性。说明在此温度区间,温度不是影响亚硝酸根分解的主要因素。由于亚硝酸根的不稳定性以及受硝酸根分解过程的影响,亚硝酸根在此温度区间表现出更复杂的动力学行为。推断在813~893 K温度区间,亚硝酸根损失速率的变化为多个化学反应共同作用的结果,生成亚硝酸根与消耗亚硝酸根的反应达到动态平衡,从而使温度对亚硝酸根损失率的影响不大,损失速率稳定在0.12×10-5~0.13×10-5K-1。当温度升至873 K时,平衡被打破,亚硝酸根的损失速率呈现下降情况,推测可能此时某一生成亚硝酸根的反应加强,使亚硝酸根的总体损失速率下降。
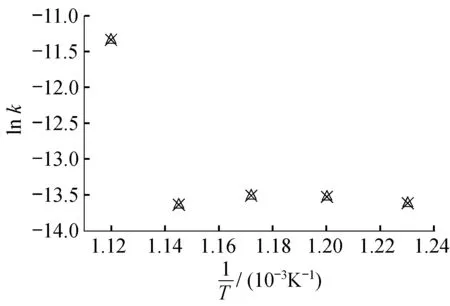
图损失的ln k -1/T图
3结论
(1)温度为813~893 K时,随着保温时长的增加,HTS中的硝酸根和亚硝酸根的损失量逐渐增加。
(2)温度为813~893 K时,温度是影响HTS中硝酸根热分解的主要因素,然而亚硝酸根的分解表现得更为复杂,其分解结果不仅受温度影响,还受硝酸根分解进程等因素影响。
(3)温度为813~893 K时,HTS中的硝酸根的反应速率系数随着温度升高逐渐增加;硝酸根的反应速率系数随温度升高呈指数型增大,主导硝酸根分解的反应属于Ⅰ型反应,分解的表观活化能约为189.8 kJ/mol,指前因子约为7.48×105s-1。
(4))温度为813~873 K时,温度对亚硝酸根的分解速率系数影响不大,亚硝酸根的分解速率系数近似为0.12×10-5~0.13×10-5s-1,当温度升至893 K时,亚硝酸根的分解速率系数则减小为0.005 8×10-5s-1。
(5)HTS中硝酸根分解的表观活化能大于单组分硝酸盐分解的表观活化能,而活化能表示物质反应所需能量,活化能越大物质越稳定,说明三元混合盐的高温热稳定性高于单组分熔盐的稳定性。
(6)现代工业多采用DCS监控,可实时获得生产系统的反应时间与反应温度,参照硝酸根的分解速率函数可计算获得实时硝酸根的损失量。根据具体工业应用情况可适时补给熔盐量,提高了生产效益与安全性。
(7)本文测试方法能定量测定反应速率、表观活化能、指前因子等动力学数据,已证明可以适合硝酸熔盐类载热体热稳定性的研究。根据从特殊到一般的归纳法推理,相信本方法亦可用于其他类熔盐载热体(如碳酸盐、氯化物盐等)和其他载热体(如导热油等)热稳定性的定量研究。
参考文献:
[1]BRADSHAW R W,CORDARO J G,SIEGEL N P.Molten nitrate salt development for thermal energy storage in parabolic trough solar power systems[C]//ASME 2009 3rd International Conference on Energy Sustainability.San Francisco,California,USA:American Society of Mechanical Engineers,2009:615-624.
[2]ZHAO Changying,WU Zhigen.Thermal property characterization of a low melting-temperature ternary nitrate salt mixture for thermal energy storage systems[J].Solar Energy Materials and Solar Cells,2011,95(12):3341-3346.
[3]LIU Ming,WASIM SAMAN,FRANK BRUNO.Review on storage materials and thermal performance enhancement techniques for high temperature phase change thermal storage systems[J].Renewable and Sustainable Energy Reviews,2012,16(4):2118-2132.
[4]WANG Tao,DIVAKAR MANTHA,RAMANA G,etal.Thermal stability of the eutectic composition in LiNO3-NaNO3-KNO3ternary system used for thermal energy storage[J].Solar Energy Materials and Solar Cells,2012,100:162-168.
[5]PACHECO J,SCHOWALTER S,KOLB W.Development of molten salt thermocline thermal storage system for parabolic trough plants[J].Solar Thermal Power,2002,124(2):153-159.
[6]杨武龙,姜洪涛,吴靥,等.熔盐在新能源领域的应用[J].过程工程学报,2012,12(5):893-899.
[7]KRAMER C M,MUNIR Z A,VOLPONI J V.Simultaneous dynamic thermogravimetry and mass spectrometry of the evaporation of alkali metal nitrates and nitrites[J].Journal of Thermal Analysis and Calorimetry,1983,27(2):401-408.
[8]KRAMER C M,MUNIR Z A,STERN K H.Evaporation of NaNO3,KNO3and NaNO2[J].High Temperature Science,1983,16(4):257-267.
[9]RAJENDRAN A G,AMMAL R A,KARTHA C B,etal.Thermal studies on boron-based initiator formulation[J].Defence Science Journal,1966,46(5):405-410.
[10]BOND B D,JACOBS P W M.The thermal decomposition of sodium nitrate[J].Journal of the Chemical Society A:Inorganic,Physical,Theoretical,1966,43(6):1265-1268.
[11]RENE I OLIVARES.The thermal stability of molten nitrite/nitrates salt for solar thermal energy storage in different atmospheres[J].Solar Energy,2012,86(9):2576-2583.
[12]KEARNEY D,KELLY B,BLAKE D,etal.Assessment of a molten salt heat transfer fluid in a parabolic trough solar field[J].Solar Energy Engineering,2003,125(171):170-176.
[13]彭强,魏小兰,丁静,等.多元混合熔融盐的制备其性能研究[J].太阳能学报,2009,30(12):1621-1626.
[14]中国国家标准化管理委员会.锅炉用水和冷却水分析方法亚硝酸盐的测定GB/T6912-2008[S].北京:中华人民共和国国家质量监督检验检疫总局,2008.
[15]中国国家标准化管理委员会.锅炉用水和冷却水分析方法硝酸盐和亚硝酸盐的测定第1部分:硝酸盐紫外光度法GB/T6912.1-2006[S].北京:中华人民共和国国家质量监督检验检疫总局,2006.
[16]胡英,吕瑞东,刘国杰,等.物理化学[M].第5版.北京:高等教育出版社,2007:249-252.
Dynamic Behaviors of High Temperature Thermal Decomposition of HTS
XIE Zhi,QIAO Jian-jiang,CHEN Shi-chen
(Safety Engineering Consulting Center,East China University of Science and Technology,Shanghai 200237,China)
Abstract:In this paper,dynamic behaviors of high temperature thermal decomposition of HTS were studied.The contents of nitrate and nitrite in HTS were detected by spectrophotometry and the kinetic parameters of thermal decomposition were obtained.The results show that decomposition of nitrate in HTS is mainly affected by temperature and the decomposition rate coefficient increases with temperature in an exponential type,which belongs to type I model reaction with the apparent activation energy (Ea) 189.8 kJ/mol and the pre-exponential factor (A) 7.48×105s-1.Nitrite in HTS shows more complex dynamic behaviors and the result of nitrite decomposition is affected by both temperature and nitrate decomposition reaction.The rate of decomposition reaction is about 0.12×10-5-0.13×10-5s-1at the temperature range from 813 K to 873 K.When the temperature increased to 893 K,the rate coefficient decreased to 0.005 8×10-5s-1.The apparent activation energy of nitrate in mixed HTS is greater than that of one-component nitrate which illustrates that the high temperature thermal stability of HTS with three elements is better than one-component molten salt.
Key words:HTS; spectrophotometry; rate coefficient; dynamic behaviors
收稿日期:2015-08-05
作者简介:谢枝(1991-),女,福建宁德人,硕士生,主要研究领域为化工安全、防火防爆。E-mail:030131221@mail.ecust.edu.cn 通信联系人:乔建江,E-mail:jjqiao@ecust.edu.cn
文章编号:1006-3080(2016)02-0216-06
DOI:10.14135/j.cnki.1006-3080.2016.02.010
中图分类号:TQ413.15
文献标志码:A
