序贯疗法与伴同疗法根除幽门螺杆菌疗效的Meta分析
2016-06-21张少君董小林
张少君,董小林
湖北医药学院附属人民医院体检中心,湖北 十堰 442000
序贯疗法与伴同疗法根除幽门螺杆菌疗效的Meta分析
张少君,董小林
湖北医药学院附属人民医院体检中心,湖北 十堰 442000
目的 系统评价序贯疗法(sequential therapy,ST)和伴同疗法(concomitant therapy,CT)根除幽门螺杆菌(Helicobacter pylori,H.pylori)的有效性和安全性。方法 计算机检索PubMed、Web of Science、Cochrane Central Register of Controlled Trials、CENTRAL、EMBASE、CJFD、CBM、CNKI、VIP及WanFang data,检索时间截至2015年7月1日,查找所有比较ST和CT根除H.pylori的随机对照试验(RCTs)。由2名评价者按照纳入和排除标准独立选择文献、提取资料、评价质量,采用RevMan 5.2和Stata 12.0软件进行Meta分析。结果 共纳入8项RCTs,共2 541例患者。合并结果显示:ST和CT的H.pylori根除率按意向性分析(ITT)分别为84.3%(95%CI:79.1%~89.4%)、86.7%(95%CI:81.0%~92.3%);按符合方案集分析(PP)分别为86.4%(95%CI:81.7%~91.0%)、89.8%(95%CI:85.1%~94.5%),2种疗法在H.pylori根除率方面差异无统计学意义(ITT:RR=1.01,95%CI:0.97~1.04,P=0.75;PP:RR=1.00,95%CI:0.96~1.03,P=0.92)。ST和CT在不良反应发生率方面差异也无统计学意义(RR=0.88,95%CI:0.78~1.00,P=0.05)。结论 基于目前的证据表明ST和CT根除H.pylori有效率和副作用方面差异无统计学意义。受纳入研究数量和质量限制,需要开展更多高质量、大样本、多中心的RCTs进一步论证其疗效。
序贯疗法;伴同疗法;幽门螺杆菌;Meta分析
幽门螺杆菌(Helicobacter pylori,H.pylori)是生存于胃部及十二指肠各区域内的一种革兰阴性微需氧菌,与慢性胃炎、胃及十二指肠溃疡、胃癌等疾病密切相关[1]。标准三联疗法(质子泵抑制剂联合两种抗菌药物)是目前推荐的根除H.pylori的一线治疗方案[2]。其中质子泵抑制剂联合克拉霉素和阿莫西林或甲硝唑最为常用。但随着抗菌药物的广泛应用,H.pylori对克拉霉素等抗菌药物的耐药率逐年上升,从而导致H.pylori根除失败[3]。国际上推出了序贯疗法(sequential therapy,ST)、伴同疗法(concomitant therapy,CT)等新的治疗方案,显示了良好的根除率[4-5]。目前已有大量研究[6-14]报道了ST和CT根除H.pylori的有效性和安全性,然而在药物选择、治疗时间及最佳治疗方案等方面仍未达成一致意见。本文我们运用循证医学的原理和方法,对ST和CT治疗H.pylori的随机对照试验(randomized controlled trials,RCTs)进行系统评价,为临床决策提供最佳证据。
1 资料与方法
1.1 文献检索 计算机检索PubMed、Web of Science、Cochrane Central Register of Controlled Trials、CENTRAL、EMBASE、CJFD、CBM、CNKI、VIP及WanFang data,检索时间均为建库至2015年7月1日。文种限中、英文。英文检索Helicobacter pylori orH.pylori, eradication, sequential therapy, concomitant therapy;中文检索幽门螺杆菌、序贯疗法、伴同疗法,同时辅以文献追溯。
1.2 纳入与排除标准 纳入标准:(1)比较ST和CT根除H.pylori感染的试验;(2)RCTs;(3)干预措施:ST前5~7 d采用PPI+阿莫西林治疗,后5~7 d采用PPI+克拉霉素+硝基咪唑或呋喃唑酮治疗;CT采用PPI+阿莫西林+克拉霉素+硝基咪唑或呋喃唑酮治疗;(4)结局指标:首要指标是H.pylori根除率,次要指标是不良反应发生率。排除标准:(1)缺失重要研究数据的文献;(2)重复发表且病例数较少的文献;(3)有摘要而无全文,且联系作者索取未果。
1.3 资料提取 由2位研究者独立进行文献筛选和资料提取,意见不一致时通过讨论解决或由第3位研究者协助解决。资料提取内容包括:作者、发表年份、国家、样本量、干预措施、随访周期、H.pylori感染诊断方法(治疗前后)。
1.4 文献质量评价 由2位研究者根据Jadad量表[15]对纳入研究的方法学质量进行评估,具体内容包括随机序列产生、盲法、分配隐藏、退出/失访。分数范围为1~5分,得分>3分提示文献质量较高。
1.5 统计学分析 采用Cochrane协作网的RevMan 5.2进行统计分析。合并效应量选用相对危险度(RR)及其95%CI。对纳入研究进行异质性检验(采用Q检验和I2统计量),如P>0.1或I2<50%提示各研究间无异质性,采用固定效应模型进行合并分析,反之则采用随机效应模型。敏感性分析为依次排除单个文献后重新进行Meta分析,估计综合效应大小。发表偏倚分析采用Stata 12.0通过Begg秩相关法、Egger回归法进行量化检测,P<0.05认为存在发表偏倚。
2 结果
2.1 文献检索结果 根据检索策略,初检出296篇文献,经初步筛查,9篇文献[6-14]初步纳入分析,其中1篇文献[14]缺少可提取数据被排除,最终纳入8篇RCTs[6-13],包括2 541例患者。纳入研究的一般情况如表1所示,其中4项研究[6,9-10,12]来自亚洲,3项研究[7,11,13]分析了欧洲人群,1项研究[8]来自拉丁美洲。Jadad评分结果显示均>3分,提示纳入文献的研究质量较好。
表 1 纳入研究的基本情况
Tab 1 Characteristics of studies included in the Meta-analysis
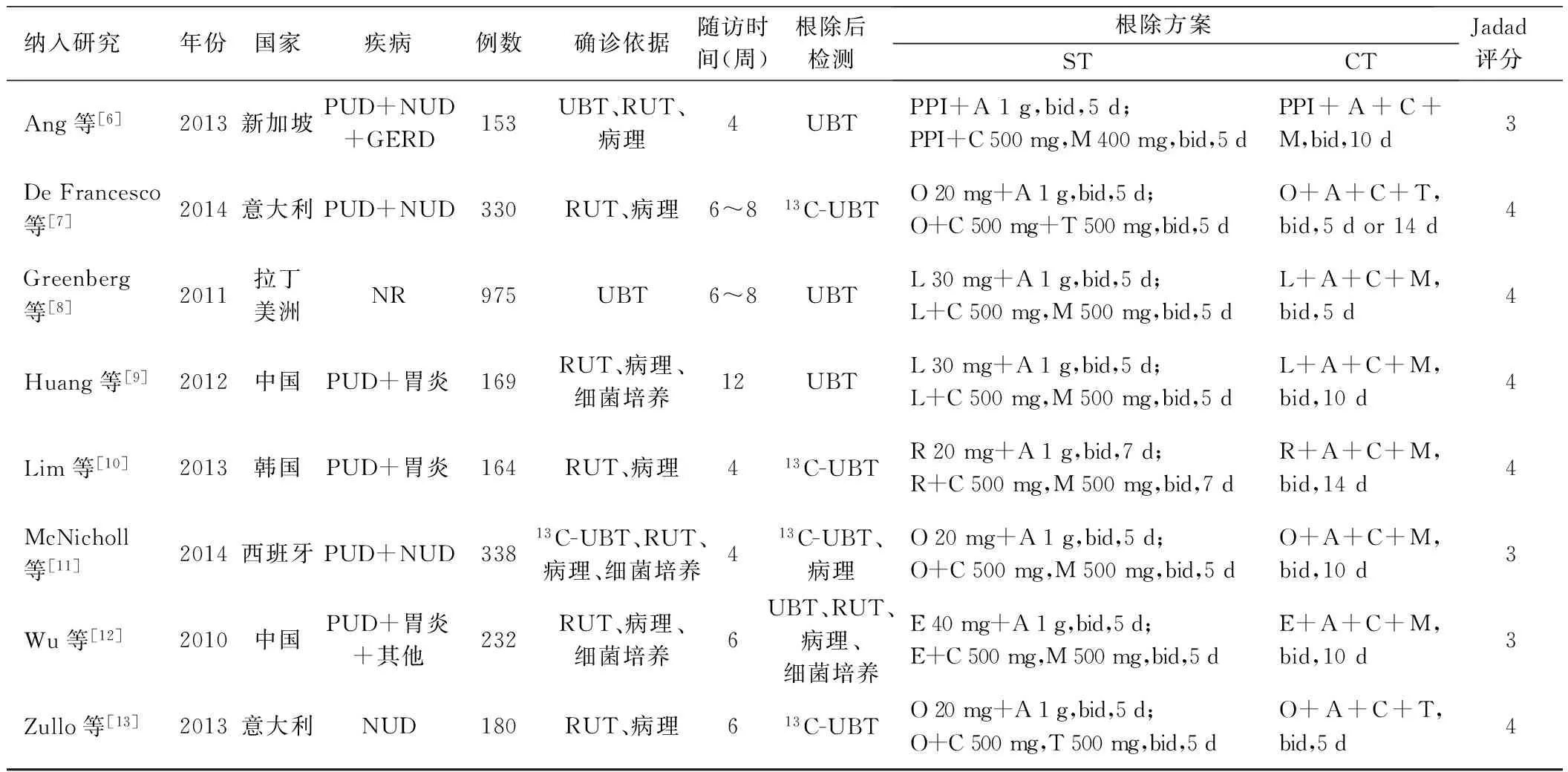
纳入研究年份国家疾病例数确诊依据随访时间(周)根除后检测根除方案STCTJadad评分Ang等[6]2013新加坡PUD+NUD+GERD153UBT、RUT、病理4UBTPPI+A1g,bid,5d;PPI+C500mg,M400mg,bid,5dPPI+A+C+M,bid,10d3DeFrancesco等[7]2014意大利PUD+NUD330RUT、病理6~813C-UBTO20mg+A1g,bid,5d;O+C500mg+T500mg,bid,5dO+A+C+T,bid,5dor14d4Greenberg等[8]2011拉丁美洲NR975UBT6~8UBTL30mg+A1g,bid,5d;L+C500mg,M500mg,bid,5dL+A+C+M,bid,5d4Huang等[9]2012中国PUD+胃炎169RUT、病理、细菌培养12UBTL30mg+A1g,bid,5d;L+C500mg,M500mg,bid,5dL+A+C+M,bid,10d4Lim等[10]2013韩国PUD+胃炎164RUT、病理413C-UBTR20mg+A1g,bid,7d;R+C500mg,M500mg,bid,7dR+A+C+M,bid,14d4McNicholl等[11]2014西班牙PUD+NUD33813C-UBT、RUT、病理、细菌培养413C-UBT、病理O20mg+A1g,bid,5d;O+C500mg,M500mg,bid,5dO+A+C+M,bid,10d3Wu等[12]2010中国PUD+胃炎+其他232RUT、病理、细菌培养6UBT、RUT、病理、细菌培养E40mg+A1g,bid,5d;E+C500mg,M500mg,bid,5dE+A+C+M,bid,10d3Zullo等[13]2013意大利NUD180RUT、病理613C-UBTO20mg+A1g,bid,5d;O+C500mg,T500mg,bid,5dO+A+C+T,bid,5d4
注:PUD:消化性溃疡;NUD:非溃疡性消化不良;GERD:胃食管反流病;UBT:尿素呼气试验;RUT:快速尿素酶试验;A:阿莫西林;C:克拉霉素;M:甲硝唑;T:磺甲硝咪唑;N:硝基咪唑;PPI:质子泵抑制剂;O:奥美拉唑;E:埃索美拉唑;L:兰索拉唑;R:雷贝拉唑;P:泮托拉唑;NR:未报道。
2.2 Meta分析结果
2.2.1H.pylori根除率:8项研究[6-13]均报道了ST和CT根除H.pylori的作用,其中ST组和CT组分别为1 220例和1 321例患者。各研究结果间无统计学异质性(I2=46%,P=0.08),故采用固定效应模型进行Meta分析。结果显示,总体上,ST和CTH.pylori根除率按意向性分析(ITT)分别为84.3%(95%CI:79.1%~89.4%)、86.7%(95%CI:81.0%~92.3%);按符合方案集分析(PP)分别为86.4%(95%CI:81.7%~91.0%)、89.8%(95%CI:85.1%~94.5%),2种疗法在H.pylori根除率方面差异无统计学意义(ITT:RR=1.01,95%CI:0.97~1.04,P=0.75;PP:RR=1.00,95%CI:0.96~1.03,P=0.92)(见图1~2)。
根据CT疗程(5 d、10 d、14 d)进行的亚组分析显示,有4篇文献[6,9,11-12]报道了ST和10 d CT的疗效比较,合并结果显示2种疗法之间差异无统计学意义(ITT:RR=0.95,95%CI:0.91~1.00,P=0.03;PP:RR=0.95,95%CI:0.91~1.00,P=0.05)(见图3A~B);有3篇文献[7-8,13]报道了ST和5 d CT之间的比较,发现2种疗法根除H.pylori的作用差异仍无统计学意义(ITT:RR=1.06,95%CI:1.00~1.12,P=0.03;PP:RR=1.04,95%CI:0.99~1.09,P=0.13)(见图3C~D);另外,有2篇文献[7,10]报道了ST和14 d CT的疗效比较,结果显示2种疗法之间疗效差异无统计学意义(ITT:RR=1.00,95%CI:0.92~1.09,P=0.97;PP:RR=0.97,95%CI:0.90~1.05,P=0.45)(见图3E~F)。
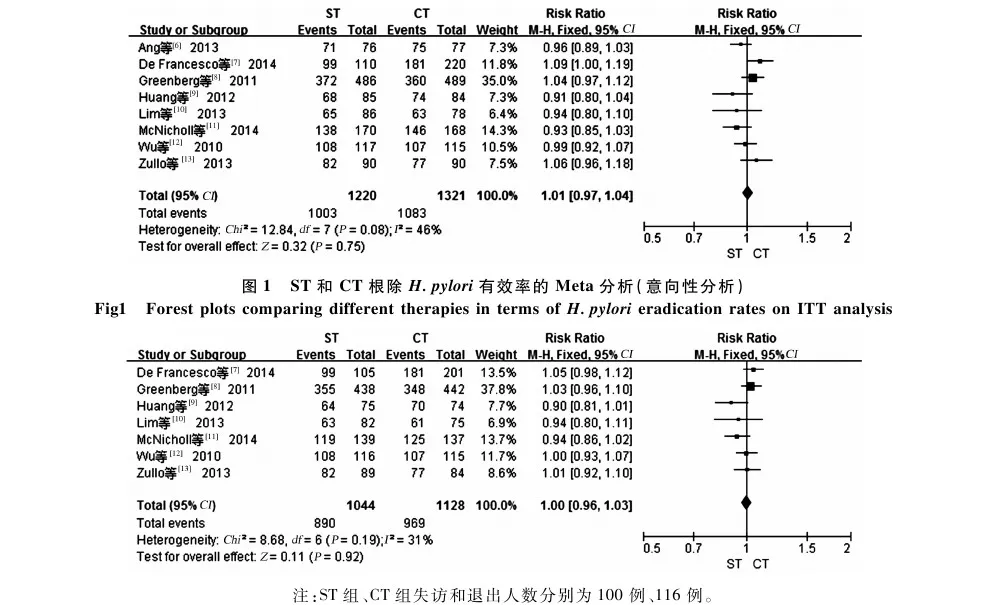
图1 ST和CT根除H.pylori有效率的Meta分析(意向性分析)Fig1 Forest plots comparing different therapies in terms of H.pylori eradication rates on ITT analysis
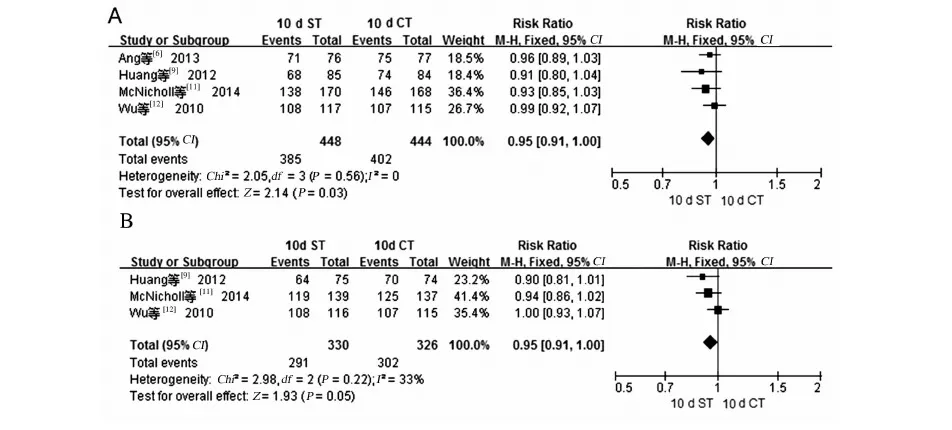
注:ST组、CT组失访和退出人数分别为100例、116例。
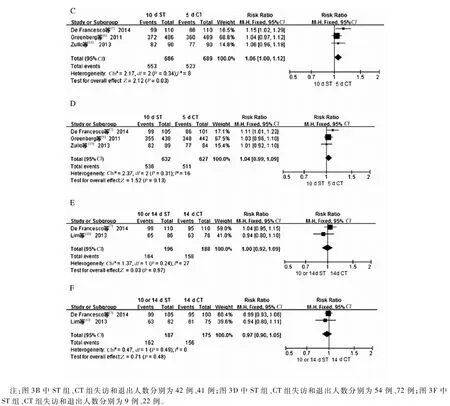
注:图3B中ST组、CT组失访和退出人数分别为42例、41例;图3D中ST组、CT组失访和退出人数分别为54例、72例;图3F中ST组、CT组失访和退出人数分别为9例、22例。
图3 基于CT疗程不同比较两种疗法根除H.pylori有效率的Meta分析A、C、E:意向性分析;B、D、F:协议性分析
Fig3 Forest plots comparing different therapies in terms ofH.pylorieradication rates based on the duration of CT A, C, E: ITT analysis; B, D, F: PP analysis
2项研究[9,12]报道了ST和CT对耐药菌株的疗效情况,合并分析显示2种疗法对耐药菌株的作用相当,差异无统计学意义(RR=0.98,95%CI:0.91~1.06,P=0.64)(见图4)。
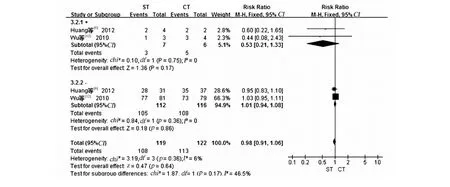
图4 ST和CT根除H.pylori耐药株有效率的Meta分析(+:对甲硝唑和克拉霉素耐药)
Fig4 Forest plots comparing different therapies in terms of eradication rates of antimicrobial resistance ofH.pylori(+: both resistances of Metronidazole and Clarithromycin)
2.2.2 不良反应:6项研究[7,9-13]报道了不良反应的情况,各研究结果间无统计学异质性(I2=6%,P=0.38),故采用固定效应模型合并统计量。结果显示ST和CT的不良反应发生率差异无统计学意义(RR=0.88,95%CI:0.78~1.00,P=0.05,见图5)。
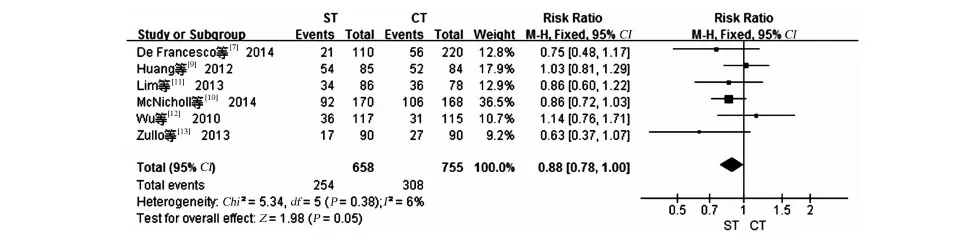
图5 ST和CT不良反应发生率的Meta分析Fig 5 Forest plots comparing different therapies in terms of side effects
2.3 敏感性和发表偏倚分析 依次单独剔除1篇文献后,合并效应量无明显改变。Begg漏斗图结果显示未见发表偏倚(见图6)。Egger回归法量化检测也未见发表偏倚(ITT:P=0.560,PP:P=0.071)。
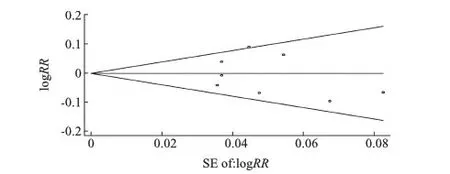
图6 Begg漏斗图分析Fig 6 Begg’s funnel plot for publication bias test on ITT analysis
3 讨论
目前,许多证据表明ST对H.pylori根除率优于标准三联疗法[16],此外,Essa等[17]进行的一项荟萃分析显示CT清除H.pylori的疗效优于三联疗法,然而,ST和CT根除H.pylori的疗效比较缺乏循证证据。
2007年,Graham等[18]对各种方案所获得的H.pylori根除率进行了如下分级:ITT分析时,分为优秀=95%,良好=90%~94%,一般=85%~89%,差=81%~84%和不能接受=80%;PP分析时,分为优秀=95%,良好=90%~94%,差=86%~89%和不能接受=85%。本研究发现无论是PP分析还是ITT分析时,ST和CT均未得到良好以上的标准。导致以上结果的原因很多,包括:H.pylori对抗生素耐药性的增加、复合菌株的感染、副作用及个体因素(如患者依从性、胃炎类型、CYP2C19基因多态性、抽烟、体质量指数等)。据报道[19],总体范围内H.pylori菌株对克拉霉素和甲硝唑的耐药率分别为17.2%和26.7%。不同地区也有所差异,在意大利,H.pylori菌株对克拉霉素和甲硝唑的耐药率仅为3.5%~4.3%[20],而在中国,耐药率达到20.5%[21]。本研究中,有2项研究[9,12]报道了ST和CT对耐药菌株的疗效情况,合并分析显示2种疗法对耐药菌株的作用相当,差异无统计学意义。然而,由于纳入研究数量有限,结论需进一步验证。
本Meta分析也存在一定的局限性:(1)纳入文献较少,且文献质量参差不齐;(2)纳入文献均为正式发表的文献,不能完全排除发表偏倚的影响;(3)纳入文献中结局指标不完全一致,影响进一步的亚组分析等;(4)纳入文献中PPI选择存在差异,可能会对结果有所影响。
综上所述,ST和CT在根除H.pylori方面疗效相当。受纳入研究数量和质量限制,尚需开展更多高质量、大样本、多中心的RCTs进一步论证其疗效。
[1]McColl KE. Clinical practice. Helicobacter pylori infection [J]. N Engl J Med, 2010, 362(17): 1597-1604.
[2]Malfertheiner P, Megraud F, O’Morain CA, et al. Management of Helicobacter pylori infection-the maastricht Ⅳ/florence consensus report [J]. Gut, 2012, 61(5): 646-664.[3]Graham DY, Fischbach L. Helicobacter pylori treatment in the era of increasing antibiotic resistance [J]. Gut, 2010, 59(8): 1143-1153.
[4]Zullo A, Rinaldi V, Winn S, et al. A new highly effective short-term therapy schedule for Helicobacter pylori eradication [J]. Aliment Pharmacol Ther, 2000, 14(6): 715-718.
[5]Treiber G, Ammon S, Schneider E, et al. Amoxicillin, metro-nidazole, omeprazole, clarithromycin: a new, short quadruple therapy for Helicobacter pylori eradication [J]. Helicobacter, 1998, 3(1): 54-58.
[6]Ang TL, Fock KM, Song M, et al. A randomized controlled trial of triple therapy versus sequential therapy versus concomitant therapy as first line treatment forH.pyloriinfection [J]. Gastroenterology, 2013, 144 (Suppl 1): S53.
[7]De Francesco V, Hassan C, Ridola L, et al. Sequential, concomitant and hybrid first-line therapies for Helicobacter pylori eradication: a prospective randomized study [J]. J Med Microbiol, 2014, 63(Pt 5): 748-752.
[8]Greenberg ER, Anderson GL, Morgan DR, et al. 14-day triple, 5-day concomitant, and 10-day sequential therapies for Helicobacter pylori infection in seven Latin American sites: a randomized trial [J]. Lancet, 2011, 378(9790): 507-514.
[9]Huang YK, Wu MC, Wang SS, et al. Lansoprazole-based sequential and concomitant therapy for the first-line Helicobacter pylori eradication [J]. J Dig Dis, 2012, 13(4): 232-238.[10]Lim JH, Lee DH, Choi C, et al. Clinical outcomes of two-week sequential and concomitant therapies for Helicobacter pylori eradication: a randomized pilot study [J]. Helicobacter, 2013, 18(3): 180-186.
[11]McNicholl AG, Marin AC, Molina-Infante J, et al. Randomised clinical trial comparing sequential and concomitant therapies for Helicobacter pylori eradication in routine clinical practice [J]. Gut, 2014, 63(2): 244-249.
[12]Wu DC, Hsu PI, Wu JY, et al. Sequential and concomitant therapy with four drugs is equally effective for eradication ofH.pyloriinfection [J]. Clin Gastroenterol Hepatol, 2010, 8(1): 36-41.[13]Zullo A, Scaccianoce G, De Francesco V, et al. Concomitant, sequential, and hybrid therapy forH.pylorieradication: a pilot study [J].
Clin Res Hepatol Gastroenterol, 2013, 37(6): 647-650.[14]Federico A, Nardone G, Gravina AG, et al. Efficacy of 5-day levofloxacin-containing concomitant therapy in eradication of Helicobacter pylori infection [J]. Gastroenterology, 2012, 143(1): 55-61.
[15]Jadad AR, Moore RA, Carroll D, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? [J]. Control Clin Trials, 1996, 17(1): 1-12.
[16]Yoon H, Lee DH, Kim N, et al. Meta-analysis: is sequential therapy superior to standard triple therapy for Helicobacter pylori infection in Asian adults? [J]. J Gastroenterol Hepatol, 2013, 28(12): 1801-1809.
[17]Essa AS, Kramer JR, Graham DY, et al. Meta-analysis: four-drug, three-antibiotic, non-bismuth-containing "concomitant therapy" versus triple therapy for Helicobacter pylori eradication [J]. Helicobacter, 2009, 14(2): 109-118.
[18]Graham DY, Lu H, Yamaoka Y. A report card to grade Helicobacter pylori therapy [J]. Helicobacter, 2007, 12(4): 275-278.
[19]De Francesco V, Giorgio F, Hassan C, et al. WorldwideH.pyloriantibiotic resistance: a systematic review [J]. J Gastrointestin Liver Dis, 2010, 19(4): 409-414.
[20]Zullo A, Perna F, Hassan C, et al. Primary antibiotic resistance in Helicobacter pylori strains isolated in northern and central Italy [J]. Aliment Pharmacol Ther, 2007, 25(12): 1429-1434.
[21]Su P, Li Y, Li H, et al. Antibiotic resistance of Helicobacter pylori isolated in the Southeast Coastal Region of China [J]. Helicobacter, 2013, 18(4): 274-279.
(责任编辑:马军)
Sequential therapy and concomitant therapy for Helicobacter pylori eradication: a Meta-analysis
ZHANG Shaojun, DONG Xiaolin
Medical Examination Center, the Affiliated People’s Hospital of Hubei Medical College, Shiyan 442000, China
Objective To compare the efficacy of sequential therapy (ST) and concomitant therapy (CT) for the treatment of Helicobacter pylori (H.pylori) infection. Methods PubMed, Web of Science, Cochrane Central Register of Controlled Trials, CENTRAL, EMBASE, CJFD, CBM, CNKI,VIP and WanFang data were searched up to the end of July 1st, 2015 in order to identify all randomized controlled trials (RCTs) reporting the effects of ST and CT onH.pylorieradication. The relative risk (RR) of eradicatingH.pyloriinfection after ST compared with CT was pooled. The eradication rates were considered both on an intention-to-treat (ITT) and a per-protocol basis (PP).Results A total of 8 RCTs involved 2 541 patients were included. The pooled data suggested there was not statistically significant in eradica thon rate between two groups (ITT analysis: STvsCT:RR=1.01, 95%CI: 0.97~1.04,P=0.75;PP analysis: STvsCT:RR=1.00, 95%CI: 0.96~1.03,P=0.92). At ITT and PP analysis, the overall eradication rates were 84.3% (95%CI: 79.1%~89.4%), 86.4% (95%CI: 81.7%~91.0%) in the ST group, 86.7% (95%CI: 81.0%~92.3%) and 89.8% (95%CI: 85.1%~94.5%) in the CT group, respectively. There was no significant difference in the rate of side events between two therapies (RR=0.88, 95%CI: 0.78~1.00,P=0.05).Conclusions ST and CT are similar to the treatment ofH.pyloriinfection. Due to the limitation of quantity and quality of the included studies, the efficacy of ST and CT has to be furthev proved by conducting more high quality, large scale and multicenter RCTs.【Key words】 Sequential therapy; Concomitant therapy; Helicobacter pylori; Meta-analysis
张少君,主治医师,研究方向:胆胰疾病的诊断。E-mail:zhangshaojunsy@163.com
董小林,主治医师,研究方向:胆胰疾病和消化道肿瘤的防治。E-mail:dongxlmail@163.com
10.3969/j.issn.1006-5709.2016.07.015
R57
A
1006-5709(2016)07-0773-06
2015-09-21
