外周血内I-FABP联合hs-CRP对溃疡性结肠炎的临床诊断价值
2016-06-21刘春华刘立新周士军
刘春华,刘立新,周士军
宝应县人民医院消化科,江苏 宝应 225800
外周血内I-FABP联合hs-CRP对溃疡性结肠炎的临床诊断价值
刘春华,刘立新,周士军
宝应县人民医院消化科,江苏 宝应 225800
目的 分析溃疡性结肠炎(ulcerative colitis,UC)患者血浆肠型脂肪酸结合蛋白(intestinal fatty acid binding protein,I-FABP)、超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)水平变化及意义。方法 选取宝应县人民医院2012年5月-2015年5月收治的104例UC患者纳入UC组,并选取同期100名健康体检者纳入对照组,比较两组受试者血浆I-FABP、hs-CRP水平差异,并比较不同病变分型、病情活动度患者上述指标差异。结果 UC组血浆I-FABP、hs-CRP水平显著高于对照组,差异有统计学意义(P<0.05)。随着患者病变活动度加重,患者血浆I-FABP、hs-CRP水平逐渐升高,差异有统计学意义(P<0.05)。广泛型组患者血浆I-FABP、hs-CRP水平显著高于左半结肠型组,差异有统计学意义(P<0.05)。Pearson相关分析结果显示,血浆I-FABP与hs-CRP呈显著正相关(r=0.824)。结论 随着UC患者病情的进展,血浆I-FABP、hs-CRP水平均显著升高,且二者呈正相关,检测I-FABP、hs-CRP有助于UC临床诊治方案的制定。
溃疡性结肠炎;肠型脂肪酸结合蛋白;超敏C反应蛋白;分型
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性炎症性疾病,以结直肠黏膜及黏膜下层炎症反应为主要表现,可导致腹泻、脓血便、腹痛、里急后重等临床症状[1]。我国UC发病率呈逐年上升趋势,但目前临床对于UC的发病机制尚不明确,在一定程度上影响了治疗质量。肠型脂肪酸结合蛋白(intestinal fatty acid binding protein,I-FABP)特异性表达于小肠黏膜细胞,正常状态下血清中含量极低,一旦肠黏膜发生损伤,大量I-FABP可释放入血,导致血浆I-FABP水平上升[2];超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)是最为敏感的炎性标记物之一,对机体炎症状态有着良好的反映作用,但特异性不高[3]。为进一步明确UC患者I-FABP、hs-CRP水平变化及意义,我们选取宝应县人民医院2012年5月-2015年5月收治的104例UC患者及同期100名健康体检者进行对照研究,现将结果报道如下。
1 资料与方法
1.1 一般资料 选取宝应县人民医院2012年5月-2015年5月收治的104例UC患者纳入UC组,并选取同期100名健康体检者纳入对照组。UC组男61例,女43例,性别比例1.4∶1,年龄19~68岁,平均年龄(46.51±6.25)岁;对照组男61名,女39名,性别比例1.6∶1,年龄18~71岁,平均年龄(45.79±6.33)岁。两组性别比例、年龄等一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入及排除标准 纳入标准:(1)参照《炎症性肠病诊断与治疗的共识意见(2012年·广州)》[4]确诊UC;(2)于我院确诊,且确诊前未接受其他相关药物治疗;(3)对此次研究知情同意。排除标准:(1)合并心、肝、肾等器官严重病变;(2)合并其他肠道炎症疾病;(3)合并全身性严重感染、恶性肿瘤或免疫系统病变;(4)有炎症性肠病家族史。
1.3 研究方法
1.3.1 血浆指标检测:抽取两组受试者空腹静脉血4 ml,以3 000 r/min离心8 min,留取血浆,-20 ℃保存统一检测。使用酶联免疫吸附(ELISA)法检测其血浆I-FABP、hs-CRP水平,试剂盒均购自上海凯博生化试剂有限公司。
1.3.2 检测结果分析:参照改良Mayo评分系统,按照UC患者活动性将其分为轻度组、中度组及重度组,分组标准[5]:轻度组:改良Mayo评分3~5分;中度组:改良Mayo评分6~10分;重度组:改良Mayo评分11~12分。并依据内镜下溃疡累及肠道的范围,将患者分为广泛型组、左半结肠型组,分组标准[6]:广泛型组:病变累及脾曲以近乃至全结肠;左半结肠型组:病变仅累及脾曲以远(左半结肠)。比较UC组与对照组,轻度组、中度组与重度组,广泛型组与左半结肠型组受试者血浆I-FABP、hs-CRP水平差异,并分析血浆I-FABP水平与hs-CRP水平的相关性。

2 结果
2.1 UC组与对照组血浆指标检测结果 UC组血浆I-FABP、hs-CRP水平分别为(139.71±63.26)pg/ml、(69.63±3.74)ng/ml,显著高于对照组的(54.20±5.04)pg/ml、(3.26±0.50)ng/ml,差异有统计学意义(P<0.05)。
2.2 不同病情活动度患者血浆指标检测结果 随着患者病变活动度加重,血浆I-FABP、hs-CRP水平逐渐升高,差异有统计学意义(P<0.05,见表1)。
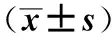
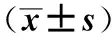

例数I-FABP(pg/ml)hs-CRP(ng/ml)轻度组4668.54±16.1035.94±10.82中度组32158.27±34.41*58.60±14.79*重度组26265.08±44.96*#98.04±17.55*#
注:与轻度组比较,*P<0.05;与中度组比较,#P<0.05。
2.3 不同病变范围患者血浆指标检测结果 广泛型组患者血浆I-FABP、hs-CRP水平分别为(233.81±26.94)pg/ml、(93.31±24.69)ng/ml,显著高于左半结肠型组的(71.05±15.27)pg/ml、(63.52±16.40)ng/ml,差异有统计学意义(P<0.05)。
2.4 血浆I-FABP与hs-CRP的相关性 Pearson相关分析结果显示,血浆I-FABP与hs-CRP呈显著正相关(r=0.824,P<0.01)。
3 讨论
UC是欧美地区常见的疾病,发病率为(1.5~14.3)/10万,近年来我国UC发病率呈上升趋势,已逐步接近欧美地区发病率,在对患者身心健康造成严重影响的同时,也加剧了社会医疗负担[7]。因此,早期判断患者病变分型与病情活动度,是预测UC进展过程、指导治疗干预方案的前提。但目前临床对UC的发病机制尚不明确,仍缺乏一种实用、特异、敏感的参考指标,导致多数患者诊断明确时往往已错过最佳治疗时间,预后不够理想。
脂肪酸结合蛋白广泛存在于哺乳动物的各类组织细胞内,占可溶性蛋白总量的3%~8%,主要参与胞内长链脂肪酸的摄取转运及代谢调节过程。I-FABP属于脂肪酸结合蛋白的一种,分布于肠道,组织特异性较高,可参与脂肪酸吸收、转运及分布环节,并与肠缺血性疾病、严重多发伤、炎症性疾病、代谢性疾病的发生发展关系密切[8]。本研究结果显示,UC患者血浆I-FABP水平显著高于正常人群,且随着病情活动度的加重及病变范围的增大,其I-FABP水平进一步升高,与Sandler等[9]研究结果相同,表明UC导致的肠道黏膜受累可引发细胞通透性增加,造成I-FABP释放入血。与此同时,我们发现,轻度UC患者血浆I-FABP水平亦显著高于对照组,说明I-FABP对早期黏膜受累亦有着良好的反映作用,其机制可能为:I-FABP在成熟小肠黏膜中呈梯度分布,即绒毛处含量高于陷窝,且近段、中段1/3空回肠中含量高于远段1/3空回肠[10-11]。肠黏膜对缺血状态极为敏感,当小肠缺血发生时,黏膜绒毛为最先受累区域,故I-FABP血浆浓度可出现明显变化。上述研究表明,血浆I-FABP水平与UC严重程度密切相关。
hs-CRP由肝脏合成,是最敏感的炎性标记物之一,对全身性炎症反应和组织损伤的发生发展有着良好的反映效果。辛丽敏等[12]指出,hs-CRP在炎症诊断、细菌感染和病毒感染的鉴别、心血管疾病的预后判断方面均具有重要作用。本研究结果显示,UC患者血浆hs-CRP水平显著高于对照组,且其变化趋势与I-FABP一致,说明hs-CRP水平亦可有效反映UC病情进展,其原因为:各种微生物抗原的刺激导致UC患者机体免疫系统激活,在诱发细胞因子网络平衡破坏的同时,可引发各类炎性细胞活化及黏附分子异常表达,并逐渐聚集于炎症部位。大量炎症因子一方面导致慢性炎症的出现,另一方面刺激肝细胞合成并释放大量hs-CRP,故使得血浆hs-CRP水平上升[13-14]。此外,Kolho等[15]认为,随着炎症因子的聚集,血管内皮细胞、血小板等免疫细胞受到激活,可分泌大量黏附分子,进一步吸引炎症因子的聚集,加重肠黏膜损伤。本研究结果显示,随着UC患者病情加重,其血浆hs-CRP水平亦显著升高,印证了上述结论。与此同时,我们发现,UC患者血浆I-FABP与hs-CRP水平呈显著正相关,表明联合检测血浆I-FABP及hs-CRP有望早期明确患者病情,指导治疗方案的选择,有望提高医疗质量、改善患者预后。
综上所述,I-FABP和hs-CRP在UC的发生发展过程中均扮演了重要角色,通过联合检测血浆I-FABP及hs-CRP水平可及时明确肠道缺血损伤状态,对疾病的诊断、预后判断及治疗方案的制定均具有指导意义,且ELISA法检测成本低、操作方便,适合基层医院开展,为该方案的推广普及奠定了良好基础。
[1]Trφseid M, Lind A, Nowak P, et al. Circulating levels of HMGB1 are correlated strongly with MD2 in HIV-infection: possible implication for TLR4-signalling and chronic immune activation [J]. Innate Immun, 2013, 19(3): 290-297.
[2]Henderson AL, Brand MW, Darling RJ, et al. Attenuation of colitis by serum-derived bovine immunoglobulin/protein isolate in a defined microbiota mouse model [J]. Dig Dis Sci, 2015, 60(11): 3293-3303.
[3]张妮, 朱炜, 朱家睿, 等. 瓜氨酸、肠型脂肪酸结合蛋白、肠三叶因子在儿童危重症急性胃肠损伤诊断中的作用[J]. 临床儿科杂志, 2015, 33(7): 650-654. Zhang N, Zhu W, Zhu JR, et al. Value of citrulline, intestinal fatty acid binding protein, and intestinal trefoil factor in the diagnosis of acute gastroin-testinal injury in critically ill children [J]. J Clin Pediatr, 2015, 33(7): 650-654.
[4]胡品津. 炎症性肠病诊断与治疗的共识意见(2012年·广州)解读[J]. 胃肠病学, 2012, 17(12): 709-711. Hu PJ. Understanding the Consensus on Diagnosis and Management of Inflammatory Bowel Disease (Guangzhou, 2012) [J]. Chin J Gastroenterol, 2012, 17(12): 709-711.
[5]Ng EW, Poon TC, Lam HS, et al. Gut-associated biomarkers L-FABP, I-FABP, and TFF3 and LIT score for diagnosis of surgical necrotizing enterocolitis in preterm infants [J]. Ann Surg, 2013, 258(6): 1111-1118.
[6]皇甫春荣, 李平, 田云粉. 肠型脂肪酸结合蛋白检测在足月新生儿坏死性小肠炎中的临床意义[J]. 中国当代儿科杂志, 2014, 16(11): 1125-1128. Huangfu CR, Li P, Tian YF. Clinical signiifcance of serum intestinal fatty acid-binding protein in full-term infants with necrotizing enterocolitis [J]. Chin J Contemp Pediatr, 2014, 16(11): 1125-1128.
[7]Adriaanse MP, Tack GJ, Passos VL, et al. Serum I-FABP as marker for enterocyte damage in coeliac disease and its relation to villous atrophy and circulating autoantibodies [J]. Aliment Pharmacol Ther, 2013, 37(4): 482-490.
[8]刘玉, 赵严, 刘苏, 等. 肠型脂肪酸结合蛋白在急性胰腺炎早期肠屏障损伤中的临床诊断价值[J]. 国际消化病杂志, 2013, 33(5): 329-330, 349. Liu Y, Zhao Y, Liu S, et al. Diagnostic value of intestinal type fatty acid binding protein in early intestinal barrier injury in patients with acute pancreatitis [J]. Int J Dig Dis, 2013, 33(5): 329-330, 349.
[9]Sandler NG, Wand H, Roque A, et al. Plasma levels of soluble CD14 independently predict mortality in HIV infection [J]. J Infect Dis, 2011, 203(6): 780-790.
[10]He T, Brocca-Cofano E, Gillespie DG, et al. Critical role for the adenosine pathway in controlling simian immunodeficiency virus-related immune activation and inflammation in gut mucosal tissues [J]. J Virol, 2015, 89(18): 9616-9630.
[11]权斌, 吕孝鹏, 谢志远. 肠型脂肪酸结合蛋白检测胃肠肿瘤手术患者肠黏膜屏障功能改变[J]. 中华全科医学, 2012, 10(11): 1695-1695. Quan B, Lv XP, Xie ZY. Role of intestinal fatty acid binding protein in evaluating intestinal mucosal barrier function in patients with gastrointestinal cancer surgery [J]. Chinese Journal of General Medicine, 2012, 10(11): 1695-1695.
[12]辛丽敏, 李楠. C反应蛋白在炎症性肠病中的应用及价值[J]. 胃肠病学和肝病学杂志, 2013, 22(6): 600-603. Xin LM, Li N. The application and value of C-reactive protein in inflammatory bowel disease [J]. Chin J Gastroenterol Hepatol, 2013, 22(6): 600-603.
[13]Shi K, Wang F, Jiang H, et al. Gut bacterial translocation may aggravate microinflammation in hemodialysis patients [J]. Dig Dis Sci, 2014, 59(9): 2109-2117.
[14]Jones ML, Martoni CJ, Prakash S. Letter to the editor regarding the report of Duboc et al: connecting dysbiosis, bile-acid dysmetabolism and gut inflammation in inflammatory bowel disease [J]. Gut, 2013, 62(4): 654-655.
[15]Kolho KL, Valtonen E, Rintamäki H, et al. Soluble urokinase plasminogen activator receptor suPAR as a marker for inflammation in pediatric inflammatory bowel disease [J]. Scand J Gastroenterol, 2012, 47(8-9): 951-955.
(责任编辑:陈香宇)
Clinical diagnostic value of I-FABP and hs-CRP for patients with ulcerative colitis
LIU Chunhua, LIU Lixin, ZHOU Shijun
Department of Gastroenterology, the People’s Hospital of Baoying Country, Baoying 225800, China
Objective To analyze changes and clinical value of intestinal fatty acid binding protein (I-FABP) and hypersensitive C-reactive protein (hs-CRP) for patients with ulcerative colitis (UC).Methods One hundred and four cases of UC patients were collected, which were treated in the People’s Hospital of Baoying Country from May. 2012 to May. 2015. Meanwhile, 100 healthy controls were selected as the control group. The levels of hs-CRP and I-FABP were compared between two groups, the lesion type and disease activity were also compared.Results The levels of I-FABP and hs-CRP in UC group were higher than those in the control group, the difference was statistically significant (P<0.05). The levels of hs-CRP and I-FABP were increased gradually with the increase of UC activity, and the difference was statistically significant (P<0.05). The levels of I-FABP and hs-CRP in extensive colitis group were higher than those in the left colon colitis type group, and the difference was statistically significant (P<0.05). The results of Pearson correlation analysis showed that the level of I-FABP was positively correlated with hs-CRP (r=0.824).Conclusion With the progression of UC patients, the plasma levels of hs-CRP and I-FABP are significantly increased, there is a positively correlation between them, the detection of I-FABP and hs-CRP could help to formulate the program of treatment and diagnosis for UC.
Ulcerative colitis; Intestinal fatty acid binding protein; Hypersensitive C-reactive protein; Typing
刘春华,副主任医师,研究方向:消化内科。E-mail:vicky0881@163.com
刘立新,主任医师,研究方向:消化内科。E-mail:vicky0881@163.com
10.3969/j.issn.1006-5709.2016.07.011
R574.62
A
1006-5709(2016)07-0756-03
2015-12-16
