细胞因子在炎症性肠病治疗中的研究进展
2016-06-21崔伯塔张发明
张 婷,崔伯塔,张发明
南京医科大学第二临床医学院 南京医科大学第二附属医院消化医学中心,江苏 南京 210011
细胞因子在炎症性肠病治疗中的研究进展
张 婷,崔伯塔,张发明
南京医科大学第二临床医学院 南京医科大学第二附属医院消化医学中心,江苏 南京 210011
抗肿瘤坏死因子α抗体已被用于炎症性肠病(inflammatory bowel disease,IBD)的临床治疗。靶向其他细胞因子或细胞因子相关信号通路的新药物也正在进行临床试验。然而,某些抗细胞因子疗法和细胞因子信号阻断剂似乎只在特定亚组IBD患者中有效,提示细胞因子调节网络的复杂性,其功能可能受基因、免疫及微生物等多方面因素的影响。本文就细胞因子及细胞因子调节途径(Th17细胞、激酶抑制剂、基因治疗、粪菌移植)治疗IBD的研究进展作一概述。
细胞因子;炎症性肠病;抗肿瘤坏死因子α抗体;Th17;激酶抑制剂;粪菌移植
炎症性肠病(inflammatory bowel disease,IBD)包括克罗恩病(Crohn’s disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),是一组以肠道炎症和肠黏膜屏障缺损为特征的慢性复发性疾病。研究[1]认为,不同细胞因子(cytokine,CK)水平和功能与IBD炎症程度和临床表现密切相关。研究[2]表明,通过调控细胞因子的功能可以治疗IBD小鼠的慢性肠道炎症。目前,临床上使用的抗肿瘤坏死因子(tumor necrosis factor-α,TNF-α)抗体的生物制剂,如英夫利昔(Infliximab)单抗已经成为治疗激素无效或激素依赖IBD患者的主要疗法。靶向其他细胞因子或细胞因子相关信号通路的新药物也正在进行临床试验,揭示了细胞因子在IBD治疗中的巨大应用前景。然而,某些抗细胞因子疗法(如针对TNF、IL-12或IL-23的特异性抗体)和细胞因子信号阻断剂(如Tofacitinib)的使用似乎只在特定亚组IBD患者中有临床疗效[3],提示细胞因子调节网络的复杂性,其功能可能受基因、免疫及微生物等多方面因素的影响。本文就细胞因子及细胞因子调节途径在治疗IBD中的研究进展作一概述。
1 细胞因子治疗IBD的研究进展
细胞因子在驱动肠道炎症方面的研究拓宽了我们对IBD形成过程的认识,近几年以特定细胞因子为靶标治疗IBD的临床试验已经广泛开展(见表1),有望为IBD的治疗带来突破。
1.1 TNF-α TNF-α是一种具有广泛生物活性的细胞因子,包括跨膜型和分泌型,两者的结构和功能存在差异。研究[4]发现,跨膜型TNF在引起肠道炎症方面起主要作用,中和跨膜型TNF能够诱导T细胞凋亡,有效抑制小鼠实验性结肠炎的发生,而跨膜型TNF诱导TNFR2的激活却加剧了结肠炎的活动性。此外,在IBD的临床治疗中,抗分泌型和跨膜型TNF的抗体(如英夫利昔单抗和阿达木单抗)被证实高度有效,可以诱导体内T细胞发生凋亡,但是如果药物主要阻断的是分泌型TNF(如Etanercept)则无效果[5]。因此,未来IBD的治疗策略应更具体地定位于跨膜型TNF-TNFR2之间的相互作用,有望取得更好的治疗效果。
1.2 白介素-1(interleukin 1,IL-1) IL-1在IBD发病中起着重要作用,IL-1受体拮抗剂可抑制IL-1促炎作用。在T细胞转移结肠炎模型中,T细胞中的IL-1受体信号传导控制了结肠中致病性CD4+T细胞的早期募集和存活。IL-1受体拮抗剂可以抑制免疫复合物诱导的急性家兔结肠炎,然而在治疗右旋葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的小鼠慢性结肠炎时IL-1阻断则无效,TNF拮抗剂治疗有效[6]。这些研究表明,IL-1随着疾病发展阶段不同具有多效功能,所以目前认为早期应用IL-1受体拮抗剂可抑制结肠炎症反应,如果肠道慢性炎症已经形成,单纯抑制IL-1作用则不能很好地控制炎症。在小鼠结肠炎模型中,IL-1家族成员IL-18的阻断能够有效抑制炎症。IL-1转化酶(human interleukin 1β converting enzyme,ICE)是细胞内蛋白酶,可活化细胞因子IL-18,促使免疫活性细胞浸润至血管外引起炎症反应。ICE的缺失可防止小鼠发生DSS诱导的结肠炎[7],提示靶向干预IL-1的家族成员也许与慢性肠道炎症的治疗有关。尚未见针对IL-1为靶点的临床试验报道。
1.3 白介素-6(IL-6) 研究[8]发现在小鼠模型中,用单克隆抗体阻断IL-6的信号传导能有效抑制慢性肠道炎症发生,表明IL-6有望成为IBD治疗的靶标。这种作用与诱导T细胞凋亡,减少IFN-γ、TNF和IL-1等促炎因子产生有关。在此基础上,用IL-6受体特异性抗体(Tocilizumab,也称为MRA)进行治疗的二期临床试验已经开展(见表1),对部分CD患者有一定治疗效果[9]。然而,仍需要进一步的研究来确定这种方法对于IBD的治疗价值。
表1 IBD治疗靶标—特定的细胞因子或细胞因子相关信号通路
Tab 1 Cytokines or cytokine related signaling pathway as therapeutic targets in IBD
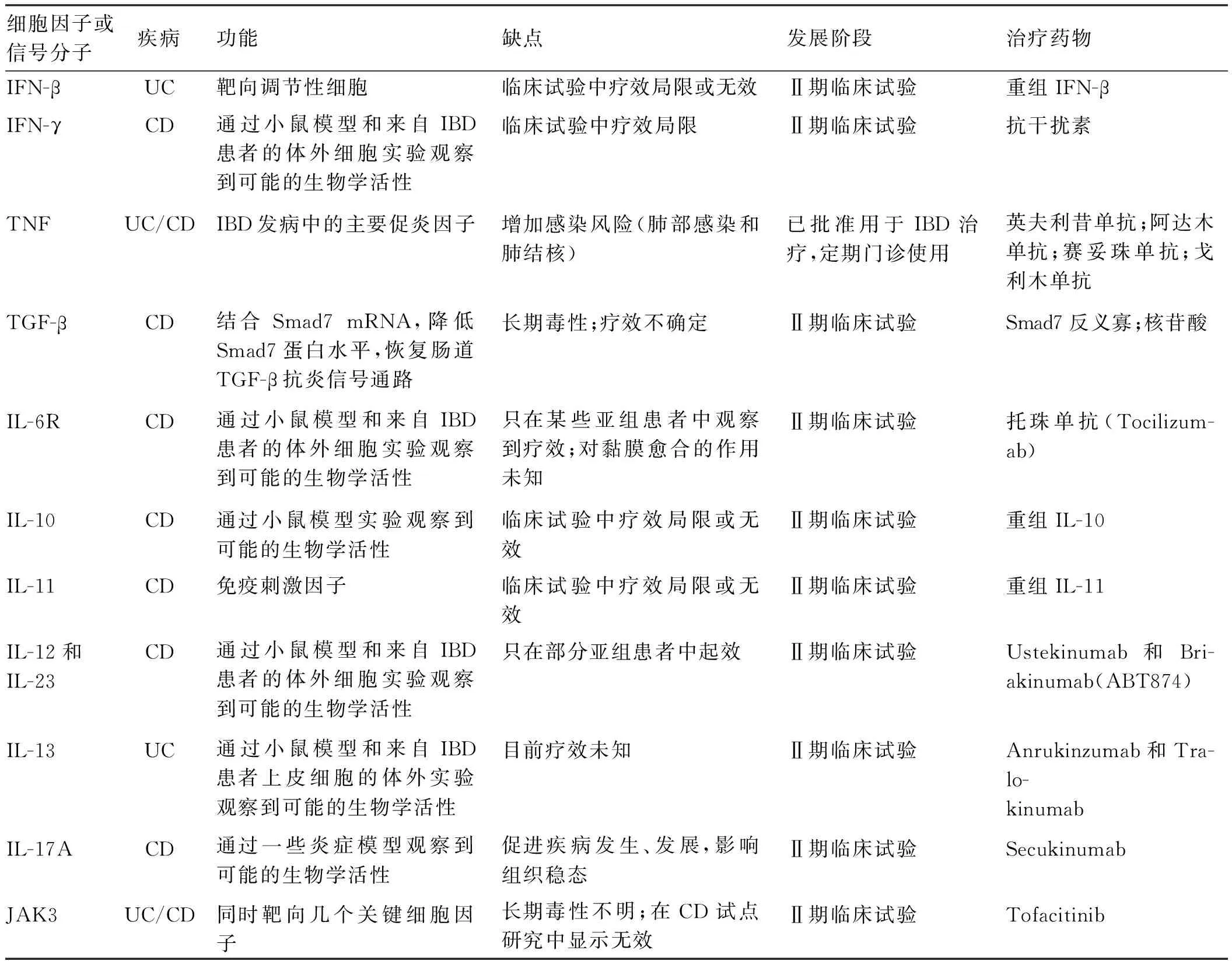
细胞因子或信号分子疾病功能缺点发展阶段治疗药物IFN-βUC靶向调节性细胞临床试验中疗效局限或无效Ⅱ期临床试验重组IFN-βIFN-γCD通过小鼠模型和来自IBD患者的体外细胞实验观察到可能的生物学活性临床试验中疗效局限Ⅱ期临床试验抗干扰素TNFUC/CDIBD发病中的主要促炎因子增加感染风险(肺部感染和肺结核)已批准用于IBD治疗,定期门诊使用英夫利昔单抗;阿达木单抗;赛妥珠单抗;戈利木单抗TGF-βCD结合Smad7mRNA,降低Smad7蛋白水平,恢复肠道TGF-β抗炎信号通路长期毒性;疗效不确定Ⅱ期临床试验Smad7反义寡;核苷酸IL-6RCD通过小鼠模型和来自IBD患者的体外细胞实验观察到可能的生物学活性只在某些亚组患者中观察到疗效;对黏膜愈合的作用未知Ⅱ期临床试验托珠单抗(Tocilizum-ab)IL-10CD通过小鼠模型实验观察到可能的生物学活性临床试验中疗效局限或无效Ⅱ期临床试验重组IL-10IL-11CD免疫刺激因子临床试验中疗效局限或无效Ⅱ期临床试验重组IL-11IL-12和IL-23CD通过小鼠模型和来自IBD患者的体外细胞实验观察到可能的生物学活性只在部分亚组患者中起效Ⅱ期临床试验Ustekinumab和Bri-akinumab(ABT874)IL-13UC通过小鼠模型和来自IBD患者上皮细胞的体外实验观察到可能的生物学活性目前疗效未知Ⅱ期临床试验Anrukinzumab和Tra-lo-kinumabIL-17ACD通过一些炎症模型观察到可能的生物学活性促进疾病发生、发展,影响组织稳态Ⅱ期临床试验SecukinumabJAK3UC/CD同时靶向几个关键细胞因子长期毒性不明;在CD试点研究中显示无效Ⅱ期临床试验Tofacitinib
1.4 白介素-12(IL-12)和白介素-23(IL-23) IL-12家族成员(如IL-23、IL-27和IL-35)在肠道炎症时由抗原提呈细胞产生。例如,树突状细胞和巨噬细胞都能促进IL-12(由p35和p40亚基组成,也称为IL-12亚单位α和IL-12亚单位β)的产生,表明激活的抗原提呈细胞可能有助于Th1细胞的分化和活化。同样,这些细胞能产生大量的IL-23(由IL-12 p40亚基和p19亚基组成,p19亚基也被称为IL-23亚单位α),可促进局部Th17细胞应答,抑制调节性T细胞活性。
IL-12和IL-23的治疗潜力在结肠炎实验模型和用其中和抗体治疗IBD的临床试验中得到证实。例如,针对IL-12和IL-23共同的p40亚基的特异性抗体(Briakinumab,也称ABT874和 Ustekinumab)在CD患者的临床试验[10]结果显示,与安慰剂组相比,其能提高临床疗效,特别是对于用TNF拮抗剂治疗无效的患者。但已有研究[11]表明,驱动肠道慢性炎症的是IL-23,而不是IL-12。如果抗体单独靶向IL-23 p19亚基,而非共同的p40亚基,是否更有利于CD治疗目前仍是未知的。
1.5 白介素-13(IL-13) IL-13和IL-4共用同一个受体,两者生物学作用有许多相似之处,都能阻断炎性介质和细胞因子的产生,抑制肠道疾病发生。但Heller等[12]的研究却发现,IL-13可以促进肠上皮细胞纤维化,引起紧密连接功能的改变及细胞凋亡,从而导致黏膜溃疡的发生。在恶唑酮诱导的小鼠结肠炎模型中,针对IL-13的特异性抗体能够抑制疾病的发生。此外,研究[13]发现针对IL-25(由肠上皮细胞产生的一种细胞因子)或其受体的抗体能够抑制自然杀伤T细胞(natural killer T cell, NKT)IL-13的产生,从而缓解恶唑酮诱导的结肠炎。可见,IL-13在UC发病中不仅起到抑炎作用,还能发挥促炎作用。基于IL-13的这种潜在促炎作用,针对IL-13的特异性抗体(即Anrukinzumab和Tralokinumab)的临床试验正在UC患者中进行。
1.6 干扰素(interferon,IFN) 针对IFN-γ的特异性抗体在小鼠T细胞转移结肠炎模型中显示治疗有效,但用IFN-γ的特异性抗体Fontolizumab治疗CD患者则显示无效。在重组活化基因1(recombinant active gene 1,RAG1)缺陷小鼠,TLR9激动剂或重组IFN-β可抑制实验性结肠炎的严重程度,表明重组IFN-β也许有望用于IBD治疗。然而在激素依赖的UC患者中,重组IFN-β的治疗虽然是安全的,但是无临床疗效[14]。相反,一种含有CpG的寡核苷酸最近成功应用于治疗激素依赖的UC患者[15],表明诱导IFN产生的免疫刺激方法有助于IBD治疗,但仍需进一步的研究来验证。
2 细胞因子调节途径治疗IBD的研究进展
2.1 Th17细胞途径 Th17细胞及其分泌的细胞因子在IBD中发挥着双向免疫调节作用。Th17型细胞因子,如IL-17和IL-21,通过上调TNF、IL-11、IL-6和IL-8的水平,促进中性粒细胞聚集和肠道成纤维细胞基质金属蛋白酶的分泌等来介导促炎作用,引起组织破坏。而另一方面,Th17细胞的保护性作用则可能与其产生的IL-22有关,后者具有控制上皮细胞增生、促进伤口愈合和产生抗菌蛋白等功能。
在T细胞转移结肠炎模型中,IL-17A或IL-17F的缺失及其中和抗体单独作用没有效果,甚至加重疾病活动性[16]。与此一致,临床上用靶向IL-17A的单克隆抗体Secukinumab治疗CD患者的结果也令人失望,且相比安慰剂治疗,不良事件发生率更高[17]。相比之下,Th17细胞相关转录因子干扰素调节因子4(interferon regulatory factor 4,IRF4)或维甲酸相关孤儿核受体γt(Retinoic acid-related orphan nuclear receptor γt,RORγt)的缺失却可显著降低结肠炎的活动性[16]。Fitzpatrick等[18]发现,二氢乳清酸脱氢酶抑制剂(4SC-101)可抑制淋巴细胞增殖并阻止IL-17产生,用4SC-101治疗DSS诱导的结肠炎小鼠,可明显减轻结肠炎症状,疗效显著。这些结果表明通过改变Th17细胞分化调节的上游细胞因子和控制Th17细胞分泌的效应细胞因子,有望为治疗IBD带来新的进展。
2.2 激酶抑制剂途径 激酶在细胞因子信号网络中可以控制细胞因子的产生和信号传导,因此,激酶抑制剂在治疗自身免疫性疾病中具有重要作用。Janus激酶3(Janus kinase 3,JAK3)抑制剂Tofacitinib阻断了IL-2、IL-4、IL-7、IL-9、IL-15和IL-21受体下游信号通路的传导,在初步临床研究中发现JAK3抑制剂对UC患者有效[3]。与JAK3优先相关联的共同γ链(gc)是IL-2受体和许多细胞因子的共同组件成分。用Tofacitinib阻断gc/JAK3信号可以影响T细胞活化的免疫过程。
在IBD治疗中,除了抑制炎性细胞因子的功能,激酶抑制剂还可以刺激抗炎细胞因子(如IL-10)的产生。盐诱导激酶2(salt-inducible kinase 2,SIK2)可以通过环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)调节转录辅激活因子3(CRTC3)的磷酸化来抑制IL-10的产生。小分子SIK2抑制剂可以模拟提高cAMP水平的刺激物(如前列腺素E2抑制剂)的作用,抑制SIK2的活动性,增加IL-10水平[19]。然而临床上用重组IL-10治疗CD患者却是无效的,可能是由于输送到肠黏膜的量不够,表明SIK2抑制剂也许能有效增加IBD患者炎症组织里IL-10的水平。此外,SIK2抑制剂还能抑制IL-12和其他炎性细胞因子产生,显示其在未来IBD治疗中的良好应用前景。
2.3 基因治疗途径 Wirtz等[20]发现利用重组Ad5腺病毒构建IL-18反义RNA表达载体对慢性T细胞介导的结肠炎小鼠有治疗作用,结肠炎症状明显改善,表明利用各种病毒或非病毒载体靶向性治疗IBD是可行的。此外,最新一项关于反义寡核苷酸药物的Ⅱ期临床试验[21]发现,异常高水平的Smad7蛋白干扰了肠道中TGF-β1抗炎信号通路,口服Smad7反义寡核苷酸Mongersen对中重度CD有明显疗效。所以通过改变细胞因子的数量和功能来发挥作用的基因治疗将是一个有前景的发展方向。
2.4 粪菌移植(fecal microbiota transplantation,FMT)途径 FMT也是目前治疗IBD的一种新方法,已经在临床试验中观察到一定治疗效果[22],但机制尚不明确。肠道菌群失调被认为是IBD发生的一个重要始动因素,细菌产物作为一种环境诱因在遗传易感宿主通过引起异常和过度的细胞因子应答来促进急慢性炎症的发生。当细菌抗原进入肠黏膜固有层后,将由巨噬细胞和树突状细胞负责加工处理后提呈给淋巴细胞,B淋巴细胞进一步分化成特异性浆细胞,而T淋巴细胞则分化激活为Th1、Th2和Th17等免疫效应细胞。大量激活的免疫细胞上的模式识别受体(pattern recognition receptor,PRR)识别相应的微生物抗原后,通过胞内信号的级联反应进一步激活细胞核内转录因子NF-κB,促使大量Th1型(如IL-2、IFN-γ)、Th2型效应细胞因子(如IL-4、IL-5)及IL-17等的释放,引起Th1/Th2型细胞因子之间的平衡失调从而导致IBD患者肠道炎症的发生[23]。FMT可能通过重建整体肠道菌群以改变细胞因子的数量和功能,使促炎因子与抑炎因子之间的作用达到平衡来发挥作用,维持机体免疫稳态,但这仍需大量研究来证实。
3 细胞因子治疗途径的优化
不同患者对相同治疗的临床反应不同,表明肠道炎症发生的病理机制在个体间有所区别,所以针对单个IBD患者进行选择性靶向治疗有望增加疗效,减少副作用发生。临床上应根据每个患者的血清学标志、基因谱和免疫学特征等个体化选择合适的治疗方案。最近一项研究[24]利用荧光标记的TNF-α特异性抗体体内成像技术,确定了在CD患者黏膜表达膜结合型TNF的免疫细胞数量,证实了表达膜结合型TNF的免疫细胞数量与用TNF特异性抗体进行序贯治疗产生的临床效果有关。如果患者体内表达膜结合型TNF的免疫细胞很少,则对这种疗法几乎没有反应。细胞因子应答的体内成像技术也许有助于个体化治疗的发展,然而在这个概念进入临床实践之前还需要进行更多的前瞻性研究。
另一种优化IBD细胞因子治疗的方法是多因子阻滞剂的使用,能够同时抑制多种细胞因子或JAK-STAT细胞因子信号传导通路[25]。由于细胞因子调节网络的复杂性,治疗IBD时阻断单一细胞因子可能会导致其他代偿的促炎细胞因子通路的发展,所以靶向单一促炎因子的抗炎治疗具有重大局限性。研究[26]发现双特异性双可变域抗体的存在,可以同时靶向两种特定促炎因子(如TNF加上另一种促炎因子),在IBD的治疗中将有重要的应用价值。
尽管目前用重组抗炎细胞因子治疗IBD一直没有成功,但局部递送细胞因子的新方法值得尝试。例如,最近发现局部递送乳酸乳球菌至肠道黏膜表面能够通过诱导宿主T细胞产生IL-10来抑制实验性结肠炎的发生[27]。另外,研究[28]发现能够产生TNF特异性纳米抗体的乳酸杆菌已成功用于实验性结肠炎的管腔治疗。这些结果表明局部递送途径可能会成为IBD优化治疗的新方向,优点在于能够增加局部药物浓度,降低与副作用相关的全身药物浓度。
目前尚无药物能根治IBD,新型药物的研发前景开阔。细胞因子在IBD免疫调节中的作用愈来愈受到重视,基于细胞因子的IBD治疗途径则是当今研究的热点领域。个体化药物治疗、使用多因子阻滞剂、局部递送抗炎因子、基因治疗、FMT等,这些靶向促炎和抗炎细胞因子表达或功能的治疗方案有望成为治疗IBD的新方法。这些新方法为目前IBD的治疗提供了美好的愿景,期待将来进一步的临床研究能够提供鼓舞人心的证据。
[1]Powell N, Lo JW, Biancheri P, et al. Interleukin 6 increases production of cytokines by colonic innate lymphoid cells in mice and patients with chronic intestinal inflammation [J]. Gastroenterology, 2015, 149(2): 456-467.e15.
[2]Munakata S, Tashiro Y, Nishida C, et al. Inhibition of plasmin protects against colitis in mice by suppressing matrix metalloproteinase 9-mediated cytokine release from myeloid cells [J]. Gastroenterology, 2015, 148(3): 565-578.e4.
[3]Sandborn WJ, Ghosh S, Panes J, et al. A phase 2 study of tofacitinib, an oral Janus kinase inhibitor, in patients with Crohn’s disease [J]. Clin Gastroenterol Hepatol, 2014, 12(9): 1485-1493.e2.
[4]Perrier C, de Hertogh G, Cremer J, et al. Neutralization of membrane TNF, but not soluble TNF, is crucial for the treatment of experimental colitis [J]. Inflamm Bowel Dis, 2013, 19(2): 246-253.
[5]Atreya R, Zimmer M, Bartsch B, et al. Antibodies against tumor necrosis factor (TNF) induce T-cell apoptosis in patients with inflammatory bowel diseases via TNF receptor 2 and intestinal CD14+ macrophages [J]. Gastroenterology, 2011, 141(6): 2026-2038.
[6]Kojouharoff G, Hans W, Obermeier F, et al. Neutralization of tumour necrosis factor (TNF) but not of IL-1 reduces inflammation in chronic dextran sulphate sodium-induced colitis in mice [J]. Clin Exp Immunol, 1997, 107(2): 353-358.
[7]Siegmund B, Fantuzzi G, Rieder F, et al. Neutralization of interleukin-18 reduces severity in murine colitis and intestinal IFN-gamma and TNF-alpha production [J]. Am J Physiol Regul Integr Comp Physiol, 2001, 281(4): R1264-R1273.
[8]Atreya R, Mudter J, Finotto S, et al. Blockade of interleukin 6 trans signaling suppresses T-cell resistance against apoptosis in chronic intestinal inflammation: evidence in crohn disease and experimental colitis in vivo [J]. Nat Med, 2000, 6(5): 583-588.
[9]Ito H, Takazoe M, Fukuda Y, et al. A pilot randomized trial of a human anti-interleukin-6 receptor monoclonal antibody in active Crohn’s disease [J]. Gastroenterology, 2004, 126(4): 989-996; discussion 947.
[10]Sandborn WJ, Gasink C, Gao LL, et al. Ustekinumab induction and maintenance therapy in refractory Crohn’s disease [J]. N Engl J Med, 2012, 367(16): 1519-1528.
[11]Uhlig HH, McKenzie BS, Hue S, et al. Differential activity of IL-12 and IL-23 in mucosal and systemic innate immune pathology [J]. Immunity, 2006, 25(2): 309-318.
[12]Heller F, Florian P, Bojarski C, et al. Interleukin-13 is the key effector Th2 cytokine in ulcerative colitis that affects epithelial tight junctions, apoptosis, and cell restitution [J]. Gastroenterology, 2005, 129(2): 550-564.
[13]Camelo A, Barlow JL, Drynan LF, et al. Blocking IL-25 signalling protects against gut inflammation in a type-2 model of colitis by suppressing nuocyte and NKT derived IL-13 [J]. J Gastroenterol, 2012, 47(11): 1198-1211.
[14]Musch E, Andus T, Kruis W, et al. Interferon-beta-1a for the treatment of steroid-refractory ulcerative colitis: a randomized, double-blind, placebo-controlled trial [J]. Clin Gastroenterol Hepatol, 2005, 3(6): 581-586.
[15]Musch E, Lutfi T, von Stein P, et al. Topical treatment with the Toll-like receptor agonist DIMS0150 has potential for lasting relief of symptoms in patients with chronic active ulcerative colitis by restoring glucocorticoid sensitivity [J]. Inflamm Bowel Dis, 2013, 19(2): 283-292.
[16]O’Connor W Jr, Kamanaka M, Booth CJ, et al. A protective function for interleukin 17A in T cell-mediated intestinal inflammation [J]. Nat Immunol, 2009, 10(6): 603-609.
[17]Hueber W, Sands BE, Lewitzky S, et al. Secukinumab, a human anti-IL-17A monoclonal antibody, for moderate to severe Crohn’s disease: unexpected results of a randomised, double-blind placebo-controlled trial [J]. Gut, 2012, 61(12): 1693-1700.
[18]Fitzpatrick LR, Deml L, Hofmann C, et al. 4SC-101, a novel immunosuppressive drug, inhibits IL-17 and attenuates colitis in two murine models of inflammatory bowel disease [J]. Inflamm Bowel Dis, 2010, 16(10): 1763-1777.
[19]Sundberg TB, Choi HG, Song JH, et al. Small-molecule screening identifies inhibition of salt-inducible kinases as a therapeutic strategy to enhance immunoregulatory functions of dendritic cells [J]. Proc Natl Acad Sci U S A, 2014, 111(34): 12468-12473.
[20]Wirtz S, Becker C, Blumberg R, et al. Treatment of T cell-dependent experimental colitis in SCID mice by local administration of an adenovirus expressing IL-18 antisense mRNA [J]. J Immunol, 2002, 168(1): 411-420.
[21]Monteleone G, Neurath MF, Ardizzone S, et al. Mongersen, an oral SMAD7 antisense oligonucleotide, and Crohn’s disease [J]. N Engl J Med, 2015, 372(12): 1104-1113.
[22]Cui B, Feng Q, Wang H, et al. Fecal microbiota transplantation through mid-gut for refractory Crohn’s disease: safety, feasibility, and efficacy trial results [J]. J Gastroenterol Hepatol, 2015, 30(1): 51-58.
[23]Abreu MT, Fukata M, Arditi M. TLR signaling in the gut in health and disease [J]. J Immunol, 2005, 174(8): 4453-4460.
[24]Atreya R, Neumann H, Neufert C, et al. In vivo imaging using fluorescent antibodies to tumor necrosis factor predicts therapeutic response in Crohn’s disease [J]. Nat Med, 2014, 20(3): 313-318.
[25]Neurath MF. Cytokines in inflammatory bowel disease [J]. Nat Rev Immunol, 2014, 14(5): 329-342.
[26]Morrison SL. Two heads are better than one [J]. Nat Biotechnol, 2007, 25(11): 1233-1234.
[27]Hanson ML, Hixon JA, Li W, et al. Oral delivery of IL-27 recombinant bacteria attenuates immune colitis in mice [J]. Gastroenterology, 2014, 146(1): 210-221. e13.
[28]Vandenbroucke K, de Haard H, Beirnaert E, et al. Orally administered L.lactis secreting an anti-TNF Nanobody demonstrate efficacy in chronic colitis [J]. Mucosal Immunol, 2010, 3(1): 49-56.
(责任编辑:马 军)
Progress of cytokines in treatment of inflammatory bowel disease
ZHANG Ting, CUI Bota, ZHANG Faming
The Second Clinical Medical College of Nanjing Medical University, Medical Center for Digestive Diseases, the Second Affiliated Hospital of Nanjing Medical University, Nanjing 210011, China
Anti-TNF-α monocolonal antibodies are common medications for patients with inflammatory bowel disease (IBD). New agents that targeting cytokines or cytokine related signaling pathway are also being investigated in clinical trials. However, anti-cytokine therapies and cytokine signaling blockers seem to only work for patients in certain subgroups which may suggest that cytokine networks are complex and they could be affected by multiple factors, including microbial, genetic and immunological factors. The progress of IBD therapies based on cytokines and the related regulation pathways were reviewed, such as the Th17 cells, kinase inhibitor, gene-therapy and fecal microbiota transplantation.
Cytokines; Inflammatory bowel disease; Anti-TNF-α monocolonal antibody; Th17; Kinase inhibitor; Fecal microbiota transplantation
江苏省科技计划项目(BL2014097)
张婷,硕士研究生,研究方向:肠道菌群与疾病。E-mail:zhangtingsweety@163.com
张发明,副主任医师,副教授,硕士生导师,研究方向:肠道菌群与疾病。E-mail:fzhang@njmu.edu.cn
10.3969/j.issn.1006-5709.2016.07.002
R574.62
A
1006-5709(2016)07-0724-05
2015-12-11
