过表达microRNA-29a上调锌脂蛋白91对大鼠肾上腺嗜铬细胞瘤细胞凋亡的影响*
2016-06-20刘永敏鄢文海
刘永敏,段 萍,鄢文海,何 芳,唐 娜,钟 华
(1.石河子大学医学院病理生理教研室,新疆石河子832002;2.郑州大学基础医学院生理学教研室,河南郑州450001;3.郑州大学基础医学院病理生理学教研室,河南郑州450001)
过表达microRNA-29a上调锌脂蛋白91对大鼠肾上腺嗜铬细胞瘤细胞凋亡的影响*
刘永敏1,段萍2,鄢文海3,何芳1,唐娜1,钟华1
(1.石河子大学医学院病理生理教研室,新疆石河子832002;2.郑州大学基础医学院生理学教研室,河南郑州450001;3.郑州大学基础医学院病理生理学教研室,河南郑州450001)
摘要:目的建立高感染效率、稳定过表达microRNA-29a(miR-29a)的大鼠肾上腺嗜铬细胞瘤细胞(PC12),探索miR-29a对PC12细胞凋亡的影响。方法将miR-29a前体表达载体、空白对照载体进行慢病毒包装,用病毒上清感染PC12并进行抗性筛选。实时荧光定量聚合酶链反应(RT-qPCR)检测miR-29a的表达,流式细胞术检测miR-29a稳定过表达组、空质粒对照组以及未感染组PC12细胞的凋亡情况,利用TargetScan 6.0数据库预测miR-29a的关键靶点,RT-qPCR以及Western blot检测预测的miR-29a下游靶基因mRNA以及蛋白表达的变化。结果经抗性筛选后获得稳定表达miR-29a的PC12细胞系,荧光显微镜下观察各组PC12细胞的感染效率均达80%以上,miR-29a过表达组凋亡率为(5.1±0.92)%,空质粒对照组为(1.832±0.26)%,未感染组为(1.667±0.185)%,miR-29a过表达促进PC12细胞凋亡(P<0.01),空质粒对照组与未感染组细胞凋亡率比较,差异无统计学意义;RT-qPCR检测miR-29a过表达时锌指蛋白91(ZFP91)的表达量升高,miR-29a过表达组ZFP91 mRNA的表达量是空质粒对照组的1.835倍(P=0.000),空质粒对照组与未感染组ZFP91 mRNA的表达量比较差异无统计学意义;Western blot检测的ZFP91蛋白表达量与空质粒对照组比较也升高。结论在PC12中miR-29a过表达促进PC12细胞凋亡,过表达miR-29a也促进ZFP91表达,其机制仍待进一步阐明。
关键词:microRNA-29a;锌指蛋白91;细胞凋亡;大鼠;嗜铬细胞瘤细胞;实时荧光定量聚合酶链反应
微小RNA(microRNA,miRNA)是一类高度保守的、长18~25 nt的非编码小分子RNA。miRNA通过直接结合目标基因的3'-非翻译区(3'- untranslated region,3'-UTR)或编码序列(coding sequence,CDS),调节其转录后水平,该调节可能通过抑制mRNA的蛋白质翻译或促进降解mRNA。miR-29a是miR-29家族成员之一,于2001年Lagos-Quintana等[1]在人Hela细胞中克隆获得的,定位于人染色体7q32.3的负链。目前,研究已确定人类miR-29广泛参与细胞增殖、分化、凋亡等多种生物学过程。
miRNA在调控细胞凋亡方面作用显著,已有很多研究表明miR-29a在很多肿瘤组织中的表达下调(如脑胶质瘤[2],慢性淋巴细胞白血病[3]、急性髓性白血病等[4]),同时也有一些研究表明miR-29在心血管疾病[5]、神经退行性疾病[6-7]、艾滋病[8-10]中也出现异常高表达,通过调控下游靶基因促进正常细胞凋亡,从而引起相关疾病。miR29a对大鼠肾上腺嗜铬细胞瘤细胞(pheochromocytoma cells,PC12)凋亡的影响及其相应靶基因的调控研究目前仍缺乏报道。本研究通过慢病毒介导miR-29a前体表达载体感染PC12细胞,采用流式细胞术检测PC12细胞凋亡的变化,用实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-qPCR)、Western blot检测下游靶基因锌指蛋白91(zinc finger protein 91,ZFP91)表达的变化,进一步丰富miR-29a促进PC12细胞凋亡相关理论,为阐明miR-29在神经退行性疾病发生中的作用机制提供科学依据,为其防治提供新靶标。
1材料与方法
1.1 实验试剂
miRNA-29a前体表达克隆RmiR6139-MR03、对照质粒CmiR60001-MR03,均带有增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP),以及Lenti-PacTMHIV Expression Packaging Kit均购自广州GeneCopoeia公司,无血清培养基Ⅰ购自美国Sigma公司,High glucose达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)、胎牛血清(fetal bovine serum,FBS)均购自美国Hyclone公司,藻红蛋白-Annexin Apoptosis Detection Kit以及异硫氰酸荧光素-Annexin Apoptosis Detection Kit购自美国BD公司,总RNA提取试剂盒(Trizol)购自北京天根生化科技有限公司,cDNA第一链试剂盒、SybrGreen PCR Master Mix(2×)购自大连宝生生物工程有限公司,ZFP91及β-Actin抗体均购自美国Santa Cruz公司,嘌呤霉素购自北京Solabio公司。
1.2 细胞培养
大鼠嗜铬瘤PC12细胞由郑州大学医学院干细胞中心馈赠,人胚肾细胞293T细胞株由郑州大学基础医学院病理生理教研室陈萍老师馈赠,两种细胞均用High-glucose DMEM和10%FBS培养。
1.3 慢病毒包装
包装前24 h,分别接种4×106~5×106个293T细胞到2个100 mm培养皿中。按照慢病毒包装试剂盒(Lenti-PacTMHIV Expression Packaging Kit)说明书,分别包装miRNA-29a前体表达质粒、对照质粒,孵育过夜(8~14 h)换新鲜培养基,再培养48 h收获病毒上清,500×g离心10 min去除细胞碎片。病毒上清可马上用于感染,或分装置于-80℃冰箱冷冻保存。
1.4 慢病毒感染PC12细胞、抗性筛选以及计算感染效率
感染前24 h接种2×105个/孔的PC12细胞于6孔板,病毒感染时细胞50%~70%融合。每孔分别加miR-29a前体表达质粒和对照质粒的病毒上清液各200μl,并各加入终浓度为4μg/ml的聚凝胺。感染24 h后,吸出原培养基,换终浓度为1.5μg/ml嘌呤霉素培养基进行筛选。之后每3天更换抗性培养基,连续筛选14 d,分别命名这两组细胞为miR29a-PC12和EGFP-PC12-control(空质粒对照组)。计算感染效率有两种方法:①通过流式细胞仪检测表达绿色荧光蛋白的细胞数占总细胞数的百分比来计算感染效率,该方法得到的感染效率很精确;②通过4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)核染色,荧光显微镜下选取同一个视野,分别数荧光细胞个数,计算EGFP阳性细胞百分比=EGFP阳性细胞数/DAPI阳性细胞数×100%,随机选取几个视野求均数,该方法可以粗略计算感染效率。
1.5 流式细胞术检测两组细胞的凋亡率
用0.25%的胰酶消化细胞,将细胞悬液移至流式管中,1 000 r/min离心5min,弃上清液,磷酸盐缓冲溶液洗2遍,离心弃上清液。将细胞重悬于Annexin ⅤBinding Buff中,再各加入4μl PE-AnnexinⅤ和4μl 7-氨基放线菌素(7-AAD),轻柔混匀,室温避光放置15 min,每管各加入200μl 1×AnnexinⅤBinding Buffer,混匀,1 h内上机检测。
1.6 RT-qPCR检测miR-29a下游的靶基因
引物序列:ZFP91正向引物:TGCGACATGCGAA ACATCATA,反向引物:GTGTACTGCCAGATTGTGG GAAC。各组细胞总RNA提取,cDNA第一链逆转录试剂盒逆转录cDNA,在冰上配置反应体系(20μl):Sybr Premix Ex TaqTMⅡ(2×)10μl,PCR Forward Primer(10μmol)0.5μl,PCR Reverse Primer (10μmol)0.5μl,Rox Reference Dyell(50×)0.4μl,cDNA模板(≤100 ng)2.0μl,ddH2O 6.0μl。两步法PCR扩增程序:95℃预变性30 s,95℃变性5 s,60℃退火34 s。
1.7 Western blot检测miR29a下游靶蛋白的变化
提取各组细胞的总蛋白并定量,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,调节电压,使过分离胶120 V,基层胶60 V,以染料的前沿迁移至凝胶的底部为标准终止电泳。恒定电流70 mA转膜1 h。5%脱脂奶粉封闭膜,一抗孵育4℃摇床过夜,加辣根酶标记山羊抗小鼠lgG(1∶5 000)37℃孵育1 h,增强化学发光法显色,显影定影,冲洗胶片,对条带进行灰度分析。
1.8 统计学方法
采用SPSS 17.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 慢病毒包装
在倒置显微镜下观察293T细胞,呈三角形,或多角形,贴壁生长,排列整齐。病毒包装前细胞达到70%~80%汇合(见图1包装前),病毒包装48 h后,293T细胞胞体略微回缩变圆,细胞状态变差,培养皿内漂浮着少量死细胞(见图1包装后),荧光显微镜下观察,在慢病毒包装后293T细胞发出大量绿色荧光(见图1荧光显微镜下包装后)。

图1 慢病毒包装前后的293T细胞(×40)
2.2 稳定过表达miR-29a细胞株建立
慢病毒感染后,经过2周的嘌呤霉素筛选,分别筛选出稳定过表达miR29a-PC12细胞株及EGFPPC12-control细胞株(见图2),PC12细胞株的整个胞体都有绿色荧光蛋白表达,通过DAPI核染色荧光显微镜下观察细胞核发出蓝色荧光,通过计算EGFP阳性细胞百分比,miR-29a-PC12的感染率为83.7% (72/84),空质粒对照组感染率为88.4%(93/105)。
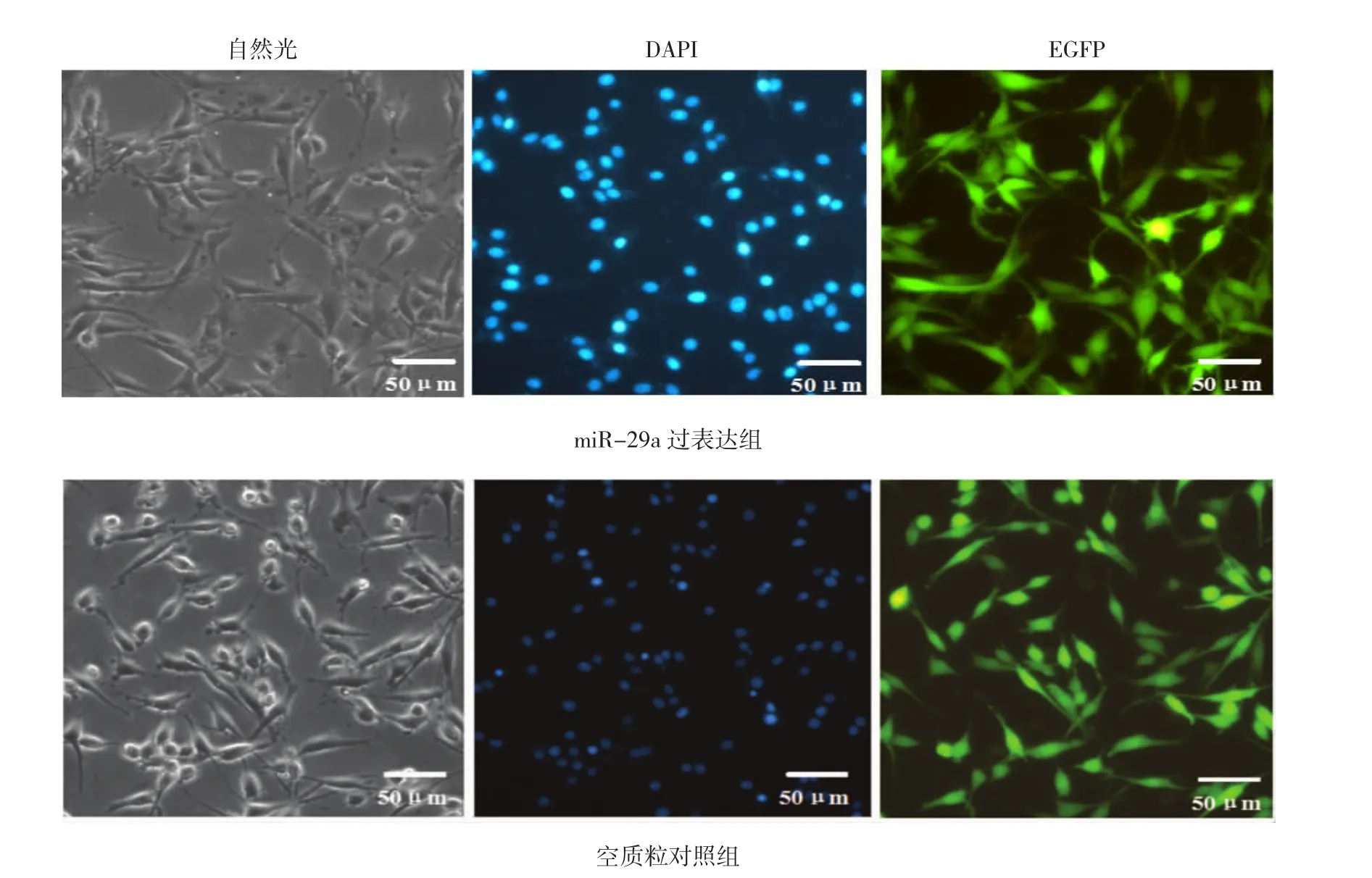
图2 中每一横列为同一视野细胞在自然光下、荧光显微镜下DAPI核染色后蓝色荧光以及荧光显微镜下绿色荧光蛋白的表达情况图2 稳定过表达miR29a-PC12细胞株及EGFP-PC12-control细胞株(×40)
2.3 流式细胞术检测各组细胞凋亡率
各组细胞凋亡率经方差分析得出,各组细胞凋亡率差异有统计学意义(F=12.099,P=0.008),进一步两两比较发现,MiR-29a过表达PC12细胞凋亡率显著高于空质粒对照组(P<0.01),说明MiR过表达可以促进PC12细胞凋亡,而空质粒对照组与未感染组比较,细胞凋亡率差异无统计学意义(P>0.05)。见图3和表1。
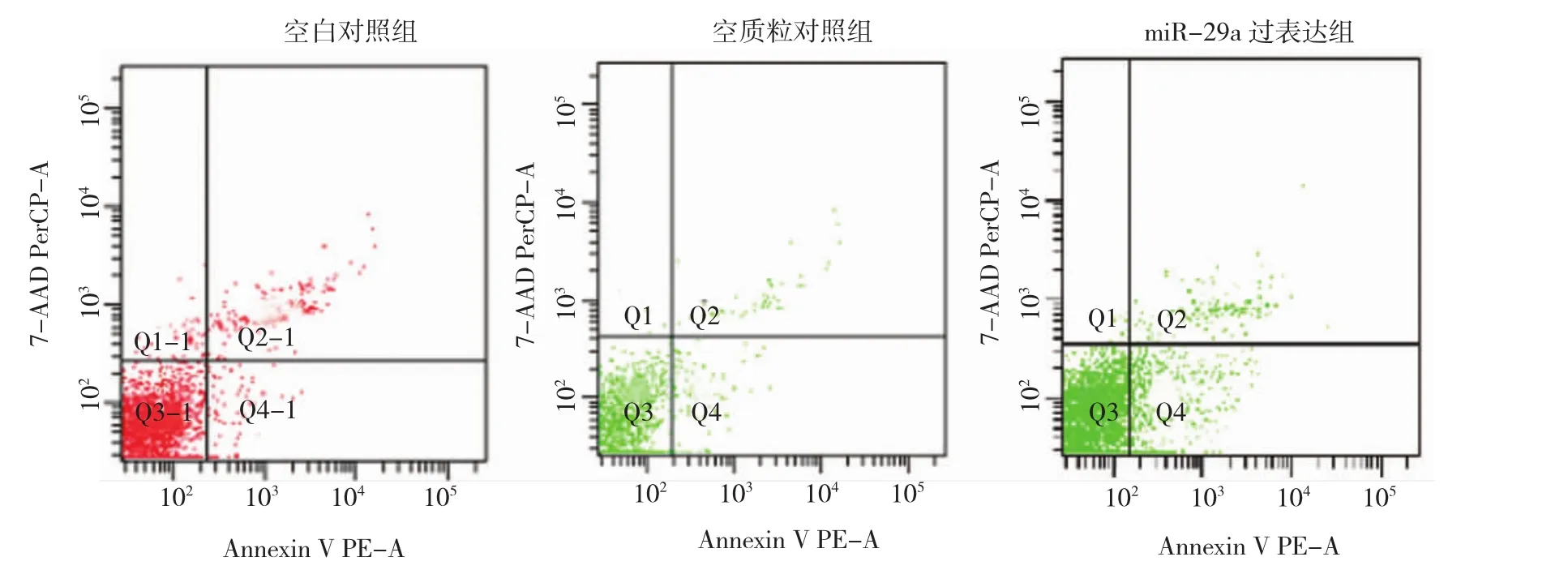
图3 过表达miR-29a对PC12细胞凋亡的影响
表1 各组PC12细胞的凋亡率比较(n=3,%,±s)

表1 各组PC12细胞的凋亡率比较(n=3,%,±s)
注:1)流式细胞术检测细胞凋亡率,计算方法:表达凋亡蛋白的细胞数(流式凋亡图的Q4象限)/表达绿色荧光蛋白的细胞数× 100%;2)通过Dunnett(双侧)两两比较,将EGFP- PC12-control设为对照组,将其与其他各组进行两两比较
组别 细胞凋亡率1)F值 P值 P值2)(两两比较)未感染组 1.667±0.185 12.099 0.008 0.972空质粒对照组 1.823±0.26 1.000 miR-29a过表达组 5.1±0.92 0.011
2.4 各组PC12细胞ZFP91 mRNA及蛋白质的表达水平
本研究前期利用Target Scan 6.0数据库以及Pictar 5数据库预测ZFP91可能是MiR-29a下游的靶基因,通过RT-qPCR及Western blot对各组PC12细胞的ZFP91 mRNA和蛋白表达进行检测验证,结果显示,miR-29a过表达时ZFP91 mRNA和蛋白质的表达升高,miR-29a过表达组ZFP91的表达量是空质粒对照组的1.835倍(P=0.000),未感染组与空质粒对照组相比ZFP91 mRNA及蛋白质表达量的差异无统计学意义(P>0.05)。见表2和图4、5。
表2 各组ZFP91 mRNA及蛋白质的表达比较(n=3,±s)

表2 各组ZFP91 mRNA及蛋白质的表达比较(n=3,±s)
注:†与空质粒对照组比较,P<0.05
组别 ZFP91 mRNA ZFP91蛋白相对倍数 F值 相对倍数 F值 P值未感染组 1.113±0.048 14.320 0.000 0.941±0.211 21.990 0.000空质粒对照组 1 1 P值miR-29a过表达组 1.835±0.211†2.17±0.47†

图4 各组PC12细胞的ZFP91 mRNA及蛋白质表达

图5 Western blot检测各组ZFP91蛋白的表达
3 讨论
PC12细胞是大鼠肾上腺髓质嗜铬细胞瘤分化细胞株,具有神经内分泌细胞的一般特征。本实验拟以PC12细胞为研究对象,通过慢病毒介导的miR-29a前体感染PC12细胞,使miR-29a在PC12细胞中过表达,慢病毒感染后再经过嘌呤霉素筛选,成功获得稳定过表达miR-29a的PC12细胞系,该细胞系可以稳定传代、冻存及复苏,为后续实验奠定良好基础。
miR-29a是miR-29家族中的一员,其存在于第7号染色体7q32上。已有很多研究证明miR-29a在肿瘤组织中低表达,提示miR-29a可抑制肿瘤细胞的增殖,促进凋亡,其机制主要有miR-29a过表达可抑制NF-ΚB信号途径[11],直接抑制DNA甲基转移酶的活性[12]以及激活Caspase途径[13],诱导细胞凋亡。本研究也证实,miR-29a可促进PC12细胞凋亡,而在细胞培养中本研究发现一些有意义的现象:①经过相同的培养条件培养48 h后,miR-29a过表达组和对照组的培养基颜色明显不同,miR-29a过表达组的培养基依旧为红色,而空质粒对照组和未感染组的培养基为橙黄色;②在相同的接种密度下,miR-29a过表达组细胞的增殖速度较空质粒对照组慢。基于上述现象,笔者分析认为由于培养液中有指示剂酚红存在,故培养基颜色的变化可间接提示细胞生长的状态,miR-29a过表达可能抑制PC12细胞的增殖,使细胞生长状态变差,产酸减少,所以在经过48 h细胞培养后培养基还为红色,这也从另一个角度印证miR-29a过表达促进PC12细胞凋亡而抑制其增殖。
ZFP91是编码63.4 kD的核蛋白,含有5个连续的锌指结构域,属于锌指蛋白家族。ZFP91最早在人类急性髓性白血病模型中被发现,认为它在促进细胞增殖以及抗细胞凋亡中起重要作用,抑制ZFP91的表达可显著增加细胞凋亡率[14]。后续又有研究报道ZFP91在前列腺癌以及前列腺癌细胞系,例如前列腺淋巴结癌及人前列腺癌细胞、DU145、22Rv1中高表达[15],其机制可通过泛素化和激活丝裂原活化蛋白激酶3K14进而主动调控非经典的核转录因子-κB(nuclear transcription factor-κB,NF-κB)信号通路[15-16]。在结核杆菌感染子宫内膜癌Ishikawa细胞系模型中ZFP91随感染时间先升高后降低,这与结核杆菌感染后泛素蛋白酶体系统活化有关[17]。本研究前期利用Target Scan 6.0数据库以及Pictar 5数据库预测ZFP91的3'-非翻译区有miR-29a的结合位点,ZFP91可能是miR-29a的靶基因,RT-qPCR 及Western blot验证后发现,miR-29a在PC12中长期、稳定地过表达时ZFP91的表达是上调的,这与传统意义上miRNA通过结合到靶基因的3'-UTR或编码序列进而下调靶基因mRNA或蛋白质的经典理论不相符,提示miRNA调控下游靶基因的方式可能不止靶向抑制这一种,还可以通过稳定和上调靶基因进而调控细胞的增殖和凋亡以及生物学特性。笔者推测可能的原因是:①由于miRNAs的网络调节特点,几个miRNA可以共同调控一个基因的表达,miR-29a在PC12细胞中过表达,可能影响到其他miRNA或其他表观遗传学调控,进而影响ZFP91的表达;②外源性miR-29a过表达抑制细胞增殖而促进凋亡,而PC12细胞自身可能会产生应激来抵抗这种作用。已有文献报道,miR-29过表达可以抑制NF-κB信号通路的激活[11,18],而ZFP91作为一个抗凋亡基因,其也是NF-κB信号通路的一个重要的调控元件,ZFP91通过泛素化作用,激活和稳定E3泛素连接酶[19]及MAP3K14来激活非经典的NF-κB信号途径,以削减miR-29a过表达对NF-κB信号通路的抑制作用,它的表达量增加可以有效对抗miR-29a促进细胞凋亡。
综上所述,miR-29a可以促进PC12细胞凋亡,并提示ZFP91与miR-29a及细胞凋亡有着必然的联系,其机制可能是ZFP91作为一个抗凋亡蛋白激活非经典的NF-κB信号通路来抵制miR-29a的促凋亡作用,进一步丰富miR-29a促进神经细胞凋亡的相关理论,为神经退行性疾病的防治提供新思路。
参考文献:
[1]LAGOS-QUINTANA M,RAUHUT R,LENDECKEL W,et al. Identification of novel genes coding for small expressed RNAs[J]. Science,2001,294(5543): 853-858.
[2]XU H,CHEUNG I Y,GUO H F,et al. MicroRNA miR-29 modulates expression of immune based therapy of human solid tumors for immunoinhibitory molecule B7-H3: potential implication[J]. Cancer Res,2009,69(15): 6275-6281.
[3]CALIN G A,FERRACIN M,CIMMINO A,et al. A microRNA signature associated with prognosis and progression in chronic lymphocytic leukemia[J]. N Engl J Med,2005,353(17): 1793-1801.
[4]GARZON R,HEAPHY C E,HAVELANGE V,et al. MicroRNA29b functions in acute myeloid leukemia[J]. Blood,2009,114(26): 5331-5341.
[5]VAN ROOIJ E,SUTHERLAND L B,THATCHER JVAN ROOIJ E,et al. Dysregulation of microRNAs after myocardial infarction reveals a role of miR-29 in cardiac fibrosis[J]. Proc Natl Acad Sci USA,2008,105: 13027-13032.
[6]VERRIER J D,LAU P,HUDSON L,et al. Peripheral myelin protein 22 is regulated post-transcriptionally by miRNA-29a[J]. Glia,2009,57: 1265-1279.
[7]HÉBERT SS,HORRE K,NICOLAÏ L,et al. Loss of microRNA cluster miR-29a/b-1 insporadic Alzheimer's disease correlates with increased BACE1/β-secretase expression[J]. Proc Natl Acad Sci USA,2008,105: 6415-6420.
[8]HARIHARAN M,SCARIA V,PILLAI B,et al. Targets for human encoded microRNAs in HIV genes[J]. Biochem Biophys Res Commun,2005,337: 1214-1218.
[9]AHLUWALIA J K,KHAN S Z,SONI K,et al. Human cellular microRNA hsa-miR-29a interferes with viral nef protein expression and HIV-1 replication[J]. Retrovirology,2008,5: 117.
[10]NATHANS R S,CHU C Y,SERQUINA A,et al. Cellular microRNA and P bodies modulate host-HIV-1 interactions[J]. Mol Cell,2009,34: 696-709.
[11]ZHOU Q Q,COSTINEAN S,CROCE C M,et al. MicroRNA 29 targets nuclear factor-κB-repressing factor and claudin 1 to increase intestinal permeability[J]. Gastroenterology,2015,148(1): 158-169.
[12]FABBRI M,GARZON R,CIMMINO A,et al. MicroRNA-29 family reverts aberrant methylation in lung cancer by targeting DNA methyltransferases 3A and 3B[J]. Proc Natl Acad Sci USA,2007,104: 15805-15810.
[13]张振辉,黎佼,刘本荣,等.过表达miR-29a对大鼠心肌细胞凋亡的影响[J].中国动脉硬化杂志,2012,20(12): 1079-1082.
[14]UNOKI M,OKUTSU J,NAKAMURA Y. Identification of a novel human gene,ZFP91,involved in acute myelogenous leukemia[J]. Int J Oncol,2003,22(6): 1217-1223.
[15]PASCHKE L,RUCINSKI M,ZIOLKOWSKA A,et al. ZFP91-A newly described gene potentially involved in prostate pathology[J]. Pathol Oncol Res,2014,20(2): 453-459.
[16]JIN H R,JIN X,LEE J J. Zinc-finger protein 91 plays a key role in LIGHT-induced activation of non-canonical NF-κB pathway[J]. Biochem Biophys Res Commun,2010,400(4): 581-586.
[17]MEENU S,THIAGARAJAN S,RAMALINGAM S,et al. Modulation of host ubiquitin system genes in human endometrial cell line infected with mycobac-terium tuberculosis[J]. Med Microbiol Immunol,2016,205(2): 163-171. DOI: 10.1007/s00430-015-0432-z.
[18]ZHANG X Y,DONG C Y,SUN X N,et al. Induction of the cellular miR-29c by influenza virus inhibits the innate immune response through protection of A20 mRNA[J]. Biochem Biophys Res Commun,2014,450(1): 755-761.
[19]JIN X J,JIN H R,JUNG H S,et al. An atypical E3 ligase zinc finger protein 91 stabilizes and activates NF-kappaB-inducing kinase via Lys63-linked ubiquitination[J]. J Biol Chem,2010,285(40): 30539-30547.
(申海菊编辑)
Overexpression of microRNA-29a up-regulates zinc finger protein 91 expression and regulates cell apoptosis in PC12*
Yong-min Liu1,Ping Duan2,Wen-hai Yan3,Fang He1,Na Tang1,Hua Zhong1
(1. Department of Pathophysiology,Medical College of Shihezi University,Shihezi,Xinjiang 832002,China;2. Department of Physiology,3. Department of Pathophysiology,College of Basic Medical Sciences,Zhengzhou University,Zhengzhou,Henan 450001,China)
Abstract:Objective To establish a rat adrenal pheochromocytoma cell line(PC12)with highly-infective efficiency and stable overexpression of miR-29a,and to explore the role of miR-29a in apoptosis of PC12. Methods The miR-29a precursors expressing viral vectors(Lvx-miR-29a-eGFP)and control vector(LvxeGFP-control)were packaged to Lentivirus respectively,and PC12 cells were infected by Lentivirus and underwent resistance screening. Flow cytometry(FCM)was used to detect the cell apoptosis,and then real time quantitative PCR(RT-qPCR)and Western blot were used to measure the levels of targets gene mRNA and protein of miR-29a. Results PC12 cell lines with high infection efficiency and stable overexpression of miR-29a were established,the EGFP-positive cell percentage was over 80%in the infected PC12 cells. miR-29aoverexpression significantly increased cell apoptosis rate in PC12 when campared to the eGFP-control group and non-infection group(P<0.01),and significantly up-regulated the mRNA and protein levels of zinc finger protein 91(ZFP91)in the PC12. Conclusions Our study demonstrated overexpression of miR-29a can effectively up-regulate ZFP91 expression and promote apoptosis of PC12. Its mechanism remains to be further elucidated.
Keywords:microRNA 29a;zinc finger protein 91;cell apoptosis;PC12;RT-qPCR;rat
中图分类号:R736.6
文献标识码:A
DOI:10.3969/j.issn.1005-8982.2016.11.004
文章编号:1005-8982(2016)011-0018-06
收稿日期:2015-12-28
*基金项目:石河子大学优秀青年科技人才培育计划(No:2013ZRKXYQ25)
