转录因子Sp3在肝细胞癌中的表达意义*
2016-06-15莫伟嘉陆会平冯振博
莫伟嘉,李 佳,陆会平,冯振博
(广西医科大学第一附属医院病理科,南宁 530021)
转录因子Sp3在肝细胞癌中的表达意义*
莫伟嘉,李佳,陆会平,冯振博△
(广西医科大学第一附属医院病理科,南宁 530021)
[摘要]目的研究转录因子Sp3(Sp3)在肝细胞癌(HCC)发生、发展及预后中的作用。方法采用Western blot法和RT-PCR法检测该院49例HCC组织及其癌旁肝组织中Sp3和β-Catenin的表达情况,分析二者在HCC和癌旁肝组织中的表达差异、二者的表达与HCC临床病理特征的关系,以及Sp3与预后的关系。结果Western blot和RT-PCR法的结果均显示:(1)Sp3在HCC中的表达高于癌旁肝组织,差异有统计学意义(P<0.05);(2)β-Catenin在HCC中的表达高于癌旁肝组织,差异有统计学意义(P<0.05);(3)Sp3和β-Catenin在HCC中的表达与肿瘤直径和分级相关;(4)Sp3和β-Catenin在HCC中的表达呈正相关(Western blot:r=0.681、P=0.000;RT-PCR:r=0.641,P=0.000),均与肿瘤大小和分化程度有关;(5)Sp3高表达的病例预后较低表达的病例差 (P<0.05)。结论Sp3在HCC发生中起促进作用且与肿瘤恶性程度相关; Wnt通路可能是其参与HCC发生、发展的途径。
[关键词]癌,肝细胞;肝肿瘤;转录因子Sp3;β-Catenin
肝细胞癌(hepatocellular carcinoma,HCC)是我国,尤其是广西地区最常见的恶性肿瘤之一,其发生、发展是一个多因素、多阶段积累的过程,多种基因参与其中。转录因子Sp3(transcription factor Sp3,Sp3)参与多种基因转录活性的调节,目前已发现在多种肿瘤中均存在Sp3的异常表达[1],部分非肿瘤疾病如肾小球硬化也与Sp3相关[2]。对于Sp3与肿瘤发生、发展的关系,已有若干研究成果,但关于Sp3在HCC中的作用目前相关的研究尚较少。β-Catenin是Wnt信号通路中的关键因子,在通路的关键环节调控c-myc和Cyclin D1等癌基因的表达。研究显示,Wnt通路参与HCC的发生[3],β-Catenin与HCC的高度恶性和浸润转移有关。目前,对于Sp3与β-Catenin在HCC中的关系、Sp3是否通过Wnt通路参与HCC发生、发展等问题未见相关报道。本试验对Sp3在HCC发生、发展中的作用,及其与β-Catenin的关系进行研究,现报道如下。
1资料与方法
1.1一般资料选取本院2009年1月至2011年1月新鲜冻存的肝细胞癌及其癌旁肝组织标本49例(梁索型20例,透明细胞型9例,混合细胞型13例,腺样型7例);患者年龄25~73岁,中位年龄45岁;男43例,女6例;按分化程度分高分化(1~2级)和低分化(3~4级)两组(分级标准参照2010版《WHO肿瘤分类与诊断标准》)。并收集肿瘤体积、甲胎蛋白及乙型肝炎表面抗原检测情况、TNM分期、随访情况等资料。所有患者均未进行放疗及化疗,以确保结果无其他影响因素。
1.2方法
1.2.1试验试剂Trizol试剂购自美国Invitrogen公司;cDNA逆转录试剂盒、Mixer、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液购自美国Thermo公司;兔抗人Sp3多克隆抗体购自美国Bio-Legend公司;兔抗人β-Catenin抗体购自美国Cell Signal Technology公司;羊抗兔IgG(H+L)HRP连接二抗购自美国Santa cruz公司;Western-Blot GAPDH内参购自上海康成公司;RIPA裂解液(强)、BCA蛋白浓度测定试剂盒工作盒、发光剂、苯甲基磺酰氟(PMSF)等购自北京碧云天生物技术研究所。引物由上海捷瑞公司设计及合成目的基因Sp3:上游5′-GCT TGC ACC TGT CCC AAC TGT A-3′,下游5′-CTC CAG AAT GCC AAC GCA GA-3′;目的基因β-Catenin:上游5′-GAG TGC TGA AGG TGC TAT CTG TC-3′,下游5′-CTG AAC AAG AGT CCC AAG GAG A-3′;内参基因β-actin:上游5′-GCA CCA CAC CTT CTA CAA TGA GC-3′;下游5′-GGA TAG CAC AGC CTG GAT AGC AAC-3′。
1.2.2Western blot法提取总蛋白、加入上样缓冲液煮沸5 min变性后上样电泳,100 mA恒流条件下转膜(Sp3 90 min、β-Catenin 120 min、内参 60 min),5%脱脂牛奶室温封闭1 h,4 ℃孵育一抗(Sp3工作浓度为1.33 μL/mL、β-Catenin工作浓度为1 μL/mL)12 h,TBST洗膜5 min×2次,室温孵育二抗(二抗工作浓度0.1 μL/mL)1 h,TBST洗膜5 min×2次,滴加发光剂,柯达胶片曝光显影,胶片拍照后用Quantity one软件分析图像及数据。
1.2.3RT-PCR法Trizol提取总RNA后逆转录得到cDNA,以β-actin为内参按以下程序进行PCR反应:95 ℃预变性5 min。以95 ℃变性1 min、退火(Sp3和内参54 ℃、β-Catenin 56 ℃)30 s、72 ℃延伸1 min为一个循环,Sp3和β-Catenin分别35、37个循环;内参25个循环。之后均72 ℃再延伸10 min、4 ℃暂保存。所得产物以18 g/L琼脂糖凝胶电泳、核酸染料染色,应用Bio-Rad凝胶成像系统采图后用Quantity one软件分析图像及数据。
1.3统计学处理采用SPSS16.0统计软件处理,对Sp3、β-Catenin在HCC及其癌旁肝组织中表达的差异性、二者表达与HCC临床病理特征的关系用χ2检验或Fisher′s确切概率法分析;对Sp3和β-Catenin在HCC中表达相关性用Spearmen等级相关分析;对Sp3与HCC预后的关系用Log-Rank法分析。检验水准α=0.05,以P<0.05为差异有统计学意义。
2结果
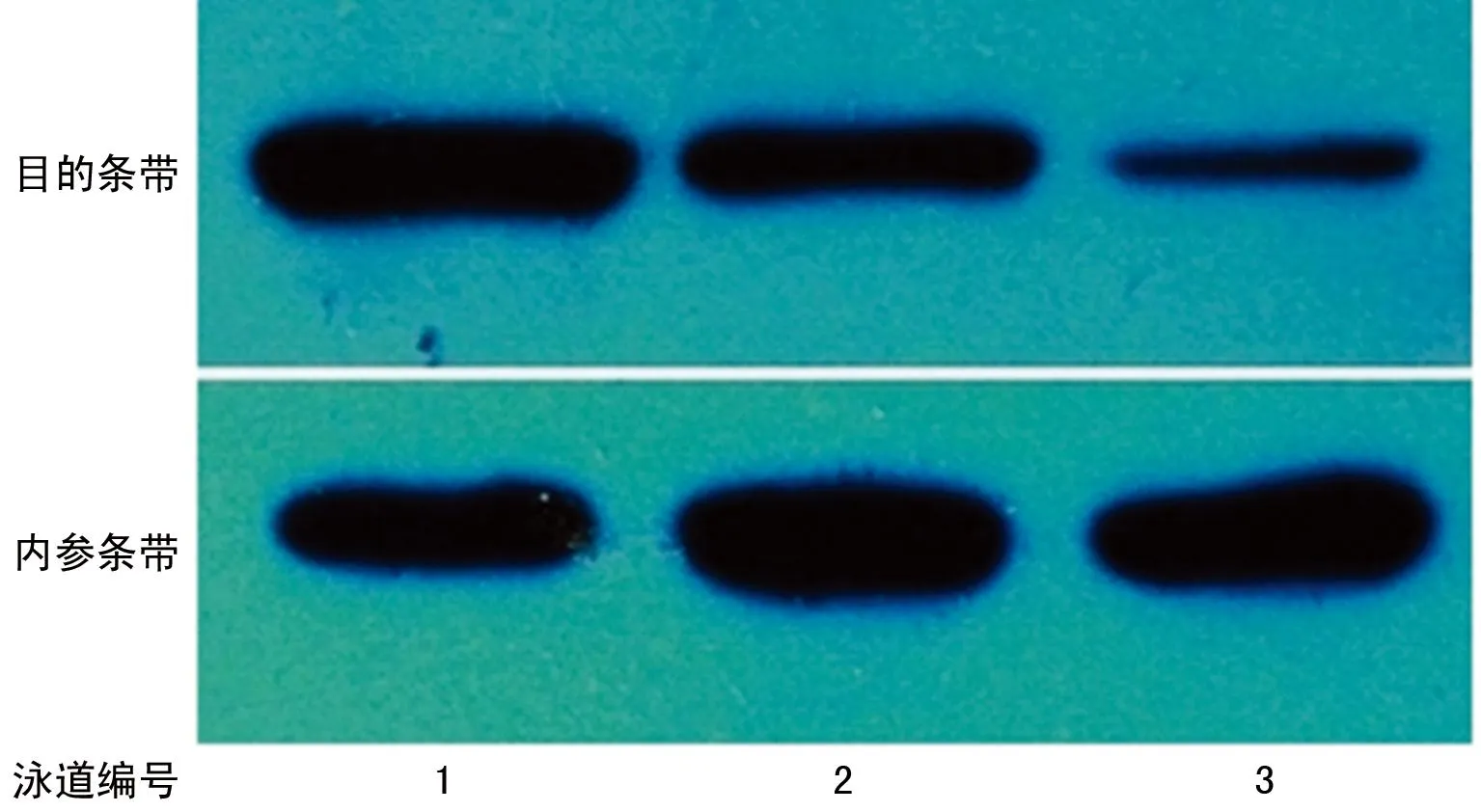
2.1Sp3表达结果经Western blot法检测,HCC组织中Sp3的高表达率高于癌旁肝组织[59.18%(29/49)vs.28.57%(14/49),χ2=4.732,P=0.03],见图1。Sp3在HCC中的表达与肿瘤直径和分级相关(P<0.05),而与年龄、性别、TNM分期、甲胎蛋白及乙型肝炎表面抗原情况无关(P>0.05),见表1、图2~3。
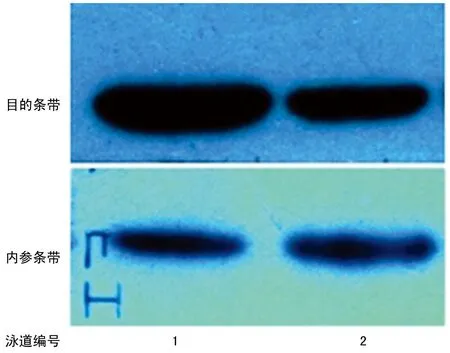
1:HCC;2:癌旁肝组织。
图1Sp3在HCC与癌旁肝组织中的表达(Western blot)
经RT-PCR法检测,HCC组织中Sp3的高表达率高于癌旁肝组织[63.27%(31/49)vs.26.53%(13/49),χ2=13.364,P=0.000],见图4。Sp3在HCC中的表达与肿瘤直径和分级相关(P<0.05),而与年龄、性别、TNM分期、甲胎蛋白及乙肝表面抗原情况无关(P>0.05),见表2、图5~6。
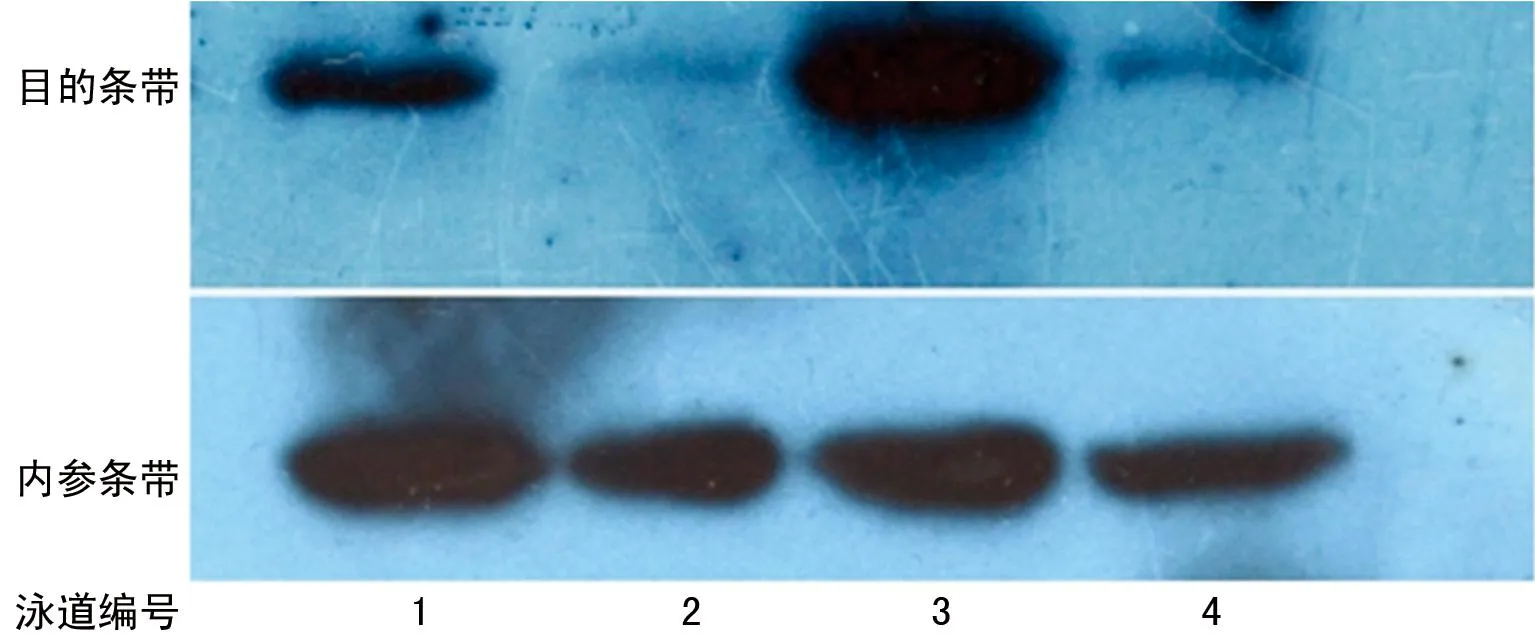
1:小体积HCC;2:泳道1对应的癌旁肝组织;3:大体积HCC;4:泳道3对应的癌旁肝组织。
图2Sp3在不同体积HCC中的表达(Western blot)
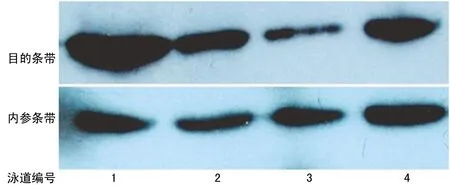
1:低分化HCC;2:泳道1对应的癌旁肝组织;3:泳道4对应的癌旁肝组织;4:高分化HCC。
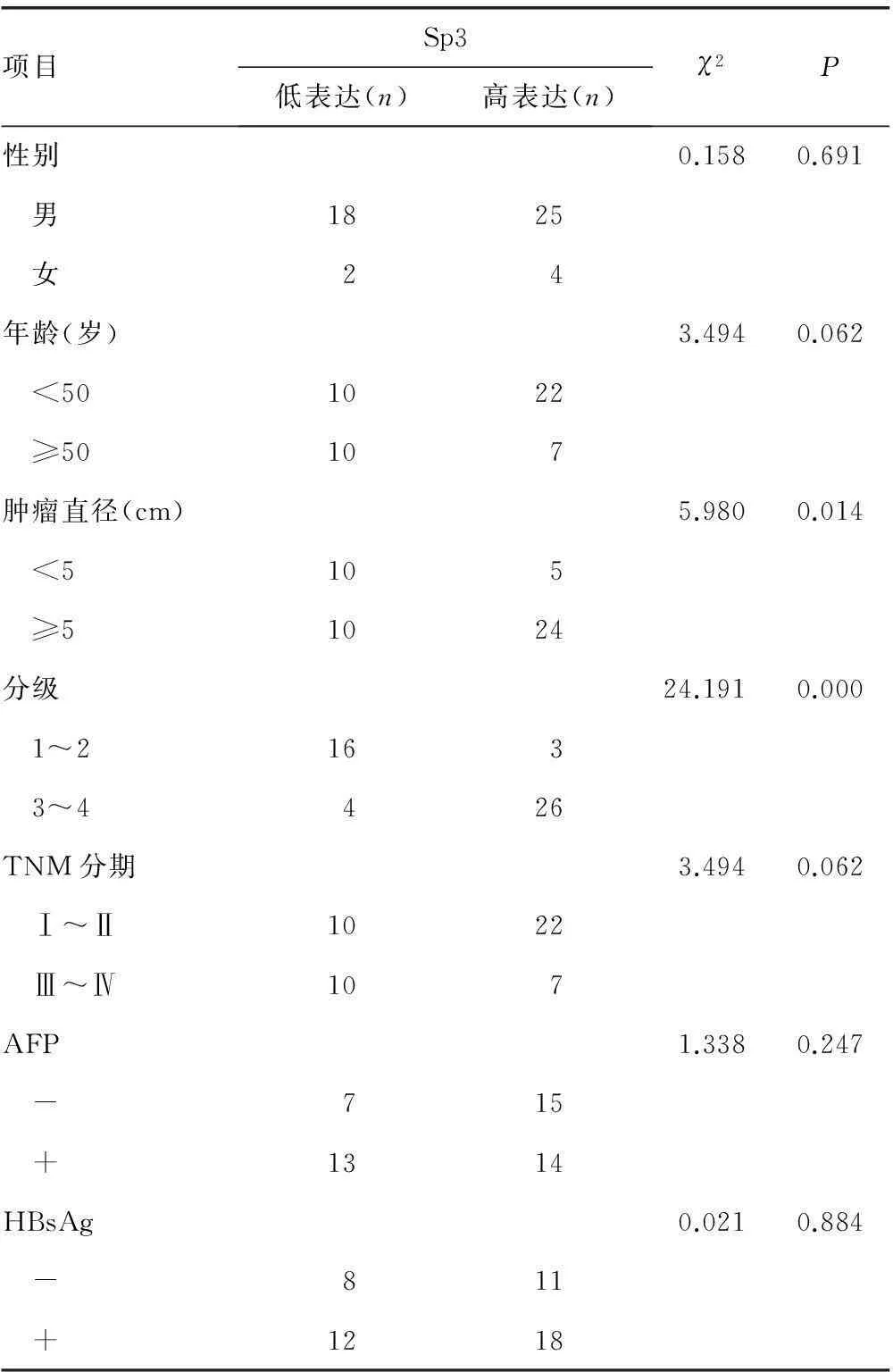
图3 Sp3在不同分化HCC中的表达(Western blot)
AFP:甲胎蛋白;HBsAg:乙型肝炎表面抗原。
两种方法均显示Sp3在有肝硬化的癌旁肝组织中的表达高于无明显病变的癌旁肝组织[Western blot:52.17%(12/23)vs.7.69%(2/26),χ2=11.832,P=0.001;RT-PCR:47.83%(11/23)vs.7.69%(2/26),χ2=10.085,P=0.001],见图7~8。
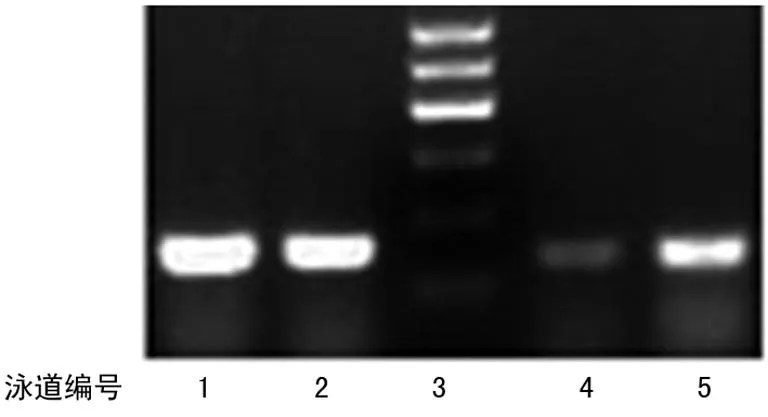
1、2:泳道4、5的内参;3:Marker;4:癌旁肝组织;5:HCC。
图4Sp3在HCC与癌旁肝组织中的表达(RT-PCR)
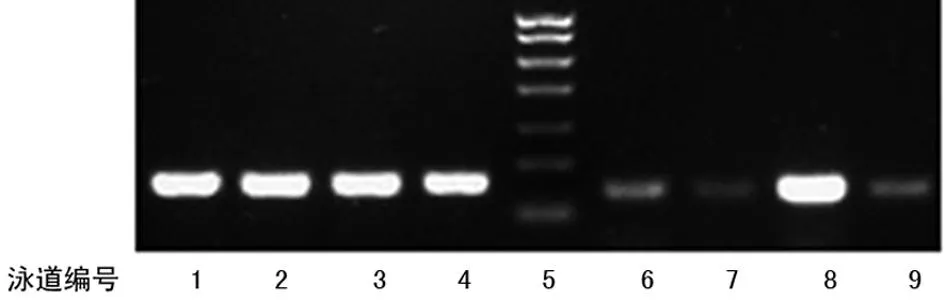
1~4:泳道6~9的内参;5:Marker;6:小体积HCC;7:泳道6对应的癌旁肝组织;8:大体积HCC;9:泳道8对应的癌旁肝组织。
图5Sp3在不同体积HCC中的表达(RT-PCR)

1~4:泳道6~9的内参;5:Marker;6:高分化HCC;7:泳道6对应的癌旁肝组织;8:低分化HCC;9:泳道8对应的癌旁肝组织。
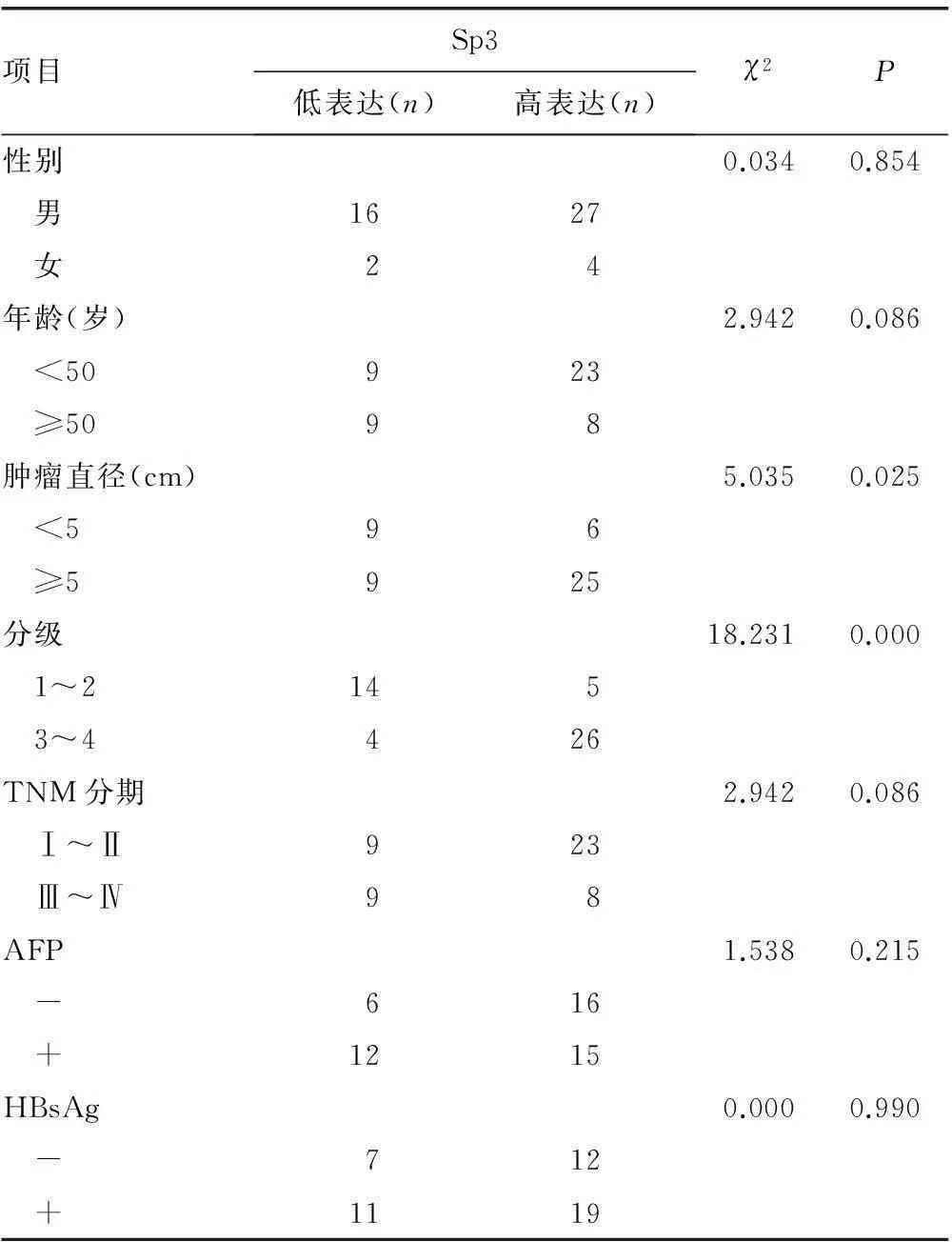
图6 Sp3在不同分化HCC中的表达(RT-PCR)
1:HCC;2:硬化癌旁肝组织;3:无硬化癌旁肝组织。
图7Sp3在无硬化癌旁肝组织与硬化癌旁肝组织中的表达(Western blot)
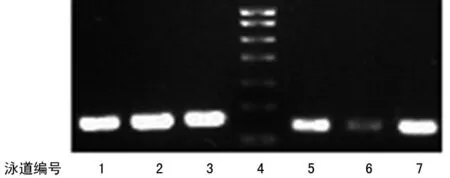
1~3:泳道5~7内参;4:Marker;5:硬化癌旁肝组织;6:无硬化癌旁肝组织;7:HCC组织。
图8Sp3在无硬化癌旁肝组织与硬化癌旁肝组织中的表达(RT-PCR)
2.2两种方法检测Sp3结果的一致性经Spearman等级相关分析两种方法检测Sp3结果的一致性显示:两种方法的检测结果呈正相关(r=0.789,P<0.01)。
2.3β-Catenin表达经Western blot法检测,HCC组织中β-Catenin的高表达率高于癌旁肝组织[51.02%(25/49)vs. 24.49%(12/49),χ2=7.338,P=0.007],见图9。β-Catenin在HCC组织中的表达与肿瘤直径和分级相关(P<0.05),而与年龄、性别、TNM分期、甲胎蛋白及乙肝表面抗原情况无关(P>0.05),见表3、图10~11。
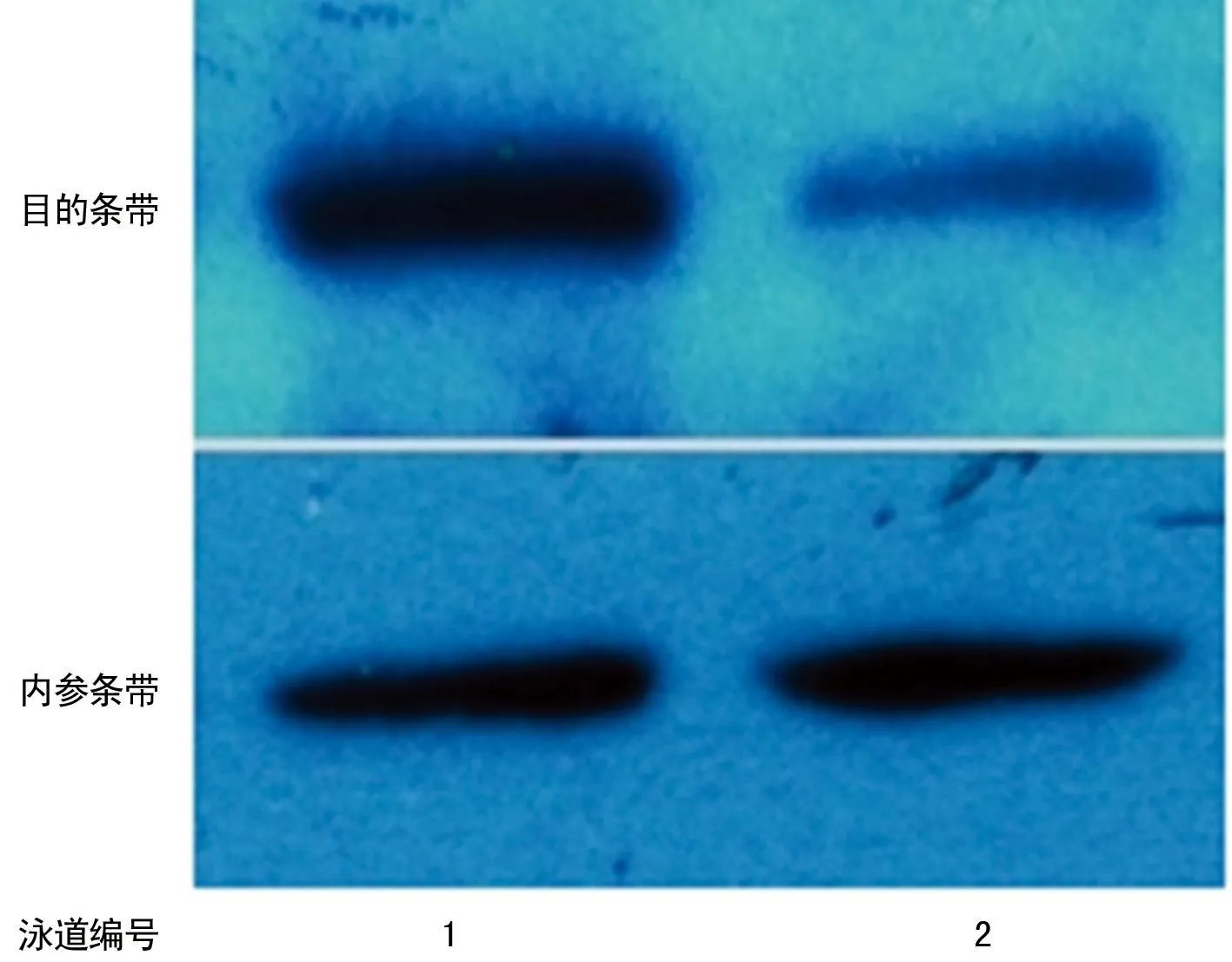
1:HCC;2:癌旁肝组织。
图9β-Catenin在HCC与癌旁肝组织中的
表达(Western blot)

1:小体积HCC;2:泳道1对应的癌旁肝组织;3:大体积HCC;4:泳道3对应的癌旁肝组织。
图10β-Catenin在不同体积HCC中的
表达(Western blot)
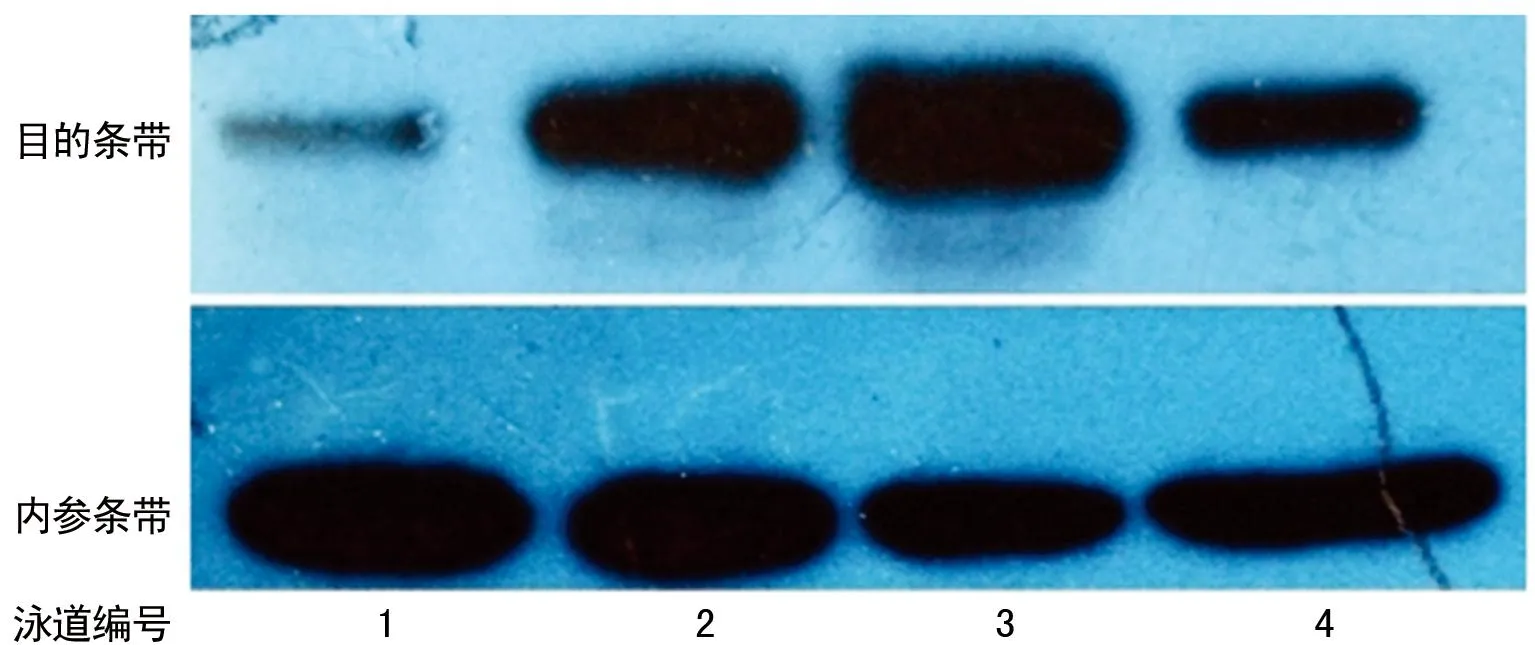
1:泳道2对应的癌旁肝组织;2:高分化HCC;3:低分化HCC;4:泳道3对应的癌旁肝组织。
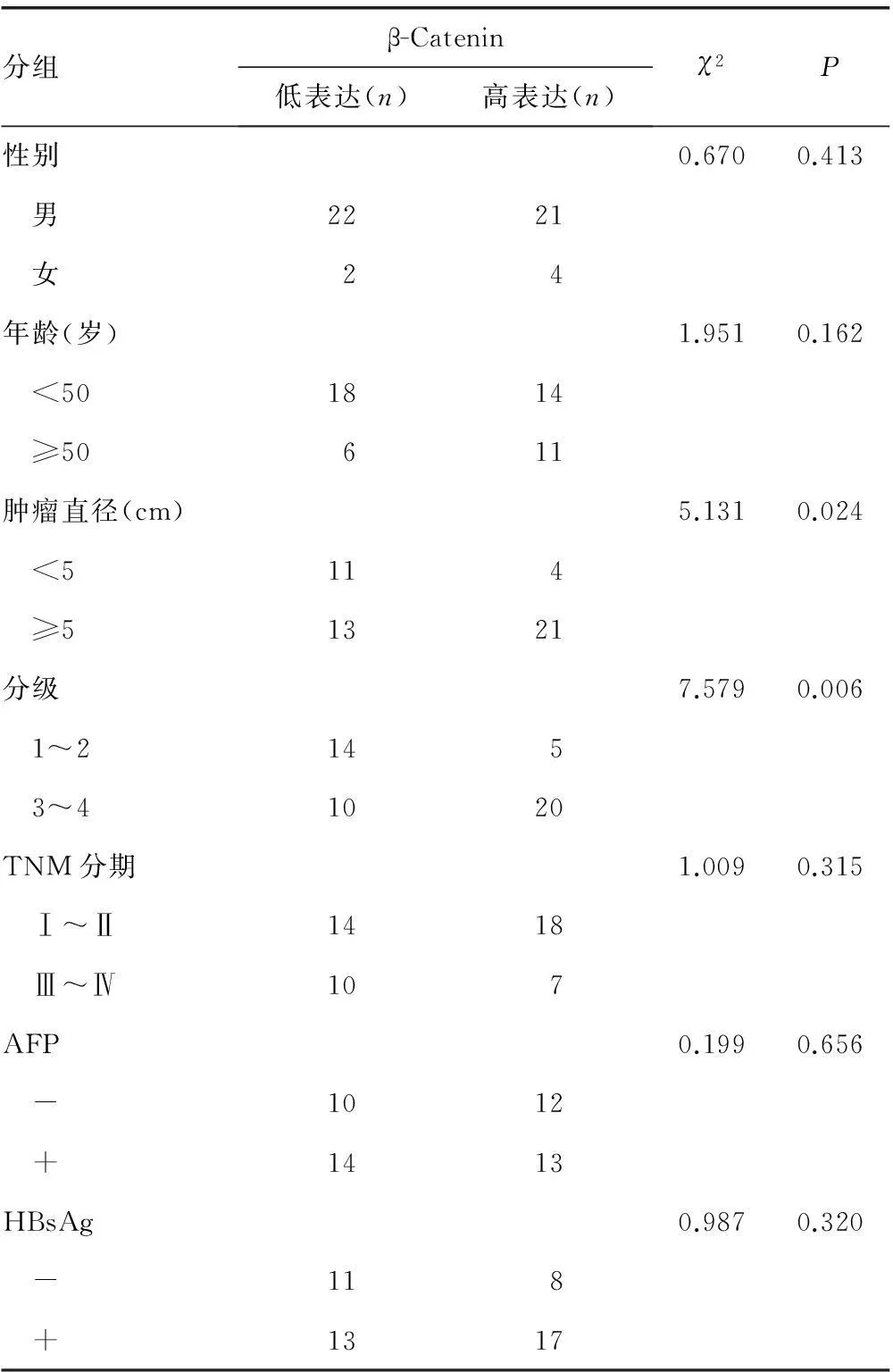
图11 β-Catenin在不同分化HCC中的
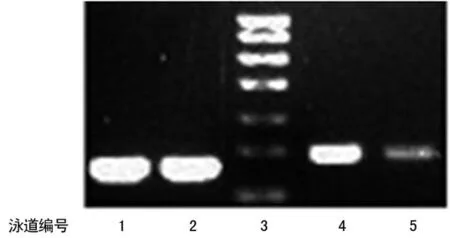
1~2:泳道4~5的内参;3:Marker;4:HCC;5:癌旁肝组织。
图12β-Catenin在HCC与癌旁肝组织中的
表达(RT-PCR)
经RT-PCR法检测,HCC组织中β-Catenin的高表达率高于癌旁肝组织[53.06%(26/49)vs.14.29%(7/49),χ2=16.493,P=0.000],见图12。β-Catenin在HCC组织中的表达与肿瘤直径和分级相关(P<0.05),而与年龄、性别、TNM分期、甲胎蛋白及乙肝表面抗原情况无关(P>0.05),见表4、图13~14。
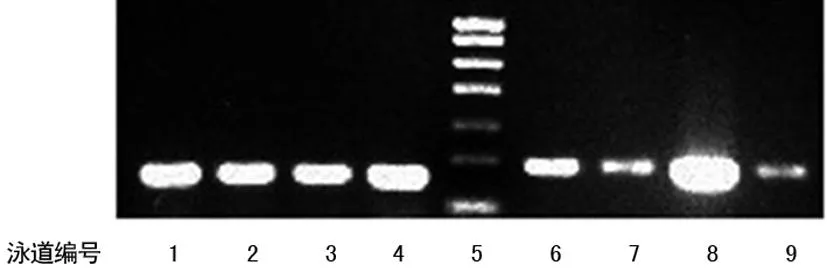
1~4:泳道6~9的内参;5:Marker;6:小体积HCC;7:泳道6对应的癌旁肝组织;8:大体积HCC;9:泳道8对应的癌旁肝组织。
图13β-Catenin在不同体积HCC中的表达
(RT-PCR)
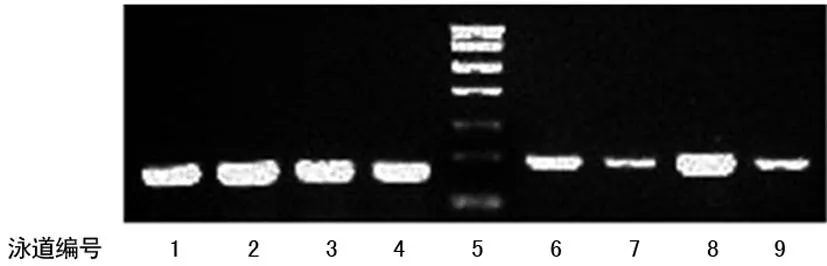
1~4:泳道6~9的内参;5:Marker;6:高分化HCC;7:泳道6对应的癌旁肝组织;8:低分化HCC;9:泳道8对应的癌旁肝组织。

图14 β-Catenin在不同分化HCC中的
2.4Sp3与β-Catenin相关性分析两种方法均显示:多数Sp3高表达的病例β-Catenin也高表达。经相关性分析,在HCC组织中二者的表达呈正相关(Western blot:r=0.681,P=0.000;RT-PCR:r=0.641,P=0.000)。
2.5Sp3与HCC预后的关系随访时间为28个月,死亡及复发均判为终止事件。经Western blot法检测,20例Sp3低表达的病例无病生存时间平均为23.4个月,预后明显好于Sp3高表达的病例(此类病例无病生存时间平均为18.4个月)。生存分析显示预后差异有统计学意义(P=0.001),见图15。经RT-PCR法检测,18例Sp3低表达的病例无病生存时间平均为23.6个月,预后明显好于Sp3高表达的病例(此类病例无病生存时间平均为18.6个月),生存分析显示预后差异有统计学意义(P=0.001),见图16。

1:Sp3高表达的HCC病例;2:Sp3低表达的HCC病例。
图15生存曲线(Western blot)

1:Sp3高表达的HCC病例;2:Sp3低表达的HCC病例。
图16生存曲线(RT-PCR)
3讨论
Sp3与Sp1均为Sp家族成员,并有最为相似的细胞分布和DNA识别序列,Sp3对Sp1的结合位点均有较强的结合能力。Sp1与HCC发生、发展的关系已被研究证实[4-6],但对与其同家族的Sp3在HCC发生、发展过程中作用的研究则鲜有报道。
本试验研究以Western blot及RT-PCR两种方法检测Sp3在HCC及其癌旁肝组织中的表达情况,发现Sp3在HCC中的表达高于癌旁肝组织,提示Sp3在HCC的发生过程中是一促进因子。此外,在大体积、低分化的HCC组织中,Sp3的高表达率增加,因而推测Sp3还能反映肿瘤的恶性程度,Sp3高表达的HCC具有较高的恶性程度。这一推论符合生存分析的结果:Sp3高表达的HCC病例,预后较低表达的病例差,出现了更短的平均生存时间和更高的病死/复发率。因此,Sp3高表达或许可作为HCC的危险信号,提示高度恶性、预后不佳。以往有研究报道Sp3高表达与头颈部肿瘤预后不良相关[7],本研究结果与以往文献报道相符。
HCC的发生是一个多种基因参与、多阶段、多因素积累的过程,Shiraha等[8]的研究表明至少有4类基因的变异及其所引起的生物学变化参与了HCC的发生,其中之一是促肿瘤生成通路的激活。在各种促肿瘤形成通路中,Wnt是最主要的通路,其在HCC发生过程中所起的关键作用已被较多研究证实[9-10]。β-Catenin作为Wnt通路参与众多基因表达调节的中心环节[11],是Wnt通路促进HCC发生、发展的关键因子[12]。因此,β-Catenin及其所在的Wnt通路与HCC的发生、发展关系密切。本试验研究以Western blot和RT-PCR两种方法检测β-Catenin在HCC及其癌旁肝组织中的表达情况,所得结果相似,即β-Catenin在HCC组织中的表达高于癌旁肝组织,且在大体积、低分化的HCC组织中,β-Catenin表达进一步增强,再次证实了β-Catenin在HCC发生中的促进作用,及其与HCC恶性程度相关。
β-Catenin富含GC序列[13],而Sp3可以特异地识别和调控富含GC序列的基因,故Sp3与β-Catenin之间极有可能存在调控机制。相关分析发现,在HCC组织中Sp3与β-Catenin呈正相关,且二者的表达与HCC临床病理特征的关系也一致,提示Wnt通路可能是Sp3促进HCC发生、发展的机制之一。目前,有少量关于Sp家族蛋白与Wnt通路关系的研究,如Pathi等[14]的研究认为,在大肠癌中Sp家族蛋白Sp1、Sp3及Sp4对β-Catenin有调控作用。而另有研究报道,Sp家族蛋白在Wnt/β-Catenin通路中是一关键作用因子[15]。本试验所显示出的Sp3与β-Catenin在HCC组织中的相关性,可作为Sp3参与HCC发生、发展机制及Sp3与Wnt/β-Catenin通路关系的初步探讨。
HCC进展较快,且起病隐匿难以早期发现,手术治疗效果普遍不理想[16]。据文献报道HCC根治性切除后5年复发率仍高达70%,且复发时多数患者已发生远处转移[16]。因此,应用更多的早期诊断手段、确立更多的早期诊断指标以尽可能的早诊早治是提高HCC疗效的关键。本试验发现,在存在硬化病变的癌旁肝组织中,Sp3表达高于无明显病变的癌旁肝组织,鉴于肝硬化是HCC公认的高危因素和癌前病变[17],可将Sp3视为一个潜在的HCC早期诊断指标进行相关研究。
参考文献
[1]Li L,Davie JR.The role of Sp1 and Sp3 in normal and cancer cell biology[J].Ann Anat,2010,192(5):275-283.
[2]Xu HG,Ren W,Zou L,et al.Transcriptional control of human CD2AP expression:the role of Sp1 and Sp3[J].Mol Biol Rep,2012,39(2):1479-1486.
[3]Fatima S,Lee NP,Luk JM.Dickkopfs and Wnt/β-catenin signalling in liver cancer[J].World J Clin Oncol,2011,2(8):311-325.
[4]Guo D,Wu B,Yan J,et al.A possible gene silencing mechanism:hypermethylation of the Keap1 promoter abrogates binding of the transcription factor Sp1 in lung cancer cells[J].Biochem Biophys Res Commun,2012,428(1):80-85.
[5]Song IS,Ha GH,Kim JM,et al.Human ZNF312b oncogene is regulated by Sp1 binding to its promoter region through DNA demethylation and histone acetylation in gastric cancer[J].Int J Cancer,2011,129(9):2124-2133.
[6]Wei M,Liu B,Gu Q,et al.Stat6 cooperates with Sp1 in controlling breast cancer cell proliferation by modulating the expression of p21(Cip1/WAF1) and p27 (Kip1)[J].Cell Oncol (Dordr),2013,36(1):79-93.
[7]Essafi-Benkhadir K,Grosso S,Puissant A,et al.Dual role of Sp3 transcription factor as an inducer of apoptosis and a marker of tumour aggressiveness[J].PLoS One,2009,4(2):e4478.
[8]Shiraha H,Yamamoto K,Namba M.Human hepatocyte carcinogenesis (review)[J].Int J Oncol,2013,42(4):1133-1138.
[9]Koga H,Tsedensodnom O,Tomimaru Y,et al.Loss of the SxxSS motif in a human T-cell factor-4 isoform confers hypoxia resistance to liver cancer:an oncogenic Switch in Wnt signaling[J].PLoS One,2012,7(6):e39981.
[10]Liu G,Jiang S,Wang C,et al.Zinc finger transcription factor 191,directly binding to β-catenin promoter,promotes cell proliferation of hepatocellular carcinoma[J].Hepatology,2012,55(6):1830-1839.
[11]Li ZQ,Ding W,Sun SJ,et al.Cyr61/CCN1 is regulated by Wnt/β-catenin signaling and plays an important role in the progression of hepatocellular carcinoma[J].PLoS One,2012,7(4):e35754.
[12]Guan CN,Chen XM,Lou HQ,et al.Clinical significance of axin and β-catenin protein expression in primary hepatocellular carcinomas[J].Asian Pac J Cancer Prev,2012,13(2):677-681.
[13]Kojima N,Saito H,Nishikawa M,et al.Lithium induces c-Ret expression in mouse inner medullary collecting duct cells[J].Cell Signal,2011,23(2):371-379.
[14]Pathi S,Jutooru I,Chadalapaka G,et al.Aspirin inhibits colon cancer cell and tumor growth and downregulates specificity protein (Sp) transcription factors[J].PLoS One,2012,7(10):e48208.
[15]Dunty WC,Kennedy MW,Chalamalasetty RB,et al.Transcriptional profiling of Wnt3a mutants identifies Sp transcription factors as essential effectors of the Wnt/β-catenin pathway in neuromesodermal stem cells[J].PLoS One,2014,9(1):e87018.
[16]Ho CM,Lee PH,Shau WY,et al.Survival in patients with recurrent hepatocellular carcinoma after primary hepatectomy:comparative effectiveness of treatment modalities[J].Surgery,2012,151(5):700-709.
[17]Jepsen P,Ott P,Andersen PK,et al.Risk for hepatocellular carcinoma in patients with alcoholic cirrhosis:a Danish nationwide cohort study[J].Ann Intern Med,2012,156(12):841-847.
Expression of transcription factor Sp3 in hepatocellular carcinoma*
MoWeijia,LiJia,LuHuiping,FengZhenbo△
(DepartmentofPathology,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning,GuangxiZhuangAutonomousRegion530021,China)
[Abstract]ObjectiveTo research the expression of Sp3 and β-Catenin in HCC and study the assessable factors of them for prognosis in patients with hepatocellular carcinoma.MethodsWestern blot and RT-PCR methods were used to detect the expression of Sp3 and β-Catenin in HCC and the liver tissue beside tumor among 49 cases.We analyzed the difference of these two indexes expressed in HCC and the liver tissue beside tumor.Then we detected the correlation between these two indexes and the character of clinic pathology,and researched the correlation between Sp3 and the prognosis of HCC.ResultsThe high expression rate of Sp3 in HCC was higher than that of liver tissue beside tumor(P<0.05) according to Western blot and RT-PCR,the same to β-Catenin(P<0.05).Expression of Sp3 and β-Catenin were both related with size of tumor and degree of differentiation.Positive correlation existed between these two indexes according to Western blot method(r=0.681,P=0.000) and RT-PCR method(r=0.641,P=0.000).The prognosis of cases with high expression of Sp3 was poorer than the low expression cases(P<0.05).ConclusionSp3 plays a promoter role in occurrence of HCC,which is correlated with the grade malignancy of HCC.Sp3 might participated in occurrence and development of HCC via the Wnt pathway.
[Key words]carcinoma,hepato cellular;liver neoplasms;transcription factor Sp3;β-Catenin
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.03.022
*基金项目:广西区域性高发恶性肿瘤规范化诊治关键技术研究及应用示范(桂科攻1298003-2-5)。
作者简介:莫伟嘉(1985-),住院医师,硕士,主要从事肝细胞癌发生、发展机制的研究。△通讯作者,E-mail:zhenbofeng@yahoo.com.cn。
[中图分类号]R735.7
[文献标识码]A
[文章编号]1671-8348(2016)03-0356-05
(收稿日期:2015-08-08修回日期:2015-10-16)
