骨形态发生蛋白在胶原诱导关节炎小鼠模型中的表达*
2016-06-15张莹莹焦志军顾金金
刘 强,张莹莹,焦志军,顾金金
(1.江苏大学附属医院检验科/镇江市免疫学重点实验室,江苏镇江 212001;2.江苏省镇江市第一人民医院老年科 212002)
骨形态发生蛋白在胶原诱导关节炎小鼠模型中的表达*
刘强1,张莹莹1,焦志军1,顾金金2△
(1.江苏大学附属医院检验科/镇江市免疫学重点实验室,江苏镇江 212001;2.江苏省镇江市第一人民医院老年科212002)
[摘要]目的建立DBA/1J小鼠胶原诱导关节炎(CIA小鼠)模型,初步研究CIA小鼠外周血单个核细胞中及病变关节组织中BMPs的表达水平。方法利用牛Ⅱ型胶原诱导DBA/1J小鼠发生关节炎病理改变;利用荧光定量PCR检测发病外周血单个核细胞中及关节组织BMPs的mRNA的表达水平,利用免疫荧光技术检测关节组织中BMP9蛋白表达水平。结果成功建立了CIA小鼠模型,检测发现BMP4 mRNA和BMP9 mRNA在发病的CIA小鼠外周血单个核细胞及病变关节组织中表达明显下调(P<0.05),荧光免疫技术显示BMP9蛋白在CIA小鼠病变关节组织中表达明显下调(P=0.002)。结论在基因水平BMP4、9在CIA小鼠外周血单个核细胞中及病变组织中表达明显下调,蛋白水平BMP9在CIA小鼠病变组织中表达明显下调。
[关键词]骨形态发生蛋白;聚合酶链反应;CIA小鼠
类风湿关节炎(RA)是一种以慢性、进行性、侵袭性关节炎为主要表现的自身免疫性疾病。患者关节组织伴随着炎症细胞的浸润和滑膜细胞的增殖,通过细胞之间的作用和分泌的细胞因子,同时在破骨细胞的参与下形成不同程度的骨破坏,不仅表现为受累关节的骨侵蚀,还表现为全身性的骨质疏松[1-3]。骨形态发生蛋白(BMPs)是诱导骨再生最为重要细胞因子之一,属于转化生长因子β(TGF-β)超家族成员。研究已证明BMP(2、4、6、7、9)具有较强的诱导成骨分化的作用,其中BMP7可以抑制CD14+单核细胞向破骨细胞转化[4];学者发现BMP2所诱导的异位成骨过程中,破骨前体细胞在骨基质行成之前就已出现,可破骨性吸收肥大的软骨,是骨形成调节的关键因素[5-6]。可见,成骨细胞与破骨细胞的平衡状态对骨形成和重塑至关重要。本研究通过牛Ⅱ型胶原激发DBA/1J小鼠发生诱导性关节炎(CIA小鼠)病理改变,来模拟人RA病程。实验通过荧光定量PCR和免疫荧光技术检测BMPs在CIA小鼠外周血单个核细胞及发病关节组织中表达情况,为RA骨破坏研究提供新的理论和实验依据。
1材料与方法
1.1材料
1.1.1主要试剂与仪器Trizol试剂(Invitrogen公司),反转录试剂盒(Promega公司),SYBR GreenⅠ(TaKaRa公司),Rotor Gene 6000 荧光定量PCR仪(Corbett Research公司),荧光倒置显微镜(Leica公司 IX71),BMP9多克隆抗体(Santa公司),羊抗兔二抗异硫氰酸荧光素(FITC,厚普生物),牛Ⅱ型胶原(美国Chondrex公司)。
1.1.2实验对象7周龄DBA/1J雄性小鼠购自南京大学模式动物研究所,CIA小鼠是利用牛Ⅱ型胶原蛋白诱导DBA/1J小鼠发生RA病理改变。
1.1.3实时荧光定量PCR引物设计与合成引物根据GenBank中小鼠BMPs和β-actin基因(NM_007393.3)序列,运用primer3(http://www.bioinformatics.nl/cgi-bin /primer3plus/primer3plus.cgi)设计,由TaKaRa公司合成,引物信息见表1。
1.2方法
1.2.1CIA小鼠模型建立选取7周龄DBA/1J雄性小鼠分为对照组10只和诱导组20只,诱导组小鼠于第0天,每只小鼠尾部皮内注射牛Ⅱ型胶原(终浓度1 mg/mL)和完全弗氏佐剂的混合溶液0.1 mL;第21天,尾部皮内注射同等剂量的该乳剂作为激发;对照组小鼠于相同时间仅注射等体积弗氏完全佐剂。1~42 d,隔日记录小鼠发病情况。CIA小鼠关节炎指数评价:通过测量小鼠足掌厚度和肉眼观察关节红肿部位对小鼠进行炎症指数评分。a:足爪没有红肿为0分;b:小趾关节轻微红肿为1分;c:趾关节和足趾关节红肿为2分;d:踝关节以下足爪肿胀为3分;e:包括踝关节在内的全部足爪肿胀为4分。各肢体得分相加为该小鼠关节炎症总评分。

表1 BMPs基因和β-actin基因引物信息
1.2.2CIA小鼠发病关节苏木素-伊红(HE)染色于第42天,选取对照组和诱导组(单个关节评分4分)小鼠组织各3份进行HE染色,观察病理改变。
1.2.3对照组小鼠和诱导组CIA小鼠的外周血单个核细胞cDNA制备第42天,对照组小鼠及CIA组小鼠摘除眼球采血1.0 mL,加入等量的Hank′s液,混匀后轻轻加到Ficoll液中,1 500 r/min离心15 min,轻轻吸出单个核细胞后用磷酸盐缓冲液(PBS)进行洗涤。再用Trizol提取RNA,并逆转录成cDNA。
1.2.4对照组小鼠和诱导组CIA小鼠关节组织cDNA制备第42天,取对照组小鼠及CIA组小鼠(单个关节评分3分及以上)踝关节以下组织,剥离皮肤和肌肉后加入Trizol进行匀浆,提取组织RNA 并逆转录成cDNA。
1.2.5荧光定量PCR检测以cDNA为模板,分别进行BMP2、4、6、7、9基因扩增,扩增条件优化为:预变性95 ℃ 20 s,变性95 ℃ 10 s,退火 56 ℃ 10 s,延伸 72 ℃ 20 s,终末延伸72 ℃ 1 min,共40个循环。所有样品均为3个平行管,采用2-ΔΔCt分析基因相对表达水平。
1.2.6对照组小鼠和诱导组CIA小鼠关节组织中BMP9的免疫荧光检测取对照组小鼠和CIA组小鼠(单个关节评分3分及以上),分别进行石蜡包埋,先孵育兔抗鼠BMP9一抗,再孵育羊抗兔二抗FITC,最后用荧光显微镜进行观察并采集图片,利用Image-ProPlus6.0图像软件分析两组BMP9的表达情况。
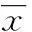
2结果
2.1CIA小鼠模型的建立诱导组16只DBA/1J小鼠经免疫30 d后,趾骨关节、掌骨关节开始出现肿胀,42 d达到高峰(图1A);对照组10只小鼠无发病现象(图1B)。HE染色观察,对照组小鼠滑膜组织无增生(图1C),衬覆1~2层滑膜细胞,无炎细胞浸润、血管扩张、血管翳;诱导组CIA小鼠关节明显可以看到滑膜组织增生(图1D),衬覆多层滑膜细胞,血管扩张充血,炎细胞浸润,血管翳出现,骨质被侵蚀。
A:诱导组;B:对照组;C:对照组小鼠趾关节组织(×100);D:诱导组小鼠趾关节组织(×100)。
图1CIA小鼠RA组织HE染色结果
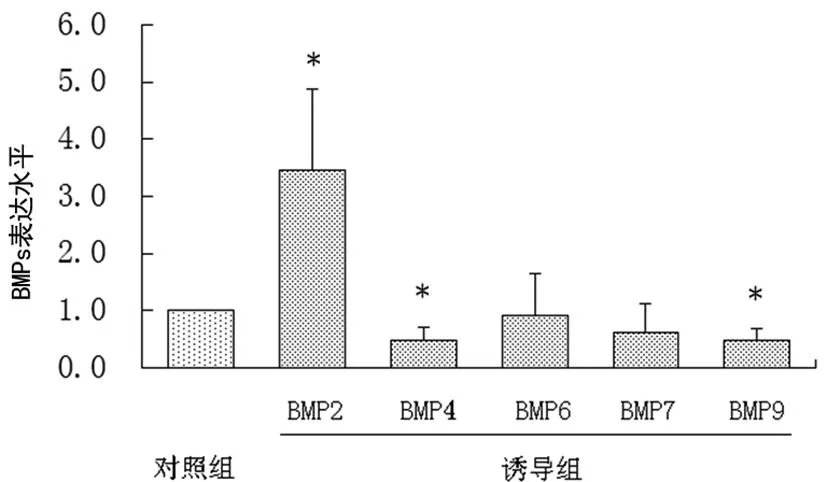
*:P<0.05,与对照组比较。
图2BMPs在CIA小鼠外周血单个核细胞中表达情况

*:P<0.01,与对照组比较。
图3BMPs在CIA小鼠发病组织中表达情况
2.2BMPs在CIA小鼠外周血单个核细胞中的表达利用荧光定量PCR检测对照组和诱导组小鼠外周血单个核细胞,诱导组CIA小鼠中BMP2与对照组比相对表达水平为3.03±1.42(P=0.024),BMP4和BMP9相对表达水平分别为0.47±0.24、0.48±0.21(P=0.013、0.012),BMP6和BMP7表达差异无统计学意义,分别为0.92±0.74、0.62±0.51(P=0.703、0.071),见图2。
2.3BMPs在CIA小鼠发病关节组织中的表达在对照组和诱导组(CIA小鼠)中分别采用荧光定量PCR检测BMPs mRNA的表达情况。由图3可知,与对照组比,BMP2在诱导组相对表达水平为0.31±0.08(P<0.01),BMP4在诱导组相对表达水平为0.30±0.04(P=0.001),BMP6在诱导组相对表达水平为0.12±0.15(P=0.001),BMP7在诱导组相对表达水平为0.17±0.07(P<0.01),BMP9在诱导组相对表达水平为0.29±0.11(P=0.008)。
2.4免疫荧光检测CIA小鼠肿胀关节组织中BMP9的蛋白表达免疫荧光检测CIA小鼠发病趾关节组织中BMP9的蛋白表达,用Image-Pro Plus图像分析软件对免疫荧光图片上平均荧光密度进行分析,结果显示BMP9在诱导组CIA小鼠表达明显低于对照组(P=0.002),见图4。

A:对照组(×200);B:CIA小鼠发病组(×200);C:两组的BMP9平均荧光强度比较。*:P<0.01,与对照组比较。
图4BMP9在CIA小鼠发病关节组织中表达情况
3讨论
RA是以慢性多关节滑膜炎,骨及软骨破坏为主要特征的全身性自身免疫性疾病,主要影响四肢关节的功能。RA的发生、发展受多条信号通路的调节,其中TGF-β是一条重要通路。BMPs是TGF-β超家族成员之一,对组织的生长发育有着重要的作用,在组织的损伤修复平衡中起着一定的调节作用。BMPs对不同种类细胞的增殖、分化、黏附、迁移和凋亡起着重要调节作用,在RA患者滑膜中证实了BMPs的存在[7-8]。CIA小鼠是近年来研究RA病理机制的较为理想动物模型,主要表现为关节红肿,多发性关节炎,严重时可致关节畸形并伴有炎性细胞浸润。本实验通过牛Ⅱ型胶原诱导DBA/1J小鼠发病,发病率较高,另外4只小鼠因为个体差异或注射效果差而未发病。发病的CIA小鼠表现为滑膜组织增生,衬覆多层滑膜细胞,血管扩张充血,炎细胞浸润,血管翳出现,骨质被侵蚀等病理变化,类似于人RA的临床病理改变[9-10]。
在CIA小鼠外周血单个核细胞中BMPs表达谱发生不同程度改变,BMP2表达明显上调,同时BMP4和BMP9表达明显下调。接下来检测病变关节组织中的BMPs,5种BMPs均表达明显下调,其中BMP4和BMP9与外周血检测结果一致。其中BMP2在外周血单个核细胞中表达与其在病变关节组织中表达存在明显差异,推测其原因:(1)产生部位和产生细胞不同,外周血中主要由单个核细胞(主要是淋巴细胞和单核细胞产生),病变关节组织中主要由巨噬细胞样滑膜细胞和成纤维样滑膜细胞产生;(2)细胞因子相互作用呈复杂网络性,具体产生机制需要进一步研究证实。依据现有报道BMPs可协同TGF-β促进Foxp3+调节性T细胞分化,可见BMPs在病变关节中的表达减少,导致T细胞分化减弱,不能有效抑制免疫反应,进一步发展局部关节受到炎症侵蚀破坏[11-12]。BMP9是近年来研究较热的BMPs,其在成骨分化诱导上起着重要作用,早期可以促使成骨标志物碱性磷酸酶增高[13-15],为进一步证实BMP9表达情况,利用免疫荧光技术检测关节组织中BMP9的蛋白水平,发现发病关节组织中BMP9表达明显下调与其基因水平变化一致。由此推测BMP9的下调改变可能促进了CIA小鼠关节骨破坏的发生、发展,与学者Lories 研究结论:在小鼠体内上调BMPs信号通路可保护软骨免受炎症侵蚀一致[16]。由此可见BMPs信号通路可能是治疗关节炎骨破坏新的靶点。
综合以上实验结果,本研究证实了BMPs在胶原诱导关节炎发生、发展过程中存在表达谱的改变,其中BMP9表达明显下调,这为进一步研究其作用机制提供实验和理论基础。
参考文献
[1]Ochi S,Shinohara M,Sato K,et al.Pathological role of osteoclast costimulation in arthritis-induced bone loss[J].Proc Natl Acad Sci U S A,2007,104(27):11394-11399.
[2]Kotake S,Yago T,Kawamoto M,et al.Human receptor activator of NF-kappaB ligand (RANKL) induces osteoclastogenesis of primates in vitro[J].In Vitro Cell Dev Bio Anim,2012,48(9):593-598.
[3]McInnes IB,Schett G.The pathogenesis of rheumatoid arthritis[J].N Engl J Med,2011,365(23):2205-2219.
[4]Cheng H,Jiang W,Phillips FM,et al.Osteogenic activity of the fourteen types of human bone morphogenetic proteins (BMPs)[J].J Bone Joint Surg Am,2003,85-A(8):1544-1552.
[5]Zheng Y,Wang L,Zhang X,et al.BMP2/7 heterodimer can modulate all cellular events of the in-vitro rankl-mediated osteoclastogenesis respectively in different dose-patterns[J].Tissue Eng Part A,2012,18(5/6):621-630.
[6]Lysdahl H,Baatrup A,Foldager CB,el al.Preconditioning human mesenchymal Stem cells with a low concentration of BMP2 stimulates proliferation and osteogenic differentiation in vitro[J].Biores Open Access,2014,3(6):278-285.
[7]BramlageCP,HäuplT,KapsC,etal.Decreaseinexpressionofbonemorphogeneticproteins4
and 5 in synovial tissue of patients with osteoarthritis and rheumatoid arthritis[J].Arthritis Res Ther,2006,8(3):R58.
[8]Williams JC,Maitra S,Anderson MJ,et al.BMP-7 and bone regeneration:evaluation of dose-response in a rodent segmental defect model[J].J Orthop Trauma,2015,29(9):e336-341.
[9]Lories RJ,Matthys P,de Vlam K,et al.Anhylosing enthesitis,dactylitis,and onychoperiostitis in male DBA/1 mice:a model of psoriatic arthrtis[J].Ann Rheum Dis,2004,63(5):595-598.
[10]Wang XQ,Peng YP,Liu Z,et al.Roles of tyrosine hydroxylase expressed by CD4+ T cell subsets in collagen type Ⅱ-induced arthritis[J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2014,30(5):390-394.
[11]Lu L,Ma J,Wang X,et al.Synergistic effect of TGF-beta superfamily members on the induction of Foxp3+ Treg[J].Eur J Immunol,2010,40(1):142-152.
[12]Mellado U,Martínez-Muoz L,Cascio G,et al.T cell migration in rheumatoid arthritis[J].Front Immunol,2015,6:384.
[13]Kanakaris NK,Calori GM,Verdonk R,et al.Application of BMP-7 to tibial non-unions:a 3-year multicenter experience[J].Injury,2008,39(Suppl 2):S83-90.
[14]Vaccaro AR,Whang PG,Patel T,et al.The safety and efficacy of OP-1 (rhBMP-7) as a replacement for iliac crest autograft for posterolateral lumbar arthrodesis:minimum 4-year follow-up of a pilot study[J].Spine J,2008,8(3):457-465.
[15]Li XL,Liu YB,Ma EG,et al.Synergistic effect of BMP9 and TGF-β in the proliferation and differentiation of osteoblasts[J].Genet Mol Res,2015,14(3):7605-7615.
[16]Lories RJ,Daans M,Matthys P,et al.Noggin haploinsufficiency differentially affects tissue responses in destructiveand remodeling arthritis[J].Arthritis Rheum,2006,54(6):1736-1746.
Expression of bone morphology proteins in mice with collagen-induced arthritis*
LiuQiang1,ZhangYingying1,JiaoZhijun1,GuJinjin2△
(1.ClinicalLaboratory,theAffiliatedHospitalofJiangsuUniversity/ZhenjiangKeyLaboratoryofImmunology,Zhenjiang,Jiangsu212001,China;2.DepartmentofGerontology,ZhenjiangFirstPeople′sHospital,Zhenjiang,Jiangsu212002,China)
[Abstract]ObjectiveTo establish collagen-induced arthritis (CIA) model used of DBA/1J mouse,a preliminary study of the expression levels of BMPs in mononuclear cells of peripheral blood and the joints tissue of CIA mice.MethodsWe induced DBA/1J mice and developed arthritis pathology by using of bovine type Ⅱ;then,we detected mRNA and protein expression levels of BMPs by using quantitative PCR and immunohistochemical staining.ResultsWe successfully established CIA mouse model.The expression of BMP4 and BMP9 mRNA was significantly down-regulated in peripheral blood mononuclear cells and in the pathogenesis of joint tissues of CIA mice (P<0.05).It showed that BMP9 protein significantly decreased in joint tissues of CIA mice by immunofluorescence technique (P=0.002).ConclusionAt the genetic level,the expression of BMP4 and BMP9 could be significantly down-regulated in the CIA mouse.At the protein level,BMP9 could be significantly down-regulated in the CIA mouse.
[Key words]bone morphogenetic proteins;polymerase chain reaction;CIA mice
doi:·论著·10.3969/j.issn.1671-8348.2016.03.002
*基金项目:国家自然科学基金(81373217);江苏大学2012年度医学临床科技发展基金(JLY20120169)。
作者简介:刘强(1985-),主管检验技师,硕士,主要从事BMPs信号通路在类风湿关节炎骨破坏中作用研究。△通讯作者,E-mail:gujinjin_free@163.com。
[中图分类号]R392.9
[文献标识码]A
[文章编号]1671-8348(2016)03-0293-03
(收稿日期:2015-08-08修回日期:2015-10-16)
