EGR3在口腔鳞状细胞癌中的表达及对细胞行为的影响*
2016-06-15翁海勇郑根建王琼超李鹏程唐乃高
翁海勇,郑根建,何 龙,云 蔓,王琼超,李鹏程,唐乃高,肖 旭
(海南医学院附属医院口腔科,海南海口 570100)
EGR3在口腔鳞状细胞癌中的表达及对细胞行为的影响*
翁海勇,郑根建△,何龙,云蔓,王琼超,李鹏程,唐乃高,肖旭
(海南医学院附属医院口腔科,海南海口 570100)
[摘要]目的探讨早期生长反应因子3(EGR3) 在口腔鳞状细胞癌(以下简称口腔鳞癌)中的表达及对细胞行为的影响。方法选择2010年3月至2013年3月该院收治的口腔鳞癌患者20例的肿瘤组织样本及配对的癌旁组织样本作为研究对象,另选正常口腔黏膜样本7份作为对照组。经过转染后分析EGR3表达水平,并分析EGR3在人舌鳞癌细胞(Tca-8113)中高表达对细胞系增殖的影响及EGR3转染后Tca-8113细胞凋亡情况。结果口腔鳞癌组织中,EGR3 mRNA水平为0.008±0.004,显著低于鳞癌癌旁组织的1.723±1.195(P<0.05);而EGR3 mRNA于鳞癌细胞系的表达水平为0.008±0.002,显著低于鳞状上皮细胞的2.109±0.997(P<0.05);转染24 h后,EGR3转染组的EGR3水平显著低于未转染及空质粒对照组(均P<0.05);EGR3转染组在转染24、48 h时的早期凋亡率与中晚期凋亡率,以及坏死细胞率均低于空质粒对照组(均P<0.05)。结论EGR3在口腔鳞癌中低表达或缺失,高表达能够抑制肿瘤的生长,加快细胞凋亡。
[关键词]早期生长反应因子3;口腔;肿瘤,鳞状细胞;基因表达;细胞行为
目前,口腔鳞状细胞癌(以下简称口腔鳞癌)的发病机制仍未完全明晰,但有部分实验证实其发生、发展均与癌基因和抑癌基因异常性表达联系紧密[1]。亦有报道指出,染色体的不稳定性可能是口腔鳞癌产生机制当中的重要环节之一[2],且现已有研究指出早期生长反应因子3(EGR3)是潜在抑癌基因,其通过表达下调参与到各类肿瘤的发生及进展。然而,对于EGR3的研究却鲜少涉及,且作用机制亦不明确。本文通过EGR3在口腔鳞癌的表达及其对于细胞行为产生的影响,得到了一些结论,现报道如下。
1资料与方法
1.1一般资料选择2010年3月至2013年3月在本院接受治疗的口腔鳞癌患者20例的肿瘤组织样本及配对的癌旁组织样本作为研究对象。其中男12例,女8例;年龄60~89岁,平均(72.30±3.50)岁。纳入标准:(1)患者均满足WHO关于口腔鳞癌的诊断标准[3];(2)通过影像学等手段证实;(3)所有患者病历资料完整。排除标准[4]:(1)患者有其他种类的口腔恶性肿瘤;(2)对诊治等方案的依从性不高,拒绝接受进一步治疗者。另选本院志愿者正常口腔黏膜样本7份作为对照组,其中男4例,女3例;年龄62~85岁,平均(71.90±4.20)岁。
1.2方法
1.2.1材料试剂(1)RPMI 1640培养基和胎牛血清均产于美国GIBCO公司;(2)BIY-Pdc316-mCMV-EGFP-EGR3荧光蛋白(EGFP)与EGR3表达质粒、对照质粒BIY-Pdc316-mCMV-EGFP等均产于北京博淼公司;(3)膜联蛋白/碘化丙啶(Annexin/PI)试剂产于北京宝赛公司;(4)BrdU增殖试剂盒产于瑞士罗氏公司;(5)反转录RT试剂盒产于美国ABI公司;(6)总RNA的提取试剂盒产于美国Qiagen公司。
1.2.2复苏培养将口腔鳞癌的细胞系KB及人舌鳞癌细胞(Tca-8113)进行复苏培养处理,消化收集细胞,将总RNA进行部分提取,剩余细胞接种在6孔板以备转染。
1.2.3EGR3 mRNA检测根据逆转录PCR对EGR3 mRNA的表达进行测定。引物序列EGR3的上游为5′-AAT GGA CAT CGG TCT GAC CAA-3′,下游为5′-GGC GAA CTT TCC CAA GTA GGT-3′;产物长度为109 bp。GAPDH的上游为5′-CCA CAT CGC TCA GAC ACC AT-3′,下游为5′- GGC AAC AAT ATC CAC TTT ACC AGA GT-3′。
1.2.4转染测定增殖、凋亡应用EGR3质粒对Tca-8113进行转染,评价细胞增殖和凋亡。其中未经过转染的Tca-8113为未转染组;经过空质粒转染的Tca-8113为空质粒对照组;经过EGR3质粒转染的Tca-8113为EGR3转染组。转染并继续培养96 h,分别在0、24、48、96 h评价肿瘤增殖和凋亡情况。其中凋亡检测选择Annexin/PI双染标记,并经流式细胞仪分析。使用蛋白免疫印迹法(western blot)对EGR3表达进行测定。相关试剂的使用严格遵照说明书进行。质粒构建与转染:构建EGFP及EGR3 cDNA表达载体,为“BIY-pDC3160-mCMV-EGFP”。体外经阳离子型脂质体对口腔鳞癌的“Tca-8113”细胞系进行转染,由反转录PCR对转染后Tca-8113内EGR3的mRNA与蛋白表达明显上调进行验证。
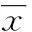
2结果
2.1EGR3表达水平分析口腔鳞癌组织中,EGR3 mRNA水平为0.008±0.004,低于鳞癌癌旁组织的1.723±1.195,差异有统计学意义(t=4.538,P=0.000)。而EGR3 mRNA在鳞癌细胞系的表达水平为0.008±0.002,低于鳞状上皮细胞的2.109±0.997,差异有统计学意义(t=6.664,P=0.000)。
2.2EGR3在Tca-8113中高表达对于细胞系增殖的影响转染24 h后,EGR3转染组的EGR3水平低于未转染及空质粒对照组,差异均有统计学意义(P<0.05),见表1。
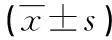
表1 EGR3表达水平分析
a:P<0.05,与EGR3转染组比较。
2.3EGR3转染后Tca-8113细胞凋亡情况EGR3转染组在转染24、48 h时的早期凋亡率与中晚期凋亡率及坏死细胞率均低于空质粒对照组,差异有统计学意义(P<0.05),见表2。
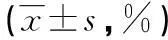
表2 EGR3转染后Tca-8113细胞凋亡情况
3讨论
EGR家族主要含有4个基因,分别为EGR1~EGR4,此类基因均含1个关于EGR的早期反应元件,从而结合DNA锌指结构[5]。EGR3正是其中的一个基因,此基因编码出的蛋白是EGR家族Cys2His2 锌指结构性转录因子,亦为有丝分裂所刺激诱导的一种早期的生长反应性基因[6]。此基因编码而成的蛋白质可参与能够控制到生物节律转录调控的过程中,具有十分重要的意义。有报道称,口腔鳞癌组织及一些鳞癌细胞系内,EGR家族基因均呈现表达低下或缺失状态[7]。为更加具体地进行研究,本文选择EGR3基因进行深入分析,旨在进一步研究EGR3基因在口腔鳞癌中的表达及其对细胞行为的影响。
本研究发现,口腔鳞癌组织中,EGR3 mRNA水平显著低于鳞癌癌旁组织。而EGR3 mRNA于鳞癌细胞系的表达水平显著低于鳞状上皮细胞的水平。表明鳞癌组织或细胞系均有较强的EGR3表达,与Lai等[8]的报道结果一致。分析原因,可能是因为EGR3对于肿瘤而言,可作为人凋亡相关因子配体(Fasl)的一种重要调控分子,其自身表达后能够使FasL表达上升,进而促使凋亡发生,换言之,EGR3表达的低下或缺失状态无法有效启动使Fas-FasL依赖的相关凋亡途径,进而导致细胞增殖异常而无法出现凋亡,在一定程度上促使了肿瘤的进一步发展[9]。因此EGR3转染24 h后,EGR3水平显著低于未转染及空质粒对照组的水平,且EGR3转染组在转染24、48 h时的早期凋亡率、中晚期凋亡率及坏死细胞率均低于空质粒对照组,与Garewal等[10]的相关报道一致。关于EGR基因家族和肿瘤间的联系,有研究证实EGR1是一种参与到多类肿瘤进展的抑癌基因,但其同时指出,EGR3亦有类似的抑癌作用。目前在临床上,关于EGR3的研究大都集中于神经和免疫细胞的发育方向,主要认为其是肌肉与中枢神经系统等发育过程中的重要调节基因,亦可调节FasL和肿瘤坏死因子α(TNF-α),进而诱导有关的凋亡配体及TNF-α的表达[11]。另一项针对白血病患者的研究发现,EGR3启动子呈现异常的高甲基化,致使T细胞中的FasL表达缺失,且Fas-FasL所依赖的凋亡亦发生缺失,由此引发急性T细胞性白血病[12]。本研究中,还构建出EGR3表达质粒,将其转染到Tca-8113型鳞癌细胞系内,结果发现EGR3在患者口腔鳞癌细胞系中表达能够有效地抑制肿瘤细胞增殖及凋亡,表明EGR3可能已参与到口腔鳞癌发生及肿瘤抑制过程。但EGR3是否是一种潜在与口腔肿瘤有关的抑制性基因,仍须通过更多深入研究加以证实。
综上所述,EGR3在口腔鳞癌中低表达或者表达缺失,临床可增强其表达来抑制肿瘤生长,并促使肿瘤细胞凋亡,值得临床重视。
参考文献
[1]李茵,温颖,周进学,等.口腔鳞状细胞癌中EGR3基因表达缺失对细胞行为的影响[J].中华医学杂志,2013,93(32):2549-2552.
[2]Tasoulas J,Giaginis C,Patsouris E,et al.Histone deacetylase inhibitors in oral squamous cell carcinoma treatment[J].Expert Opin Investig Drugs,2014,12(1):1-10.
[3]谢舒乐,杨宏宇.TGF-β信号通路与口腔鳞状细胞癌的研究进展[J/CD].中华口腔医学研究杂志:电子版,2014,8(3):61-65.
[4]Chuang WY,Yeh CJ,Chao YK,et al.Concordant podoplanin expression in cancer-associated fibroblasts and tumor cells is an adverse prognostic factor in esophageal squamous cell carcinoma[J].Int J Clin Exp Pathol,2014,7(8):4847-4856.
[5]张舒,王博,周旋,等.趋化因子CXC亚家族受体4调控口腔鳞状细胞癌上皮间质转化介导淋巴转移的体外实验[J].中华口腔医学杂志,2014,49(3):171-176.
[6]Lindgren G,Ekblad L,Vallon-Christersson J,et al.Erythropoietin suppresses the activation of pro-apoptotic genes in head and neck squamous cell carcinoma xenografts exposed to surgical trauma[J].BMC Cancer,2014,14(1):648-649.
[7]孔祥盼,西玉立,步荣发,等.表观遗传学在口腔鳞状细胞癌分子机制中的研究进展[J].中华老年口腔医学杂志,2013,11(4):244-248.
[8]Lai YH,He RY,Chou JL,et al.Promoter hypermethylation and silencing of tissue factor pathway inhibitor-2 in oral squamous cell carcinoma[J].J Transl Med,2014,12(1):237-238.
[9]刘兴光,蒋盼,旷世佳,等.肿瘤抑制蛋白 FBW7在口腔鳞状细胞癌中表达的研究[J/CD].中华临床医师杂志:电子版,2013,11(1):4835-4839.
[10]Garewal J,Garewal R,Sircar K,et al.Expression of Bcl-2 and MIB-1 Markers in Oral Squamous Cell Carcinoma (OSCC)-A Comparative Study[J].J Clin Diagn Res,2014,8(7):1-4.
[11]张波.老年人口腔鳞状细胞癌组织中pontin和KAI1蛋白的表达及意义[J].中国老年学杂志,2013,33(4):774-775.
[12]Wang X,Sun C,He S,et al.Apoptotic effects of diosgeninlactoside on oral squamous carcinoma cells in vitro and in vivo[J].Biol Pharm Bull,2014,37(9):1450-1459.
doi:·经验交流·10.3969/j.issn.1671-8348.2016.06.022
基金项目:海南省卫生厅科技计划项目(琼卫2010-54)。
作者简介:翁海勇(1974-),主治医师,大学本科,主要从事口腔颌面外科疾病诊治的研究。△通讯作者,Tel:18789259928;E-mail:airforcezhgj@163.com。
[中图分类号]R780
[文献标识码]B
[文章编号]1671-8348(2016)06-0793-02
(收稿日期:2015-06-03修回日期:2015-10-10)
