Fe3O4-β-环糊精聚合物固相萃取紫外可见光谱法分离分析孔雀石绿
2016-06-15平文卉朱霞石
冯 刚, 平文卉,朱霞石*
1. 扬州大学化学化工学院,江苏 扬州 225002 2. 江苏省扬州商务高等职业学校,江苏 扬州 225002
Fe3O4-β-环糊精聚合物固相萃取紫外可见光谱法分离分析孔雀石绿
冯 刚1,2, 平文卉1,朱霞石1*
1. 扬州大学化学化工学院,江苏 扬州 225002 2. 江苏省扬州商务高等职业学校,江苏 扬州 225002
合成并以元素分析、红外及电镜等方法表征Fe3O4/羟丙基-β-环糊精聚合物磁性纳米材料(CM-HP-β-CDCP-MNPs),以此作为固相萃取剂,建立磁性固相萃取-紫外可见光谱法分离分析孔雀石绿的新方法。考察影响吸附和洗脱的条件(pH, 萃取剂用量,洗脱剂类型用量,萃取用洗脱时间等)。结果表明: 室温下,pH 7.0时,CM-HP-β-CDCP-MNPs能快速定量吸附孔雀石绿(吸附率92%); 乙醇在30 min内可脱附孔雀石绿(脱附率90%); CM-HP-β-CDCP-MNPs可重复使用5次。在最佳实验条件下,该方法的富集倍数为7.5,检出限为5.6 ng·mL-1,线性范围为0.08~8.00 μg·mL-1,测定样品中的孔雀石绿结果令人满意。利用红外光谱初步讨论Fe3O4/羟丙基-β-环糊精聚合物纳米材料吸附机理。
孔雀石绿; Fe3O4-β-环糊精聚合物; 固相萃取; 光谱法
引 言
孔雀石绿(图1),由于抗菌、抗寄生虫效力较强且价格便宜,被广泛用于池塘水的水体消毒和防治鱼类疾病。孔雀石绿对人类细胞有致突变性、致癌性,如形成肝脏肿瘤、肾脏肿瘤,引起鱼类生殖异常等,在很多国家是被禁用的。因此,严格监控水体中孔雀石绿残留量对于建立无公害水环境,保证人体健康具有重要意义[1]。
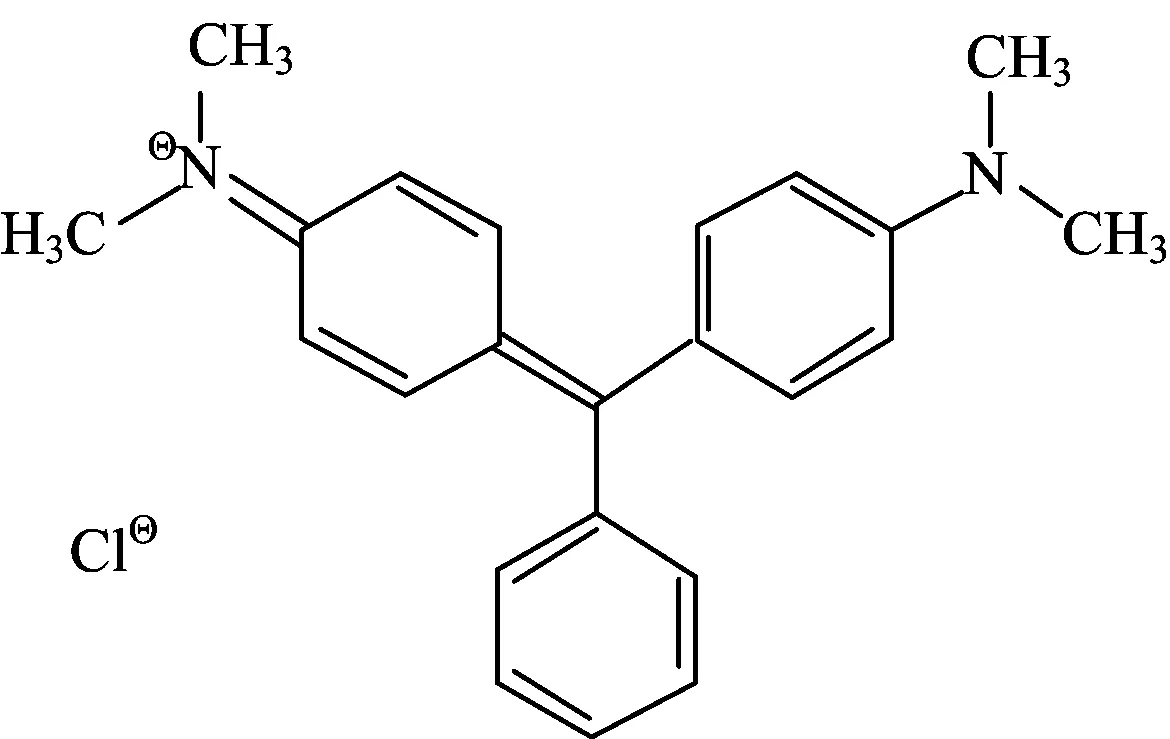
Fig.1 Chemical structure of malachite green
孔雀石绿测定方法包括高效液相色谱法[2],紫外光谱法[3],毛细管电泳[4],伏安法[5]等。其中紫外光谱法操作简单,仪器成本低,方法稳定性好,但仅以紫外光谱法作为检测手段,检出限较高,测定结果易受实际样品中基体干扰。为了提高方法的灵敏度和选择性,将预富集手段与紫外光谱法相结合的联用技术,就显得尤为重必要。
固相萃取因其具有富集倍数高、选择性好、操作简单等特点,受到越来越多的关注[6]。固相萃取材料选择是影响萃取效果的重要因素之一。固相萃取材料主要包括: 纤维[7],硅胶[8],螯合树脂[9],环糊精聚合物[10],纳米材料[11]等。四氧化三铁磁性纳米材料具有较大比表面积及特殊的磁学性质[12],作为固相萃取材料广泛应用于分离分析样品中的金属元素[12-13]、有机化合物[14, 15]等。功能化磁性纳米材料利用磁性纳米分子作为骨架进行选择性修饰,构建新型纳米材料,既保持了本体的优点,修饰基团又可以体现其功能性,性能往往优于其母体。已经报道四氧化三铁磁性纳米材料与壳聚糖、藻酸盐、阿拉伯树胶、纤维素等树脂的功能化应用[16]。功能化磁性纳米材料用于染料分析未见报道。
工作中合成羧甲基-羟丙基-β-环糊精聚合物(CM-HP-β-CDCP),并成功负载到Fe3O4纳米粒子表面,建立Fe3O4/羟丙基-β-环糊精聚合物纳米材料(CM-HP-β-CDCP-MNPs)作为固相吸附材料与UV-Vis联用分离分析孔雀石绿新方法。并探讨Fe3O4/羟丙基-β-环糊精聚合物纳米材料包合孔雀石绿的机理。实际样品测定结果令人满意。
1 实验部分
1.1 仪器与试剂
数显恒温水浴锅(国华电器有限公司); UV-2500紫外-可见分光光度计(日本岛津公司); 红外光谱仪(德国BRUKER公司); 电动搅拌器(国华电器有限公司); 2400 SERIES Ⅱ元素分析仪 (美国PerkinElmer公司)。
甲醇、乙醇(AR,国药集团化学试剂有限公司); 羟丙基-β-环糊精、NaOH、HCl、丙酮、环氧氯丙烷、孔雀石绿标准品(国药集团化学试剂有限公司)。
1.2 方法
1.2.1 Fe3O4/羟丙基-β-环糊精聚合物纳米材料制备
(1)HP-β-CD(羟丙基-β-环糊精)(5.0 g)溶解在50 mL 10%(w/v)NaOH溶液中,加入10 mL环氧氯丙烷,于50 ℃,大功率搅拌8 h,再加入5 mL环氧氯丙烷,搅拌放置10 h,洗脱时间30 min。将上层溶液浓缩到15 mL, 用冷乙醇(500 mL)沉淀,再用乙醇、丙酮洗该沉淀,于真空中干燥。
(2)将上述2 g聚合物溶解在50 mL 3.5% (w/v) NaOH溶液,加入2.5 g氯乙酸钠,在40 ℃,大功率搅拌24 h,用2 mol·L-1HCl调节至中性,浓缩到15 mL再冷却到4 ℃,将NaCl过滤掉,再用冷乙醇(500 mL)沉淀上层清液。沉淀物用乙醇及丙酮洗两次,在真空下干燥12 h。
(3)将1.202 6 g FeSO4·7H2O,1.4167 g FeCl3及 3.0 g CM- HP-β-CD,溶解在40 mL去除气泡的超纯水中,以1 200 r·min-1大力搅拌。溶液加热到90 ℃时,加入5 mL NH4OH(25%),在氮气环境下,反应1 h。最后获得纳米粒子,将其用高纯水洗5~6次,去除未反应的物质,将其真空干燥。
1.2.2 孔雀石绿静态吸附
准确称取CM-HP-β-CDCP-MNPs 0.05 g于离心管中,加入一定量孔雀石绿(20.0 mL, 2.00 μg·mL-1),调节pH至7.0,室温振荡15 min,离心分离,取上层清液,用紫外光谱法进行测定(孔雀石绿的最大吸收波长为620 nm)。
孔雀石绿萃取率可由下式计算
(1)
RE%为萃取率,ci为萃取前水相中孔雀石绿浓度,cf为萃取后水相中孔雀石绿浓度。
1.2.3 元素分析
连续设定空白运行至空白平行,将标样与空白交替运行至:C: ±0.15,H: ±3.75,N: ±0.16,仪器标定完成后上样(不同量的CM-HP-β-CD修饰纳米Fe3O4)运行。直接获得样品中元素的含量。
2 结果与讨论
2.1 CM-HP-β-CDCP-MNPs表征
2.1.1 元素分析
试验不同量CM-HP-β-CD修饰纳米Fe3O4,考察修饰效果,采用元素分析进行表征(图2),随着CM-HP-β-CD量的增加,碳元素含量逐渐增加,说明羧基成功地修饰到了Fe3O4的表面,但是当CM-HP-β-CD增加到3.0~6.0 g时,碳元素含量几乎没有变化,说明纳米材料表面修饰已经达到了饱和。实验中选择CM-HP-β-CD的量为3.0 g。
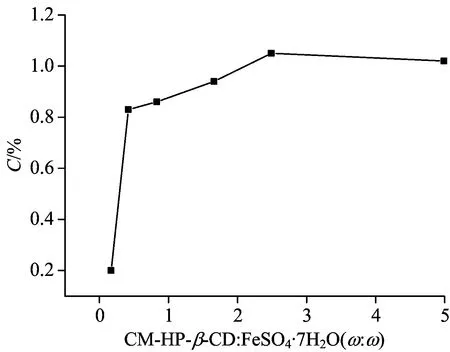
Fig.2 Element composition of CM-HP-β-CD/Fe3O4
2.1.2 傅里叶变换红外光谱分析(FTIR)[17]
图3是HP-β-CD及其中间产物的FTIR谱图,其中(a)—(e)分别为Fe3O4,CM-HP-β-CDCP-MNPs,CM-HP-β-CDCP,HP-β-CDCP,HP-β-CD的FTIR谱图。从图3中看出: (1)比较曲线c和d, 1 710 cm-1为羰基伸缩振动,3 200 cm-1为O—H的伸缩振动,说明羧甲基接到CM-β-CDCP上。(2)比较曲线a和b,2 400和2 850 cm-1处是C—H的伸缩振动峰,说明材料中含有HP-β-CDCP; 586 cm-1为四面体结构中的Fe—O引起的特征吸收峰,表明该材料中存在Fe3O4; 1 628 cm-1处吸收峰,CM-HP-β-CDCP-MNPs(b)比Fe3O4(a)的强度大; 说明HP-β-CDCP成功负载到Fe3O4上。
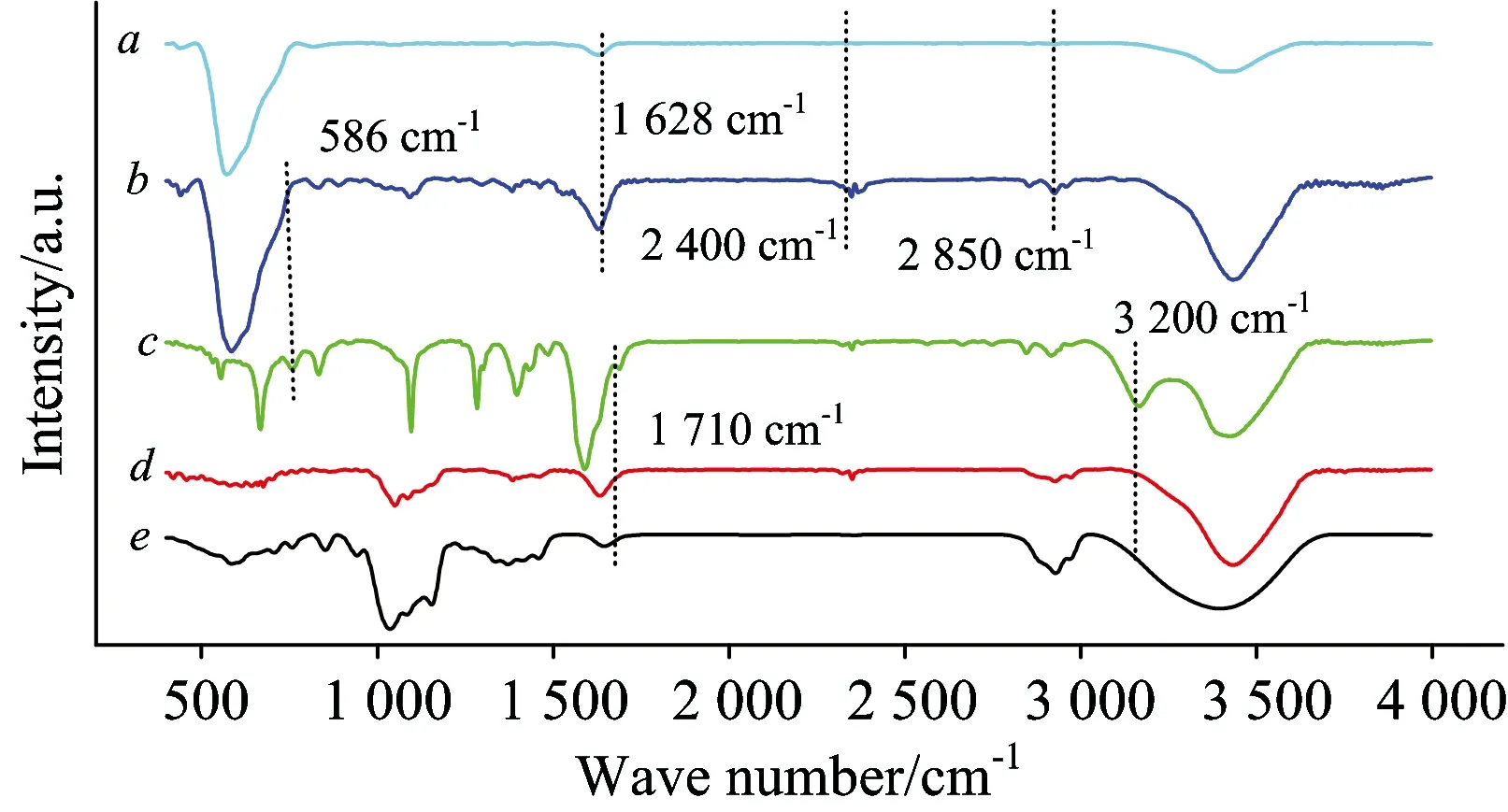
Fig.3 FTIR spectra of Fe3O4a,CM-HP-β-CDCP-MNPs b, CM-HP-β-CDCP c,HP-β-CDCP d,and HP-β-CD e
2.1.3 电镜
图4为CM-HP-β-CDCP-MNPs透射电镜图,从图4中可以看出,浅灰色CM-HP-β-CDCP包裹于黑色Fe3O4粒子表面[18],且CM-HP-β-CDCP-MNPs纳米颗粒平均直径为20 nm。
2.2 吸附条件优化
研究了pH、体积等吸附条件对CM-HP-β-CDCP-MNPs吸附孔雀石绿吸附率的影响。
2.2.1 pH影响
实验研究了不同pH(3.0~9.0)对CM-HP-β-CDCP-MNPs及Fe3O4吸附孔雀石绿的影响,以0.1 mol·L-1HCl 及0.1 mol·L-1NaOH调节pH的大小。如图5,CM-HP-β-CDCP-MNPs对孔雀石绿的吸附率(a)明显高于相同pH条件下Fe3O4对孔雀石绿的吸附率(b)。当溶液pH值为6.0~7.0时,CM-HP-β-CDCP-MNPs吸附率达到85%以上,pH值7.0时,吸附率为92%,因此实验选择在溶液pH 7.0的条件下进行。
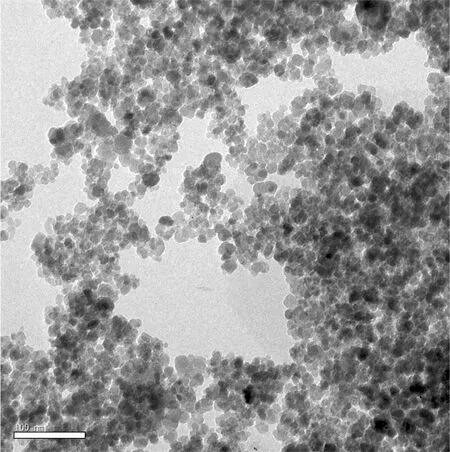
Fig.4 TEM of CM-HP-β-CDCP-MNPs
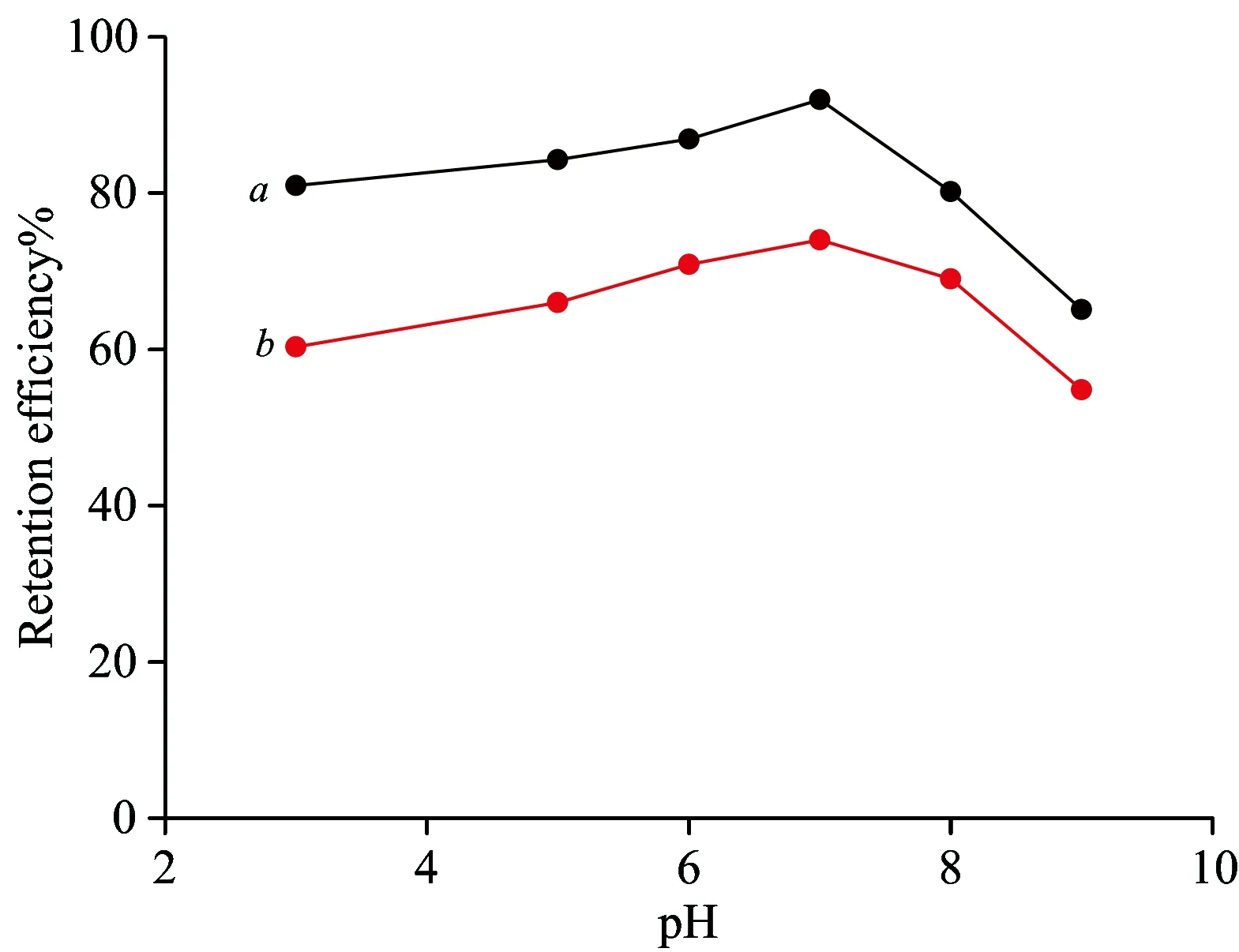
Fig.5 Effect of pH on retention efficiency CM-HP-β-CDCP-MNPsaand Fe3O4b(cc0=2.0 μg mL-1)
2.2.2 样品体积影响
样品体积与洗脱液比例越大,该方法对孔雀石绿富集效果越好。实验固定孔雀石绿量为0.2 μg,溶液体积从5.0~40.0 mL。结果如图6所示,样品体积在5.0~30.0 mL时,吸附率≥85%,5.0~20.0 mL时,吸附率最大。选择溶液体积20.0 mL。
2.2.3 吸附温度和时间影响
试验了不同温度(5.0~50.0 ℃)下材料对孔雀石绿的吸附情况,随着温度升高,吸附率递减,5.0~35.0 ℃内吸附率>90%。进行了材料的吸附动力学研究,随着吸附时间的延长(10.0~60.0 min),吸附过程在30.0 min内完成,并且在1.0 h内吸附率保持稳定(92.0%)。实验选择室温吸附,30.0 min。
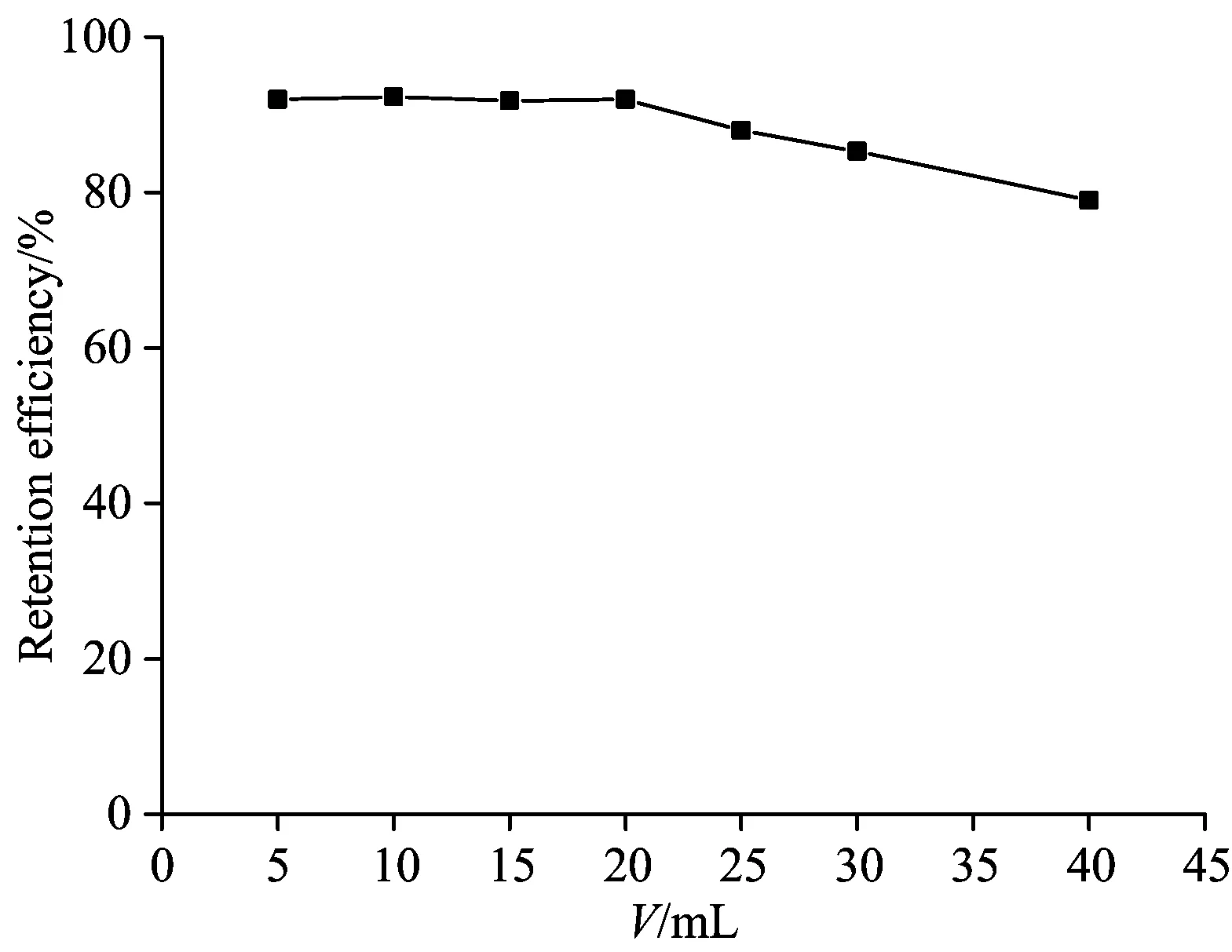
Fig.6 Effect of sample volume on retention efficiency (cc0=2.00 μg mL-1)
2.3 洗脱条件优化
2.3.1 洗脱液选择
实验研究了SDS(1%),CTAB(1%),醋酸,甲醇,无水乙醇不同的洗脱液的脱附效果(图7),其脱附率分别为24%,51%,68%,81%,90%,因此选择无水乙醇作为洗脱剂。
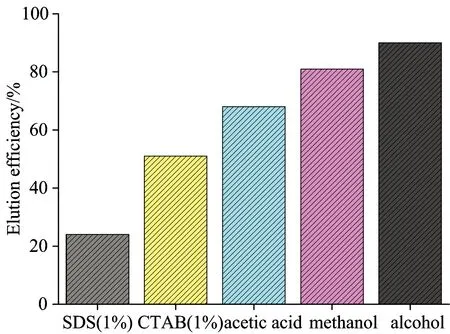
Fig.7 Selection of eluants
洗脱剂体积从2.0~10.0 mL递增,用量在4.0~10.0 mL时,脱附率保持在85%以上,4.0 mL时达到90%。本实验选择最佳洗脱液体积4.0 mL。预富集倍数7.5(吸附前样品体积/洗脱体积)。
2.3.2 洗脱时间影响
试验了不同时间材料对孔雀石绿的吸附情况,随着吸附时间的延长(10.0~60.0 min),洗脱过程在30.0 min内完成,并且在1.0 h内吸附率保持稳定(90.0%)。本实验选择时间30.0 min。
2.4 吸附容量
试验了材料对孔雀石绿的吸附容量(1.0 g CM-HP-β-CDCP-MNPs吸附孔雀石绿的最大量,图8)。结果表明: 当体系中孔雀石绿的浓度达到50.00 μg·mL-1时,吸附达到饱和,CM-HP-β-CDCP-MNPs对孔雀石绿吸附容量是10.6 mg·g-1。
2.5 CM-HP-β-CDCP-MNPs重复利用
材料经5次洗脱后(图9),对孔雀石绿的吸附率保持在85.0%以上,表明该材料有良好的重复利用性能。
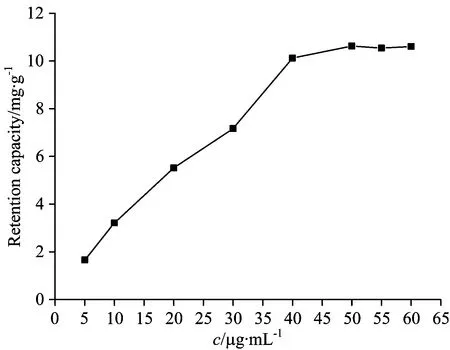
Fig.8 Retention capacity
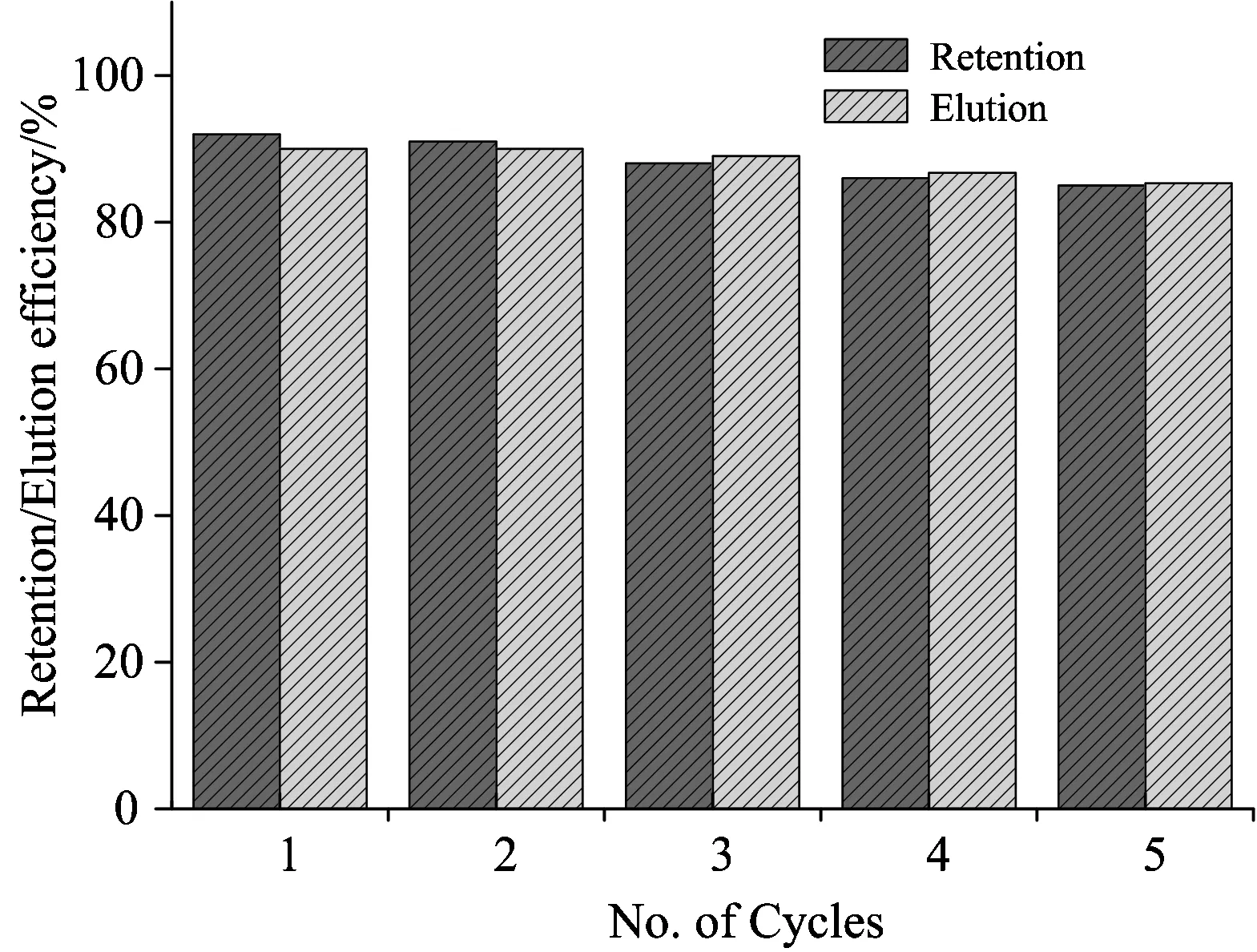
Fig.9 Adsorption-desorpption cycles of CM-HP-β-CDCP-MNPs
2.6 干扰试验
研究了干扰物质对孔雀石绿吸附作用的影响,允许误差范围≤±5%,结果如表1。结果表明,干扰物质对样品中孔雀石绿测定干扰较小, 因此,不影响水样中孔雀石绿测定。
2.7 分析性能
根据试验方法,改变体系中的孔雀石绿浓度绘制工作曲线, 其线性范围是0.08~8.00 μg·mL-1,线性方程是A=0.47c+0.022(μg·mL-1),线性相关系数0.998 8,相对标准偏差0.95%(n=5,c=2.00 μg·mL-1),对11份空白试样进行测定,测得检出限(DL)5.6 ng·mL-1,富集倍数为7.5。

Table 1 Tolerance of interference ions
2.8 样品测定
按试验方法测定养鱼水样(扬州石塔寺菜场),瘦西湖水样, 均未检测出孔雀石绿。在最佳实验条件下,对样品进行加标回收实验, 结果如表2。
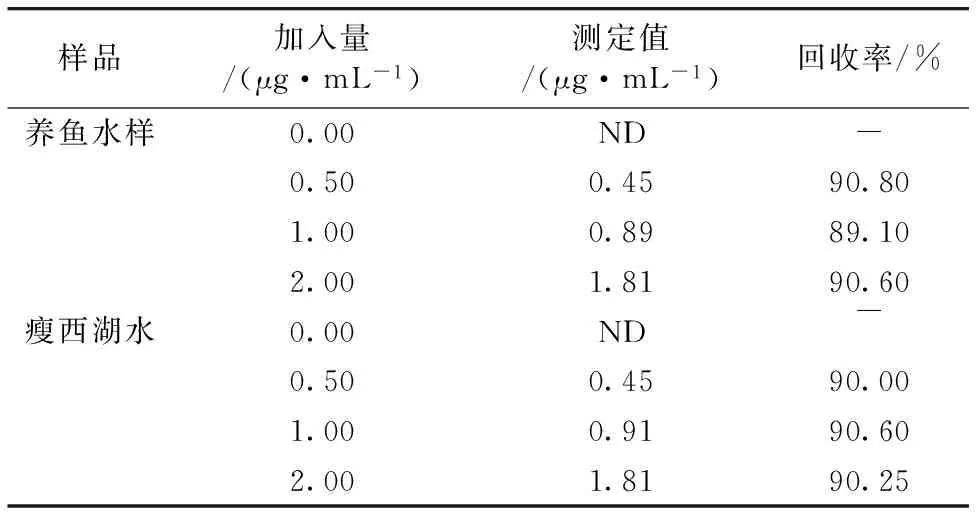
Table 2 Determination results of the samples(n=3)
2.9 文献比较
将本方法与其他文献测定孔雀石绿方法比较[17-19]。从表3看出本方法的线性范围宽,灵敏度高,操作简单。
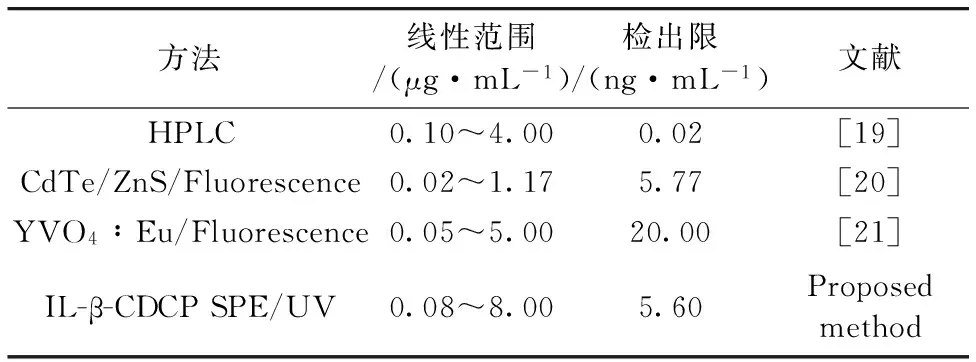
Table 3 Comparison with other previously reported methods
2.10 CM-HP-β-CDCP-MNPs与孔雀石绿包合机理
红外光谱是证明包含物形成的有力工具,峰位置或强度的变化能证明主体与客体之间的化学作用[22]。通过FTIR对孔雀石绿与CM-HP-β-CDCP-MNPs的包合机理进行了探讨。
图10中(a)—(c)分别为CM-HP-β-CDCP-MNPs,孔雀石绿-CM-HP-β-CDCP-MNPs包含物和孔雀石绿的FTIR谱图。如图10所示: 曲线a与曲线b相比,曲线a在1 375和1 295 cm-1处的吸收峰明显增强,1295~1 375 cm-1为 孔雀石绿(曲线c)中—CH3的弯曲振动,说明孔雀石绿与CM-HP-β-CDCP-MNPs存在包合作用。
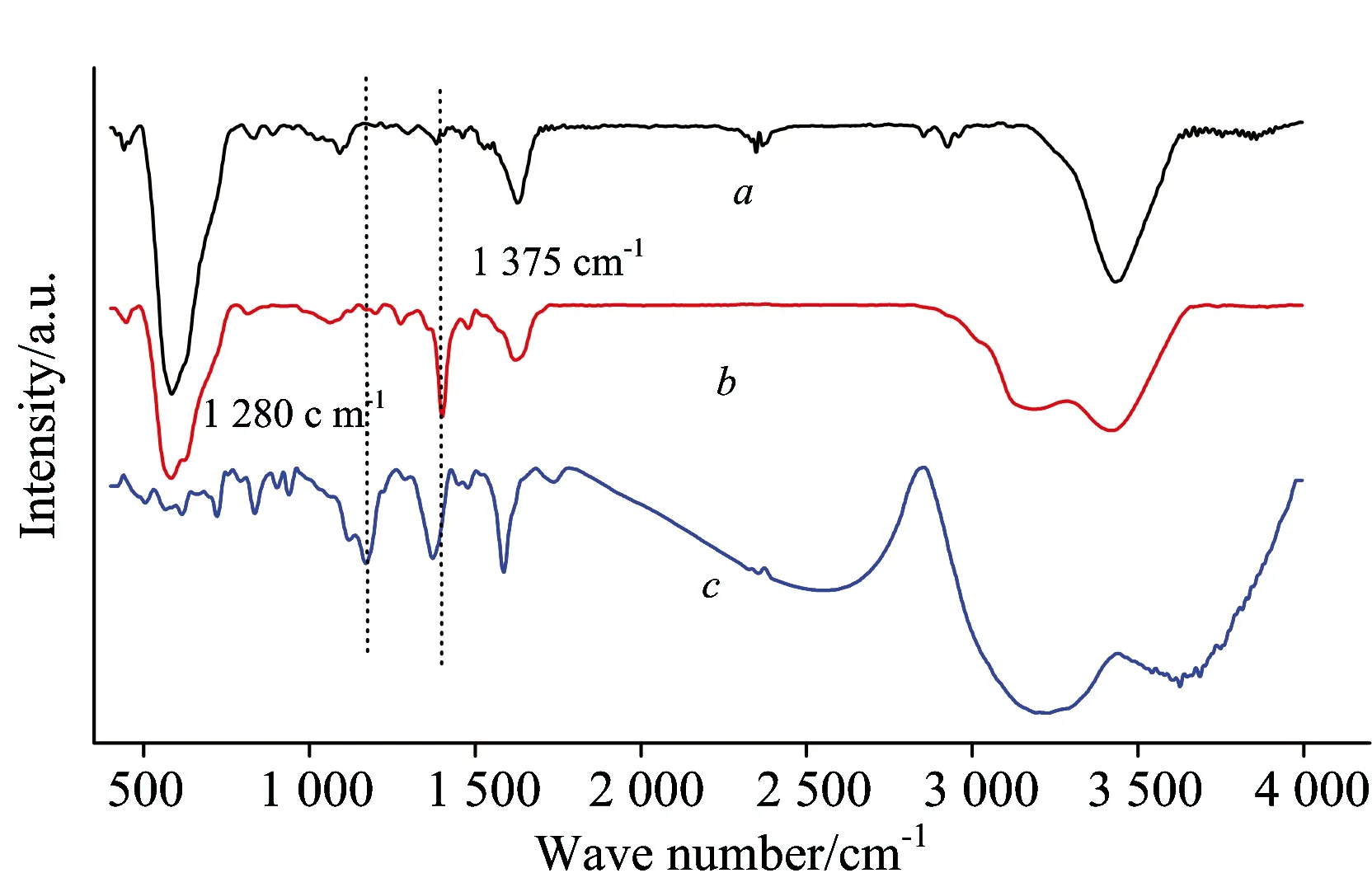
Fig.10 FTIR spectra of CM-HP-β-CDCP-MNPsa, malachite green-CM-HP-β-CDCP-MNPsb, malachite greenc
3 结 论
研究了Fe3O4/羟丙基-β-环糊精树脂纳米材料的合成方法,用固相萃取紫外可见光谱联用分析了其对孔雀石绿的吸附行为,建立了分离分析孔雀石绿的新方法。该方法简单、安全、便宜、稳定性好,样品测定结果令人满意。
[1] Bahram M, Keshvari F, Moghaddam P N. Talanta, 2011, 85(2): 891.
[2] Chen L Y, Lu Y B, Li S Y, et al. Food Chem., 2013, 141(2): 1383.
[3] Afkhami A, Moosavi R, Madrakian T. Talanta, 2010, 82(2): 785.
[4] HUANG Bao-mei, YAO Cheng-wei, CHEN Hong, et al(黄宝美, 姚程炜, 陈 红,等) Chinese Journal of Applied Chemistry(应用化学), 2007, 24(3): 327.
[5] MA Ming-ming, SONG Jun-feng, FAN Zeng-lu, et al(马明明, 宋俊峰, 樊增禄, 等). Chinese Journal of Analytical Chemistry(分析化学) 2008, 36(10): 1431.
[6] Hennion M C. J. Chromatogr. A, 1999, 856(1): 3.
[7] Vukcevic M, Kalijadis A, Radisic M, et al. Chem. Eng. J., 2012, 211: 224.
[8] Panavaite D, Padarauskas A, Vickackaite V. Anal. Chim. Acta, 2006, 571(1): 45.
[9] Kagaya S, Maeba E, Inoue Y, et al. Talanta, 2009, 79(2): 146.
[10] Zhu X, Wu M, Gu Y. Talanta, 2009, 78(2): 565.
[11] Abdolmohammad-Zadeh H, Rezvani Z, Sadeghi G H, et al. Anal. Chim. Acta, 2011, 685(2): 212.
[12] Jiang W, Cai Q, Xu W, et al. Environ. Sci. Technol.,2014, 48(14), 8078.
[13] Jiang W, Pelaez M, Dionysios D. et al. Chem. Eng. J. 2013, 222(15), 527.
[14] Liang M M, Fan K L, Pan Y. Anal. Chem., 2012, 85(1): 308.
[15] LI Yuan, XIAO Le-hui, ZHOU Nai-yuan, et al(李 媛, 肖乐辉, 周乃元,等). Journal of Analytical Chemistry(分析化学), 2013, 41(1): 63.
[16] MA Zhan-ying, HE Yang-qing, XU Wei-xia, et al(马占营, 何仰清, 徐维霞, 等). Chinese Journal of Molecular Catalysis(分子催化), 2012, 3(24): 228.
[17] Jiang W, Jeffrey A Joens, Dionysios D Dionysiou, et al. J. Photochem. Photobiol. A: Chem., 2013, 262: 7.
[18] Zhang N, Peng H Y, Hu B. Talanta, 2012, 94: 278.
[19] GUI Ying-ai, MA Lin, WANG Dan, et al(桂英爱, 马 琳, 王 丹,等). Chinese Journal of Environment and Health(环境与健康杂志). 2007, 24(8): 633.
[20] CHEN Xiao-lan, FAN Ping, WU You-li, et al(陈效兰, 范 萍, 吴有丽,等). Chinese Journal of Instrumental Analysis(分析测试学报), 2013, 32(7): 840.
[21] ZHAI Han, YU Yong-li, CHENG Li-yan, et al(翟 晗, 于永丽, 成利艳, 等). Chinese Journal of Acta Chimica Sinica(化学学报) 2011, 69(10): 1205.
[22] Yang Z J, Chai K G, Ji H B. Separation and Purification Technology, 2011, 80: 209.
*Corresponding author
Fe3O4-β-Cyclodextrin Polymer Nano Composites Solid-Phase Extraction-UV-Vis Spectrophotometry for Separation Analysis Malachite Green
FENG Gang1, 2, PING Wen-hui1,ZHU Xia-shi1*
1. College of Chemistry & Chemical Engineering, Yangzhou University, Yangzhou 225002, China 2. Yangzhou Commerice Higher Vocational School, Yangzhou 225002, China
In this paper, carboxymethyl-hydroxypropyl-β-cyclodextrin polymer modified magnetic particles Fe3O4(CM-HP-β-CDCP-MNPs) were prepared and applied to magnetic solid phase extraction of malachite green combined with UV-Visible spectrometry detection. The synthesized magnetic particles were characterized by element analysis, Fourier transform infrared spectra and transmission electron microscopy. Several variables affecting the extraction and desorption of malachite green such as pH, the amount of adsorbent, the type and volume of eluent, extraction and desorption time, and temperature were investigated. Under the optimum conditions, malachite green could be adsorbed by CM-HP-β-CDCP-MNPs(RE%=92), and elution by C2H5OH(EE%=90). the preconcentration factor of the proposed method was approximately 7.5, the CM-HP-β-CDCP-MNPs could be used repeatedly for 5 times and offered better recovery. The linear range and detection limit (DL) were found to be 0.08~8.00 μg·mL-1and 5.6 ng·mL-1respectively. This technique had been successfully applied to the determination of malachite green in real samples. The inclusion interaction of CM-HP-β-CDCP-MNPs with malachite green was studied through FTIR.
Malachite green Fe3O4-β-cyclodextrin-cross-linked polymer; Solid phase extraction; Spectrophotometry
Jul. 23, 2014; accepted Nov. 10, 2014)
2014-07-23,
2014-11-10
国家自然科学基金项目(21375117)资助
冯 刚,1964年生,江苏省扬州商务高等职业学院副教授 e-mail: fg7180055@126.com *通迅联系人 e-mail: xszhu@yzu.edu.cn; zhuxiashi@sina.com
O657.3
A
10.3964/j.issn.1000-0593(2016)02-0436-06
