基于共聚焦显微拉曼光谱的毛竹细胞结构和成分研究
2016-06-15李晓丽周斌雄姚炎明
李晓丽,周斌雄,张 怡,姚炎明,何 勇*
1. 浙江大学生物系统工程与食品科学学院,浙江 杭州 310058 2. 浙江大学农学院茶学系,浙江 杭州 310058 3. 浙江大学港口、海岸及近海工程研究所,浙江 杭州 310058
基于共聚焦显微拉曼光谱的毛竹细胞结构和成分研究
李晓丽1,周斌雄1,张 怡2,姚炎明3,何 勇1*
1. 浙江大学生物系统工程与食品科学学院,浙江 杭州 310058 2. 浙江大学农学院茶学系,浙江 杭州 310058 3. 浙江大学港口、海岸及近海工程研究所,浙江 杭州 310058
采用共聚焦显微拉曼光谱对毛竹薄壁细胞、薄壁纤维过渡细胞和纤维细胞进行研究。通过构建偏最小二乘(PLS)定量区分模型来对这三种细胞中的差异进行分析,结果表明,该区分模型的建模和交互验证决定系数(R2)分别为0.810和0.800,均方根误差(RMSE)分别为0.323和0.332。根据这一模型的回归系数,发现三种细胞的区别主要体现在1 095,1 319和1 636 cm-1三个波数,这三个波数分别为纤维素、半纤维素和木质素的指纹特征峰。以这三个波数为自变量建立多元线性回归(MLR)模型,该回归模型的建模和交互验证决定系数(R2)分别为0.644和0.643,均方根误差(RMSE)分别为0.442和0.443,表明三种细胞在这三个波数处存在明显的差异。对小波变换基线消除后的拉曼光谱信号进行化学成像分析,结果显示,纤维素微纤维与纤维轴成一个很大的角度,这一结构有利于提高细胞的弹性模量和硬度。半纤维素和纤维素微纤维通过氢键相连,并在范德华力的作用下紧密地结合在一起,因此在拉曼化学成像中可以看到半纤维素和纤维素有相似的分布规律。三种细胞的细胞角和胞间层都高度的木质化,从细胞壁外层到内层木质化程度逐渐降低,表明细胞壁的木质化从细胞角和胞间层开始,且木质化程度并不完全。
毛竹; 纤维细胞; 薄壁细胞; 共聚焦显微拉曼光谱; 小波变换
引 言
中国是世界上竹类资源最多,分布最广的国家之一。随着木材资源的匮乏,竹材成为造纸、纺织和板材的重要原材料。为了更好、更有效地利用竹材,需要对毛竹的结构和成分进行更深入的研究[1]。
竹子是单子叶植物,能够快速地伸长,却缺少维管束形成层,不存在二次增厚过程,这造成了竹秆的细长和中空[2]。和木材相比,竹材的强度更高、韧性更好、硬度更大,这些特性主要是由分散在传输单元周围纤维帽中的纤维决定的。
Zou[3]对毛竹纤维进行研究,发现纤维由直径在21~198 nm之间的鹅卵石般的纤维素颗粒构成,这使毛竹变得柔软、不易碎。Wang[4]运用拉曼成像技术和纳米压痕技术对毛竹维管束区域进行了研究,发现毛竹纤维的纤维素纤维丝几乎都是轴向的,这增大了纤维弹性模量的临界阈值,有助于提高细长毛竹茎部的抗弯性。然而,还没有学者通过毛竹内部细胞的差异,来对毛竹纤维的成分和结构进行研究。
共聚焦显微拉曼光谱技术是拉曼光谱分析技术与显微分析技术的有机结合,能对细胞结构进行原位、无损的检测,避免了传统化学检测方法对组织结构的破坏[5]。基于拉曼光谱的化学成像技术,能够在原始状态下,直接显示细胞中的化学信息[6]。目前,这一方法被广泛地运用于植物细胞的成分和结构的研究中[7]。
利用拉曼光谱技术结合偏最小二乘法,对毛竹薄壁细胞(PAC)、薄壁纤维过渡细胞(TC)和纤维细胞(FC)进行定量区分,来探究这三种组织在成分和结构上的差异; 并通过回归系数分析,探索造成这三种细胞差异的主要成分。然后运用小波变换方法去除拉曼光谱中荧光背景的干扰,并基于小波重构信号进行化学成像分析。
1 实验部分
1.1 植物材料和标准品
毛竹试材采自浙江省丽水市景宁畲族自治县毛垟村,地处东经119°23′,北纬27°43′,海拔325 m; 属亚热带季风气候,温暖湿润、雨量充沛、四季分明。取1年生毛竹1株,截取基部起第二个竹节,风干,自竹节顶部向下1/3处向下取1 cm,并将其去除竹青和竹黄,将竹中部分用旋转切片机沿横向切成10 μm的小薄片,置于载玻片上,滴上一滴清水,再盖上盖玻片,供拉曼光谱采集使用。
阿魏酸(Ferulic acid),别名 反式-4-羟基-3-甲氧基肉桂酸,购于sigma公司,产品编号128708。对香豆酸(p-Coumaric acid),别名反式对羟基肉桂酸,购于sigma公司,产品编号C9008。
1.2 拉曼光谱采集
采用雷尼绍共聚焦显微拉曼光谱仪(in Via-Reflex 532/ XYZ)进行拉曼光谱采集。将制好的毛竹切片固定在显微拉曼光谱仪物镜下方载物台上,激光束通过20X的物镜聚焦到样本的表面。运用“WIRE”软件进行参数设置,设置曝光时间2 s,激光强度是50 mV,累计次数2次,拉曼光谱采集范围为229.6~2 803.6 cm-1,整个实验过程都在恒温(约25 ℃)条件下进行。
运用“WiRE”软件进行图像采集区域设定。用矩形来选择扫描区域,设定扫描步长为1.5 μm,以获得高分辨率的拉曼光谱成像。图1(a)是5X物镜下的毛竹维管束组织,包括了用于光谱采集的三种细胞区域,其中黑色方框内为PAC,红色方框内为TC,蓝色方框内为FC。图1(b)是20X物镜下的PAC的扫描区域,包含51×24矩形区域的1 224个点; 图1(c)是20X物镜下的TC的扫描区域,包含51×20矩形区域的1020个点; 图1(d)是20X物镜下的是FC的扫描区域,包含25×19矩形区域的475个点。

Fig.1 (a) Vasculer bundle of moso bamboo including parenchyma cell (PAC), transition tissue between parenchyma cell and fiber cell (TC) and fibre cell (FC); (b) Enlarged view of PAC; (c) Enlarged view of TC; (d) Enlarged view of FC
1.3 数据处理
利用Unscrambler化学计量学软件包对三种细胞共2 719个样本的拉曼光谱曲线进行定量区分,PAC,TC和FC的类别属性分别设定为1,2和3,用偏最小二乘回归模型(PLS)和交互验证方式建立定量区分模型[8]。筛出特征波数为自变量,以三种细胞的类别属性为因变量,建立多元线性回归模型(MLR)[9]。PLS和MLR的模型性能主要通过决定系数和均方根误差来评价,决定系数越高,均方根误差越低,表明模型的性能越好。
2 结果与讨论
2.1 背景信号的消除和拉曼光谱的分析
本实验中背景信号主要是由载玻片和盖玻片引起的,图2中背景信号即是不包括样本的载玻片和盖玻片的拉曼响应特性,样本信号是以薄壁细胞为例的1 224个样本的平均拉曼光谱谱线。从图2(a)背景信号和样本信号的对比中可以看到,样本信号主要在波数800~1 750 cm-1范围有明显的峰值,将其放大后如图2(b)所示。从图2(b)中可以看到,样本信号和背景信号在波数1 456~1 477和1 513~1 544 cm-1范围存在波峰重合,这些波峰会影响定量区分模型的区分结果,需要通过去除含有相同峰值的区域来消除背景信号的干扰[4],因此将这些波段剔除后再进行定量分析。
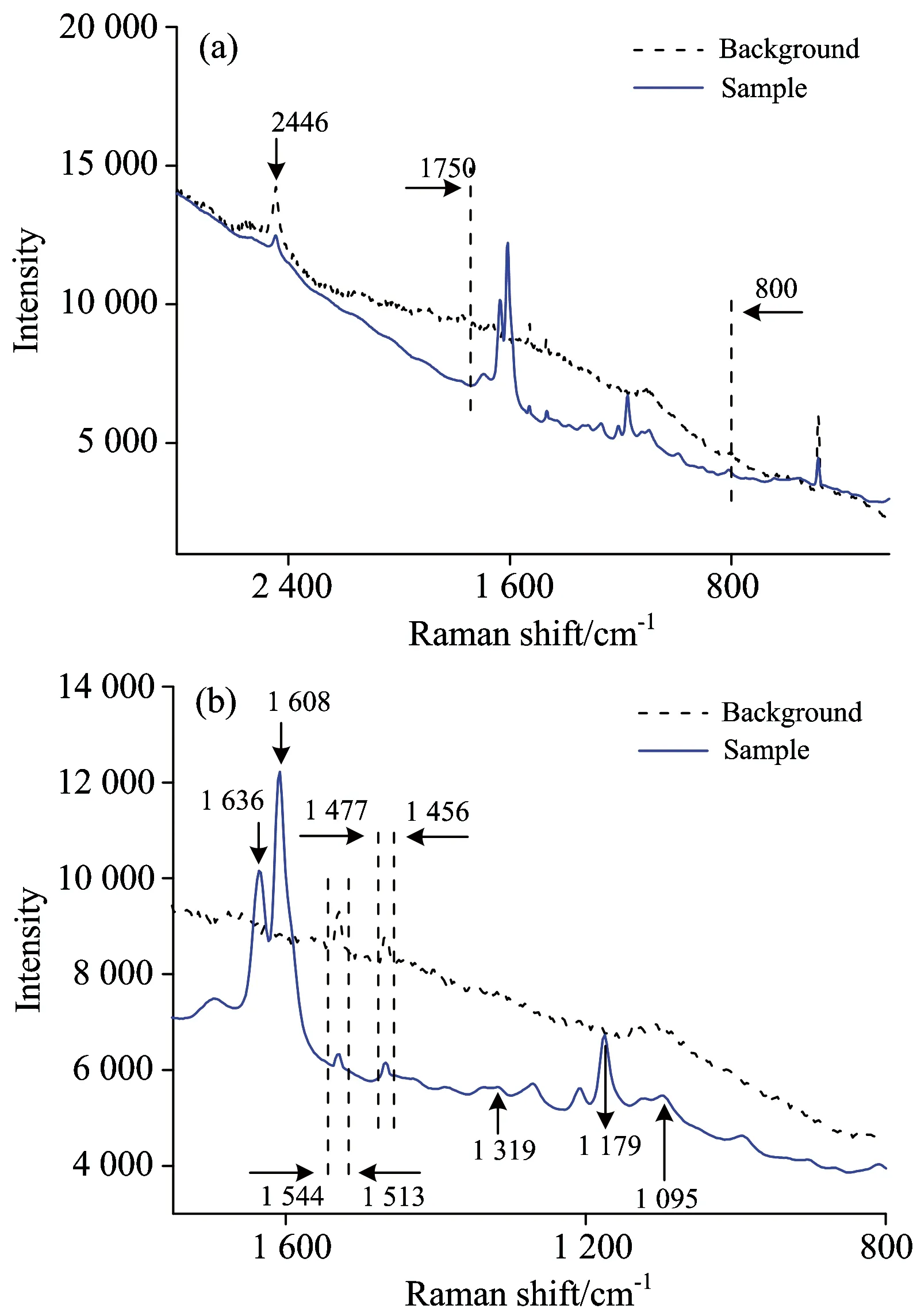
Fig.2 Raman spectra of sample and background in full-range (a) and enlarged (b) graph
从图2(b)中可以发现,样本在波数1 179,1 608和1 636 cm-1处有非常明显的拉曼峰。Heitner[10]指出毛竹木质素的拉曼峰值主要位于波数1 604和1 630 cm-1处,主要是由自由的和酯化了的酚醛树脂引起的。实验中分别对阿魏酸和对香豆酸的标准品进行拉曼光谱采集,将采集到的光谱以最大值为参照进行归一化处理,处理后的结果如图3所示。从图3中可以看到,PAC和阿魏酸以及对香豆酸在1 179,1 608和1 636 cm-1三个波数附近都有明显的峰值,这与Cyril的结果一致,表明样本中1 179,1 608和1 636 cm-1三个波数属于包含酚酸的木质素弯曲振动。同时,样本在波数1 095和1 319 cm-1处也有明显的拉曼峰。Edwards[11]研究发现1 095 cm-1是属于纤维素中C—O—C的弯曲振动。Himmelsbach[12]对买自Megazyme的木葡聚糖和阿拉伯聚糖标准品进行了拉曼光谱扫描,发现木葡聚糖分子和阿拉伯聚糖分子在1 319 cm-1处有明显的拉曼峰,这一波数属于半纤维素中OH/CH和CH/CH2的弯曲振动。因此,样本中1 095和1 319 cm-1两个波数分别属于纤维素和半纤维素的弯曲振动。
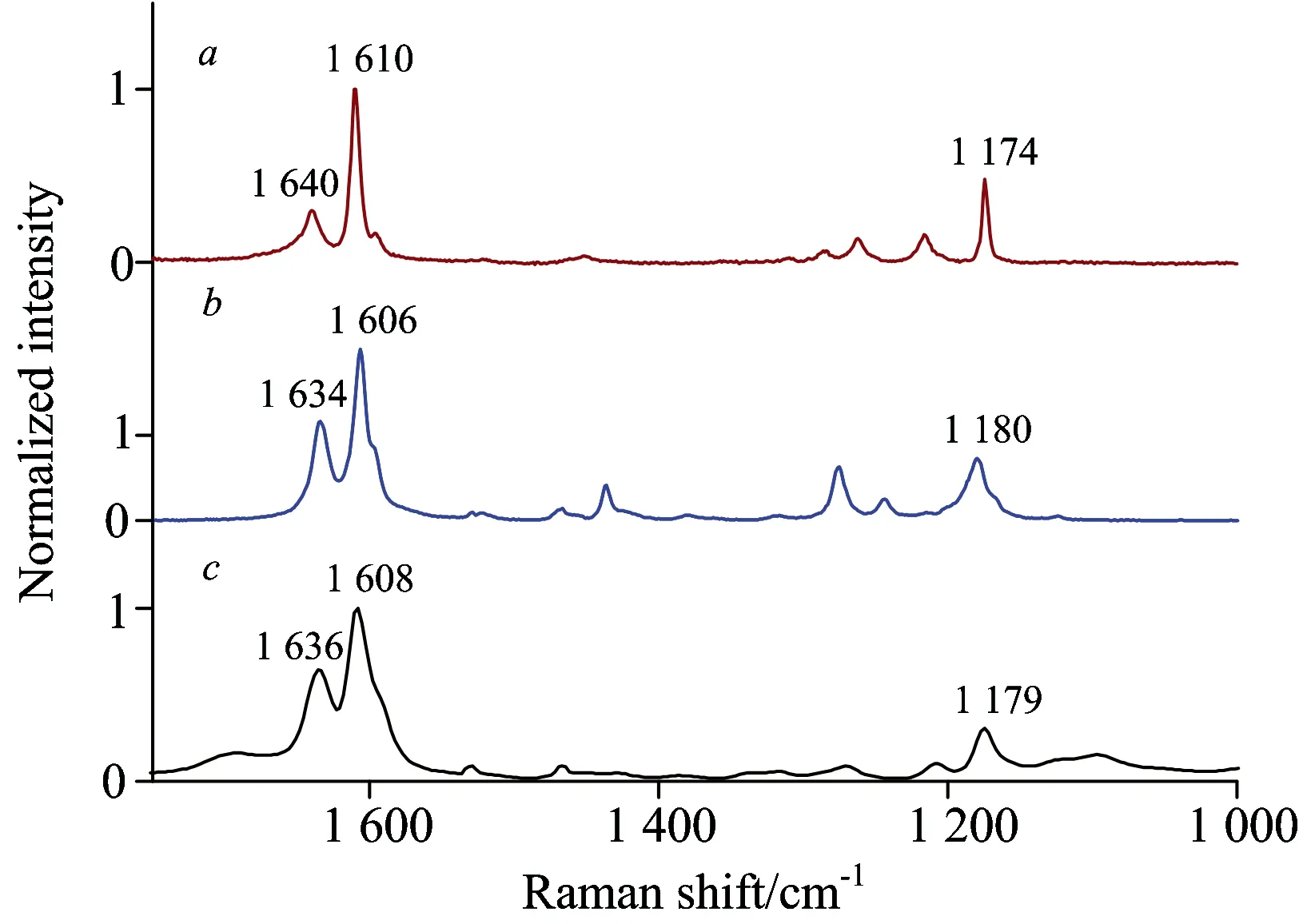
Fig.3 Normalized raman spectra: (a) ferulic acid, (b)p-Coumaric acid, (c) parenchyma cell (PAC)
2.2 偏最小二乘定量区分和多元线性回归模型
为了获取PAC,TC和FC的差异,对三种细胞进行定量区分,对三种细胞的样本在波数800~1 455,1 478~1 512和1 545~1 750 cm-1范围内的拉曼光谱进行偏最小二乘回归分析。分析结果表明,三种细胞区分模型的建模和交互验证决定系数(R2)分别为0.810和0.800,均方根误差(RMSE)分别为0.323和0.332,其中建模和交互验证的散点分布图如图4所示。
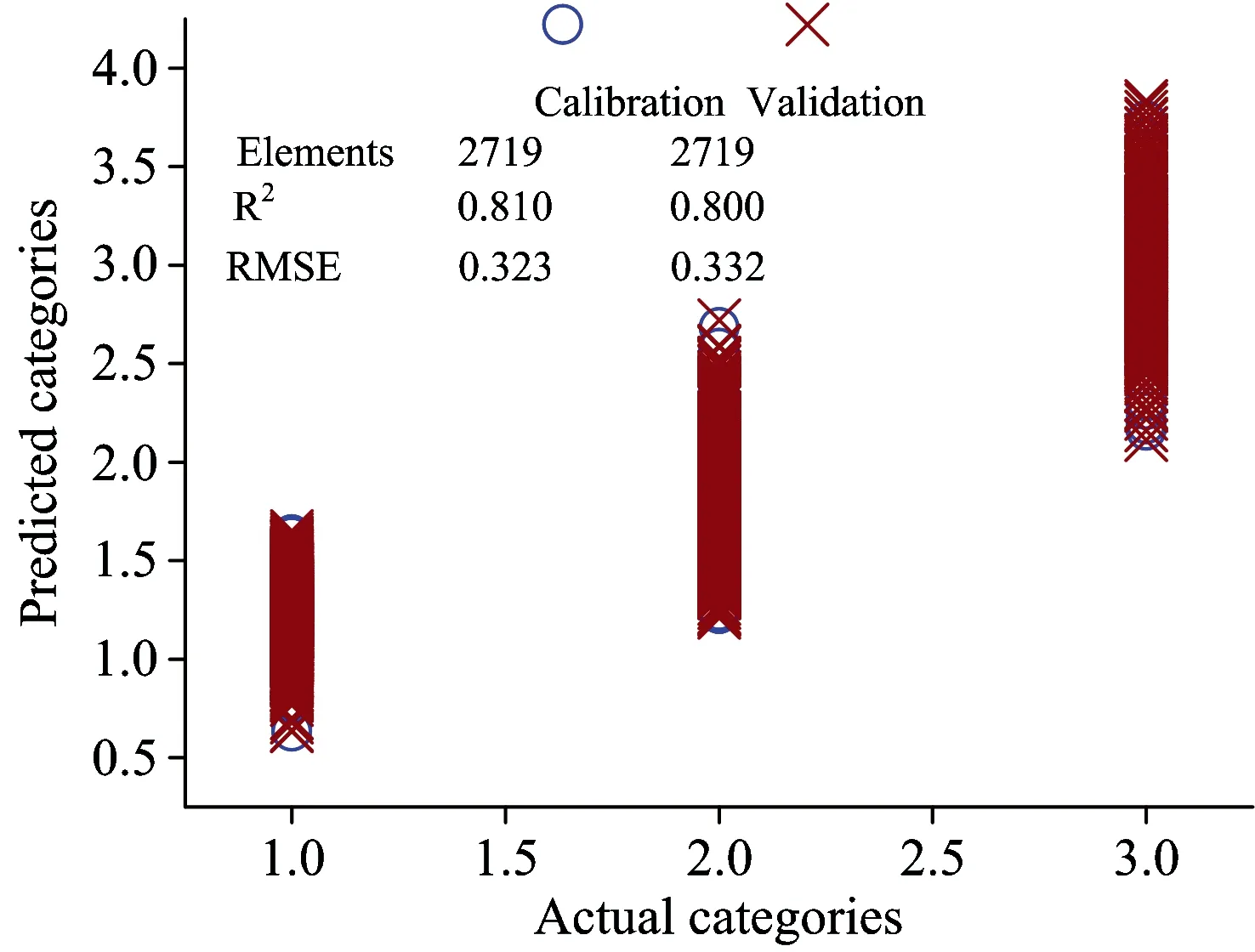
Fig.4 Calibration and validation results of the PLS
为了进一步分析对于区分起重要作用的波数,对该回归模型的回归系数进行分析,模型的回归系数越大,表明这一回归系数对应的拉曼峰值对于区分越重要[13-14]。因此,通过对回归系数的分析,可以得到对于区分PAC,TC和FC的重要拉曼峰值,同时由于拉曼具有指纹特征响应性,所以根据这些峰值可以得到影响这三种细胞差异的主要化学成分。图5显示了PLS模型的回归曲线,从中可以看到在波数1 095,1 319和1 636 cm-1处有很高的系数,表明三种细胞在这三处拉曼峰值有明显的差异。为了进一步评估这三个波数对于区分模型的作用,以波数1 095,1 319和1 636 cm-1为自变量建立MLR模型,其建模和交互验证的散点分布如图6所示。回归模型的建模和交互验证决定系数(R2)分别为0.644和0.643,均方根误差(RMSE)分别为0.442和0.443,表明这三种细胞在波数1 095,1 319和1 636 cm-1处存在明显的差异。
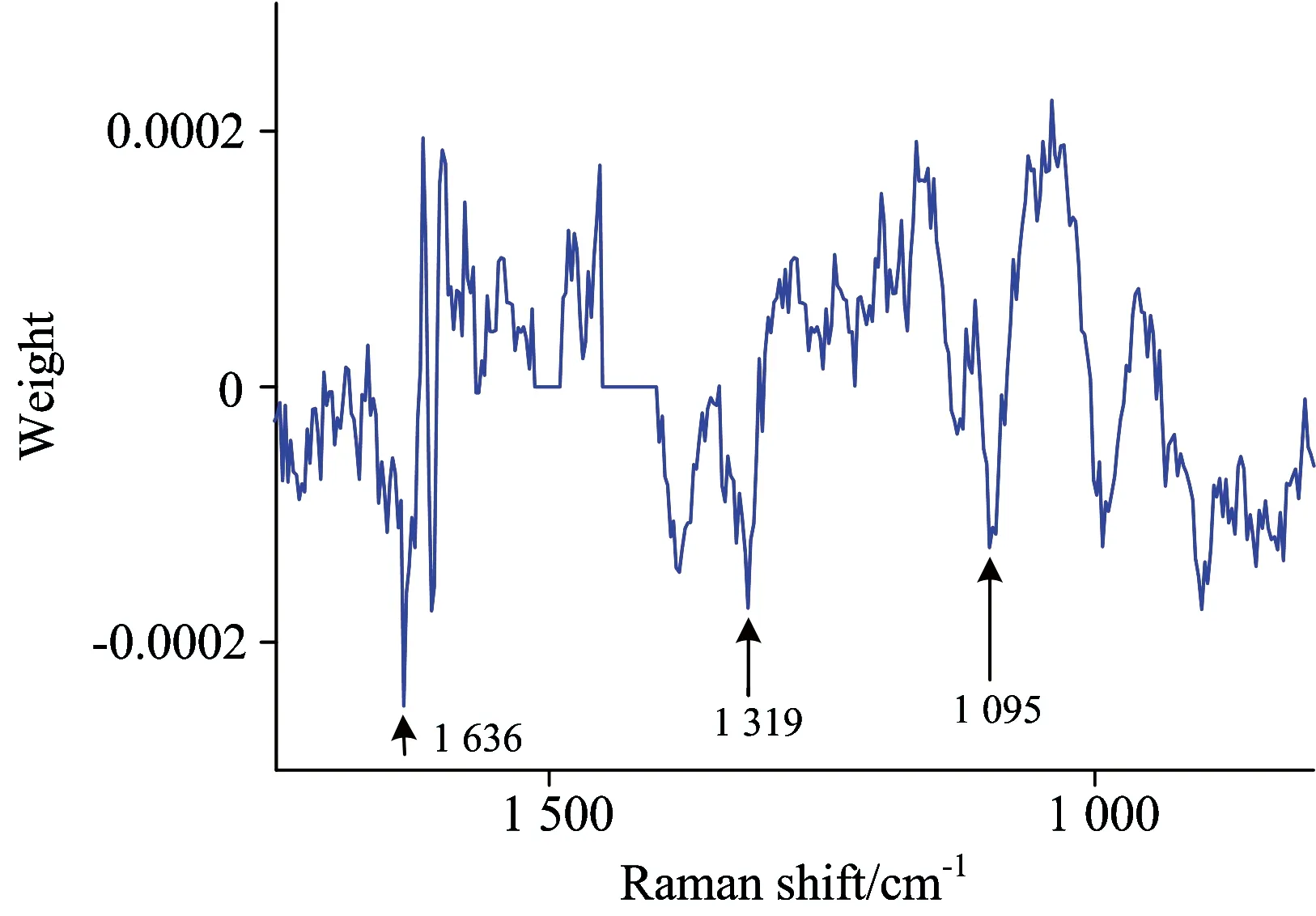
Fig.5 Regression coefficient of the PLS
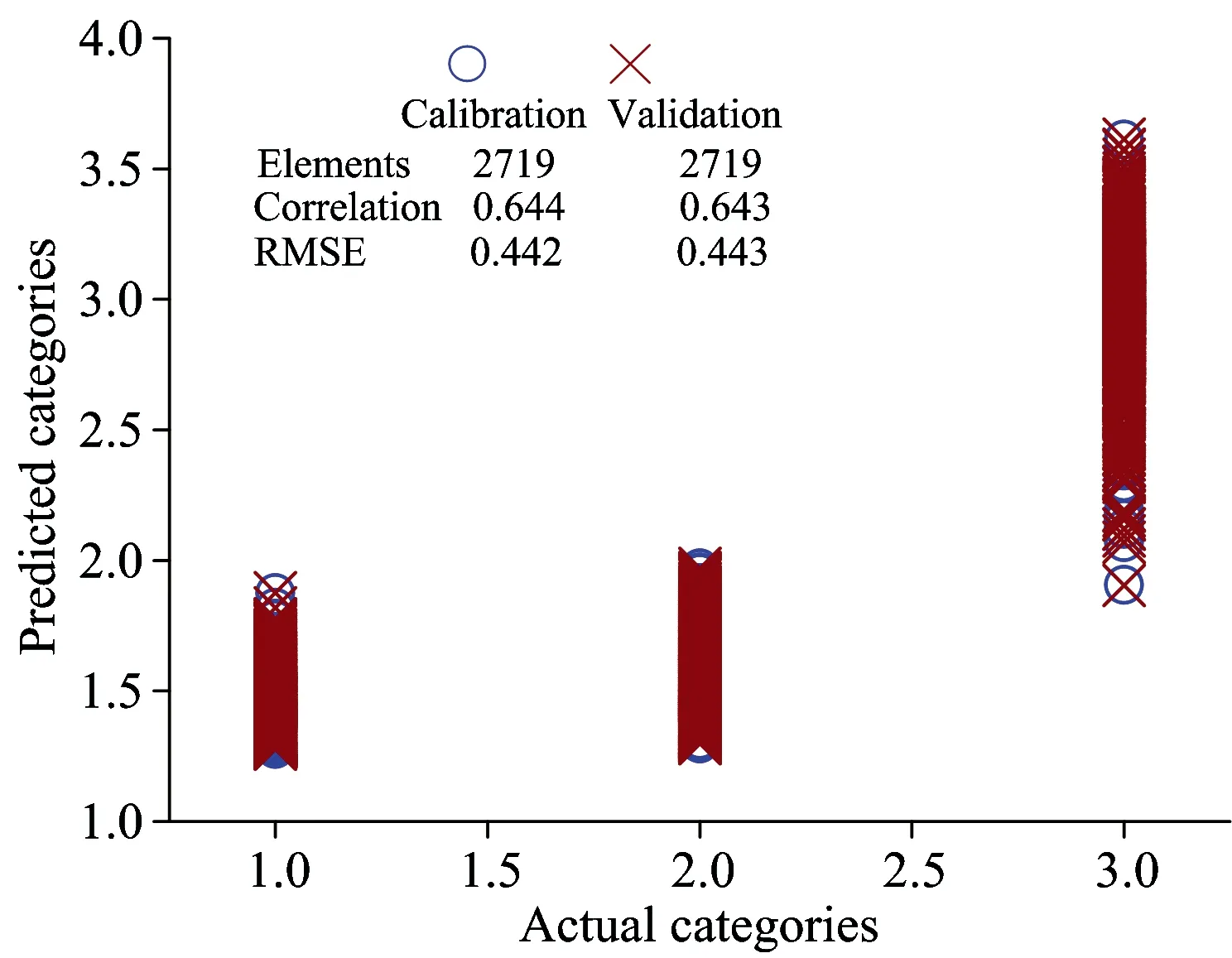
Fig.6 Calibration and validation results of the MLR
2.3 小波变换
拉曼光谱中存在明显的荧光和噪声干扰,而小波变换能够有效地去除这些干扰,目前已被用于拉曼光谱的处理。运用Matlab 小波分析工具箱,采用db1小波基函数分别对三种细胞共2 719个拉曼谱线进行离散小波变换(DWT)和离散小波系数重构(IDWT)。以PAC样本为例的小波分解和重构结果如图7所示。图7(a)显示小波处理前的光谱信号,从中可以看到明显的荧光信号。图7(b), (c), (d)分别表示一、二和三水平的高频信号,图7(e)表示三水平低频信号(a3)。通过图7(b), (c), (d), (e)的对比可以看到,d3在保留了PAC光谱中的重要峰值信息的同时排除了荧光信号的干扰。对d3进行小波系数重构得到D3,结果如图7(f)所示。
2.4 毛竹成分的拉曼光谱成像分析
通过PLS模型和MLR模型,已经得到了区分三种细胞的特征波数。为了分析这三个特征波数对应的化学成分在组织中的空间分布情况,对PAC,TC和FC分别在波数1 095,1 319和1 636 cm-1处进行积分成像。将三水平分解重构后(D3)的光谱数据用于拉曼化学成像,成像结果如图8所示。
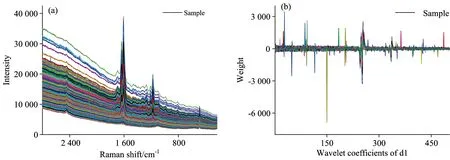
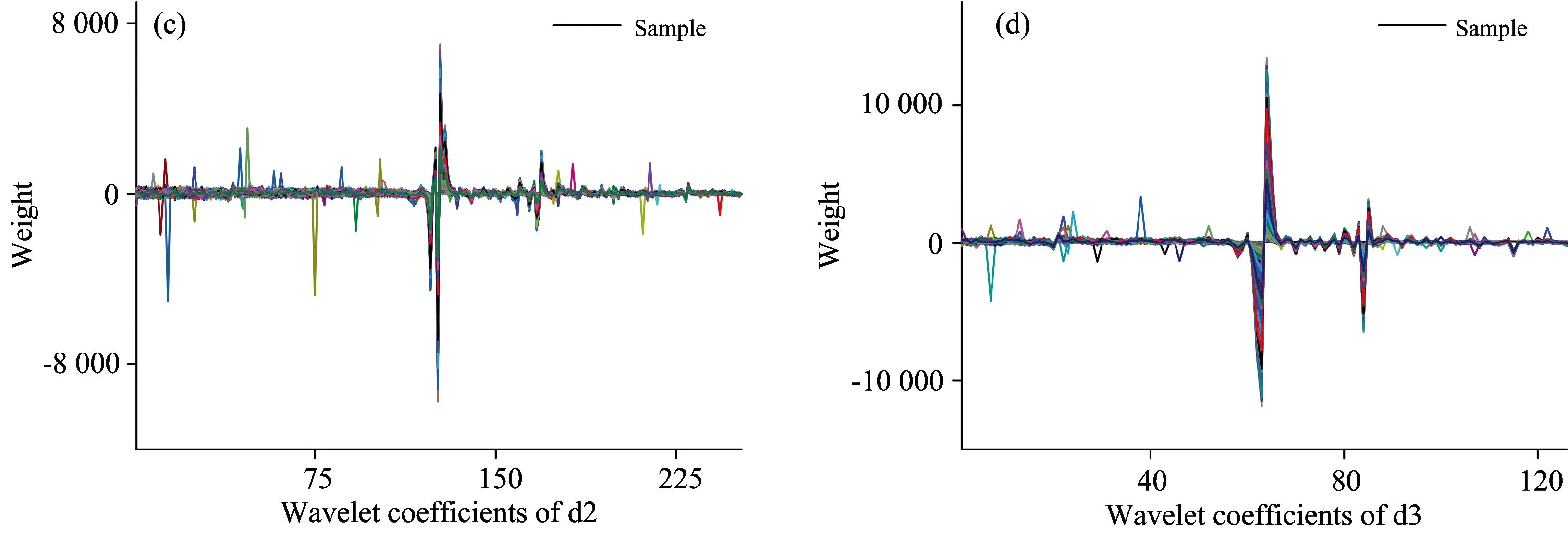
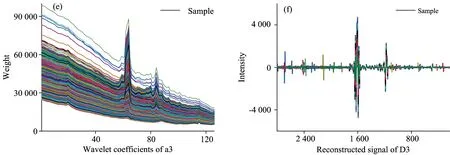
Fig.7 DWT and IDWT of parenchyma cell (PAC)
从图8中光学显微镜图和拉曼化学成像图的对比中可以看出,拉曼化学成像能够将模糊的显微图像[特别是图8(i)]清晰化,并能清晰地显示细胞中化学成分的分布。从图8(b),(f),(j)中细胞的胞腔内可以看到纤维素的存在,这主要是因为纤维素微纤维与纤维轴形成了一个很大的角度,这一结构极大地提高了细胞的弹性模量和硬度[4]。图8(c),(g),(k)显示半纤维素在细胞中的分布,这一分布与图8(b),(f),(j)中纤维素的分布相似,这主要是因为半纤维素和纤维素微纤维通过氢键相连,并在范德华力的作用下紧密地结合在一起。从图8(d),(h),(i)中可以看到木质素在细胞中的分布,其中细胞的细胞角(CC)和胞间层(CML)呈现高度的木质化,而且从细胞壁外层到内层木质化程度逐渐降低,这表明细胞壁的木质化从细胞角和胞间层开始,且木质化程度并不完全。
3 结 论
采用共聚焦显微拉曼光谱技术研究了毛竹PAC,TC和FC的差别,研究表明拉曼光谱能够对毛竹的细胞成分和结构进行无损检测,并良好地区分这三种细胞。毛竹三种细胞的差异主要体现在波数1 095,1 319和1 636 cm-1处的拉曼峰值,对应的物质为纤维素、半纤维素和木质素。以这三个拉曼峰值进行拉曼光谱成像,发现毛竹维素微纤维与纤维轴构成一个很大的角度,这极大地提高了细胞的弹性模量和硬度。本工作将PLS和MLR的统计学方法和拉曼化学成像技术结合起来,有效地分析出三种毛竹细胞在化学成分和结构上的差异。
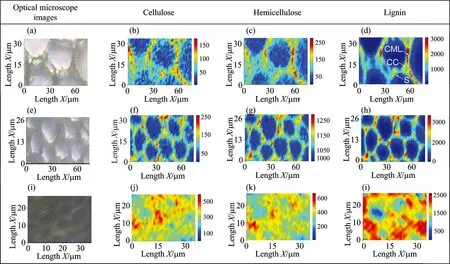
Fig.8 Optical microscope images of PAC (a), TNC (e) and TKC (i); Raman chemical images of cells: (b), (f) and (j), intensity of pectin band of 1 095 cm-1; (c), (g) and (k), intensity of the Hemicellulose band of 1 319 cm-1; (d), (h) and (l), intensity of the Lignin band of 1 636 cm-1
[1] Chen H, Cheng H, Wang G, et al. Journal of Wood Science, 2015, 61(6): 552.
[2] Wang X, Keplinger T, Gierlinger N, et al. Annals of Botany, 2014, 114(8): 1627.
[3] Zou L, Jin H, Lu W Y, et al. Materials Science and Engineering: C, 2009, 29(4): 1375.
[4] Wang X, Ren H, Zhang B, et al. Journal of the Royal Society Interface, 2011, 9(70): 988.
[5] Bellaloui N, Mengistu A, Zobiole L H S, et al. Toxin Reviews, 2012, 31(1-2): 16.
[6] Griffiths P R. Infrared and Raman Spectroscopic Imaging, (Eds: Salzer R, Siesler H) Wilcy-MCH, Weinheim, Germany, 2009.
[7] Gierlinger N, Keplinger T, Harrington M. Nature Protocols, 2012, 7(9): 1694.
[8] Bao Y, Liu F, Kong W, et al. Food and Bioprocess Technology, 2014, 7(1): 54.
[9] Wu D, Chen J, Lu B, et al. Food Chemistry, 2012, 135(4): 2147.
[10] Heitner C, Schmidt J, Dimmel D. Industrial Crops and Products, 2011, 3: 1399.
[11] Edwards H G M, Farwell D W, Webster D. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 1997, 53(13): 2383.
[12] Himmelsbach D S, Akin D E. Journal of Agricultural and Food Chemistry, 1998, 46(3): 991.
[13] Haaland D M, Thomas E V. Analytical Chemistry, 1988, 60(11): 1193.
[14] Wu D, Nie P, He Y, et al. Food and Bioprocess Technology, 2012, 5(4): 1402.
*Corresponding author
Revealing the Cell Structure and Formation of Bamboo with Confocal Raman Microscopy
LI Xiao-li1, ZHOU Bin-xiong1, ZHANG Yi2, YAO Yan-ming3, HE Yong1*
1. College of Biosystems Engineering and Food Science,Zhejiang University,Hangzhou 310058,China 2. Department of Tea Science, Zhejiang University, Hangzhou 310058, China 3. Institute of Harbor Coastal and Nearshore Engineering,Zhejiang University,Hangzhou 310058,China
Parenchyma cell (PAC), transition tissue between parenchyma cell and fiber cell (TC) and fibre cell (FC) of bamboo were studied by confocal Raman microscopy in this paper. Partial least squares regression was applied to establish a quantitative differentiation model for the three types of cells. The result showed that the determination coefficients (R2) of calibration and validation were respectively 0.810 and 0.800, and the root mean square error (RMSE) were respectively 0.323 and 0.332. What’s more, three raman bands of 1 095, 1 319 and 1 636 cm-1, verified to the characteristic peaks of pectin, hemicellulose and lignin, were found to be the important bands for the differentiation. Subsequently, these three raman bands were used to establish a multiple linear regression (MLR) model, and the determination coefficients(R2) of calibration and validation of the model were respectively 0.644 and 0.643, and the root mean square error (RMSE) were respectively 0.442 and 0.443. This result showed that there existed obvious difference among the three types of cells in these three raman bands. Finally, the raman spectral signal processed by wavelet transform to eliminate baseline were used to chemical imaging analysis. These results showed a rather large microfibril angle between cellulose fibrils and fibre axis, which contributed to higher modulus and hardness of cells. Hemicellulose and cellulose have similar distribution in the raman chemical image, due to the connection of hemicellulose and cellulose microfiber through hydrogen bond and the closely combination under the action of van der Waals force. The cell corners (CC) and compound middle lamella (CML) were heavily lignified, and a gradual decrease of lignification from the outer layer to the inner layer of the three cells indicate that lignification was first occurred at the CC and CML, and the lignification was not fully completed.
Bamboo; Fibre cell; Parenchyma cell; Confocal Raman microscopy; Wavelet Transform
Nov. 19, 2014; accepted Mar. 24, 2015)
2014-11-19,
2015-03-24
2014年度浙江省公益性技术应用研究计划项目(2014C32091),国家自然科学基金项目(61201073,31471417)资助
李晓丽,女,1982年生, 浙江大学生物系统工程与食品科学学院副教授 e-mail: xiaolili@zju.edu.cn *通讯联系人 e-mail: yhe@zju.edu.cn
O657.3
A
10.3964/j.issn.1000-0593(2016)02-0413-06
