烟草烟雾通过TGF-β1/Smad2通路诱导RLE-6TN发生上皮间质转化①
2016-06-15巫凤苹余秀英陈亚娟
巫凤苹 陈 虹 余秀英 廖 科 张 慧 张 露 陈亚娟
(重庆医科大学附属第一医院呼吸科,重庆400016)
·基础免疫学·
烟草烟雾通过TGF-β1/Smad2通路诱导RLE-6TN发生上皮间质转化①
巫凤苹陈虹余秀英廖科张慧张露陈亚娟
(重庆医科大学附属第一医院呼吸科,重庆400016)
[摘要]目的:探讨烟草烟雾提取物(Cigarette smoke extract,CSE)在诱导大鼠Ⅱ型肺泡上皮细胞RLE-6TN发生上皮间质转化(Epithelial-mesenchymal transition,EMT)中的作用及机制。方法:以不同浓度(0.25%,0.5%及1%)CSE刺激RLE-6TN细胞株;TGF-β1受体抑制子(SB431542)预处理后,加入1% CSE共培养。实时定量PCR(RT-PCR)检测E-cadherin和Vimentin RNA表达;印迹法(Western blot)检测TGF-β1、Smad2、磷酸化的Smad2(p-Smad2)、E-cadherin、N-cadherin和Vimentin蛋白的表达量。结果:经不同浓度的CSE作用,E-cadherin无论是在RNA还是在蛋白水平表达均下调,而Vimentin表达均上调;同时,TGF-β1、 p-Smad2和N-cadherin蛋白表达量增加;TGF-β1受体抑制子(SB431542)干预后, p-Smad2表达量明显降低(P<0.05),E-cadherin蛋白表达量较对照组明显增加(P<0.05),N-cadherin和Vimentin蛋白表达量较对照组明显降低(P<0.05)。结论:CSE可能通过激活TGF-β1/Smad2信号通路,参与调节E-cadherin、N-cadherin和Vimentin蛋白的表达,从而诱导RLE-6TN发生EMT。
[关键词]大鼠Ⅱ型肺泡上皮细胞;烟草烟雾提取物;上皮间质转化;TGF-β1;p-Smad2
上皮间质转化是指完全分化的上皮细胞发生表型改变后转变成间质细胞。EMT参与机体多个生理病理过程,在胚胎发育、慢性炎症、组织重建、癌症转移和多种纤维化疾病中发挥了重要作用。最近的研究表明EMT在呼吸系统疾病,如慢性阻塞性肺病(Chronic obstructive pulmonary disease,COPD)发病机制中起着重要作用[1,2]。吸烟是COPD的重要高危因素,目前已知的烟草烟雾成分复杂,因其患病率和死亡率高,造成沉重的社会经济负担。文献报道烟草烟雾可诱导上皮间质转化[3-5],提示EMT可能参与吸烟所致肺损伤,但具体发病机制仍不十分清楚。
TGF-β1是一种多功能蛋白质,是诱导EMT发生的重要因子之一,诱导细胞发生形态学改变,从上皮细胞转化为具有间质表型的细胞,同时伴随上皮细胞标志物如E-cadherin的丧失,从而获得间质细胞表型标志物如Vimentin、Fibronectin和 N-cadherin[6,7]。TGF-β1与配体结合后,可激活受体性Smad2和Smad3,进而与共同通路性Smad4形成三聚体转位到核内,调节EMT相关蛋白的表达[8]。而烟草燃烧所产生的烟雾中含大量的自由基(Reactive oxygen species ,ROS),如烷基、烷氧基、Nox自由基等[9],可以促进TGF-β1释放,引起下游Smad2/3 瀑布式激活,进而促进支气管重塑[10]。我们前期研究亦发现TGF-β1/Smad2信号通路参与CSE诱导的肺泡上皮细胞凋亡[11]。故我们认为烟草烟雾可能通过TGF-β1/Smad2信号通路调节RLE-6TN发生EMT,进而导致肺部疾病。
本研究首次在RLE-6TN中探究CSE通过TGF-β1/Smad2信号通路调节肺泡细胞发生EMT。我们选取E-cadherin作为上皮表型标志物,N-cadherin和Vimentin作为间质表型标志物[3,12-14],通过CSE诱导RLE-6TN,检测上述EMT特征蛋白表达,进一步探讨烟草烟雾所致肺损伤的发病机制。
1材料与方法
1.1材料
1.1.1药物、试剂和仪器高糖DMEM培养基、胎牛血清、胰蛋白酶均购自美国Gibco公司;BCA蛋白浓度测定试剂盒购自Thermo公司;SDS-PAGE 凝胶配置试剂盒均购自碧云天生物技术研究所;E-cadherin、N-cadherin抗体购自Abcam公司;Vimentin抗体、Smad2以及p-Smad2均购自美国Cell Signaling Technology公司;TGF-β1多克隆抗体购自美国ImmunoWay公司;GAPDH抗体以及辣根过氧化物酶标记山羊抗兔IgG购于美国Santa公司;SB431542 购于美国MCE公司;ECL发光液购自美国Milipore公司;RNAiso Plus试剂、逆转录试剂盒、SYBR Green Supermix均购自TaKaRa公司;其余均为国产试剂;CO2恒温培养箱,美国Thermo Scientific公司;超低温冰箱,美国Revco公司;高速台式离心机,美国Sigma公司;纯水仪,美国Milipore公司;M450酶标仪,美国Bio-Rad公司; PAC3000型电泳仪、电转仪,北京六一公司。
1.1.2细胞株来源及培养大鼠肺泡Ⅱ型上皮细胞(RLE-6TN)购自上海必畅生物科技有限公司(细胞来自美国模式培养物集存库,货号:CRL-2300,国内传代)。用含10%胎牛血清的高糖DMEM完全培养基,于37℃,5% CO2及饱和湿度条件下常规培养,每2~3 d传代1次,所有实验均在细胞对数生长期进行。
1.2方法
1.2.1CSE的制备宏升牌香烟购自重庆烟草公司,每只烟成分:焦油11 mg,一氧化碳17 mg,尼古丁1.1 mg。根据Wirtz[15]文献中提及的CSE制备方法进行操作。简要描述如下:去掉过滤嘴,安放在抽吸装置上,点燃香烟。匀速地抽吸,使烟雾通过一个装有10 ml无血清的DMEM培养基的玻璃瓶,此时可见烟草烟雾匀速通过DMEM培养基并产生大小均匀的气泡,且保证每支香烟燃烧4 min。当10支香烟燃烧产生的烟雾通过该培养基后,停止抽吸。调节烟草烟雾-DMEM培养基混合物的pH至7.4,并用0.22 μm的过滤器除去杂质和细菌,即为CSE。使用Beckman DU 640 分光计(Fullerton,CA,USA)测定CSE在320nm处的吸光度值,约为1.36±0.12,将此时对应的CSE设为100%。实验时,根据实验需要将100%CSE稀释至所需浓度即可。CSE现配现用,在制备好30 min内使用。
1.2.2实时定量PCR(RT-PCR)检测E-cadherin、Vimentin RNA的表达取处于对数生长期的RLE-6TN细胞以2×105ml-1的密度接种于六孔板中,分别设置对照组和实验组,常规培养24 h后实验组分别加入终浓度为0.25%、0.5%、1%CSE处理48 h后收集细胞,采用Trizol法分别提取各细胞内的总RNA,经核酸浓度测定仪(Fullerton,CA,USA)测定RNA的浓度,并且样品A260/280比值均介于1.8~2.0。使用TaKaRa逆转录试剂盒采用两步法将样品逆转为cDNA,然后在PCR仪(Bio-Rad,USA)上进行实时定量PCR测定上皮细胞标志物E-cadherin和间质细胞标志物Vimentin的RNA表达量。用于扩E-cadherin目的片段的上游引物为:5′-TCATCACAGACCCCAAGACC-3′,下游引物为:5′-GATCTCCAGACCCACACCAA-3′;Vimentin上游引物为:5′-TGACATTGAGATCGCCACCT-3′,下游引物为:5′-TCATCGTGGTGCTGAGAAGT-3′。
1.2.3Western blot检测TGF-β1、Smad2、p-Smad2和EMT相关蛋白的表达取处于对数生长期的RLE-6TN以5×105ml-1的密度接种于10 cm的培养皿中,分别设置对照组和实验组,常规培养24 h后实验组分别加入终浓度为0.25%、0.5%、1%CSE处理72 h,用细胞裂解液于冰上裂解各组细胞30 min,12 000 r/min 离心10 min,提取各组细胞总蛋白,BCA法测定蛋白含量。每个点样孔加样40 μg蛋白样品液,SDS-PAGE凝胶电泳分离蛋白质。凝胶上的蛋白转到0.45 μm的PVDF膜,5%的脱脂牛奶或BSA封闭膜上的蛋白结合位点2 h。采用TGF-β1(1∶500)、Smad2(1∶1 000)、p-Smad2(1∶1 000)、E-cadherin(1∶3 000)、N-cadherin(1∶8 000)、Vimentin(1∶1 000)、内参GAPDH多抗(1∶1 000),4℃孵育过夜。用TBST溶液漂洗3次,每次10 min。分别加入辣根过氧化物标记的山羊抗兔IgG(1∶1 000)常温孵育2 h。TBST溶液漂洗,用ECL试剂发光。运用图像分析软件Quantity One分析条带的灰度值,将对照组和实验组目的条带的灰度值和内参的灰度值比值表示蛋白质相对表达水平。
1.2.4TGF-β1受体抑制子SB431542阻滞TGF-β1/Smad2信号通路取处于对数生长期的RLE-6TN以5×105ml-1的密度接种于10 cm的培养皿中,分别设置对照组和实验组,常规培养24 h后实验组分别加入终浓度为10、100、10 00 nmol/L的SB431542处理48 h,提取各组细胞总蛋白,BCA法测定蛋白含量。并用Western blot检测Smad2和p-Smad2的表达量,以筛选TGF-β1受体抑制子的最佳实验浓度。再取对数生长期的RLE-6TN设置空白对照组、CSE处理组、SB431542处理组、CSE+ SB431542处理组,常规培养72 h,提取各组细胞总蛋白,后用Western blot检测Smad2、p-Smad2、EMT相关蛋白的表达量。

2结果
2.1CSE对RLE-6TN细胞E-cadherin、Vimentin RNA的影响不同浓度的CSE作用RLE-6TN细胞48 h后,提取总RNA检测E-cadherin(图1A)和Vimentin(图1B)表达量。处理组随着CSE浓度的上升E-cadherin的表达下调,在CSE浓度为1%,与空白对照组比较差异有统计学意义(P<0.05);其他组无统计学意义。CSE浓度为1%时Vimentin的表达上调,与空白对照组比较,差异有统计学意义(P<0.05);其他CSE组Vimentin表达量与对照组比较,无明显变化(P>0.05)。
2.2CSE对RLE-6TN细胞EMT相关蛋白的影响运用Western blot方法检测CSE对RLE-6TN细胞E-cadherin、N-cadherin和Vimentin的影响。如图2所示, CSE处理后E-cadherin蛋白表达下调,在浓度为0.25%、0.5%和1%时与对照组比较差异有统计学意义(P<0.05)。N-cadherin在浓度为0.5%和1%时蛋白表达上调,与对照组比较差异有统计学意义(P<0.05)。CSE处理后Vimentin的蛋白表达上调,与对照组比较差异有统计学意义(P<0.05)。结果表明,CSE能调节EMT相关蛋白的变化,诱导EMT发生,在浓度为1%最明显,故后续实验CSE选用1%作为工作浓度(图1、2)。
2.3Western blot检测TGF-β1、Smad2和p-Smad2蛋白的表达运用Western blot方法检测CSE对RLE-6TN细胞TGF-β1/Smad2信号通路蛋白的影响。结果显示随着CSE的增加,TGF-β1蛋白的表达上调,与对照组相比差异均有统计学意义(P<0.05)。CSE处理后, p-Smad2蛋白表达增加,在CSE浓度为0.5%和1%时与对照组比较差异有统计学意义(P<0.05)。结果表明,CSE能激活RLE-6TN中的TGF-β1/Smad2信号通路,并能诱导EMT发生(图2和图3)。但两者之间是否有内在联系,尚需进一步论证。

图1 CSE对RLE-6TN细胞E-cadherin和Vimentin mRNA的影响Fig.1 mRNA expressions of E-cadherin and Vimentin in different groups were detected by real-time PCRNote: Treated RLE-6TN with CSE at different concentrations for 48 h,then total RNA was isolated for real-time PCR to detect the mRNA expressions of E-cadherin(A)and Vimentin(B).Values are mean±SD of three independent experiments.*.P<0.05,**.P<0.01 compared with control.
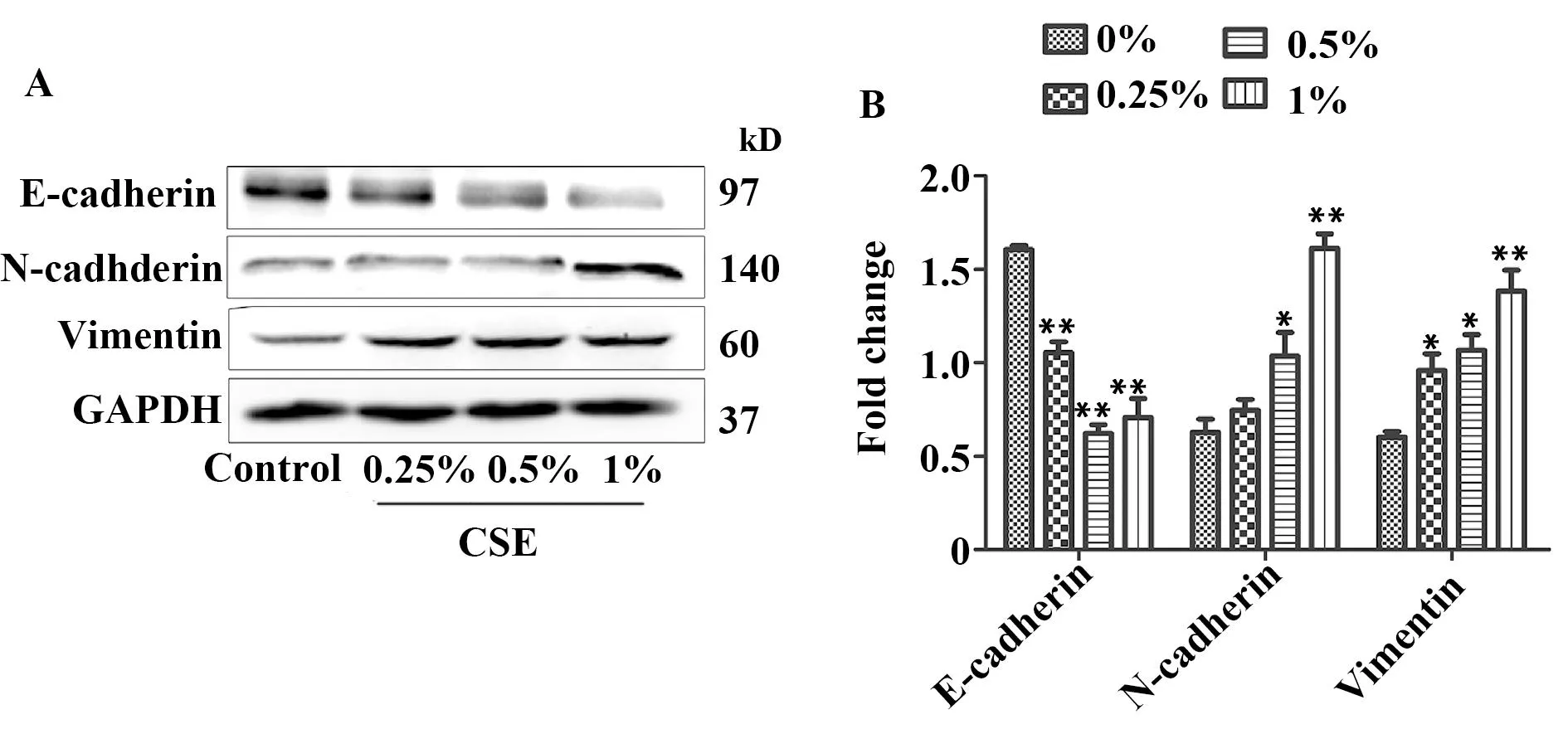
图2 CSE对RLE-6TN细胞EMT相关蛋白的影响Fig.2 Effects of CSE on expressions of EMT markers in RLE-6TNNote: Treated RLE-6TN with different concentrations of CSE,the expressions of E-cadherin,N-cadherin,Vimentin and GAPDH in cell lysis were detected by Western blot.The figures were visualized and quantified using quantity one software.Values are mean±SD of three independent experiments.*.P<0.05,**.P<0.001 compared with control.

图3 烟草烟雾提取物对RLE-6TN细胞TGF-β1、Smad2和p-Smad2蛋白的影响Fig.3 Effects of CSE on expressions of TGF-β1,Smad2 and p-Smad2 proteins in RLE-6TNNote: 0.25%-1% of CSE co-cultured with RLE-6TN ,the expressions of TGF-β1,Smad2,p-Smad2 and GAPDH were detected by Western blot.The figures were visualized and quantified using quantity one software.Values are mean±SD of three independent experiments.*.P<0.05,**.P<0.01,***.P<0.001 compared with control.

图4 SB431542对RLE-6TN细胞中Smad2磷酸化的影响Fig.4 Effects of SB431542 on expressions of Smad2 and p-Smad2 proteins in RLE-6TNNote: 10-1 000 nmol/L of SB431542 were co-cultured with RLE-6TN cells for 48 h.Expressions of p-Smad2 and Smad were detected by Western blot.The figures were visualized and quantified using quantity one software.Values are mean±SD of three independent experiments.*.P<0.05,**.P<0.01,***.P<0.001 compared with control.
2.4阻滞TGF-β1/Samd2信号通路,筛选SB431542的最佳浓度Smad2是TGF-β1信号下传的第一个分子。当Smad2接受经TGF-β1传递的信号后,会发生磷酸化,故通过检测RLE-6TN细胞Smad2磷酸化的情况,可以间接地反映TGF-β1/Samd2信号通路被激活的情况。将不同摩尔浓度(10、100、1 000 nmol/L)的TGF-β1受体抑制子(SB431542)与RLE-6TN共培养,提取总蛋白,检测TGF-β1信号通路的下游蛋白Smad2的磷酸化情况,以评估TGF-β1受体抑制子对TGF-β1/Smad2通路的阻滞效率,用以筛选SB431542的最佳浓度。如图4示SB431542在10~1 000 nmol/L范围内对RLE-6TN中TGF-β1/Smad2通路的阻滞作用逐渐增强,且1 000 nmol/L的SB431542对最大限度地阻止TGF-β1/Smad2通路。

图5 阻滞TGF-β1/Smad2通路后,观察CSE对EMT相关蛋白表达的影响Fig.5 Block TGF-β1/Smad2 pathway and detect expressions of EMT markersNote: 1 000 nmol/L SB431542 was added into the CSE-treated rat lung epithelial cells to block the TGF-β1/Smad2 pathway.The expressions of p-Smad2 and EMT markers were detected by Western blot.Values were mean±SD of three independent experiments.*.P<0.05,**.P<0.001,significant difference from the control group;#.P<0.05,##.P<0.01,significant difference from the CSE induced groups.
2.5阻滞TGF-β1/Smad2信号通路对CSE诱导的RLE-6TN细胞EMT相关蛋白的影响为进一步研究TGF-β1/Smad2信号通路在CSE诱导的RLE-6TN中的作用,我们将TGF-β1/Smad2通路阻滞后,观察CSE对EMT相关蛋白表达的影响。结果显示(图5),SB431542与CSE共培养后,与CSE组比较,E-cadherin表达增加;N-cadherin和Vimentin表达下降,差异都有统计学意义(P<0.05)。说明SB431542能部分逆转CSE诱导EMT相关蛋白的表达。由此说明,CSE通过激活TGF-β1/Smad2信号通路诱导RLE-6TN发生EMT。
3讨论
COPD是一种以气流受限为特征的慢性气道炎症性疾病,气流受限不可逆,呈进行性发展,严重影响患者的生活质量,甚至危及生命。吸烟是COPD发生发展的主要危险因素[16]。吸烟引起呼吸道慢性炎症和肺气肿的发生发展,导致气道的不可逆受阻和肺功能的急剧下降[17]。已有研究证明,烟草烟雾可诱导人非小细胞肺癌细胞株H358 、支气管上皮细胞和A549发生上皮间质转化[3-5]。有研究证实,烟草烟雾可诱导上皮细胞间质转化,COPD患者的肺组织中亦可见上皮间质转化[2,4],故EMT可能参与吸烟所致肺损伤及肺部疾病如COPD,但其致病机制复杂,目前仍不十分明确。
本实验采用RT-PCR技术,结果显示CSE可诱导E-cadherin RNA表达下调, Vimentin RNA表达上调(图1),表明CSE可诱导RLE-6TN细胞发生EMT。经CSE处理细胞后,Western blot检测发现RLE-6TN细胞发生EMT改变(图2):E-cadherin蛋白随CSE浓度增加而下调,N-cadherin和Vimentin表达则上调。并且CSE能激活TGF-β1/Smad2信号通路(图3),这些都与Wang等[10]得出的结论一致。为进一步论证,TGF-β1/Smad2信号通路在CSE诱导的RLE-6TN细胞发生EMT中的作用,我们通过抑制剂SB431542阻滞掉TGF-β1/Smad2通路,发现该通路被阻滞后,能逆转CSE对EMT相关蛋白的表达(图5)。
转化生长因子-β1(TGF-β1)属于调节细胞生长和分化的TGF-β超家族中的一员。其对炎症、组织修复和胚胎发育以及细胞的生长和分化都有重要的调节作用。越来越多的实验证明不论在体内实验还是体外实验TGF-β1都是EMT的重要调节因子。Smads家族蛋白是TGF-β1信号由细胞外传导至细胞核的过程中关键载体,在TGF-β1家族成员的信号转导中起传递信号的作用。TGF-β1与其配体形成的复合物,可激活Smads进入核内,共同激活或抑制它们调节的靶基因的转录。我们前期研究发现CSE可刺激肺泡上皮细胞分泌TGF-β1增加[11]。本研究亦发现,CSE可诱导大鼠肺泡上皮细胞发生EMT,激活TGF-β1/Smad2信号通路,下调E-cadherin的表达,上调N-cadherin和Vimentin;阻滞TGF-β1/Smad2信号通路后,能逆转CSE对EMT相关蛋白的调节。
综上所述,烟草烟雾中的有害物质,可以诱导RLE-6TN发生EMT,其机制可能为烟草烟雾激活肺泡上皮细胞中的TGF-β1/Smad2信号通路。通过研究TGF-β1/Smad2信号通路在CSE诱导的RLE-6TN发生EMT中的作用,可以为研究烟草烟雾所致的肺部疾病提供思路和参考,为治疗此类疾病提供新的靶点。
参考文献:
[1]Kalita M,Tian B,Gao B,etal.Systems approaches to modeling chronic mucosal inflammation[J].Biomed Res Int,2013,2013:505864.
[2]Sohal SS,Reid D,Soltani A,etal.Reticular basement membrane fragmentation and potential epithelial mesenchymal transition is exaggerated in the airways of smokers with chronic obstructive pulmonary disease[J].Respirology,2010,15(6):930-938.
[3]Zhang H,Liu H,Borok Z,etal.Cigarette smoke extract stimulates epithelial-mesenchymal transition through Src activation[J].Free Radic Biol Med,2012,52(8):1437-1442.
[4]Milara J,Peiró T,Serrano A,etal.Epithelial to mesenchymal transition is increased in patients with COPD and induced by cigarette smoke[J].Thorax,2013,68(5):410-420.
[5]Liu Y,Gao W,Zhang D.Effects of cigarette smoke extract on A549 cells and human lung broblasts treated with transfor ming growth factor-β1 in a coculture system[J].Clin Exp Med,2010,10(3):159-167.
[6]Zavadil J,Bottinger EP.TGF-beta and epithelial-to-mesenchymal transitions[J].Oncogene,2005,24(37):5764-5774.
[7]Liu Y.Epithelial tomesenchymal transition in renal brogenesis:Pathologic significance,molecular mechanism,and therapeutic intervention[J].J Am Soc Nephrol,2004,15(1):1-12.
[8]Sullivan BP,Kassel KM,Manley S,etal.Regulation of transfor ming growth factor-b1-dependent integrin b6 expression by p38 mitogen-activated protein kinase in bile duct epithelial cells[J].J Pharmacol Exp Ther,2011,337(2):471-478.
[9]Perfetti TA,Rodgman A.The complexity of tobacco and tobacco smoke[J].Contrib Tob Res,24(2011):215-232.
[10]Wang RD,Wright JL,Churg A.Transfor ming growth factor-beta1 drives airway remodeling in cigarette smoke-exposed tracheal explants[J].Am J Respir Cell Mol Biol,2005,33(4):387-393.
[11]Celli BR,MacNee W,Agusti A,etal.Standards for the diagnosis and treatment of patients with COPD:a summary of the ATS/ERS position paper[J].Eur Respir J,2004,23(6):932-946.
[12]Nagarajan D,Melo T,Deng Z,etal.ERK/GSK3β/Snail signaling mediates radiation-induced alveolar epithelial-to-mesenchymal transition[J].Free Radic Biol Med,2012,52(6):983-992.
[13]Wang Q,Wang Y,Zhang Y,etal.The role of uPAR in epithelial-mesenchymal transition in small airway epithelium of patients with chronic obstructive pulmonary disease[J].Respir Res,2013,14(1):67.
[14]Shen HJ,Sun YH,Zhang SJ,etal.Cigarette smoke-induced alveolar epithelial-mesenchymal transition is mediated by Rac1 activation[J].Biochim Biophys Acta,2014,1840(6):1838-1849.
[15]Wirtz HRW,Schmidt M.Acute influence of cigarette smoke on secretion of pulmonary surfactant in rat alveolar type Ⅱ cells in culture[J].Eur Respir J,1996,9(1):24-32.
[16]Chapman KR,Mannino DM,Soriano JB,etal.Epidemiology and costs of chronic obstructive pulmonary disease[J].Eur Respir J,2006,27(1):188-207.
[17]廖 科,陈亚娟,赵绿翠,等.烟草烟雾提取物通过TGF-β1/Smad2通路诱导RLE-6TN细胞凋亡[J].第三军医大学学报,2015,37(14):1412-1416.
[收稿2015-08-30修回2015-10-14]
(编辑张晓舟)
Cigarette smoke extract induce EMT of RLE-6TN cells via TGF-β1/Smad2 pathway
WUFeng-Ping,CHENHong,YUXiu-Ying,LIAOKe,ZHANGHui,ZHANGLu,CHENYa-Juan.
DepartmentofRespiratoryMedicine,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China
[Abstract]Objective:To investigate the effect of cigarette smoke extract(CSE)induced EMT in rat alveolar type Ⅱ cells(RLE-6TN).Methods: The different concentrations of CSE co-cultured with RLE-6TN and inhibitor of the transforming growth factor-β1(TGF-β1)typeⅠ receptor was administered prior to CSE exposure (SB431542).Expression levels of E-cadherin and Vimentin were examined by RT-PCR.The expression levels of TGF-β1,p-Smad2,Smad2,E-cadherin,N-cadherin and Vimentin were examined by Western blot.Results: Our results showed that the expression of E-cadherin decreased in CSE-treated group,while the expression of TGF-β1,p-Smad2,N-cadherin and Vimentin obviously increased after CSE exposure,however,which could be abrogated by SB431542.Conclusion: TGF-β1/Smad2 signal pathway may be involved in the CSE induced EMT in rat alveolar cells.
[Key words]Rat alveolar type Ⅱ cells;Cigarette smoke extract;Epithelial-mesenchymal transition;TGF-β1;p-Smad2
doi:10.3969/j.issn.1000-484X.2016.05.002
作者简介:巫凤苹(1989年-),女,在读硕士,主要从事呼吸系统疾病发病机制研究。通讯作者及指导教师:陈亚娟(1980年-),女,博士,讲师,主治医师,主要从事呼吸系统小气道疾病发病机制的研究,E-mail:yajuanchencqmu@sina.com。
中图分类号R363.2+1
文献标志码A
文章编号1000-484X(2016)05-0615-05
①本文受国家自然科学基金青年基金(81200009)、重庆市卫生局中医药研究课题(ZY20132165)和国家临床重点专科专项资助(卫办医政函[2012]649号)。