乳腺癌髓系来源抑制细胞浸润与IL-6表达水平及患者预后的相关性研究*
2016-06-15陈洁英蒋蒙蒙于文文魏枫任秀宝于津浦
陈洁英 蒋蒙蒙 于文文 魏枫 任秀宝 于津浦②
乳腺癌髓系来源抑制细胞浸润与IL-6表达水平及患者预后的相关性研究*
陈洁英①蒋蒙蒙①于文文①魏枫①任秀宝①于津浦①②
摘要目的:探讨乳腺癌髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)浸润与肿瘤组织原位白介素-6(interleukin-6,IL-6)表达及患者预后的相关性。方法:收集天津医科大学肿瘤医院2012年10月至2014年10月间经手术切除的113例女性乳腺癌石蜡组织切片、上海芯超生物科技有限公司提供的2001年1月至2004年8月经手术切除的女性乳腺癌患者组织芯片140例,免疫组织化学方法检测肿瘤源性IL-6表达水平和MDSCs浸润情况,分析MDSCs的浸润与IL-6表达的相关性,以及MDSCs浸润与临床病理指标及预后的相关性。结果:MDSCs浸润与肿瘤大小、淋巴结受累、病理分期、组织分级和患者预后相关,MDSCs浸润数与IL-6表达水平相关。结论:乳腺癌细胞分泌的IL-6可能是肿瘤局部MDSCs浸润与募集的原因之一,乳腺癌MDSCs浸润可作为患者预后不良的预测因素。
关键词乳腺癌髓系来源抑制细胞白介素-6预后
作者单位:①天津医科大学肿瘤医院免疫室,国家肿瘤临床医学研究中心,天津市肿瘤免疫与生物治疗重点实验室,天津市肿瘤防治重点实验室(天津市300060);②肿瘤分子诊断中心
*本文课题受国家自然科学基金项目(编号:81472473)资助
髓系来源抑制细胞(myeloid-derived suppressor cells,MDSCs)是由未成熟的髓系来源细胞组成的一类具有强大免疫抑制功能的细胞[1],最早在荷瘤鼠中被发现[2],之后在人类头颈恶性肿瘤中亦证实其存在[3]。MDSCs在健康人中的数量极少,但在恶性肿瘤患者中明显增加[4]。目前MDSCs尚无明确的表型标志,根据细胞核形态分为单核细胞样MDSCs和粒细胞样MDSCs两种亚型[5]。本研究组前期在乳腺癌患者体内鉴定出一类表型特点为CD45+CD33+CD13+CD14-CD15-的MDSCs,该群细胞不仅在患者肿瘤组织和外周血中明显升高,且能明显抑制T细胞的功能[6]。另有研究报道[7],在乳腺癌鼠模型中肿瘤源性白介素-6(interleukin-6,IL-6)可在肿瘤周围募集MDSCs,从而促进肿瘤的侵袭和转移,提示乳腺癌组织IL-6表达水平的升高可能是MDSCs浸润增加的一个重要原因。因此,本研究旨在初步探讨乳腺癌组织中MDSCs浸润与IL-6表达水平及患者预后的相关性,以期为研究MDSCs的生成和免疫抑制作用机制提供临床证据。
1 材料与方法
1.1材料
本研究试验病例包括病例组1和病例组2。病例组1收集天津医科大学肿瘤医院2012年10月至2014 年10月间经手术切除的女性乳腺癌患者113例,中位年龄为52岁,均为首次手术,均经病理诊断为原发性乳腺癌,其中浸润性导管癌占78.8%(89/113),术前均未接受化疗、放疗等相关治疗。病例组2为上海芯超生物科技有限公司提供的2001年1月至2004年8月经手术切除的乳腺癌患者组织芯片140例,均为女性患者,中位年龄为51岁,所有患者均为首次进行乳腺切除手术,所有病例均经病理诊断确认为原发性乳腺癌,其中浸润性导管癌占93.6%(131/140),患者术前均未接受过化疗、放疗等相关治疗,术后中位随访时间11.7年,死亡44例。本研究获得患者的书面知情同意书,并通过天津医科大学医学伦理委员会的审核。所有253例患者的临床病理资料见表1。
鼠抗人IL-6单克隆抗体购自美国PeproTech(派普泰克)公司,鼠抗人CD33单克隆抗体购自美国Abcam(艾博抗)公司,抗鼠/兔二抗、抗体稀释液、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.2方法
1.2.1组织标本病例组1的肿瘤组织手术切除后立即进行福尔马林固定、石蜡包埋制成组织蜡块,4 μm连续切片。病例组2的肿瘤组织为上海芯超生物科技有限公司提供的的石蜡块,制成厚度4 μm、直径1.5 mm的石蜡组织芯片待用。
1.2.2免疫组织化学染色组织切片经二甲苯脱蜡、梯度酒精水化、0.01 mol/L枸橼酸钠溶液(pH=6)修复、3%过氧化氢封闭内源性过氧化物酶后,普通组织切片滴加40 μL的抗人IL-6和抗人CD33单克隆抗体,组织芯片滴加200 μL的抗人IL-6和抗人CD33单克隆抗体。滴加抗鼠/兔二抗37℃孵育30 min,DAB显色,光学显微镜下观察。
1.2.3评分方法IL-6阳性细胞表现为胞浆着色,采用双评分半定量法对IL-6表达水平进行评价,即IL-6表达总得分为IL-6阳性细胞比例得分和染色强度得分之和,阳性细胞比例得分标准为:阳性细胞比例≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;染色强度得分标准为:无染色为0分,浅黄色为1分,黄色为2分,棕黄色为3分。光学显微镜下随机选择10个400倍视野进行评价,10个视野的平均得分即为该样本的最终总得分。总得分范围为0~7分,≤3分定义为低表达,>3分定义为高表达。免疫组织化学染色有效例数共253例。

表1 253例乳腺癌患者临床病理资料 例Table 1 Baseline characteristics of all patients n
根据本研究组前期研究结果[6],本试验将CD33+间质细胞定义为乳腺癌MDSCs。MDSCs散在分布于乳腺癌肿瘤组织的间质中,表现为胞膜着色,部分有胞质着色。随机选择10个光学显微镜下400倍视野,计数MDSCs细胞数,10个视野的平均数即为该样本的MDSCs浸润数,以所有样本的MDSCs浸润数的中位数为界分为浸润高组和浸润低组。免疫组织化学染色有效例数共208例。
1.3统计学分析
采用SPSS 19.0和GraphPad Prism 5软件对数据进行统计学分析。计数资料用中位数(范围)表示,计量资料以x±s表示。计数资料的比较采用χ2检验,计量资料的比较采用t检验。用Kaplan-Meier法确定累积生存概率,用Log-rank检验对各亚组患者的总生存时间(overall survival,OS)进行比较。以P<0.05为差异具有统计学意义。OS定义为从手术日起至患者死亡日或最后随访日。乳腺癌特异生存时间(breast cancer specific survival,BCSS)定义为手术日至患者因乳腺癌原因死亡日或最后随访日。因病例组1术后时间短,故本研究有关预后分析数据仅包含病例组2。
2 结果
2.1IL-6表达情况及其与患者临床病理指标的相关性
IL-6主要表达于乳腺癌细胞的胞浆,可见少量细胞核着色,偶有间质细胞着色(图1A,1B)。病例组1中,IL-6高表达病例占44.4%(48/108);病例组2中,IL-6高表达病例占50.5%(50/99)。本研究分别对两病例组中乳腺癌IL-6表达与患者的年龄、组织分级、淋巴结浸润、肿瘤大小、病理分期、ER、PR及HER2表达情况等进行相关性分析。病例组1和病例组2的结果显示一致的相关性,即IL-6表达与患者年龄、组织分级、肿瘤大小、ER、PR和HER-2表达之间无相关性,但与患者淋巴结浸润与否及肿瘤病理分期具有相关性,IL-6表达高者,更易出现淋巴结浸润(病例组1:P<0.001;病例组2:P=0.012),肿瘤病理分期更高(病例组1:P<0.001;病例组2:P=0.001,表2),提示IL-6表达水平高的乳腺癌更易发生侵袭转移。
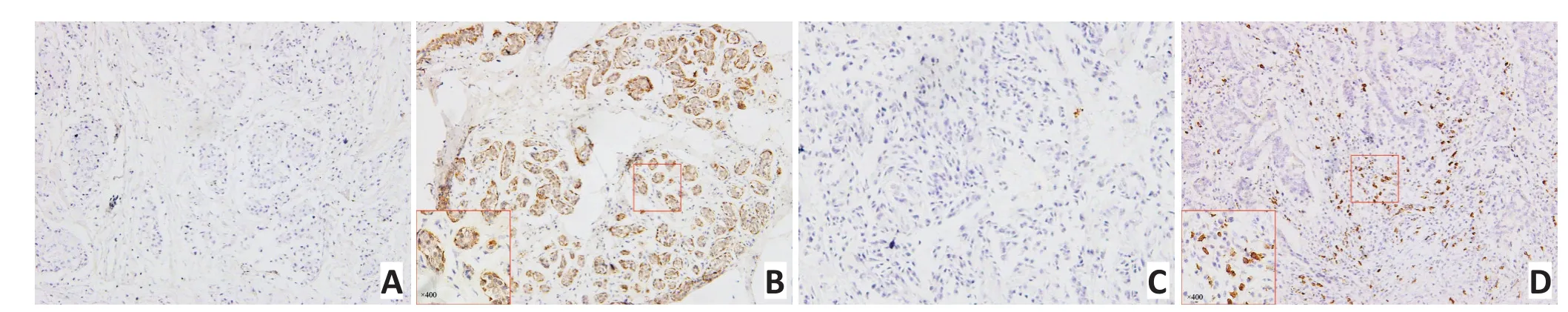
图1 乳腺癌IL-6表达和MDSCs浸润情况(IHC×200)Figure 1 Expression of interleukin-6(IL-6)and infiltration of myeloid-derived suppressor cells(MDSCs)in breast cancer patients(IHC×200)
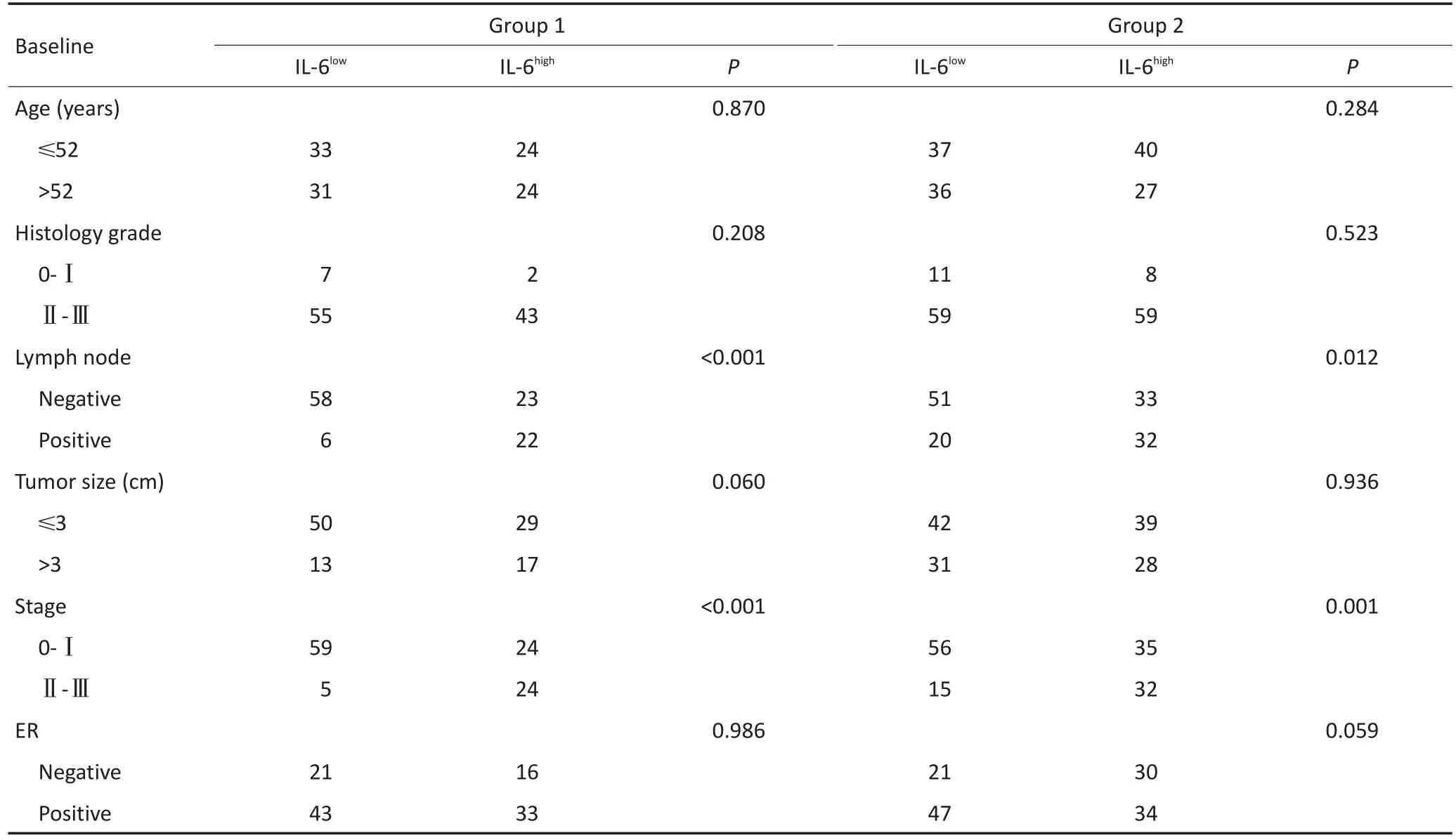
表2 IL-6与乳腺癌患者临床病理指标的相关性Table 2 Correlations of IL-6 with the pathologic characteristics of breast cancer patients
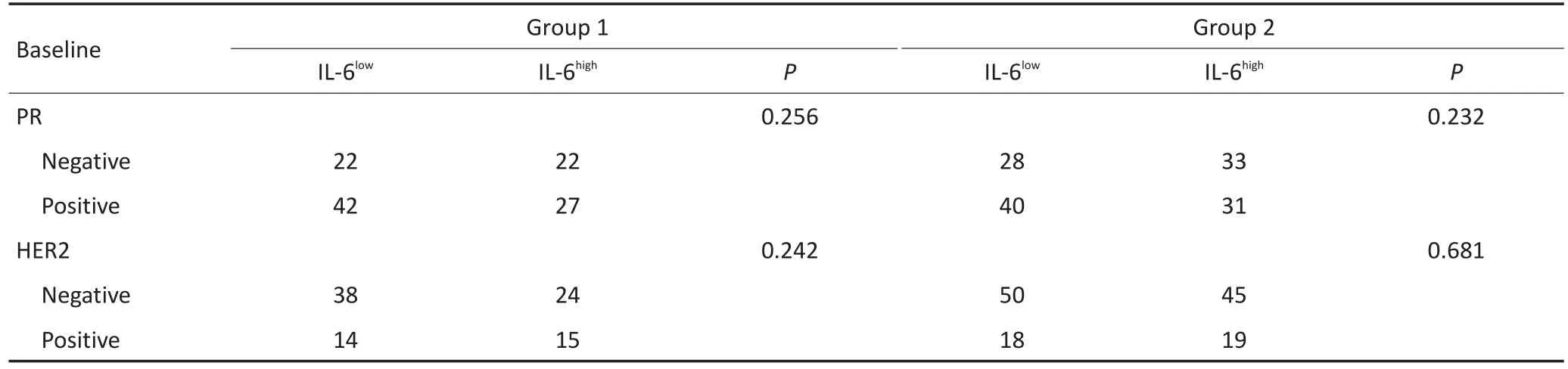
表2 IL-6与乳腺癌患者临床病理指标的相关性(续表2 )Table 2 Correlations of IL-6 with the pathologic characteristics of breast cancer patients
采用Kaplan-Meier法和Log rank检验分析乳腺癌患者肿瘤组织IL-6表达与患者OS的关系,发现IL-6高表达组的OS明显优于IL-6低表达组(P<0.001,图2A),IL-6高表达组的3、5年及10年总生存率均低于IL-6低表达组(表3)。为准确反映乳腺癌IL-6表达与患者预后的关系,本研究排除3例非乳腺癌原因死亡患者后,对乳腺癌患者肿瘤组织IL-6表达和患者BCSS的相关性进行了分析,结果显示IL-6高表达组的BCSS明显优于IL-6低表达组(P<0.001,图2B),IL-6高表达组的3、5年及10年乳腺癌特异生存率均低于IL-6低表达组(表3)。
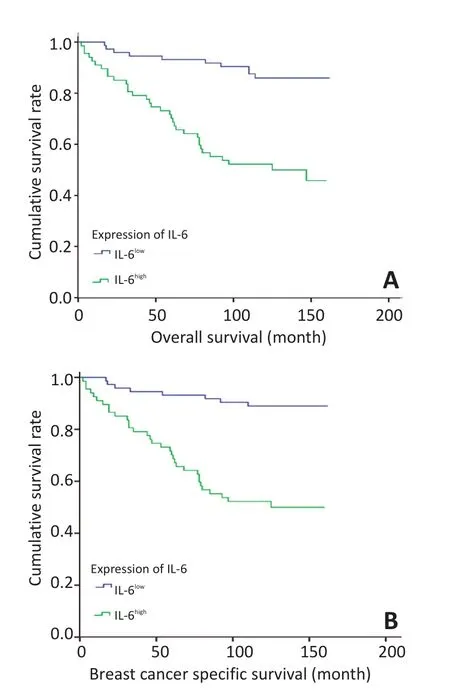
图2 IL-6表达与乳腺癌患者预后的关系Figure 2 Correlation of IL-6 with prognosis in patients with breast cancer
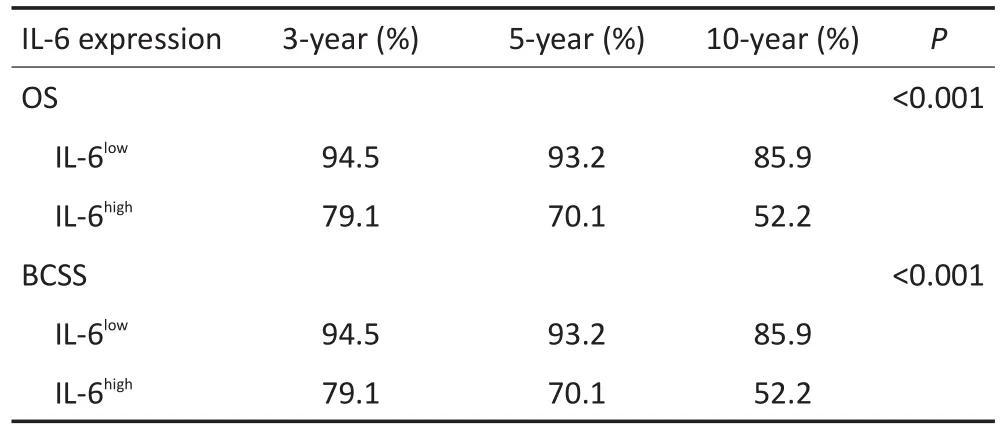
表3 IL-6不同表达水平患者的生存率比较Table 3 Survival rate of breast cancer patients with different levels of IL-6 expression
2.2MDSCs浸润情况及其与患者临床病理指标的相关性
MDSCs呈散在分布于乳腺癌组织的间质中,不同乳腺癌患者MDSCs的浸润情况具有明显异质性(图1C,1D)。本研究分别对两组病例中乳腺癌MDSCs浸润数与患者的年龄、组织分级、淋巴结浸润、肿瘤大小、病理分期、ER、PR及HER2表达情况等临床病理指标之间的相关性进行分析。病例组1和病例组2的结果均显示MDSCs浸润与肿瘤组织分级(P=0.025,P=0.018)、淋巴结浸润与否(P<0.001,P=0.007)、肿瘤大小(P=0.022,P=0.032)、病理分期(P<0.001,P<0.001)具有相关性,而与其他临床病理指标无相关(表4)。MDSCs浸润较多者肿瘤组织分级更高、淋巴结浸润更多、肿瘤体积更大、分期更晚,提示MDSCs浸润较多的乳腺癌亦更易发生侵袭转移。
本研究也分析了乳腺癌患者肿瘤组织MDSCs浸润与患者OS的关系,发现MDSCs浸润较多患者的OS明显短于MDSCs浸润较少的患者(P<0.001,图3A),MDSCs浸润高组的3、5年及10年总生存率均低于MDSCs浸润低组(表5)。同样,MDSCs浸润高者BCSS明显短于MDSCs浸润低者(P<0.001,图3B),MDSCs浸润高组3、5年及10年乳腺癌特异生存率均低于MDSCs浸润低组(表5)。
2.3MDSCs浸润情况与IL-6表达水平的相关性
本研究分别对两组病例中乳腺癌组织MDSCs浸润及IL-6表达的相关性进行分析。病例组1中IL-6低表达组的MDSCs浸润数(每400×视野)为(1.95± 0.26)个,明显低于IL-6高表达组的(6.40±0.48)个(P<0.001,图4A);病例组2的结果亦显示IL-6低表达组的MDSCs浸润数(每400×视野)低于高表达组的MDSCs浸润数[(1.31±0.27)vs.(6.43±0.79),P<0.001,图4B]。以上结果提示乳腺癌细胞IL-6表达水平越高,乳腺癌组织中浸润的MDSCs越多。
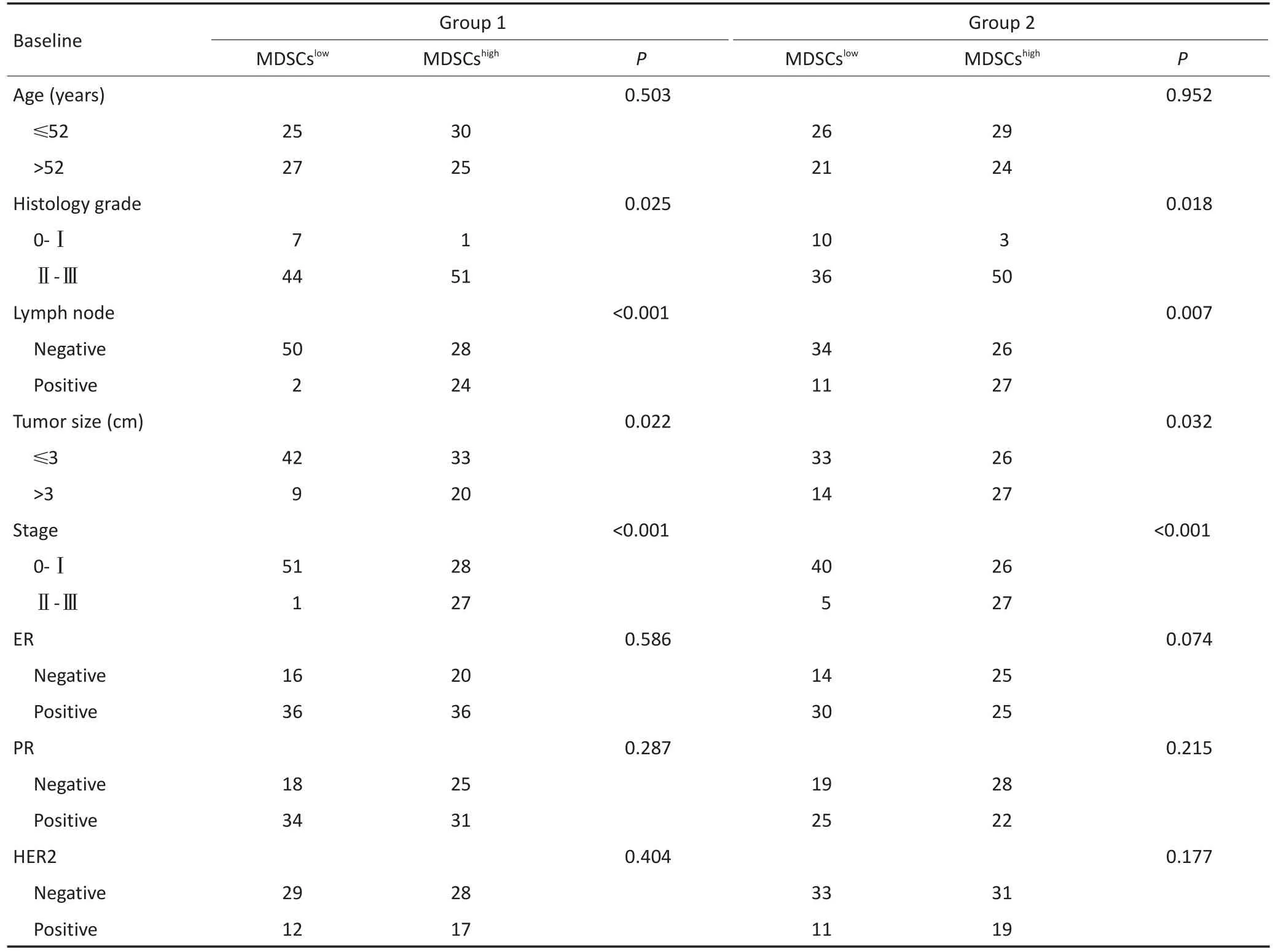
表4 MDSCs与乳腺癌患者临床病理指标的相关性Table 4 Correlations of MDSCs with the clinicopathological characteristics of breast cancer patients
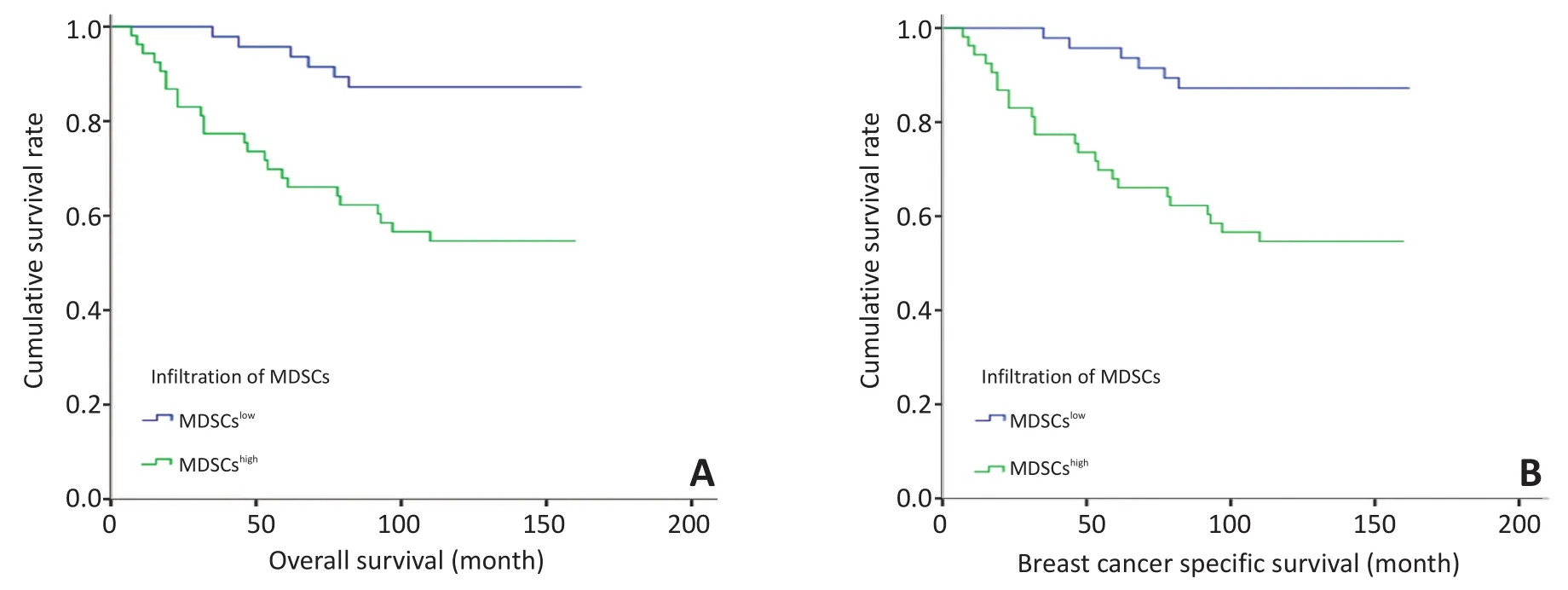
图3 MDSCs浸润与乳腺癌患者预后的关系Figure 3 Correlation of MDSCs with the prognosis of breast cancer patients
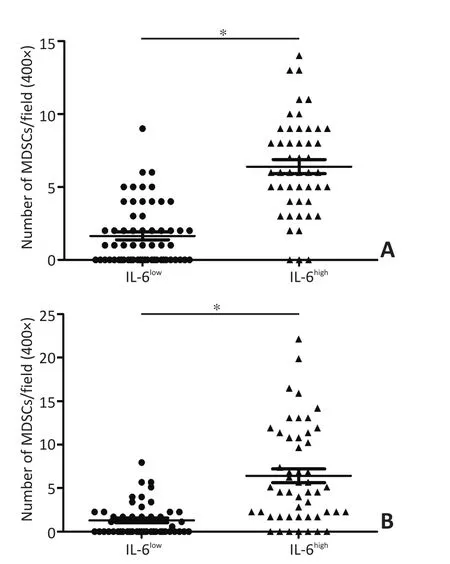
图4 MDSCs浸润数与IL-6表达之间的相关性Figure 4 Correlation between MDSC infiltration and IL-6 expression
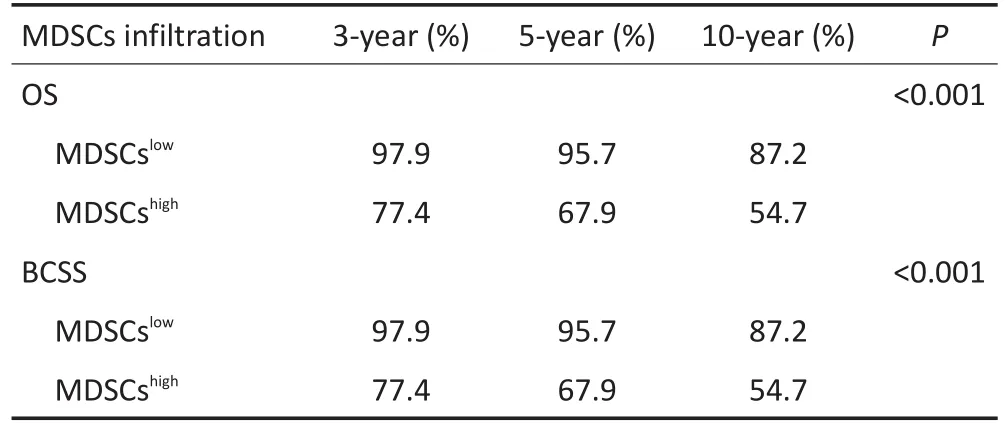
表5 MDSCs不同浸润水平乳腺癌患者的生存率的比较Table 5 Survival rate of breast cancer patients with different levels of MDSC infiltration
3 讨论
MDSCs是肿瘤微环境中重要的免疫调节细胞,可通过分泌多种细胞因子(如IL-10、TGF-β)[8]和调节T细胞代谢(如精氨酸、色氨酸代谢)[9]等机制损害机体的正常免疫能力,导致恶性转化的细胞逃避机体的免疫监视,并削弱免疫系统对肿瘤细胞的攻击能力,从而促进肿瘤的发生发展。因此,过多的MDSCs不仅形成免疫抑制性肿瘤微环境,而且削弱了肿瘤免疫治疗的疗效,故深入研究MDSCs的生成和发挥免疫抑制作用的机制,对于预防肿瘤发生发展、提高疗效具有重要意义。
此前有研究报道[6],乳腺癌MDSCs水平与患者的淋巴结浸润及分期呈正相关,在乳腺癌荷瘤鼠模型中,MDSCs水平升高促进了肿瘤的侵袭和转移[7]。本研究结果显示,MDSCs浸润水平较高的患者,淋巴结受累更多、肿瘤体积更大、病理分期更晚、组织分级更高,进一步证明MDSCs浸润对肿瘤的促进作用。本研究还对乳腺癌MDSCs浸润对患者生存的影响进行分析,发现MDSCs水平升高的患者预后较差,在多种消化系统恶性肿瘤[10]、前列腺癌[11]、恶性黑色素瘤[12]和卵巢癌[13]中也得到证实,提示MDSCs浸润水平升高是乳腺癌患者预后不良的预测因素。
IL-6是由184个氨基酸组成的分泌性细胞因子,可由单核细胞、巨噬细胞、淋巴细胞、成纤维细胞和部分肿瘤细胞分泌,并通过与受体CD126/gp130结合发挥生物学效应[14]。此前曾有多项研究提示乳腺癌细胞表达的IL-6可分泌至微环境中[15-16]。血清IL-6水平升高有助于肿瘤细胞扩增,并与患者不良预后相关[17]。而本研究注重于乳腺癌原位IL-6的表达水平,其表达水平高提示患者预后不良。此外,本研究还着重探讨乳腺癌原位IL-6表达水平与肿瘤组织中浸润MDSCs数量的相关性,研究结果显示IL-6表达水平与肿瘤组织中浸润的MDSCs数量相关,IL-6表达水平较高者,MDSCs浸润数也较多。本研究组前期研究显示,外源性IL-6因子刺激乳腺癌MDSCs后,可提高后者IDO的表达,反之对乳腺癌MDSCs使用IL-6中和抗体之后,MDSCs中的p-STAT3、NIK和IDO的表达较不使用抗体组明显降低,由此推断IL-6可能是诱导乳腺癌MDSCs中STAT3依赖的IDO表达的主要启动子[18]。Chen等[19]报道肿瘤患者血清IL-6水平增高与MDSCs比例上升明显相关,在动物模型中也证实血清IL-6水平与肿瘤生长和MDSCs积聚相关,在完全培养基中加入重组IL-6因子刺激可提高健康人外周血单个核细胞中CD11b+CD14+HLA-DRMDSCs的比例,并诱导活性氧、精氨酸合酶1及p-STAT3的表达,阻断IL-6则逆转了对MDSCs的诱导。IDO、活性氧和精氨酸合酶1均是MDSCs发挥免疫抑制活性的重要功能分子[20]。上述两项研究结果提示IL-6 在MDSCs免疫抑制活性的活化及其生成和聚集中发挥关键作用。本研究在乳腺癌患者中证实了肿瘤组织中浸润的MDSCs数量与肿瘤原位IL-6表达水平具有相关性,因此推断乳腺癌细胞分泌的IL-6可能是MDSCs生成、聚集及抑制免疫功能的重要因子之一。
综上所述,本研究证明乳腺癌组织中MDSCs浸润数目与肿瘤原位IL-6表达水平具有相关性,且与患者预后不良相关,这不仅为MDSCs在肿瘤免疫逃逸中的重要性提供了新的临床证据,还为乳腺癌MDSCs的生成和免疫调节机制的研究提供新的方向。
参考文献
[1]Solito S,Marigo I,Pinton L,et al.Myeloid-derived suppressor cell heterogeneity in human cancers[J].Ann N Y Acad Sci,2014,1319:47-65.
[2]Young MR,Newby M,Wepsic HT.Hematopoiesis and suppressor bone marrow cells in mice bearing large metastatic Lewis lung carcinoma tumors[J].Cancer Res,1987,47(1):100-105.
[3]Pak AS,Wright MA,Matthews JP,et al.Mechanisms of immune suppression in patients with head and neck cancer: presence of CD34(+)cells which suppress immune functions within cancers that secrete granulocyte-macrophage colony-stimulating factor[J].Clin Cancer Res,1995,1(1):95-103.
[4]Diaz-Montero CM,Salem ML,Nishimura MI,et al.Increased circulating myeloid-derived suppressor cells correlate with clinical cancer stage,metastatic tumor burden,and doxorubicin-cyclophosphamide chemotherapy[J].Cancer Immunol Immunother,2009,58 (1):49-59.
[5]Peranzoni E,Zilio S,Marigo I,et al.Myeloid-derived suppressor cell heterogeneity and subset definition[J].Curr Opin Immunol,2010,22(2):238-244.
[6]Yu J,Du W,Yan F,et al.Myeloid-derived suppressor cells suppress antitumor immune responses through IDO expression and correlate with lymph node metastasis in patients with breast cancer[J].J Immunol,2013,190(7):3783-3797.
[7]Oh K,Lee OY,Shon SY,et al.A mutual activation loop between breast cancer cells and myeloid-derived suppressor cells facilitates spontaneous metastasis through IL-6 trans-signaling in a murine model[J].Breast Cancer Res,2013,15(5):R79.
[8]Suzuki S,Shibata M,Gonda K,et al.Immunosuppression involving increased myeloid-derived suppressor cell levels,systemic inflammation and hypoalbuminemia are present in patients with anaplastic thyroid cancer[J].Mol Clin Oncol,2013,1(6):959-964.
[9]Zea AH,Rodriguez PC,Atkins MB,et al.Arginase-producing myeloid suppressor cells in renal cell carcinoma patients: a mechanism of tumor evasion[J].Cancer Res,2005,65(8):3044-3048.
[10]Gabitass RF,Annels NE,Stocken DD,et al.Elevated myeloid-derived suppressor cells in pancreatic,esophageal and gastric cancer are an Independent prognostic factor and are associated with significant elevation of the Th2 cytokine interleukin-13[J].Cancer Immunol Immunother,2011,60(10):1419-1430.
[11]Idorn M,Køllgaard T,Kongsted P,et al.Correlation between frequencies of blood monocytic myeloid-derived suppressor cells,regulatory T cells and negative prognostic markers in patients with castration-resistant metastatic prostate cancer[J].Cancer Immunol Immunother,2014,63(11):1177-1187.
[12]Weide B,Martens A,Zelba H,et al.Myeloid-derived suppressor cells predict survival of patients with advanced melanoma: comparison with regulatory T cells and NY-ESO-1-or melan-A-specific T cells[J].Clin Cancer Res,2014,20(6):1601-1609.
[13]Cui TX,Kryczek I,Zhao L,et al.Myeloid-derived suppressor cells enhance stemness of cancer cells by inducing microRNA101 and suppressing the corepressor CtBP2[J].Immunity,2013,39(3):611-621.
[14]Yao X,Huang J,Zhong H,et al.Targeting interleukin-6 in inflammatory autoimmune diseases and cancers[J].Pharmacol Ther,2014,141(2):125-139.
[15]Conze D,Weiss L,Regen PS,et al.Autocrine production of interleukin 6 causes multidrug resistance in breast cancer cells[J].Cancer Res,2001,61(24):8851-8858.
[16]Chavey C,Bibeau F,Gourgou-Bourgade S,et al.Oestrogen receptor negative breast cancers exhibit high cytokine content[J].Breast Cancer Res,2007,9(1): R15.
[17]Coward J,Kulbe H,Chakravarty P,et al.Interleukin-6 as a therapeutic target in human ovarian cancer[J].Clin Cancer Res,2011,17(18): 6083-6096.
[18]Yu J,Wang Y,Yan F,et al.Noncanonical NF-κB activation mediates STAT3-stimulated IDO upregulation in myeloid-derived suppressor cells in breast cancer[J].J Immunol,2014,193(5):2574-2586.
[19]Chen MF,Kuan FC,Yen TC,et al.IL-6-stimulated CD11b+ CD14+ HLADR-myeloid-derived suppressor cells,are associated with progression and poor prognosis in squamous cell carcinoma of the esophagus[J].Oncotarget,2014,5(18):8716-8728.
[20]Rodríguez PC,Ochoa AC.Arginine regulation by myeloid derived suppressor cells and tolerance in cancer: mechanisms and therapeutic perspectives[J].Immunol Rev,2008,222(1):180-191.
(2015-11-20收稿)
(2016-02-22修回)
(编辑:郑莉校对:邢颖)
陈洁英专业方向为肿瘤免疫微环境。
E-mail:chenjy15@foxmail.com

Correlations of the infiltration of myeloid-derived suppressor cells with IL-6 expression and prognosis in patients with breast cancer
Jieying CHEN1,Mengmeng JIANG1,Wenwen YU1,Feng WEI1,Xiubao REN1,Jinpu YU1,2
Correspondence to: Jinpu YU;E-mail: jinpu_yu@hotmail.com
1Department of Immunology,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Immunology and Biotherapy,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China;2Cancer Molecular Diagnostic Core,Tianjin Medical University Cancer Institute and Hospital,National Clinical Research Center for Cancer,Tianjin Key Laboratory of Cancer Immunology and Biotherapy,Tianjin Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China
This work was supported by the National Natural Science Foundation of China(No.81472473)
AbstractObjective: To investigate the correlation of the infiltration of myeloid-derived suppressor cells(MDSC)with interleukin-6(IL-6)expression and prognosis in patients with breast cancer.Methods: Tumor tissue slices were obtained from patients with breast cancer who underwent surgery.The expression of IL-6 and the number of MDSCs were detected through immunohistochemistry analysis.The correlation of MDSC infiltration with IL-6 expression and prognosis in patients with breast cancer was also analyzed.Results: MDSC infiltration was correlated with the infiltration of lymph nodes,tumor volume,tumor stage,histology grade,and overall survival of the patients.MDSC infiltration was also significantly correlated with IL-6 expression.Conclusion: IL-6 secreted by breast cancer cells may induce local infiltration and aggregation of MDSCs.Increased number of MDSCs could be the negative prognostic factor of patients with breast cancer.
Keywords:breast neoplasms,myeloid-derived suppressor cells,interleukin-6,prognosis
doi:10.3969/j.issn.1000-8179.2016.06.266
通信作者:于津浦jinpu_yu@hotmail.com
作者简介
