两种化学诱变剂对沙芦草染色体的加倍效果
2016-06-14周璐璐伏兵哲许冬梅高雪芹
周璐璐,伏兵哲,许冬梅,高雪芹
(1.宁夏大学农学院草业科学研究所,宁夏 银川 750021; 2.宁夏大学西北土地退化与生态恢复省部共建国家重点实验室培训基地,宁夏 银川 750021; 3.宁夏大学科学技术处,宁夏 银川 750021)
两种化学诱变剂对沙芦草染色体的加倍效果
周璐璐1,2,伏兵哲1,2,许冬梅1,2,高雪芹3
(1.宁夏大学农学院草业科学研究所,宁夏 银川 750021; 2.宁夏大学西北土地退化与生态恢复省部共建国家重点实验室培训基地,宁夏 银川 750021; 3.宁夏大学科学技术处,宁夏 银川 750021)
摘要:为提高沙芦草(Agropyron mongolicum)的牧草品质,筛选最优的染色体加倍方案,采用不同浓度的秋水仙素(0.02%,0.05%,0.08%,0.11%,0.14%+1.5%二甲基亚枫)和氟乐灵(1,5,10,15,20 μmol·L-1)处理沙芦草种子,并进行表观形态及染色体数目的鉴定。结果表明,经处理的沙芦草种子成活后的变异植株均为二倍体与四倍体的混倍体;0.11%秋水仙素+1.5%二甲基亚砜处理20 h的染色体数目变异率最大,高达50%,其成活率为40%;1 μmol·L-1氟乐灵处理6 h变异效果显著,变异率达38.46%。本研究为后期进一步筛选沙芦草加倍植株奠定了理论与试验基础。
关键词:沙芦草;诱变剂;染色体加倍;倍性鉴定
沙芦草(Agropyronmongolicum)又称蒙古冰草,为禾本科(Gramineae)小麦族冰草属多年生草本植物,主要分布于我国中西部的荒漠草原,具有抗旱、抗寒、耐风沙、耐贫瘠等特性,青绿持续期长,适口性好,营养成分含量较高[1],具有重要饲用价值、生态价值和遗传价值。我国学者在沙芦草的分类学历史、植物学特征、生物学特征、经济价值以及遗传育种学和栽培学等方面进行了研究[2-8],并通过人工野生驯化和混合选择,成功培育出内蒙沙芦草(A.mongolicumcv. Neimeng)和蒙农1号蒙古冰草(A.mongolicumcv. Mengnong No.1)两个沙芦草新品种[9];于肖夏等[10]利用秋水仙素对二倍体航道冰草(A.cristatumcv. Fairway)与沙芦草杂交的F1代种子进行染色体加倍诱导,并选育得到四倍体杂交冰草优良新品系SZB-02。
沙芦草是异交率很高的二倍体(2n=2x=14)植物,其叶量少、产草量相对较低,严重影响其经济效益。经过染色体加倍的植物一般具有植株巨大性、抗逆性强、营养成分丰富等特性[11],因此考虑利用倍性育种方法,培育产草量较高的沙芦草新品种。许多研究表明,在化学诱变染色体加倍过程中的诱变剂类型、诱变剂浓度、处理时间以及处理时期是影响植物染色体加倍效果的主要因素[12-13],因此,探索最佳的沙芦草染色体加倍条件对多倍体沙芦草的培育具有重要意义。本研究对沙芦草染色体加倍诱变剂种类、诱变剂浓度以及处理时间进行研究,旨在筛选出最佳的沙芦草染色体加倍条件,为沙芦草四倍体培育提供理论基础。
1材料与方法
1.1试验材料
2014年于银川市宁夏大学南场实训基地采集的沙芦草种子。
1.2多倍体诱导
1.2.1种子消毒用75%酒精浸泡种子1 min,再用0.1% HgCl2浸泡10 min,最后用无菌水漂洗3次。
1.2.2染色体加倍处理1)秋水仙素处理:将种子用清水浸泡12 h,待胚根刚刚萌发时取出,用0.02%、0.05%、0.08%、0.11%、0.14%的秋水仙素分别加1.5%二甲基亚砜(DMSO),在25 ℃下依次浸泡处理6、10、16、20、24 h,并以蒸馏水浸泡作对照。每个处理3次重复,每个重复30粒种子。2)氟乐灵处理:用上述同样方法处理种子,用氟乐灵作加倍诱变剂,处理浓度分别为1、5、10、15、20 μmol·L-1,处理时间依次为6、12、18、24、30 h,用蒸馏水处理作对照。每个处理3次重复,每个重复30粒种子。
1.2.3恢复培养将处理后的种子用清水彻底清洗,并分别放入铺有两层滤纸的培养皿中恢复培养,生长10 d后移植到土壤中继续生长。观察生长状况,成苗后进行染色体倍性鉴定。
1.3多倍体鉴定过程
1.3.1表观形态的鉴定发芽10 d测量苗高与根长,并统计发芽率,观察幼苗形态,统计形态变异率;移栽30 d统计成活率和染色体数目变异率。
1.3.2染色体制片法1)预处理:取根部,用0.002 mol·L-18-羟基喹啉浸泡4 h;2)固定:取出根尖放入卡诺固定液中固定12 h;3)解离:1 mol·L-1的盐酸解离20 min;4)染色制片:卡宝品红染液染色15~20 min;5)显微镜下观察染色体数目。
1.3.3各指标计算方法
发芽率=第10天发芽种子数/供试种子总数×100%;
形态变异率=形态变异的幼苗数/幼苗总数×100%;
成活率=30 d成活苗数/移栽苗总数×100%;
染色体变异率=染色体数目变异苗数/成活苗数×100%。
1.4数据统计分析
运用SAS 9.0和Excel做数据统计及方差分析。
2结果与分析
2.1两种诱变剂对沙芦草苗期形态的影响
经两种诱变剂的处理,沙芦草幼苗形态出现不同程度的变异(表1、图1)。萌发初期,诱变剂使部分细胞染色体加倍,造成细胞体积增大,对植物组织的正常生理环境造成破坏,使芽体表面凹凸不平,细胞组织疏松变形,幼苗出现粗化苗、卷化苗和球状苗等变异苗。正常幼苗形态:叶片纤细,幼根发达细长,透明乳白色;粗化苗形态:叶片呈鼓锤状,颜色深绿,幼根颜色发黄,有膨大现象;卷化苗形态:叶片发生卷曲化,表面组织疏松,幼根颜色发黄;球化苗形态:叶片呈球状,表面凹凸不平,幼根粗短褐化。秋水仙素处理的变异幼苗以粗化苗为主,氟乐灵处理的变异幼苗以球状苗为主。随秋水仙素和氟乐灵的浓度增大和处理时间的延长,沙芦草形态变异率明显增加,其中,0.08%秋水仙素处理24 h、15 μmol·L-1氟乐灵处理24 h和20 μmol·L-1处理30 h的变异率较高,分别为92.31%、56.25%和56.25%。由此可见,秋水仙素和氟乐灵对沙芦草种子的幼苗生长形态有不同程度的影响。
2.2两种诱变剂对沙芦草发芽率的影响
随秋水仙素浓度的升高,沙芦草发芽率总体呈下降趋势,以0.05%秋水仙素处理下平均发芽率最高,为44.67%;相同秋水仙素浓度处理下,随处理时间的延长,发芽率呈下降趋势,但24 h处理下的种子因浸泡作用使得发芽率在0.05%、0.11%和0.14%水平又有所升高(图2),各浓度水平短时间处理(6 h)与长时间处理(20 h)发芽率差异显著(P<0.05)。氟乐灵处理的沙芦草种子发芽率随浓度的升高无规律性变化(图3),各浓度处理的平均发芽率均低于40%,其中,15 μmol·L-1氟乐灵处理后的沙芦草种子平均发芽率最高,为33.11%,且该浓度下不同时间处理之间差异显著(P<0.05),1、5、20 μmol·L-1浓度水平不同时间处理差异不显著(P>0.05)。
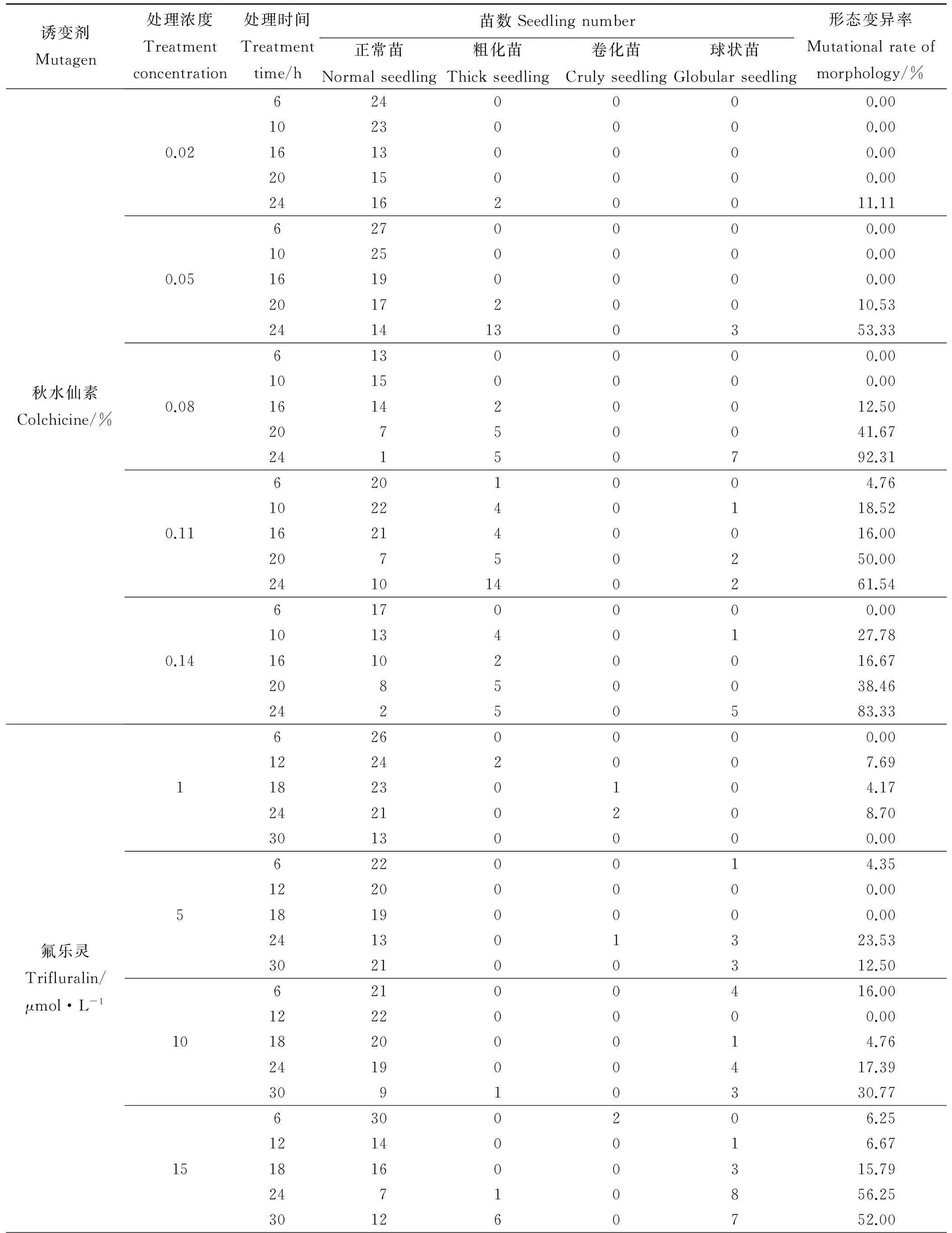
表1 秋水仙素和氟乐灵处理后不同变异苗形态比较统计结果
续表1

诱变剂Mutagen处理浓度Treatmentconcentration处理时间Treatmenttime/h苗数Seedlingnumber正常数Normalseedling粗化苗Thickseedling卷化苗Crulyseedling球状苗Globularseedling形态变异率Mutationalrateofmorphology/%氟乐灵Trifluralin/μmol·L-1206210014.5512220014.3518130017.14241400630.0030710856.25

图1 不同变异幼苗形态
注:a,正常幼苗形态;b,粗化幼苗形态;c,卷曲幼苗形态;d,球状幼苗形态;e,正常幼茎形态;f,粗化苗幼茎形态;g,卷曲苗幼茎形态;h,球状苗幼茎形态;i,正常幼根形态; j,粗化苗幼根形态;k,卷曲苗幼根形态;l,球状苗幼根形态。
Note: a, Normal seedling morphology; b, Thick seedling morphology; c, Cruly seedling morphology; d, Globular seedling morphology; e, Normal young stem morphology; f, Thick young stem morphology; g, Cruly young stem morphology; h, Globular young stem morphology; i, Normal radicle morphology; j, Thick radicle morphology; k, Cruly radicle morphology; l, Globular radicle morphology.

图2 秋水仙素浓度和处理时间对沙芦草发芽率的影响
注:不同小写字母表示相同浓度不同处理时间之间差异显著(P<0.05)。下同。
Note:Different lower case letters for the same concentration indicate significant difference among different treatment time at 0.05 level.The same below.
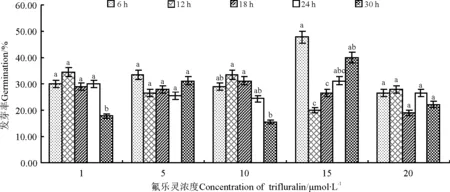
图3 氟乐灵浓度和处理时间对沙芦草发芽率的影响
2.3两种诱变剂对沙芦草苗高和根长的影响
两种诱变剂对沙芦草种子第10天的苗高与根长的生长有抑制作用(图4,图5),且秋水仙素的抑制作用大于氟乐灵,说明秋水仙素毒性更强。随秋水仙素浓度的增大,第10天平均苗高和根长总体变化较小,处理24 h的种子,除0.02%和0.11%水平外,其他浓度处理苗高均显著减小;各浓度处理的种子苗高与根长均显著小于对照。经氟乐灵处理的沙芦草种子第10天苗高与根长随浓度的升高均呈下降趋势,除1 μmol·L-1的氟乐灵处理6 h的种子苗高和根长大于对照外,其他各处理水平下的苗高和根长均低于对照,且浓度越高,抑制作用越大,苗高与根长值越小;1和5 μmol·L-1浓度下,不同处理时间苗高与根长的变化较小,10、15、20 μmol·L-1浓度下不同处理时间苗高和根长变化较大,说明浓度越大,对种子萌发后的生长影响越大。
2.4两种诱变剂对沙芦草种子发芽率、苗高及根长影响的方差分析
为判断诱变剂浓度和处理时间单个因素的影响水平和两因素之间的交互作用,用SAS软件进行方差分析(表3),结果显示诱变剂的浓度和处理时间对沙芦草的发芽率、苗高与根长有不同程度的影响。秋水仙素的浓度对沙芦草的平均发芽率、苗高和根长无显著影响(P>0.05),不同时间处理对平均发芽率、苗高和根长均有极显著影响(P<0.01),说明秋水仙素的处理时间是影响发芽率的主要因素,同时秋水仙素处理浓度和时间对发芽率、苗高和根长的影响存在显著交互作用。不同浓度的氟乐灵和不同处理时间下,沙芦草发芽率上均不存在显著差异(P>0.05),但在苗高和根长上存在极显著差异(P<0.01);氟乐灵浓度和时间对发芽率的影响存在交互作用,但对苗高和根长的影响不存在交互作用。
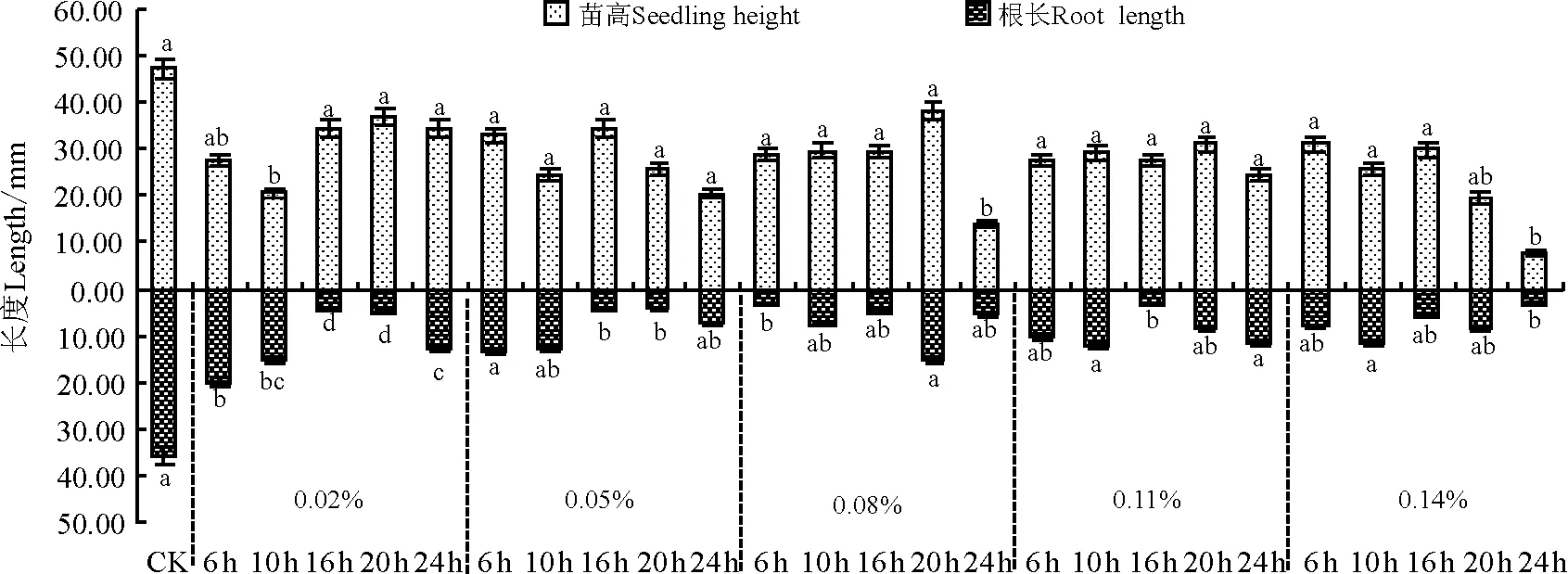
图4 秋水仙素浓度和处理时间对沙芦草第10天苗高与根长的影响
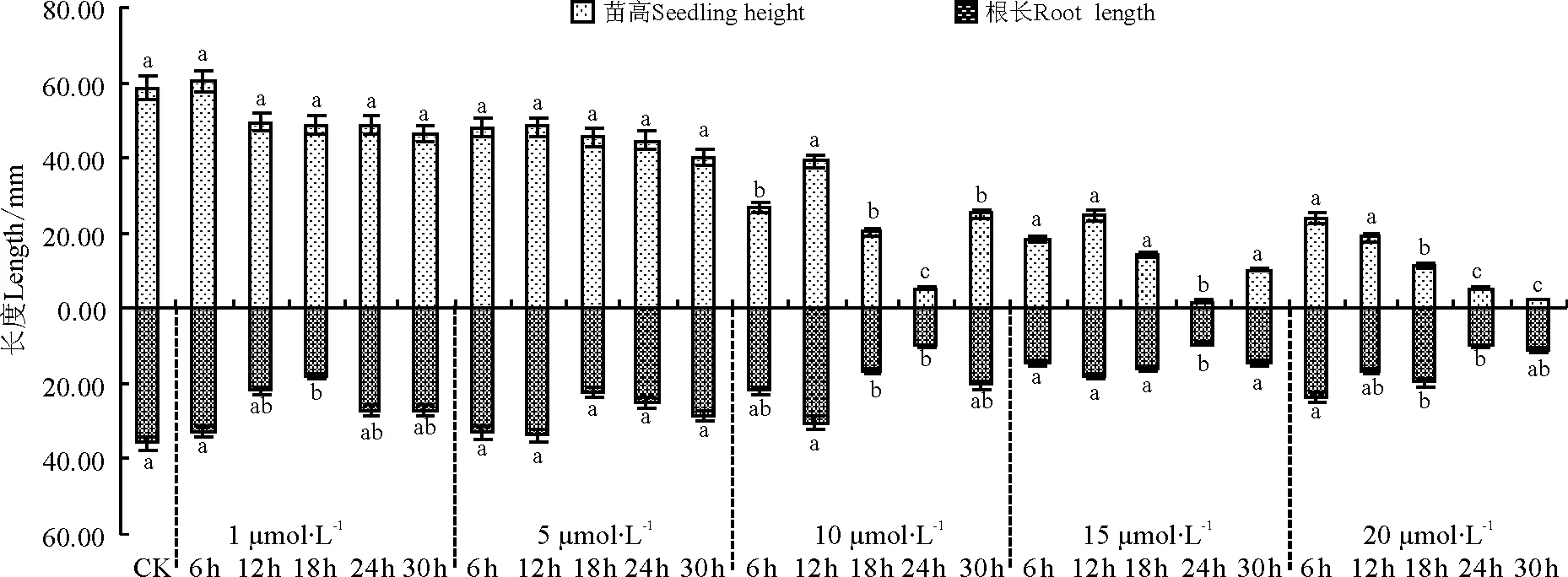
图5 氟乐灵浓度和处理时间对沙芦草第10天苗高与根长的影响
2.5染色鉴定结果及变异统计
2.5.1染色体数目鉴定结果正常二倍体染色体数为2n=14条,加倍后的染色体数为4n=28条,但试验结果中没有成功加倍的四倍体,均为二倍体细胞和四倍体细胞组成的混倍体(图6)。加倍处理后的染色体只在数量上发生了变异,形态上与正常细胞染色体没有差异。
2.5.2秋水仙素对沙芦草成活率与染色体变异率的影响秋水仙素+1.5%二甲基亚砜处理的沙芦草幼苗成活率相对较高,平均成活率达到63.77%,0.11%秋水仙素浸种10 h的处理水平成活率最高,可达到91.43%;各处理的染色体变异率均较低,平均变异率仅为13.30%,0.11%秋水仙素浸种20 h的处理水平变异率最大,为50.00%,整体呈现出高浓度的秋水仙素比低浓度的诱导效果更好(表3)。综合考虑成活率和变异率,0.11%浓度处理20 h的染色体数目变异率最大,高达50%,其成活率为40%,因本试验目的是在不过度影响成活率的基础上得到更高的变异率,因此可将此处理水平暂定为最佳变异处理水平。
2.5.3氟乐灵对沙芦草成活率与染色体变异率的影响氟乐灵处理的种子成活率与变异率变化幅度较大(表3)。随浓度的升高,成活率总体呈下降趋势,其中5 μmol·L-1氟乐灵处理24 h的成活率最高,可达到86.96%,20 μmol·L-1浓度下长时间的处理水平(24和30 h)因其毒害作用过大,幼苗全部死亡;氟乐灵各处理的染色体变异率普遍较低,平均变异率仅为13.05%,最高变异率为38.46%(1 μmol·L-1处理30 h)。综合分析成活率与染色体变异率可知:1 μmol·L-1处理30 h的成活率与变异率都较高,成活率高达81.25%,变异率可达38.46%,初步判断为氟乐灵最佳诱变处理水平。
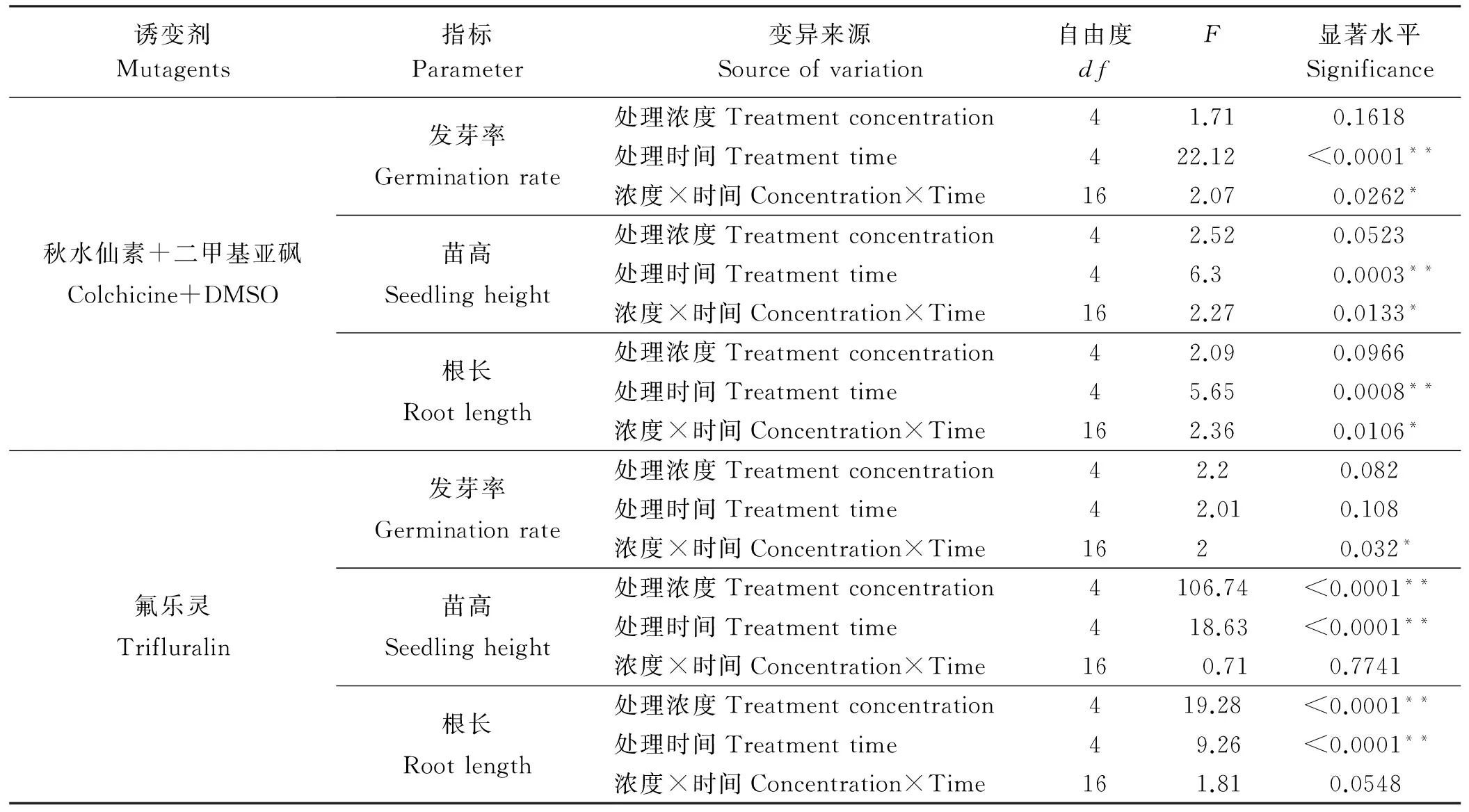
表2 不同诱变剂对沙芦草发芽率、苗高与根长影响的方差分析
注: *表示差异显著(P<0.05),**表示差异极显著(P<0.01),下同。
Note:* indicates significant difference at 0.05 level, **indicates significant difference at 0.01 level. The same below.
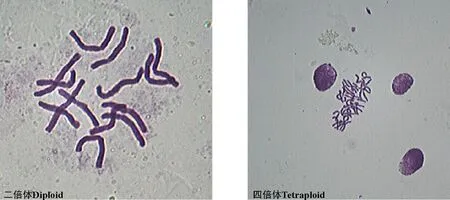
图6 二倍体细胞染色体数和四倍体细胞的染色体数
3讨论与结论
本研究用诱变剂处理萌动种子以得到多倍体植株,因其简单易行,曾被学者们广泛使用,并得到不同的加倍效果。秋水仙素和氟乐灵的加倍原理相似,秋水仙素是与微管蛋白异二聚体结合,抑制微管装配的一种生物碱[14];氟乐灵是一种可以抑制微管形成,诱变率较高、毒性较小的新型除草剂[15],Stadler等[16]和Wan和Widholm[17]也曾研究证实除草剂对植物细胞具有加倍作用。诱变剂只在细胞分裂时期通过抑制纺锤体的形成导致细胞不分裂,从而使染色体数目加倍,对不分裂的成熟细胞没有作用[18],因此,在诱发多倍体的过程中,只是部分细胞加倍,分生组织中的一层、两层或者所有细胞会受到影响,继续发育成为一个混倍体或多倍体细胞系[19],有学者们用秋水仙素处理菘蓝(Isatisindigotica)获得混倍体的加倍植株而非多倍体植株[20]。植物混倍体是不稳定的,它是繁殖过程中出现的新植株类型[21],所以混倍体植株是由二倍体诱导四倍体植株加倍成功的标志,本研究所得植株也均为混倍体植株,可以为培育沙芦草新品种提供材料基础。
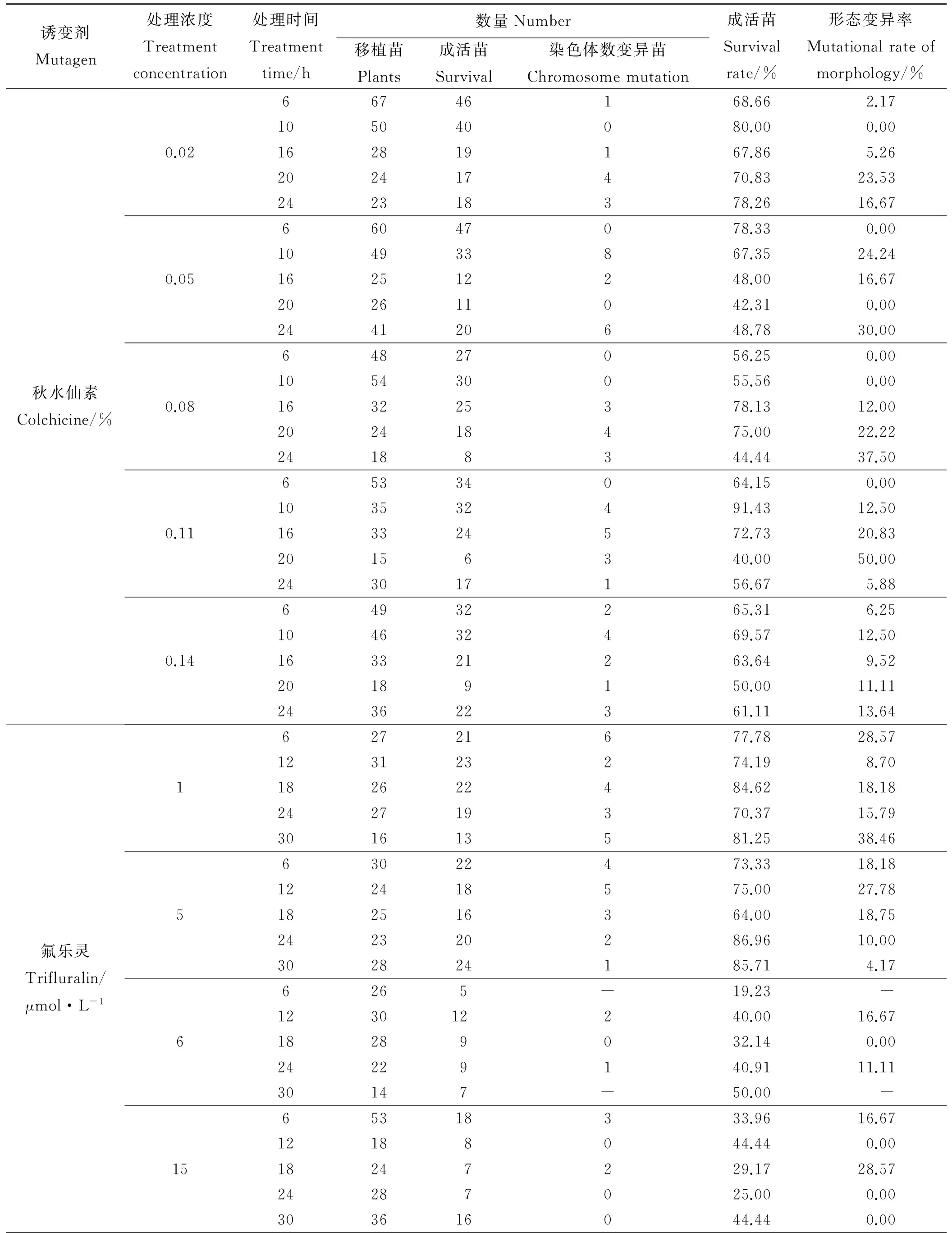
表3 秋水仙素和氟乐灵处理沙芦草种子变异率统计
续表3
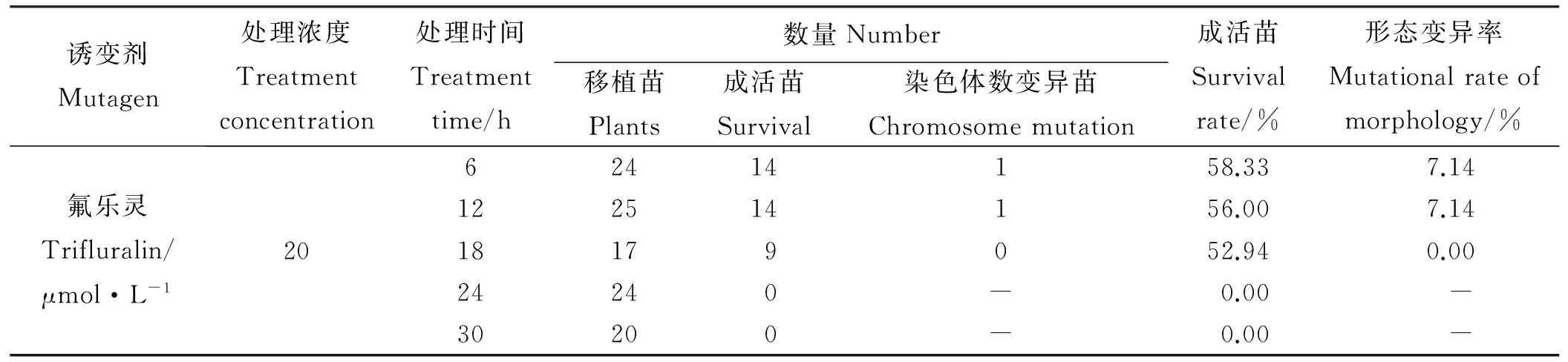
诱变剂Mutagen处理浓度Treatmentconcentration处理时间Treatmenttime/h数量Number移植苗Plants成活苗Survival染色体数变异苗Chromosomemutation成活苗Survivalrate/%形态变异率Mutationalrateofmorphology/%氟乐灵Trifluralin/μmol·L-12062414158.337.14122514156.007.1418179052.940.0024240-0.00-30200-0.00-
两种试剂相比,微量氟乐灵就可达到加倍效果,因此更受到研究者的青睐。同时不同植物对不同试剂浓度与处理时间的敏感度不同,因此,要根据不同植物设计不同的处理水平。魏育国和蒋菊芳[22]用400倍的氟乐灵处理萌动的甜瓜(Cucumismelo)种子8 h可使诱变率高达32.2%;葛志东等[23]用浸种法和生长点滴液法处理西葫芦(Cucurbitapepo)种子,诱变率可达到20%;赵晓潘[24]用20 μmol·L-1氟乐灵溶液处理半枝莲(Scutellariabarbata)枝条,变异率达到64.7%;张竞秋等[25]研究发现氟乐灵会使小麦(Triticumaestivum)根尖细胞发生畸变。本研究沙芦草变异植株的统计结果显示:0.11%的秋水仙素+1.5%二甲基亚砜处理20 h的染色体数目变异率最大,高达50%,其成活率为40%;1 μmol·L-1的氟乐灵处理30 h的成活率与变异率都较高,成活率高达81.25%,染色体数目变异率可达38.46%,因此可以初步确定为最佳处理水平。
此外,通过对发芽率、苗高与根长以及成活率的综合统计分析,发现两种诱变剂主要抑制沙芦草的生长,但所抑制的阶段有所不同,秋水仙素主要抑制种子的萌发及初期的伸长生长,表现为发芽率低,苗高与根长值相对较小;而氟乐灵显著降低后期的成活率,其原因有待进一步进行生理生化试验来证实。
参考文献References:
[1]周璐璐,伏兵哲,许冬梅,陈丽萍,吴小娟,高雪芹.盐胁迫对沙芦草萌发特性影响及耐盐性评价.草业科学,2015,32(8):1252-1259.
Zhou L L,Fu B Z,Xu D M,Chen L P,Wu X J,Gao X Q.Effects of salt stress on germination characteristics ofAgropyronmongolicumand salt-tolerance evaluation.Pratacultural Science,2015,32(8):1252-1259.(in Chinese)
[2]《中国植物志》编委会.中国植物志.北京:科学出版社,1987.
Editoril Committee of Chinese Journal of Plant.Flora of China.Beijing:Science Press,1987.(in Chinese)
[3]《内蒙古植物志》编委会.内蒙古植物志.呼和浩特:内蒙古人民出版社,1994:139.
[4]云锦凤,张众,于卓,解新民,包金刚.蒙古冰草新品系的选育.中国草地,2005,27(6):7-12.
Yun J F,Zhang Z,Yu Z,Xie X M,Bao J G.A New strain breeding of mongolia wheatgrass.Grassland of China,2005,27(6):7-12.(in Chinese)
[5]云锦凤,米福贵.冰草属分类学研究的历史回顾.中国草地,1989,11(2):3-7.
[6]高卫华,云锦凤,杨静,韩文生.冰草属牧草营养器官解剖学研究.内蒙古草业,1990(4):19-22.
[7]孙启忠.四种冰草幼苗抗旱性的研究.中国草地,1991,13(3):29-32.
Sun Q Z.A study on drought research of four specise seeding ofAgropyron.Grassland of China,1991,13(3):29-32.(in Chinese)
[8]解新明,云锦风,高艳春,卢小良,李秉滔.蒙古冰草外稃微形态特征的变异式样.植物研究,2002,22(2):168-171.
Xie J M,Yun J F,Gao Y C,Lu X L,Li B T.Variation patterns on micro-morphologiccal characteristics of lemmas ofAgropyronmongolicum.Bulletin of Botanical Research,2002,22(2):168-171.(in Chinese)
[9]云锦凤,米福贵.干旱地区一种优良禾草——蒙古冰草.内蒙古草业,1990(2):70-71.
[10]于肖夏,姜志艳,于卓,马艳红,云锦凤,苏和,张志成.四倍体杂交冰草新品种——蒙杂冰草1号的选育.草业科学,2015,32(5):738-744.
Yu X X,Jiang Z Y,Yu Z,Ma Y H,Yun J F,Su H,Zhang Z C.The new variety breeding of tetraploid hybrid wheatgrass— Mengza No.1.Pratacultural Science,2015,32(5):738-744.(in Chinese)
[11]云锦凤,米福贵.冰草属牧草的种类与分布.中国草地,1989,11(3):14-17.
[12]代西梅,黄群策.植物多倍体研究进展.河南农业科学,2005(1):9-11.
Dai X M,Huang Q C.Advance on polyploid in plants.Journal of Henan Agricultural Sciences,2005(1):9-11.(in Chinese)
[13]陶抵辉,刘明月,肖君泽,邓建平.生物多倍体诱导方法研究进展.生命科学研究,2007,11(4):6-13.
Tao D H,Liu M Y,Xiao J Z,Deng J P.Advances in the research on induction means of biopolyploid.Life Science Research,2007,11(4):6-13.(in Chinese)
[14]杨民和,郑重,Jan E L.微管、微丝特异性抑制剂处理对水稻抗病性的影响.植物病理学报,2003,33(2):156-161.
Yang M H,Zheng Z,Jan E L.Effects of cytoskeleton inhibitors on defense responses of rice toMagnaporthegrisea.Acta Phytopathologica Sinica,2003,33(2):156-161.(in Chinese)
[15]张锡庆,吴红芝,周涤,郑思乡.新型除草剂Oryzalin的浓度和处理时间对诱导彩色马蹄莲多倍体的影响.云南农业大学学报,2008,23(6):806-810.
Zhang X Q,Wu H Z,Zhou D,Zheng S X.Effects of the new herbicide-oryzalin’s concentration and time duration on inducing polyploidy of colouredZantedeschiaaethiopica.Journal of Yunnan Agricultural University,2008,23(6):806-810.(in Chinese)
[16]Stadler J,Phillips R,Leonard M.Mitotic blocking agents for suspension cultures of maize’Black Mexican Sweet’cell lines.Genome,1989,32(3):475-478.
[17]Wan Y,Widholm J M.Effect of chromosomes doubling agents on some clonal variation in the progeny of doubled haploids of maize.Plant Beed,1995,114(3):253-255.
[18]彭静,魏岳荣,熊兴华.植物多倍体育种研究进展.中国农学通报,2010,26(11):45-49.
Peng J,Wei Y R,Xiong X H.Polyploid induction of plant research summary.Chinese Agricultural Science Bulletin,2010,26(11):45-49.(in Chinese)
[19]李天菲,蔡得田.植物嵌合体机理及研究进展.湖北大学学报:自然科学版,2002,24(1):81-86.
Li T F,Cai D T.Studies on mechanism and research progress of plant chimera.Journal of Hubei University:Natural Science Edition,2002,24(1):81-86.(in Chinese)
[20]刘丽萍.菘蓝离体再生体系的建立及多倍体诱导.大庆:黑龙江八一农垦大学硕士学位论文,2008.
Liu L P.Fast propagation and polyploidy induction ofIsatisindigoticaFort.Master Thesis.Daqing:Heilongjiang Bayi Agricultural University,2008.(in Chinese)
[21]李明银,何云晓.植物遗传嵌合体及其在观赏植物育种中的应用.植物学通报,2005,22(6):641-647.
Li M Y,He Y X.Plant chimeras and application in the breeding of the ornamental plant.Chinese Bulletin of Botany,2005,22(6):641-647.(in Chinese)
[22]魏育国,蒋菊芳.氟乐灵诱导甜瓜四倍体研究初探.华北农学报,2006,21(S1):73-76.
Wei Y G,Jiang J F.The preliminary explore on induction of tetraploidinMuskmelonwith trifluralin.Acta Agriculturae Boreali-Sinica,2006,21(S1):73-76.(in Chinese)
[23]葛志东,李海真,王惠林,许利彩.氟乐灵诱导西葫芦染色体加倍研究.中国农学通报,2009,25(8):215-218.
Ge Z D,Li H Z,Wang H L,Xu L C.The research on induction of pumpkin chromosome doubling with trifluralin.Chinese Agricultural Science Bulletin,2009,25(8):215-218.(in Chinese)
[24]赵晓潘.氟乐灵离体诱导半枝莲多倍体的研究.南京:南京师范大学硕士学位论文,2013.
Zhao X P.In vitro induction of polyploidy inScutellariabarbataD.Don.by trifluralin.Master Thesis.Nanjing:Nanjing Normal University,2013.(in Chinese)
[25]张竞秋,李卓,李海婴.除草剂氟乐灵对小麦根尖细胞有丝分裂的影响.植物研究,2008(5):552-555.
Zhang J Q,Li Z,Li H Y.The influence of trifluralin on mitosis of wheat root cells.Bulletin of Botanical Research,2008(5): 552-555.(in Chinese)
(责任编辑王芳)
Effects of chemical mutagens on chromosome doubling ofAgropyronmongolicum
Zhou Lu-lu1,2, Fu Bing-zhe1,2, Xu Dong-mei1,2, Gao Xue-qin3
(1.Grassland Science Institute, Agricultural College, Ningxia University, Yinchuan 750021, China;2.Breeding Base for State Key Labotatory of Land Degradation and Ecological Restoration in Northwest China, Ningxia University, Yinchuan 750021, China;
3.Science and Technology Department, Ningxia University, Yinchuan 750021, China)
Abstract:In order to improve the forage quality of Agropyron mongolicum and screen the best chromosome doubling treatment, the seeds of A. mongolicum were treated with different concentrations of Colchicine (0.02%,0.05%,0.08%,0.11%,0.14%+1.5% DMSO) and Trifluralin (1,5,10,15,20 μmol·L-1) and the morphology and chromosome number were identified after treatment. The results showed that the surviving plants after treated were mixoploid of diploid and tetraploid. The treatment with 0.11% colchicine 1.5% DMSO for 20 h had the highest mutation rate of 50% and the survival rate of 40%. The treatment with 1 μmol·L-1trifluralin for 6 h had significant mutation effect with probability of 38.46%. These results provide theoretical and experimental basis for further screening the chromosome doubling plants of A. mongolicum.
Key words:Agropyron mongolicum; mutagen; chromosome doubling; ploidy identification
DOI:10.11829/j.issn.1001-0629.2015-0519
*收稿日期:2015-09-16
基金项目:宁夏高等学校科学研究项目(NGY2013026);宁夏自然科学基金(NZ2013030); 宁夏牧草育种专项子课题(2014NYYZ040101)
通信作者:高雪芹(1984-),女,甘肃白银人,讲师,博士,主要从事牧草种质资源和遗传育种研究。Email:qinqin_803@sina.com
中图分类号:S540.3;Q945.5
文献标志码:A
文章编号:1001-0629(2016)5-0897-10*1
Corresponding author:Gao Xue-qinEmail:qinqin_803@sina.com
周璐璐,伏兵哲,许冬梅,高雪芹.两种化学诱变剂对沙芦草染色体的加倍效果.草业科学,2016,33(5):897-906.
Zhou L L,Fu B Z,Xu D M,Gao X Q.Effects of chemical mutagens on chromosome doubling ofAgropyronmongolicum.Pratacultural Science,2016,33(5):897-906.
接受日期:2015-12-08
第一作者:周璐璐(1990-),女,河北沧州人,在读硕士生,主要从事牧草种质资源和遗传育种研究。Email:zll_19901211@126.com
