PLGA-TPGS负载α-TIF-siRNA纳米粒对疱疹病毒1的抑制作用
2016-06-08杨成明王可斌
杨成明 王可斌
·论著·
PLGA-TPGS负载α-TIF-siRNA纳米粒对疱疹病毒1的抑制作用
杨成明王可斌
【摘要】目的研究以PLGA-TPGS生物可降解材料为载体包载α-TIF-siRNA的纳米粒对HSV1的抑制作用。方法以PLGA-TPGS为载体,采用双乳蒸发法制备包载α-TIF-siRNA的PLGA-TPGS纳米粒(命名为PLGA-TPGS/α-TIF-siRNA NPs),并对其进行表征,包括粒径大小、zeta电位、包封率和释放率,用MTT法检测纳米粒对上皮细胞和HeLa细胞的细胞毒作用,免疫荧光观察纳米粒在细胞内的释放,用空斑实验研究体外研究纳米粒对HSV1病毒的抑制作用。结果PLGA-TPGS/α-TIF-siRNA NPs的粒径大小为(257±2.94) nm,zeta电位为(-31.25±1.70) mV,siRNA的包封率为(56.23±3.68)%,纳米释放siRNA呈双相,即在96 h释放达到50%,之后呈缓慢释放,用MTT法分析PLGA-TPGS/α-TIF-siRNA NPs对原代角质形成细胞和HeLa细胞几乎无细胞毒性。荧光显微镜能观察纳米粒siRNA细胞内释放。PLGA-TPGS/α-TIF-siRNA NPs能明显延长抑制感染HeLa细胞的HSV1。结论PLGA-TPGS纳米粒可以作siRNA的载体。PLGA-TPGS/α-TIF-siRNA NPs在体外对HSV1病毒具有明显的抑制作用,可以成为治疗HSV1-诱导的角膜炎在内的相关疾病的候选药物。
【关键词】单纯疱疹病毒1(HSV1);α基因反式诱导因子(α-TIF);纳米粒,siRNA
项目来源:广东省医学科研基金项目(编号:A2013616);广东省深圳市创新委知识创新计划项目(编号:JCY20130327094102249,JCY20140411091643396)
单纯疱疹病毒1(HSV1)是双链DNA病毒,是一种重要的病原体,常导致慢性感染、潜伏感染,在一定条件下重新激活而复发。HSV1感染可引起不同临床症状,包括无症状的感染、唇疱疹、角膜炎等。HSV1感染是致盲的重要原因。在HSV1感染细胞中,极早(IE或α)基因表达被α基因反式诱导因子(alphagene trans-inducing factor,α-TIF)反式激活[1-3]。HSV-αTIF含2个不同的原件:一个和Oct-1和CFF结合,有助于结合TAATGARAT基序,另一个则被赋予转录激活。由于HSV1的感染反复发作,现有的核苷类药物常常产生药物耐受,因此,寻求新的治疗方法非常必要。siRNA沉默常导致基因表达减少,可以作为新型药抑制剂,但siRNA本身难以进入细胞,需要载体,这可能导致对机体的毒副作用。纳米载体因其制备简单、高效,较病毒性载体等相对安全,毒副作用低,无免疫原性和具有缓释作用受到广泛关注。我们曾用PLGA-TPGS负载地塞米松治疗结节型角膜炎,实验证明较地塞米松眼药具有滞留时间长,治疗效果较好的特点[4]。在本研究中,我们以PLGA-TPGS作为载体制备含α-TIFsiRNA的PLGA-TPGS纳米粒,对其进行表征,包括粒径大小、zeta电位、包封率、稳定性等,在体外研究包载α-TIF siRNA的PLGA-TPGS纳米粒对HSV1的抑制作用,为HSV1感染导致的相关疾病提供一种候选药物制剂。
1 材料与方法
1.1材料与试剂PLGA-TPGS共聚体由清华大学深圳研究生院梅林教授提供。Poly (vinyl alcohol) (PVA;80%水化),3-(4,5-dimethylthiazol-2-yl) -2,5-diphenyl-2H-tetrazolium bromide (MTT )购自Sigma-Aldrich (St.Louis,MO,USA)。4’,6-Diamidino-2-phenylindole dihydrocloride(DAPI)购自VECTOR(Burlingame,CA,USA),RPMI培养基购自Gibco公司,胎牛血清(FBS)购自杭州四季青生物公司,HSV1病毒由中国科学院武汉病毒研究所提供,其他试剂均为分析纯试剂。HeLa细胞和Vero细胞购自武汉大学典型物种保存中心。未标记的和用荧光FAM标记的α-TIF-siRNA序列由上海吉玛公司设计并合成。其序列为:正链:5’-CGCUAUGUACCAUGCUCGAUATT-3’,反意义链:5’-UAUCGAGCAUGGUACAUAGCGTT-3’。Mock siRNA由吉玛公司提供。
1.2方法
1.2.1负载siRNA的PLGA-TPGS纳米粒的制备:采用双乳蒸发法制备负载siRNA的PLGA-TPGS纳米粒。简单描述如下:溶于DEPC-处理的20 μmol/L siRNA 50 μl用含5 mg的PLGA-TPGS 250 μl的二氯化碳(CH2Cl2)通过超声乳化60 s,获得油包水的乳液,然后加入1 ml 2% (W/V) PVA,混合物超声12次(超声5 s停止5 s),形成水-油-水(w1/o/w2)双乳液。接着用5 ml 2% (w/v) PVA稀释,并在室温下搅拌1.5 h,蒸发二氯化碳。最后,纳米悬液在4℃以18 000 g离心15 min,用6 ml无RNase水洗2次,除去PVA和未游离的siRNA,真空冷冻干燥。Mock-siRNA的PLGATPGS纳米粒的制备同上。
1.2.2纳米粒的鉴定:用动态光散射仪(dynamic light scattering,DLS,Zetasizer Nano ZS90,Malvern Instruments Ltd.,Malvern,UK)检测纳米粒的粒径大小。1 mg纳米粒以0.5 mg/ml的浓度溶解在DEPC-处理的去离子水中。纳米粒的zeta电位用激光多普勒技术检测(Zetasizer Nano ZS90)。纳米粒用去离子水稀释确保纳米粒的zeta电位在低离子强度下能准备被鉴定。多聚体的最终浓度为1 mg/ml。用扫描电镜检测纳米粒的形态学(SEM)。所有测量重复3次。
1.2.3评估包载siRNA的纳米粒的包封效率:负载siRNA纳米粒的包封效率是指被包载在纳米粒内的siRNA占最初加入的总siRNA的百分比。1 mg在250 μl氯仿中加入500 μl TE缓冲液,然后在室温下旋转30 min,在4℃以18 000×g离心20 min从有机相提取siRNA进入水相。用UV分光光度计260 nm处检测siRNA的浓度。
1.2.4体外释放实验:大约负载siRNA的PLGATPGS纳米粒1 mg悬在1 ml pH值7.4以DEPC处理的PBS缓冲液,37℃在漩涡器上以100 r/min。在指定的时间点上,在4℃以12 000 r/min离心20 min除去上清,纳米粒再用缓冲液重悬。上清中的siRNA用UV紫外分光光度计在260 nm检测。
1.2.5细胞培养:原代角质形成细胞的培养。包皮放置于含有庆大霉素浓度为(20 μg/ml)的DPBS(不含Ca2 +和Mg2 +)冲洗液中约1 h,包皮剪成2~4块并转移到含25.0 U/ml中性蛋白酶的DBPS中18 h,角质形成细胞的表皮层从真皮层分离下来后,转移到加有5~10 ml 0.05%胰蛋白酶-EDTA的60 mm有盖培养皿中,在36℃孵育约15 min,在这个过程中,每2~3分钟使用2 ml的移液管吹打以帮助细胞解离。胰蛋白酶活性使用10 ml大豆胰蛋白酶抑制剂(Cat.No.17075) (10 mg/ml)终止。细胞悬液转移到15 ml无菌离心管,在室温下40 g离心5 min后,去上清,用DMEM培养基重悬细胞。以3×106细胞接种到75 cm2组织培养瓶中,加入DMEM完全培养基,置于37℃5% CO2培养箱中培养。HeLa细胞的培养按照常规细胞的方法进行。
1.2.6包载荧光标记siRNA的PLGA-TPGS纳米粒的荧光显微镜下的观察:HeLa细胞以每孔2×105每孔接种在6孔细胞培养板上,在37℃5% CO2培养24 h。为了观察标记的siRNA被细胞摄取,把包载荧光FAM标记siRNA的纳米粒加入到培养的细胞后继续培养,在不同时间点用荧光显微镜观察纳米粒被细胞摄取和siRNA的释放。细胞用PBS洗涤3次,用4%甲醛室温下固定20 min。细胞核用DAPI室温下避光染色5 min,然后用荧光显微镜观察(Fluoview FV-1 000,Olympus Optical Co.,Ltd.,Tokyo,Japan)。
1.2.7纳米粒对细胞的细胞毒作用:用MTT方法检测检测纳米粒在不同浓度下对原代培养的角质形成细胞和HeLa细胞的细胞毒作用。简单地说,以每孔1× 104细胞接种在96-细胞培养板中培养,孵育24 h。然后用不同浓度的裸siRNA,空纳米粒和siRNA-αTIFPLGA-TPGS纳米粒(5 μg/ml)加到细胞培养孔中,每个浓度3个复孔。24 h后,每孔中加入20 μl MTT (5 mg/ml)水溶液,继续培养4 h,然后除去培养基,加入100 100 μl DMSO溶解MTT。细胞活性通过检测490 nm的吸光度。
1.2.8HSV-1感染培养的单层细胞:HeLa细胞以104细胞/cm2的密度接种在35 mm的培养皿,细胞长到75%汇合。除去培养基,用1×PBS洗涤单层。HSV-1用含2%的胎牛血清稀释后以0.2感染复数(moi)感染细胞,在37℃孵育2 h后,除去培养基,用含10%胎牛血清的新鲜培养基替换继续培养。第2天加入纳米粒αTIF-siRNA-loaded-PLGA-TPGS (5 μg/ml),Mock-siRNA-loaded-PLGA-TPGS(5 μg/ml),无环鸟苷(ACV,1 μg/ml)到HSV1感染的细胞培养物中,以HSV1感染细胞和未感染细胞为对照,加药后的第3天和第5天从感染的上清液收集子代病毒,580 g 15 min离心除去细胞碎片。用空斑实验检测病毒滴度。病毒的空斑实验采用的细胞为Vero细胞,操作按照病毒学实验手册。
1.3统计学分析应用SPSS 16.0统计软件,计量资料以±s表示,采用t检验,P<0.05为差异有统计意义。
2 结果
2.1纳米的鉴定我们以前用合成的PLGA-TPGS能够制备负载地塞米松纳米粒,并证明PLGA-TPGS/ DEX纳米粒能够对兔后段疾病的治疗效果优于单纯的地塞米松[4]。在本研究中,我们尝试用PLGA-TPGS为材料,采用双乳蒸发法制备负载siRNA的PLGATPGS纳米粒。我们对其进行了表征。用DLS测其粒径大小分别为:空纳米粒(183.56±1.75) nm,siRNA-loaded PLGA-TPGS纳米粒为(257±2.94) nm。空纳米粒的zeta电位为(-20.57±1.48) mV,siRNA-loaded PLGA-TPGS纳米粒zeta电位为(-31.25±1.70) mV,差异有统计学意义(X2值分别为0.429、0.318,P<0.05)。扫描电镜分析表明siRNA-loaded PLGA-TPGS纳米粒呈球形,大小较为均一,表面较光滑,用电镜检测的siRNA-loaded PLGA-TPGS纳米粒同DLS的检测结果较为一致。见表1,图1。

图1 扫描电镜观察siRNA-loaded PLGA-TPGS纳米粒的形态和大小
表1 2组siRNA-loaded PLGA-TPGS纳米粒比较±s

表1 2组siRNA-loaded PLGA-TPGS纳米粒比较±s
组别 粒径大小(nm) (n=5)多分散性(n=5)载药量(%)包封率(%) Zeta电位(mV) (n=5) A组183.56±1.75 0.135 0 0 -20.57±1.48 B组 257.00±2.94 0.269 4.32±0.78 56.23±3.68 -31.25±1.70
2.2体外释放siRNA-loaded PLGA-TPGS的体外释放在PBS缓冲液(pH值7.4)中进行研究。在不同时间点0、6、12、24、48、72、96、120、144和168 h在260 nm用紫外分光光度计检测siRNA的释放。在第96 h pH值7.4 siRNA的释放率为(52.30±3.06)%,随后几天释放平缓。见图2。

图2 siRNA-loaded PLGA-TPGS在体外pH值7.4的PBS中的释放
2.3荧光显微镜观察用荧光显微镜观察纳米粒被细胞摄取后siRNA在细胞内的释放。FAM荧光标记的siRNA纳米粒加入到细胞培养基中后6 h没有观察到荧光,但12 h后siRNA-loaded PLGA-TPGS纳米粒中释放的siRNA在细胞内可以观察到,到72 h细胞内荧光强度继续增加。荧光主要集中在核周胞质中。见图3。
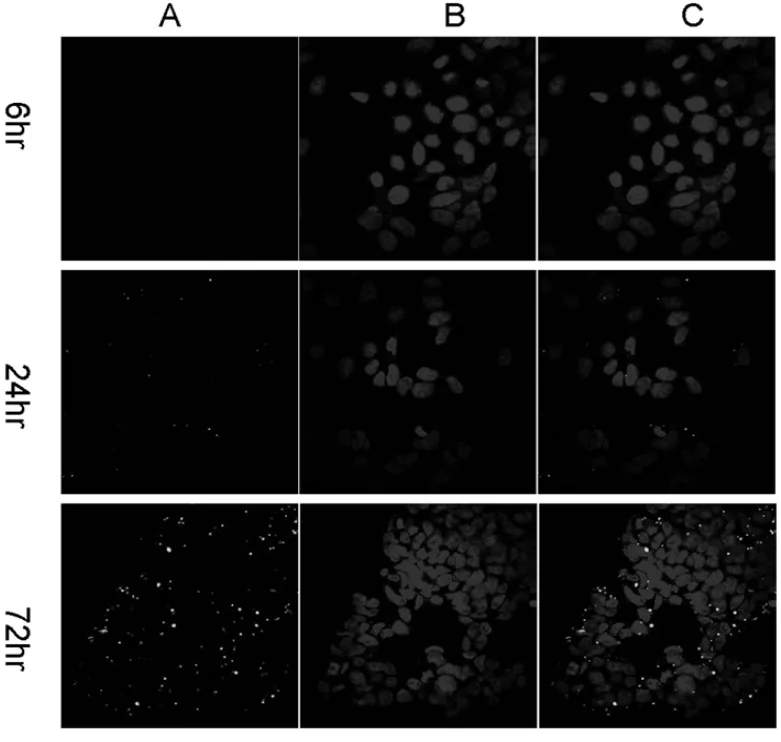
图3 siRNA-loaded PLGA-TPGS纳米粒在HeLa细胞中不同时间的释放; A直接在荧光显微镜观察标记FAM-siRNA,B用DAPI染料染细胞核,C将A和B汇合的结果
2.4细胞活性分析用MTT实验检测siRNA-loaded PLGA-TPGS纳米粒对细胞的细胞毒。siRNA-loaded PLGA-TPGS纳米粒(5 μg/ml)在24 h和72 h对原代角质形成细胞和HeLa细胞几乎无细胞毒,mock-siRNA-PLGA-TPGS纳米粒和PLGA-TPGS空纳米粒也呈类似的趋势。这表明生物可降解材料PLGA-TPGS对细胞毒性非常弱。见图4。

图4 纳米粒对原代角质形成细胞和HeLa细胞的24 h和72 h细胞毒作用
2.5α-TIFsiRNA-loaded PLGA-TPGS纳米粒对HSV1病毒的抑制作用为了观察α-TIFsiRNA-loaded PLGA-TPGS纳米粒对HSV1的抑制作用。首先我们以感染复数(moi)为0.2的HSV1感染单层细胞后12 h,以不同浓度的纳米粒加到培养液中,以PBS作为空白对照,在第3天和第5天收集培养上清,再用空斑形成实验检测HSV1的病毒量。同预期的一致,PBS、空纳米粒和mock-siRNA-PLGA-TPGS纳米粒在各个浓度对HSV1没有抑制作用。α-TIFsiRNA-loaded PLGA-TPGS纳米粒较PLGA-TPGS/Mock纳米粒明显具有HSV1的抑制作用(t=0.324,P<0.01)。在HSV1感染的前3 d无环鸟苷对HSV1抑制较为显著,但后来的3 d抑制作用减弱。而α-TIFsiRNA-loaded PLGA-TPGS纳米粒对HSV1的抑制前3 d没有无环鸟苷显著,第5天对HSV1的抑制作用较无环鸟苷强,可能因为纳米粒的缓释作用。见图5、6。

图5 空斑实验A,未感染的Vero细胞; B.HSV1感染的Vero细胞; C.无环鸟苷(2 μg/ml)处理的HSV1感染的Vero细胞; D.PLGATPGS/Mock纳米粒处理的HSV1感染的Vero细胞; E.PLGATPGS/α-TIF siRNA纳米粒处理的HSV1感染的Vero细胞

图6 用空斑实验定量各处理因素对HSV1病毒的影响
3 讨论
HSV感染细胞的病毒基因表达通过即早或者HSV-αTIF结合α基因启动子反式激活启动[5]。HSV-aTIF的C末端含一个已鉴定的激活结构域,可以和TFIIB、TAFII40和复合物的其他成员接触加快转录复合物的组装[6-10]。
在α疱疹病毒亚科的几个成员,包括HSV-2[11,12]、EHV-1[13]和EHV[14]、Marek病病毒[15]、VZV[16]和BHV-1[17]存在HSV-αTIF的同源性。除了HSV-2-αTIF外,在C末端没有一个和HSV-αTIF有明显的同源性。尽管有这些差异,但所有αTIF蛋白能反式激活α基因启动子。HSV-αTIF的N末端存在惟一和其他αTIFs同源域,具有非独立的反式激活能力; HSV-αTIF完全依赖它的C末端。Wu等[18]通过研究表明αTIF缺乏激活结构域,可以结合Oct-1后结合在TAATGARAT基序。因此,HSV-αTIF可以作为药物作用的候选靶标。因为尚未报道靶向HSV-αTIF的小分子化合物,而且现有证据表明HSV1临床分离株对这些小分子化合物,如ACV,产生耐受[19]。SiRNA能够激活内源性RNA干扰途径,介导序列特异的基因沉默。但是,裸siRNA很难进入细胞,而且在体外易于降解,传统的转染试剂毒性大。因此,开发传递siRNA的载体能克服上述siRNA用于临床面临的限制。
在我们以前的研究中,PLGA-TPGS包载地塞米松的纳米粒的粒径大小为200 nm,zeta电位为-21 mV,治疗眼后段疾病的较地塞米松更显著[4]。在本研究中,我们尝试用PLGA-TPGS作为包载siRNA的载体,我们采用双乳蒸发法成功地制备了α-TIFsiRNA-loaded PLGA-TPGS纳米粒,粒径为257 nm,ζ电位为-31 mV,包封率为56%,这些指征和包载地塞米松的PLGA-TPGS纳米粒不一致,可能因为包载的分子不同,地塞米松是脂溶性,而siRNA是水溶性的,而且带负电荷,这可能导致α-TIFsiRNA-loaded PLGA-TPGS纳米粒较载地塞米松的纳米粒粒径大,电荷也较低,包封率较低。但它们在体外药物释放动力学均呈双相分布,即早期呈爆发性释放,其后呈缓慢释放。扫描电镜观察α-TIFsiRNA-loaded PLGA-TPGS纳米粒呈较为均一分布,表面较为光滑。这些特征证明了我们成功采用双乳蒸发法制备了包载α-TIFsiRNA-loaded PLGATPGS纳米粒。用MTT方法证明了在浓度为5 μg/ml的纳米粒对原代角质形成细胞和HeLa细胞的细胞毒性较弱,表明合成的纳米粒材料PLGA-TPGS对细胞毒性较弱,适合作为药物传递的材料。PLGA-TPGS包载FAM-标记的siRNA纳米粒被细胞摄取后在12 h可以看到荧光,表明纳米粒在细胞内释放了siRNA,更进一步证明了PLGA-TPGS可以作为载体包载siRNA成为纳米粒能在细胞内发挥作用。
在本研究中,我们用PLGA-TPGS为载体包载HSV1 α-TIF siRNA制备纳米粒,为了研究其抗HSV1的功能。HSV1感染HeLa细胞单层后12 h加入纳米粒,结果表明α-TIFsiRNA-loaded PLGA-TPGS纳米粒能够抑制HSV1,并且能够持续较长时间,因为纳米粒对siRNA具有缓释作用。尽管无环鸟苷也能抑制HSV1,但持续时间较短,而且目前HSV1出现了对无环鸟苷的耐受毒株,这限制了无环鸟苷的使用。
总之,我们用PLGA-TPGS共二聚体为载体成功地制备了α-TIFsiRNA-loaded PLGA-TPGS纳米粒,该纳米粒可以较长时间抑制HSV1,这为治疗包括HSV1引起的角膜炎和HSV1相关的疾病提供了候选抗病毒药物。
参考文献
1Batterson W,Roizman B.Characterization of the herpes simplex virion-associated factor responsible for the induction of a genes.J Virol,1983,46:371-377.
2Campbell,MEM,Palfreyman JW,Preston CM.1984.Identi cation of herpes simplex virus DNA sequences which encode a trans-acting polypeptide responsible for stimulation of immediate early transcription.J Mol Biol,1984,180:1-19.
3Preston CM,Cordingley MG,Stow ND.Analysis of DNA sequences which regulate the transcription of a herpes simplex virus imme- diate-early gene.J Virol,1984,50:708-716.
4Yang C,Jiang L,Bu S,Zhang L,et al.Intravitreal administration of dexamethasone-loaded PLGA-TPGS nanoparticles for the treatment of posterior segment diseases.Journal of Biomedical Nanotechnology,2013,9:1617-1623.
5O’Hare P.The virion transactivator of herpes simplex virus.Semin.Virol,1993,4:145-155.
6Choy B,Green MR.Eukaryotic activators function during multiple steps of preinitiation complex assembly.Nature,1993,366:531-536.
7Goodrich JA,Hoey T,Thut CJ,et al.Drosophila TAFii40 interacts with both a VP16 activation domain and the basal transcription factor TFIIB,1993,75:519-530.
8Ingles C,Shales JM,Cress WD,et al.Reduced binding of TFIID to transcriptionally compromised mutants of VP16.Nature,1991,351:588-590.
9Stringer F,Ingles CJ,Greenblatt J.An acidic transcriptional activation domain binds directly and selectively to the TATA-box factor.Nature,1990,345:783-786.
10Walker S,Greaves R,O’Hare P.Transcriptional activation by the acidic domain of Vmw65 requires the integrity of the domain and involves additional determinants distinct from those necessary for TFIIB binding.Mol Cell Biol,1993,13:5233-5244.
11Cress A,Triezenberg SJ.Nucleotide and deduced amino acid sequences of the gene coding virion protein 16 of herpes simplex virus type 2.Gene,1991,103:235-238.
12Greaves RF,O’Hare P.Sequence,function,and regulation of the Vmw65 gene of herpes simplex virus type 2.J Virol,1991,65:6705-6713.
13Purewal AS,Smallwood AV,Kaushal A,et al.Identi cation and control of the cis-acting elements of the immediate early gene of equid herpesvirus type 1.J Gen Virol,1992,73:513-519.
14Purewal AS,Allsopp R,Riggio M,et al.Equid herpesvirus 1 and 4 encode functional homologues of the herpes simplex virus type 1 virion transactivator protein,VP16.Virology,1994,198:385-389.
15Koptidesova DJ,Kopacek W,Zelnik NLJ,et al.Identi? cation and characterization of cDNA clones derived from a Marek’s disease tumour cell-line rp11 encodes a homologue of a-transinducing factor (VP16) of HSV-1.Arch.Virol,1995,140:355-362.
16Greaves RF,and O’Hare P.Sequence,function,and regulation of the Vmw65 gene of herpes simplex virus type 2.J Virol,1991,65:6705-6713.
17Carpenter DE,Misra V.Sequences of the bovine herpesvirus 1 homologue of herpes simplex virus a-trans-inducing factor (UL48).Gene,1992,119:259-263.
18Wu TJ,Mmokian G,Mark OF,et al.Transcriptional activation by herpes simplex virus type 1 VP16 in vitro and its inhibition by oligopeptides.Mol Cell Biol,2014,14:3484 - 3493.
19Nozawa C,Hattori LY,Galhardi LCF,et al.Herpes simplex virus:isolation,cytopathological characterization and antiviral sensitivity.An Bras Dermatol,2014,89:448-452.
Inhibitory effects of alpha-TIF siRNA-loaded PLGA-TPGS nanoparticles on herpesviruses 1
YANG Chengming*,WANG Kebin.*Department of Ophtalmology,Xili People’s Hospital of Nanshan District of Shenzhen City,Guangdong,Shenzhen 518055,China
【Abstract】Objective To investigate the inhibitory effects of alpha-TIF siRNA-loaded PLGA-TPGS nanoparticles on herpesviruses 1(HSV1).Methods The novel biodegradable PLGA-TPGS nanoparticles (NPs) were prepared as a delivery system of small interfering ribonucleic acid (siRNA) targetingα-TIF for inhibiting HSV1,and its characteristics including size,zeta potentials,entrapment rate and in vitro release rate were represented.The cytotoxicity of α-TIF siRNA-loaded PLGA-TPGS nanoparticles on epithelial cells and HeLa cells was examined by MTT assay.The inhibitory effect of thenanoparticleson HSV1 was detected by barren spot assay.Results The size,zeta potential of PLGA-TPGS/α-TIF-siRNA NPs was (257±2.94) nm and (31.25±1.70) mV,respectively.The entrapment rate of siRNA was (56.23±3.68)%,and the in vitro release of NPs displayed biphase kinetics,that is,which reached 50% on 96 hours,then,it was slowly released.The cytotoxicity of PLGA-TPGS/α-TIF-siRNA NPs on primary keratinocytes or HeLa cells was not observed by using MTT assay.The release of SiRNA located in NPs was observed by using fluorescent microscope.PLGA-TPGS/α-TIF-siRNA NPs could inhibit HSV1 replication in HeLa cells.ConclusionPLGA-TPGS nanoparticles can be used as siRNA carrier.PLGA-TPGS/α-TIF-siRNA NPs can inhibit HSV1 replication in vitro,which may become candidate drugs for HSV1 infection -related diseases including keratitis.
【Key words】herpesviruses 1; alpha-gene trans-inducing factor; nanoparticles; siRNA
【中图分类号】R 373.4
【文献标识码】A
【文章编号】1002-7386(2016) 02-0165-05
doi:10.3969/j.issn.1002-7386.2016.02.001
作者单位:518055广东省深圳市南山区西丽人民医院眼科(杨成明);广东省深圳市南山区人民医院泌尿外科(王可斌)
(收稿日期:2015-01-06)
