新型兔出血症病毒研究进展
2016-06-07谭永贵缪秋红吴巧梅郭慧敏刘光清
谭永贵,缪秋红,吴巧梅,朱 杰,郭慧敏,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
新型兔出血症病毒研究进展
谭永贵,缪秋红,吴巧梅,朱 杰,郭慧敏,刘光清
(中国农业科学院上海兽医研究所,上海 200241)
摘 要:兔出血症病毒属于杯状病毒科,兔病毒属的成员之一,能够引起家兔的典型兔病毒性出血症。2010年,研究学者首次在法国发现一例非典型兔出血症疫情,该病原与经典兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV)基因序列差异明显,被称为RHDV2。研究发现该病原能够与经典RHDV发生部分交叉免疫保护,该病原能够感染幼龄家兔而且是唯一一个能够跨物种感染的兔病毒属成员。该病的迅速传播,严重威胁了以兔为中心的生态平衡。目前,该病毒尚未在国内有报道,但是不排除潜在的隐性感染。因此,对该病原的分析研究对于控制该病原的传播具有非常重大的意义。
关键词:新型兔出血症病毒;跨物种;交叉免疫保护
1 新型兔出血症概况
兔出血症病毒(Rabbit hemorrhagic disease virus,RHDV),能够引起家兔的病毒性出血症,是杯状病毒科兔病毒属的一个成员,该属成员包括一些非致病性的兔杯状病毒(Rabbit calicivirus,RCV)以及欧洲褐色野兔综合症(European brown hare syndrome virus,EBHSV),他们与RHDV具有相似的遗传特性,但是亲缘关系较远[1,2]。家兔一般从5~6 w龄开始对RHDV具有敏感性,并在8~9 w时完全易感。1984年,其首次在中国发病并公开报道,该病毒能够引起家兔急性、败血性高度致死性传染病,死亡率接近100%,对养兔业具有毁灭性冲击[3,4];随后欧洲于1986年第一次在意大利爆发[5],紧随以意大利为源头迅速传播,在不到三年的时间几乎传遍了整个欧洲大陆,在欧洲发生疫情的同时,该病在全球范围内也广泛传播[6,7]。
早年的研究报道中,我们发现RHDV相对比较保守,其各国分离的毒株序列差异不大,然而随着时间的发展,1998年在意大利,Capucci等[8]首次发现并报道了RHDV抗原变异株,并命名为RHDVa,随后该变异株在德国也出现[9]。于此在过去的二三十年,RHDV被分为G1-G5以及G6(RHDVa,又名RHDV抗原变异株)6种基因型[10],然而,近几年来,有新型的RHDV变异株出现,这个变异株的在基因序列和抗原特异性上与经典的G1- G6型差异很大[4,11,12],常被称之为RHDVb或RHDV2。
2010年8月份,法国的G.Le-Recule等[13]研究人员在法国西北部兔场检测到一株非典型的兔瘟,为了区分经典兔瘟病毒,被命名为RHDVb或RHDV2,随后该病在欧洲范围迅速传播。2012年,有报道称在西班牙发现一种新型的RHDV能够引起青年兔的死亡,随后在苏格兰又发现同种类型的毒株并将之命名为RHDV2[14],这类新型毒株的出现随之波及到德国、意大利等国家[4,11,12,15,16],2014年下半年在欧洲大陆1000公里以外的亚速尔群岛也检测到了RHDV2[17]的存在。2015年关于该变异株的一株全序列已提交至Genebank(登录号:KM878681),该毒株被命名为RHDV-N11[13],该毒株对比传统的G1-G6毒株,能够导致日龄小于40日龄的幼兔发病,其感染范围广,给国内外的养兔产业造成了威胁。目前在欧洲很多国家有RHDV2取代当地经典RHDV的趋势,这种状况正在扩大;而曾经RHDV肆虐的澳大利亚以及中国还没有公开报道检测到该病的存在,但也不一定排除是否真的已经发生该疫情,需要利用分子生物学检测方法去确认该病原的国内流行情况,以期待能为我国日后兔瘟疾病的防控提供一些参考意见。
2 病原学特征
2.1基因组结构特征 RHDV2为无囊膜,病毒颗粒直径为32~44nm,呈正二十面体对称结构,单股正链RNA病毒,基因组全长为7447bp。和经典的RHDV一样,RHDV2基因组有两个开放阅读框,ORF1和ORF2;ORF1(10~7044bp)编码一个含有2344个氨基酸(257 kDa)的多聚蛋白,该多聚蛋白由病毒编码的蛋白酶酶解成多个非结构蛋白NSP1(2A)NSP2(2B)NSP3(2C核苷酸水解酶)NSP4(3A)NSP5(3B VPg)NSP6(3C 蛋白酶) NSP7(3C RNA复制酶)和衣壳蛋白VP1。RHDV-N11基因组全长7447 nt,5'非编码区9 nt。3'非编码区69 nt,长于经典RHDV和RHDVa的3'非编码区(59 bp)[18]图1。
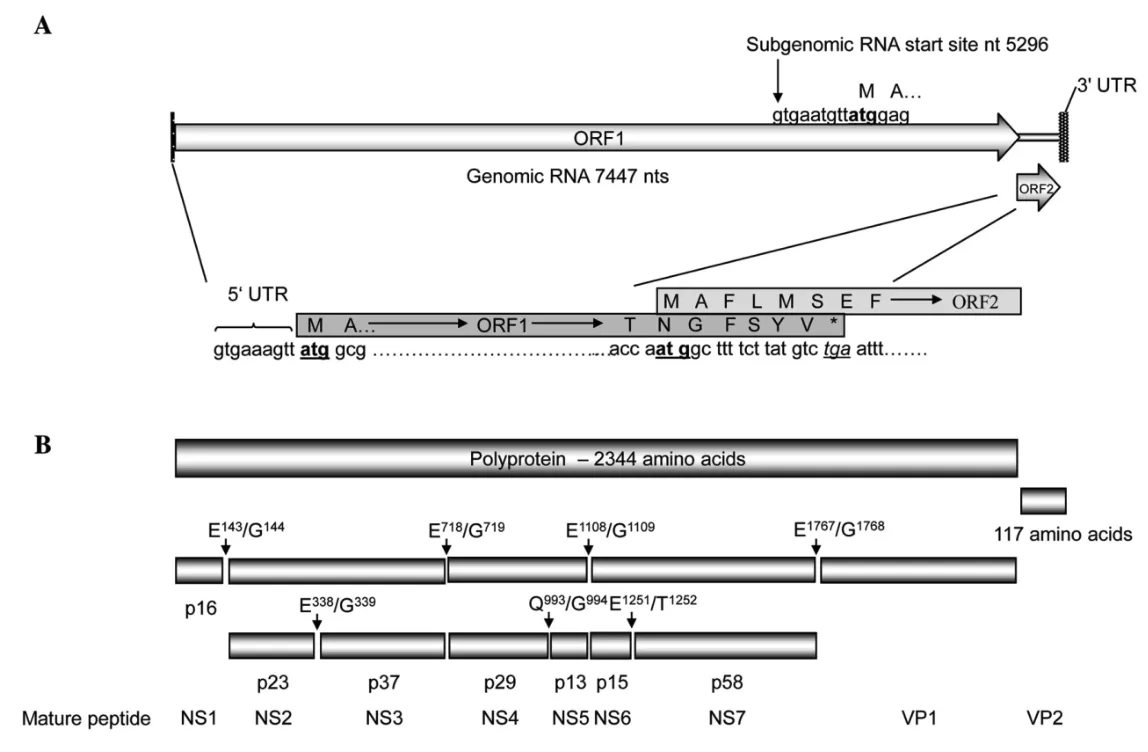
图1 RHDV-N11基因组结构及其编码蛋白图解[18]Fig. 1 Schematic of the RHDV-N11 genome structure and its coded proteinA: RHDV-N11基因组RNA图解. ORF1和ORF2以及5'UTR、3'UTR非编码区的相对位置, 亚基因组RNA转录起始位点, ORF1的终止区域和ORF2起始区域的重叠序列. B: RHDV-N11 ORF1多聚蛋白加工图谱预测. 可能的切割位点及切割后蛋白的大小, 蛋白命名沿用Sosnovtsev等[19]对鼠诺如病毒对应蛋白名称A: Schematic representation of RHDV-N11 genomic RNA. Relative positions of ORFs 1 and 2, the 5'and 3'NTR regions, and the subgenomic RNA transcription start site are indicated. The overlapping sequence for termination of ORF1 and initiation of ORF2 translation are shown in detail.B: Predicted ORF1 polyprotein processing map for RHDV-N11. The position of possible cleavage sites and the sizes of products are indicated. Mature peptides are named in accordance with those proposed by Sosnovtsev et al. for murine norovirus
2.2基因分型 历史上,根据VP60的不同将RHDV分为6株不同的亚基因型:G1~G5和抗原变异株RHDVa即G6亚基因型。最近也有一种研究结果认为G3,G4,和G5是属于同一个基因簇[20]。随后,在无临床症状的家兔身上发现了弱致病性以及非致病性的兔病毒属病毒,这些病毒与高致病性的RHDV在遗传上有着很大的差别,约有20%的差异。另外一个致病性的兔病毒属成员,欧洲褐色兔综合症病毒(EBHSV)与RHDV的基因组结构很相似,但是基因同源性只有70%左右。通过系统发生树分析,新型兔出血症病原RHDV2的亲缘关系与非致病性的RCV更近,相反与引起相同症状的RHDV亲缘关系较远,这也在一定程度上说明RHDV2的演变很可能是有非致病的兔病毒属成员发生物种跳跃传播到家兔[21]。
2.3遗传进化树分析 2010年,在一个已经免疫过经典兔出血症疫苗的兔场爆发了一起非典型的兔病毒性出血症,并从中检测到一株新的变异RHDV,随后的研究表明该变异株可能起源于一个未知的病毒种类而不是从RHDV进化而来,Le Gall-Reculé等[10]提议将这株新的兔病毒属成员命名为RHDV2。随后Puggioni 等[12]的研究结果强烈支持了这个结论,他报道了Cape hares引起的几起EBHSV-样疾病的病原是RHDV2。
兔病毒属成员的基因分型都是基于其主要衣壳蛋白VP60的差异;变异位点主要是位于衣壳蛋白高变异区的C端,所以根据C段碱基的差异进行兔出血症病毒分析是比较科学的一种方法。自从2010年爆发新型兔出血症以来,有很多的学者都对RHDV2的起源产生了浓厚的兴趣并进行了系统发生树分析,结果显示RHDV2与引起相同症状的RHDV亲缘关系较远,而与非致病性的兔杯状病毒表现出更近的系统发生关系,这样有研究人员便提出了这样一种假说:RHDV2起源于一种未知的非致病性兔病毒成员,并经过物种跨越而来。Giantonella P等[12]根据他们在意大利撒丁岛发现的兔出血症疫情中死亡的Cape Hares和Rabbits分离到的RHDV2病毒和法国报道的几株RHDV2与其他兔病毒属进行了进化树分析。他们分离的RHDV2和法国株在同一分支,与RHDV分支差异较大,与RCV更接近(图2)。

图2 RHDV和源意大利分离的RHDV2的系统发生树分析[12]Fig. 2 Phylogenetic analysis of rabbit hemorrhagic disease virus (RHDV) isolates and RHDV2 isolates identifi ed in Italian hares and rabbits
2.4毒力差异分析 大量的研究证据表明,RHDV2对目前已知的两种宿主的致病力是有很大差异的,对野兔的感染率和致死率明显低于家兔。Camarda A 等[4]的研究中,发生EBHSV样的(Cape Hares)种群中,只有很少的一部分兔子表现出临床症状,很大一部分活了下来,如其中一个死亡兔子笼子中另一个兔子竟然不表现出任何临床症状,采集这只兔子分离血清检测发现RHDV2 和 EBHSV全部为阴性,与之明显对比的是兔的感染率和死亡率则很高,在有的疫点死亡率甚至达到了经典兔出血症的死亡率。对此笔者进行大胆预测:RHDV2对两种不同的宿主肯定是采用不同的受体结合方式;并且家兔是最接近RHDV2天然宿主的物种,与家兔亲缘关系越远的物种感染率就越低。
3 流行病学特征
3.1易感动物 RHDV2是唯一一个能够跨物种感染的兔病毒属成员,能够感染家兔、幼龄家兔以及欧洲野兔的一种Cape Hares品种;而与之同属的EBHSV感染EBH,经典RHDV只感染成年家兔。新型兔瘟的这种跨物种传播能力明显加快了它的传播,特别是当发生新型兔病毒性出血症疫点的野生Cape Hares数量较多的时候,更会加快他的传播。有研究报道RHDV2虽然能够感染非单一物种,但是对不同宿主的敏感性有较大差异,越接近天然宿主的物种敏感性越高,RHDV2最易感的是家兔,也就是天然宿主。目前的流行病学数据已经有明显的证明表明欧洲褐色野兔对RHDV2不敏感,但是是否RHDV2对欧洲个褐色野兔不敏感或者是携带不发病状态还需要特异血清流行病学调查。RHDV2的毒力与经典RHDV有较大差异,且感染宿主也不完全一样,是因为他们结合不同的宿主细胞受体或者是与受体具有不同的HBGA结合方式。
3.2传染源和传播途径 一般来讲,病死的兔子以及带毒未死亡的兔子常被怀疑是主要的传染源;其中野外病死的兔子是最强的传染源,感染RHDV的病死兔的尸体散毒可达三个月以上;在兔场中,直接接触感染的动物的分泌物,排泄物可能会造成感染,接触后病毒粒子可通过口、鼻等粘膜组织进入易感动物体内;也可间接地通过被污染的食物、笼子、水、铺垫、以及其他设备;感染或者通过载体介导传播:包括以动物粪便为食物的动物,鸟类以及昆虫。目前关于RHDV2的传播途径还没有很多的研究,但是可以肯定的是间接接触是一种很重要的传播途径。杯状病毒进入的自然门户是在呼吸道和消化道的上皮细胞中,主要是这些细胞表达宿主细胞受体HBGA。例如近年研究比较透彻的人诺如病毒就是通过与HBGA结合之后进入宿主体内的。
3.3宿主受体 病毒受体(virus receptor)一般为蛋白质,病毒受体位于易感宿主细胞表面,其主要作用是识别病毒吸附相关的蛋白并与之结合,继而引发病毒感染。目前病毒受体被认为是引发病毒感染宿主细胞的关键因素,同时也决定了病毒宿主特异性。因此,鉴定兔出血症病毒受体及其特性与功能,对于从分子水平探明杯状病毒感染与免疫的机制,认清兔出血症病毒与宿主细胞的相互关系,为治疗和预防兔病毒性出血症提供重要的靶点和策略,具有重大的理论与实践价值。
对引起人类非细菌性胃肠炎的致病原诺如病毒(Norwalk virus,NV)研究发现,宿主遗传因素可能与NV的易感性有关,一些个体不会发病,并且这些个体呈聚集性;Hutson 等[22]报道中发现不同血型的志愿者的发生诺如病毒感染的概率不同:O型血志愿者中96%发生 NV 感染,65%为显性感染;A型血志愿者 78%发生 NV 感染,67%为显性感染;B 型血志愿者 60%发生 NV 感染,均系隐性感染。结果显示不同的个体所表达的HBGA是有差异的,当个体表达HBGA较弱时,在发生大规模集体疫情时,症状表现轻微或不发生感染;而诺如病毒又存在多种不同的基因型,相同个体对不同基因型的诺如病毒的抵抗力不同,不同的诺如病毒结合不同的HBGA以及结合方式会有差异。已经有报道证明经典RHDV和RHDV2结合HBGA的位点不同,RHDV2结合HBGA的方式与GII型人诺如病毒相似[23],这能够使人更好的认识HBGA。RHDV2结合HBGA的口袋位置在阴性电荷的衣壳蛋白P2区即衣壳蛋白二聚体结构的表面,与人诺如病毒GII型结合人类HBGA方式相似,与之对比的是RHDV结合HBGA的区域则在P1。充分了解不同杯状病毒与HBGAs的作用模式以及受体结合区域和位点将促进抗病毒药物和疫苗研制。
4 临床症状
以RHDV2为病原引起的兔病毒性出血症最主要的症状是急性肝坏死。一般表现为神经症状:如角弓反张,共济失调等;此外,感染兔的呼吸道症状也比较明显:主要表现为气管炎,呼吸困难,口鼻出并分泌带血泡沫。有时,兔的眼睛也会出血。RHDV2感染兔具有为典型RHD的病理特征:主要表现为胸腔和腹腔有丰富的血液样分泌液渗出,气管充、出血,肺脏出血,肝脏出血以及坏死,其他一些脏器如脾脏、肾脏等也充血、肿大[12](图3)。
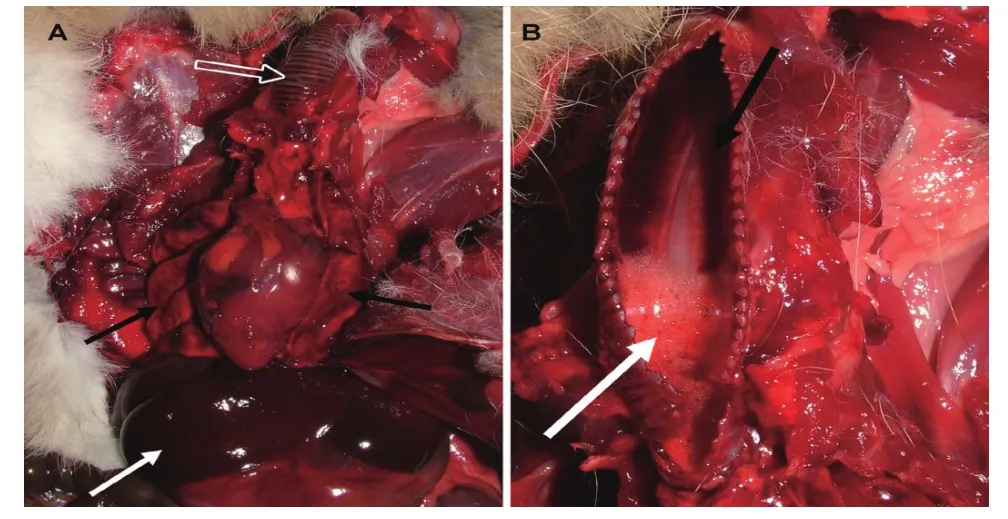
图3 意大利野兔感染RHDV2尸体剖检病变[4]Fig. 3 Gross lesions of the Italian hareA: 气管壁的弥散性充血(空箭头)和肺的弥散性充血(黑色箭头)、肝脏充血(白色箭头); B: 气管病变、大量的黏膜充血 (黑色箭头), 内腔的泡沫渗出物(白色箭头)A: Diffuse hyperaemia on the tracheal wall (empty arrow), on the lungs (black arrows), congested liver (white arrow); B: Trachea, extensive mucosal hyperaemia (black arrow) and foamy exudate (white arrow) in the lumen
5 诊断与预防
5.1诊断 包括临床观察和实验室诊断:一般首先对发病症状进行观察,然后实验人员再进行实验室的后期诊断来确诊。
5.1.1临床观察 主要是凭人工经验进行临床症状观察,尸检发现有兔出血症的经典症状:肝脏呈灰白色充血易碎、鼻出血、肺出血、气管有血样泡沫分泌物等以及实质器官肿大。仅仅根据临床观察,并不能确诊是感染了某种病原,必须通过实验室的分子生物学和其他方法加以诊断。
5.1.2实验室诊断 对于RHDV2引起的非典型兔瘟的诊断目前比较快速的方法是间接ELISA法,利用RHDV2的衣壳蛋白为包被抗原建立检测方法。该方法重复性良好,能够检测到RHDV或RHDV2的抗体,但是并不能区分RHDV与RHDV2的感染;为此,需要建立一种仅针对RHDV2的间接ELISA方法。另外对于感染新型兔出血症病毒组织病理学切片观察也能够分辨出该病的感染(图4)。有研究人员已经建立了检测RHDV2的Taq-man探针法实时RT-PCR方法,该方法快速特异,重复性良好[24]。最近,我们实验室根据RHDV2衣壳蛋白的变异区,正在建立一种基于非特异性核酸染料SYBR I 的RT-PCR方法,该方法根据两种病毒基因序列差异表现出来的高分辨率的溶解曲线不同来特异地区分RHDV与RHDV2的感染。
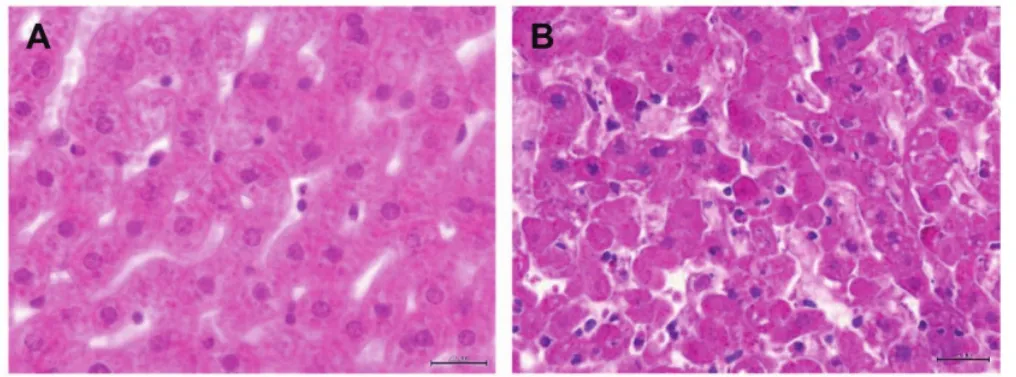
图4 感染RHDV2组织病理学切片[16]Fig. 4 Histopathological characterization of the new rabbit hemorrhagic disease virus (RHDV) variantA: 正常肝脏组织H E染色切片; B: 病变肝脏组织病理切片A: Liver section of a healthy rabbit. Staining H&E; B: Liver with lesions of microvacuolar degeneration and necrotizing hepatitis with karyolysis
5.2预防 报道发现免疫过RHDV疫苗的家兔也能够遭受RHDV2的攻击,所以针对RHDV的疫苗对RHDV2是不适用的;然而目前还没有合适的疫苗去预防新型兔瘟的发生;对该病的预防需要从切断传播途径入手,因为野兔(Cape Hares)能够带毒,也不排除其他兔类动物存在带毒的可能,科研人员还需要加快研制新型兔瘟疫苗,防止该病的迅速传播。在一些发生新型兔出血症疫情的地区可以采取紧急预防措施,免疫灭活苗,来减少兔场经济损失以及控制该病的传播。
6 结语
自从2010年爆发新型兔瘟以来,该病已经传播到欧洲大部分地区,并跨越欧洲大陆传播到距大陆1000多公里的群岛上。该病具有传播速度快、潜伏期长、并且能够跨物种感染等特点,比经典兔瘟的危害性更大。因此,虽然我国目前还没有新型兔病毒性出血症疫情出现,但仍应该引起我们的关注。鉴于RHDV2和经典RHDV的症状以及病理变化等都高度相似,因此,在临床上难以对其进行鉴别诊断,这需要我们尽快研发出特异性好、敏感性强的诊断方法。目前关于RHDV2的分子生物学特征、流行病学规律、以及致病机理等还知之甚少,迫切需要我们深入研究该病及其病原。
参考文献
[1] Strive T, Wright J D, Robinson A J. Identification and partial characterisation of a new Lagovirus in Australian wild rabbits[J].Virology, 2009, 384(1): 97-105.
[2] Le Gall-Recule G, Zwingelstein F, Fages M P, et al. Characterisation of a non-pathogenic and non-protective infectious rabbit lagovirus related to RHDV[J]. Virology, 2011, 410(2): 395-402.
[3] 刘胜江, 薛华平, 浦伯清,等. 兔的一种新病毒病—兔病毒性出血症[J]. 畜牧与兽医, 1984, (6): 253-255.
[4] Camarda A, Pugliese N, Cavadini P, et al. Detection of the new emerging rabbit haemorrhagic disease type 2 virus (RHDV2) in Sicily from rabbit (Oryctolagus cuniculus) and Italian hare (Lepus corsicanus)[J]. Res Vet Sci, 2014, 97(3): 642-645.
[5] Cancellotti F M and Renzi M. Epidemiology and current situation of viral haemorrhagic disease of rabbits and the European brown hare syndrome in Italy[J]. Rev Sci Tech, 1991, 10(2): 409-422.
[6] Gregg D A, House C, Meyer R, et al. Viral haemorrhagic disease of rabbits in Mexico: epidemiology and viral characterization[J]. Rev Sci Tech, 1991, 10(2): 435-451.
[7] Xu W Y. Viral haemorrhagic disease of rabbits in the People's Republic of China: epidemiology and virus characterisation[J]. Rev Sci Tech, 1991, 10(2): 393-408.
[8] Capucci L, Fallacara F, Grazioli S, et al. A further step in the evolution of rabbit hemorrhagic disease virus: the appearance of the first consistent antigenic variant[J]. Virus Res, 1998, 58(1-2): 115-126.
[9] Schirrmeier H, Reimann I, Kollner B, et al. Pathogenic, antigenic and molecular properties of rabbit haemorrhagic disease virus (RHDV) isolated from vaccinated rabbits: detection and characterization of antigenic variants[J]. Arch Virol, 1999, 144(4): 719-35.
[10] Le Gall G, Arnauld C, Boilletot E, et al. Molecular epidemiology of rabbit haemorrhagic disease virus outbreaks in France during 1988 to 1995[J]. J Gen Virol, 1998, 79 ( Pt 1): 11-6.
[11] Westcott D G, Frossard J P, Everest D, et al. Incursion of RHDV2-like variant in Great Britain[J]. Vet Rec, 2014, 174(13): 333.
[12] Puggioni G, Cavadini P, Maestrale C, et al. The new French 2010 Rabbit Hemorrhagic Disease Virus causes an RHD-like disease in the Sardinian Cape hare (Lepus capensis mediterraneus). [J].Vet Res, 2013, 44: 96.
[13] Le Gall-Recule G, Lavazza A, Marchandeau S, et al. Emergence of a new lagovirus related to Rabbit Haemorrhagic Disease Virus[J].Vet Res, 2013, 44: 81.
[14] Baily J L, Dagleish M P, Graham M, et al. RHDV variant 2 presence detected in Scotland[J].Vet Rec, 2014, 174(16): 411.
[15] Abrantes J, Lopes A M, Dalton K P, et al. New variant of rabbit hemorrhagic disease virus, Portugal, 2012-2013[J]. Emerg Infect Dis, 2013, 19(11): 1900-1902.
[16] Lopes A M, Correia J, Abrantes J, et al. Is the new variant RHDV replacing genogroup 1 in Portuguese wild rabbit populations? [J]. Viruses, 2015, 7(1): 27-36.
[17] Duarte M, Henriques M, Barros S C, et al. Detection of RHDV variant 2 in the Azores[J]. Vet Rec, 2015, 176(5): 130.
[18] Dalton K P, Abrantes J, Lopes A M, et al. Complete genome sequence of two rabbit hemorrhagic disease virus variant b isolates detected on the Iberian Peninsula[J]. Arch Virol, 2015, 160(3): 877-881.
[19] Sosnovtsev S V, Belliot G, Chang K O, et al. Cleavage map and proteolytic processing of the murine norovirus nonstructural polyprotein in infected cells[J]. J Virol, 2006, 80(16): 7816-7831.
[20] Abrantes J, van der Loo W, Le Pendu J, et al. Rabbit haemorrhagic disease (RHD) and rabbit haemorrhagic disease virus (RHDV): a review[J]. Vet Res, 2012, 43: 12.
[21] Lopes A M, Marques S, Silva E, et al. Detection of RHDV strains in the Iberian hare (Lepus granatensis): earliest evidence of rabbit lagovirus cross-species infection[J].Vet Res, 2014, 45: 94.
[22] Hutson A M, Atmar R L, Graham D Y, et al. Norwalk virus infection and disease is associated with ABO histoblood group type[J]. J Infect Dis, 2002, 185(9): 1335-1337.
[23] Leuthold M M, Dalton K P, Hansman G S. Structural analysis of a rabbit hemorrhagic disease virus binding to histo-blood group antigens[J]. J Virol, 2015, 89(4): 2378-2387.
[24] Duarte M D, Carvalho C L, Barros S C, et al. A real time Taqman RT-PCR for the detection of rabbit hemorrhagic disease virus 2 (RHDV2)[J]. J Virol Methods, 2015, 219: 90-95.
RESEARCH PROGRESS OF A NEW RABBIT HEMORRHAGIC DISEASE VIRUS
TAN Yong-gui, MIAO Qiu-hong,WU Qiao-mei, ZHU Jie, GUO Hui-min, LIU Guang-qing
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
Key words:Rabbit hemorrhagic disease virus; cross species; cross protection
Abstract:Rabbit hemorrhagic disease virus (RHDV) is a member of Lagovirus of the order Caliciviridae and causes rabbit hemorrhagic disease. In 2010, researchers in France found a non-classical RHD outbreaks, from which the etiological agent was different from the classic RHDV in gene sequences and designated as RHDV2. Researchers also found that RHDV2 had partial cross immune protection with classic RHDV. The study showed that the virus infected young rabbits and was the only member of the genus Lagovirus that could cause cross-species infection. The rapid spread of RHDV2 poses a great threat to the ecological balance with rabbits as the center. By now, RHDV2 has not been publicly reported in China but might have existed under sub-clinical condition. Therefore, the study and analysis of RHDV2 is of great signifi cance for control of its introduction to and spread in China.
中图分类号:S852.659.6
文献标志码:A
文章编号:1674-6422(2016)01-0080-07
收稿日期:2015-11-06
基金项目:国家自然科学基金(31270194)
作者简介:谭永贵,男,硕士研究生,预防兽医学专业
通信作者:刘光清,E-mail:liugq@shvri.ac.cn
