PTEN、VEGF、COX-2与JAK2 V617F突变阳性骨髓增殖性肿瘤血管新生*
2016-06-06成志勇付建珠赵亚玲刘桂敏卞永生梁丽青万建设张丽军
成志勇, 付建珠, 徐 倩, 赵亚玲, 刘桂敏, 卞永生, 梁丽青, 万建设, 张丽军
(1保定市第一医院血液内科, 河北 保定 071000; 2承德医学院, 河北 承德 067000)
PTEN、VEGF、COX-2与JAK2 V617F突变阳性骨髓增殖性肿瘤血管新生*
成志勇1△,付建珠1,2,徐倩1,2,赵亚玲1,2,刘桂敏1,2,卞永生1,梁丽青1,万建设1,张丽军1,2
(1保定市第一医院血液内科, 河北 保定 071000;2承德医学院, 河北 承德 067000)
[摘要]目的: 观察PTEN、VEGF、COX-2在JAK2 V617F突变阳性骨髓增殖性肿瘤(MPN)患者骨髓中的表达与血管新生之间的相互关系。方法: 收集保定市第一医院住院及门诊42例JAK2V617F阳性的MPN患者(初治组27例,治疗组15例),其中原发性血小板增多症(ET)17例,真性红细胞增多症(PV)10例,原发性骨髓纤维化(PMF)15例;此外,选取10例特发性血小板减少性紫癜(ITP)患者作为对照。Real-time PCR检测突变型与野生型JAK2比值。免疫组化检测患者及对照骨髓病理切片p-JAK2、PTEN、VEGF、COX-2的蛋白水平及CD105标记的微血管密度(MVD)。结果: 初治患者p-JAK2、VEGF、COX-2及MVD水平明显高于对照组,而PTEN表达水平明显低于对照组。治疗组患者p-JAK2、VEGF、COX-2及MVD的水平明显低于初治组,但PTEN表达水平高于初治组。JAK2 V617F突变量与VEGF、COX-2及MVD呈正相关(P<0.05)。PTEN与VEGF及MVD负相关(P<0.05)。JAK2突变型与野生型比值≥0.5的患者p-JAK2、VEGF、COX-2及MVD均明显高于比值<0.5的患者,而PTEN与上述相反。结论: PTEN、VEGF、COX-2与JAK2 V617F共同参与了骨髓增殖性肿瘤患者血管新生。
[关键词]骨髓增殖性肿瘤; JAK2 V617F; VEGF; 微血管密度; 血管新生
骨髓增殖性肿瘤(myeloproliferative neoplasms,MPNs)是一系或多系分化相对成熟的骨髓细胞克隆性增殖所致的一组肿瘤性疾病。在大部分真性红细胞增多症(polycythemia vera,PV)及半数原发性血小板增多症(essential thrombocythema,ET)、原发性骨髓纤维化(primary myelofibrosis,PMF)患者存在JAK2 V617F突变。该突变导致JAK2自发性磷酸化,激活细胞因子受体-JAK2-STAT5信号通路,诱导骨髓细胞克隆性增殖[1]。
血管新生是血管内皮细胞在促血管新生因子作用下,通过与其受体结合,刺激血管内皮细胞增殖和迁移,形成新生血管的过程[2]。研究表明部分血液系统恶性肿瘤的发生发展及预后与骨髓血管新生程度及其调控因子密切相关[3]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是血管生成的关键调控因子,与多种血管新生因子相互协同刺激血管内皮细胞的迁移、增殖[4]。环氧化酶-2(cyclooxygenase-2,COX-2)在包括恶性血液病在内的多种肿瘤中表达增加,JAK/STAT信号通路的激活能使COX-2过表达,诱发肿瘤血管新生[5]。
与张力蛋白同源10号染色体缺失的磷酸酶(phosphatase and tensin hemology deleted on chromosome ten,PTEN)基因作为抑癌基因,在调控肿瘤细胞或正常细胞生长、凋亡、黏附、浸润、迁移等方面具有重要生理、病理作用。它主要通过抑制PI3K/Akt信号通路磷酸化发挥抑制肿瘤作用。在包括白血病在内的多种肿瘤细胞中存在PTEN表达降低,并与肿瘤预后不良密切相关[6]。PTEN能够抑制包括恶性血液病在内的多种肿瘤的血管新生[7]。
本研究探讨了PTEN、VEGF、COX-2在JAK2 V617F突变阳性骨髓增殖性肿瘤患者骨髓中的表达与血管新生之间的相互关系,为抗血管新生治疗恶性血液病提供了理论依据。
材料和方法
1临床资料
选取2012年1月~2014年10月于保定市第一医院收治的42例JAK2 V617F突变阳性的MPN患者,其中男18例,女24例,年龄32~75岁,中位年龄57岁;其中PV 10例,ET 17例,PMF 15例;包括初治组25例(未经任何治疗的初治MPN患者),治疗组17例(经IFN-α 2b)。10例特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)患者作为对照,男5例,女5例,中位年龄40岁。所有实验均获得患者知情同意。
治疗组所用治疗方案:MPN患者应用IFN-α 2b皮下或肌肉注射,每次3×106U,每周3~7次,至少应用6个月以上,必要时应用羟基脲调整白细胞、血红蛋白及血小板数量。
2试剂
p-JAK2和COX-2抗人单克隆抗体购自Santa Cruz;CD105和VEGF单克隆抗体购自中杉金桥公司;CCK-8购自Dojindo;血液基因组DNA提取试剂盒购自北京博迈德生化科技有限公司;引物序列根据NCBI公布的相应基因序列设计并由北京赛百盛公司合成;TaqMan购自ABI。
3方法
3.1Real-time PCR采集新鲜骨髓液4 mL,肝素抗凝。DNA提取试剂盒提取基因组DNA。real-time PCR反应体系共25 μL。反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,40个循环。同时设标准品和空白对照。PCR反应前3~15个循环的荧光信号作为荧光本底信号,调节基线至适宜处作为阈值,各荧光信号到达所设定阈值的循环数即为Ct值。根据标准品计算JAK2和JAK2 V617F的绝对拷贝数量。计算JAK2 V617F/JAK2比值。PCR引物序列及探针如下:JAK2上游引物为5′-CAG CAA GTA TGA TGA GCA AGC TTT-3′,下游引物为5′-TGA ACC AGA ATA TTC TCG TCT CCA C-3′;MGB-Probe为 5′-FAM-TCA CAA GCA TTT GGT TTT-MGB-3′,JAK2 V617F下游引物为5′-CCA GAA TAT TCT CGT CTC CAC TGA A-3′。
3.2免疫组织化学染色组织蜡块4 μm切片,45 ℃烤片3 h,脱蜡,蒸馏水冲洗2遍,抗原修复后加3%过氧化氢,阻断内源性过氧化氢酶的活性,PBS冲洗3次,加入 I 抗(p-JAK2、VEGF和CD105抗体工作浓度分别为1∶200、1∶200和1∶50)4 ℃过夜,PBS冲洗3次,每次 5 min,滴加EliVision Plus试剂盒中试剂A(增强剂)、试剂B(酶标羊抗鼠/兔IgG聚合物),PBS冲洗后,加DAB显色,以胞膜、胞浆或胞核中出现棕黄色颗粒为阳性判断标准,苏木素复染,0.1%盐酸分化,自来水冲洗,切片经梯度乙醇脱水干燥,中性树胶封片。
3.3免疫组化判定标准以细胞胞浆内出现棕色染色颗粒为阳性。选取3个高倍镜视野区域(×400),计算阳性细胞数占全部细胞的比例。
3.4微血管密度(microvessel density,MVD)结果判定显微镜下,任何被染成棕褐色的单个内皮细胞或细胞团,不管是否形成管腔,只要与组织成分有一个清楚的分离,即判定为微血管。选定3个微血管密集区,在高倍镜视野区域(×400)计数微血管数,取均值表示MVD。
4统计学处理
所有数据用SPSS 19.0统计软件分析处理。两样本均数比较采用 t 检验,多组均数比较采用单因素方差分析,组间两两比较选用SNK-q检验。Spearman等级相关分析各变量之间的相关性。以 P<0.05 为差异有统计学意义。
结果
1JAK2 V617F突变在患者中的表达
42例患者在初次治疗时均经定量PCR检测为JAK2 V617F突变阳性,经过治疗后2例患者JAK2 V617F突变转阴性,除此2例患者外,其余40例MPN患者突变量在26.8%~75.4%之间。其中初治组25例,突变量为(46.17±19.32)%,干扰素治疗组17例,突变量为(22.69±12.64)%,前者明显高于后者(P<0.05)。
2免疫组织化学染色检测p-JAK2、VEGF、COX-2、PTEN和MVD在MPN患者中的水平
p-JAK2、VEGF和COX-2及PTEN蛋白均定位于细胞质,其中p-JAK2、VEGF和COX-2 的阳性率在初治组中最高,其次为治疗组,对照组最低,差异均有统计学显著性(P<0.01);MVD在初治组中显著高于治疗组及对照组;PTEN蛋白在初治组中表达最低,其次为治疗组,对照组表达最高,差异均有统计学意义(P<0.01),见图1。
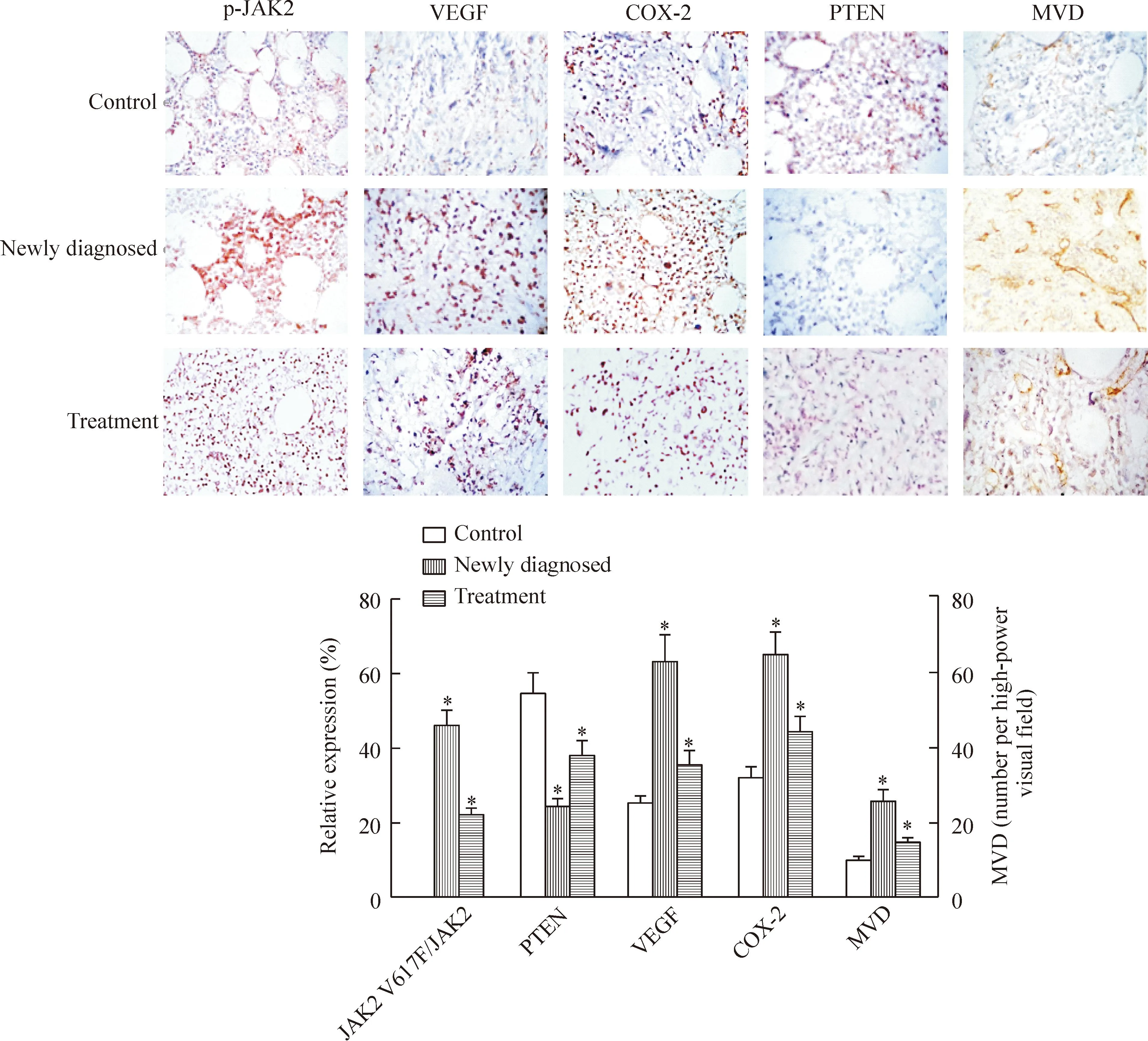
Figure 1.The levels of p-JAK2, PTEN, VEGF, COX-2 proteins and MVD in control group, newly diagnosed group and treatment group detected by immunohistochemistry (×400). Mean±SD.n=3.*P<0.05vscontrol group.
图1免疫组织化学染色检测p-JAK2、VEGF、COX-2、PTEN蛋白及MVD水平
3JAK2 V617F突变量与p-JAK2、VEGF、COX-2、PTEN和MVD的相关分析
Spearman等级相关分析显示MPN患者的JAK2V617F突变量与p-JAK2、VEGF、COX-2和MVD呈正相关,相关系数分别为0.739、0.589、0.553和0.577(P<0.05),与PTEN呈负相关(r=-0.508,P<0.05)。PTEN蛋白表达与MVD呈负相关(r=-0.584,P<0.05)。
以JAK2 V617F/JAK2比值50%为界值分为<50%及≥50%两组,其中<50%组26例,≥50%组16例,见表1。结果显示JAK2 V617F/JAK2<50%的患者其p-JAK2、VEGF、COX-2及MVD的水平均明显低于JAK2 V617F/JAK2≥50%组,PTEN在JAK2 V617F/JAK2比值<50%患者的水平要明显高于JAK2 V617F/JAK2比值≥50%患者(P<0.05)。
IFN-α 2b治疗组JAK2 V617F突变量及p-JAK2、VEGF、COX-2、MVD的水平均明显低于初治组但高于对照组(P<0.05);而PTEN与上述相反,在初治组中表达最低,其次为治疗组,在对照组中表达最高(P<0.05),见表2。

表1 JAK2 V617F/JAK2突变量与PTEN、VEGF、COX-2及MVD的关系
*P<0.05,**P<0.01 vs JAK2 V617F/JAK2<50% group.
表2初治组、治疗组及对照组JAK2 V617F与PTEN、VEGF、COX-2、MVD表达水平的关系
Table 2.The relationship between JAK2 V617F mutation and PTEN, VEGF, COX-2, and MVD in newly diagnosed group, treatment group and control group (Mean±SD)

GroupnJAK2V617F/JAK2(%)PTEN+(%)VEGF+(%)COX-2+(%)MVDNewlydiag-nosed2546.17±19.3224.78±14.8664.72±25.0165.66±20.1526.58±5.93Treatment1722.69±12.64*38.72±18.25*36.58±15.95*44.30±12.83*15.86±4.27*Control100*55.05±21.17*25.69±13.75*32.89±10.54*10.76±4.01*
*P<0.05 vs newly diagnosed group.
4JAK2 V617F及MVD与血栓栓塞的相关性
42例患者发生血栓患者19例,血栓发生率为45.24%,以JAK2 V617F/JAK2比值<50%组26例,血栓栓塞8例,血栓发生率为30.77%,≥50%组16例,血栓栓塞11例,血栓发生率为68.75%,后者明显高于前者(P<0.05)。42例患者总MVD为22.24±7.49,其中MVD<22.24患者23例,血栓栓塞7例,血栓发生率为为30.43%,MVD>22.24患者19例,血栓栓塞12例,血栓发生率为63.16%,后者明显高于前者(P<0.05)。结果表明JAK2 V617F突变量愈高,MVD愈高,患者血栓栓塞发生率愈高。
讨论
JAK2突变为BCR-ABL阴性骨髓增殖性肿瘤患者常见的基因突变,该突变在缺少细胞因子情况下能自发性激活JAK2-STAT5信号通路,从而诱发骨髓增殖性肿瘤,而以JAK2 V617F点突变最为常见。受体鼠表达JAK2 V617F可以产生类似PV和MF表型,支持JAK2 V617F在MPN发病机制中的重要作用[8]。本研究所选患者在初次治疗时均经定量PCR检测为JAK2 V617F突变阳性,经过治疗后2例患者JAK2 V617F突变转阴性,其余40例MPN患者突变量在26.8%~75.4%之间。
血管新生在多种恶性血液病如白血病、骨髓瘤发病中发挥重要作用,与肿瘤的预后密切相关[3]。血管新生的机制表现在促血管生成因子的活性上调和(或)血管生成抑制因子的活性下调[2]。VEGF是肿瘤血管新生过程中最重要的调控因素。在肿瘤细胞中通过自分泌与旁分泌途径,VEGF与其受体结合,能够促进肿瘤细胞的增殖和转移以及血管新生[9]。
在恶性血液病在内的多种肿瘤中COX-2表达增加,能够刺激肿瘤细胞的增殖、抑制肿瘤细胞凋亡;促进肿瘤内血管形成;促黏附和转移,增加肿瘤细胞的侵袭力[5]。VEGF与COX-2存在广泛的多通路联系。研究表明VEGF与COX-2基因之间存在频繁的共区域化,从而提示二者存在共同控制2个基因表达的机制[10]。同时2者能够相互促进,发挥协同诱导肿瘤血管新生作用[11]
抑癌基因PTEN具有抑制包括白血病在内的肿瘤血管新生作用,并降低肿瘤微血管密度,抑制多种促血管生成因子,如VEGF、HIF-1、COX-2等在肿瘤细胞表达[7,12]。过表达PTEN蛋白能够抑制鸡胚尿囊膜血管新生[7]。
研究表明在骨髓增殖性肿瘤患者骨髓中微血管密度明显高于正常人[2, 9, 13-14]。同时存在VEGF及其受体高表达,MVD随着JAK2 V617F突变量的增加而增加[9, 13-14]。本研究结果显示,JAK2 V617F突变阳性患者中存在促血管新生因子VEGF和COX-2高表达,同时MVD明显增加。而抑癌基因PTEN表达水平明显减低。相关分析显示MPN患者的JAK2 V617F突变量与VEGF、COX-2和MVD呈正相关,与PTEN表达呈负相关,JAK2 V617F突变率越高者VEGF和COX-2表达越高,MVD越高则血管新生越明显,而PTEN表达愈低。JAK2 V617F是BCR-ABL阴性MPN发病机制之一,随着JAK2-STAT5信号通路活化,细胞克隆性增生,骨髓细胞分泌大量促血管新生因子如VEGF和COX-2,伴随PTEN等血管新生抑制因子的表达降低,骨髓微血管新生平衡进一步打破,骨髓微血管密度进一步增加,从而介导了MPN的发病。同时JAK2 V617F突变量愈高,骨髓微血管密度愈高,患者发生血栓的风险则愈高[15]。
IFN-α 2b具有抗肿瘤作用。目前研究表明约80%的MPN患者在应用IFN-α 2b后可获得血液学反应,能够减少JAK2 V617F的突变量,甚至部分患者能够达到分子生物学缓解[16]。本研究结果显示,在JAK2 V617F阳性MPN患者在应用IFN-α 2b后JAK2 V617F突变量明显减少,部分患者转阴性。同时能够降低MPN患者VEGF及COX-2及MVD表达。随着JAK2 V617F突变量的减低,PTEN表达水平亦伴随升高。
本研究我们初步探讨了JAK2 V617F阳性骨髓增殖性肿瘤中促血管新生因子VEGF、COX-2及抑制血管新生因子PTEN与骨髓微血管密度之间相互关系及与JAK2 V617F突变量之间相互联系,为抗血管新生治疗骨髓增殖性肿瘤提供了理论依据。
[参考文献]
[1]成志勇,黄月华,梁文同,等. 骨髓增殖性肿瘤中JAK2 V617F 突变与Ⅰ型细胞因子受体相关性研究[J]. 中国全科杂志, 2012, 15(9):1019-1022.
[2]Medinger M, Passweg J. Angiogenesis in myloproliferative neoplasma, new markers and future directions[J]. Memo, 2014, 7:206-210.
[3]AbdElAal AA, Afify RA, Zaher AE, et al. Study of prognostic significance of marrow angiogenesis assessment in patients with de novo acute leukemia[J]. Hematology, 2015, 20(9):504-510.
[4]Moschetta MG, Maschio LB, Jardim-Perassi BV,et al. Prognostic value of vascular endothelial growth factor and hypoxia-inducible factor 1α in canine malignant mammary tumors[J]. Oncol Rep, 2015, 33(5):2345-2353.
[5]Yu H, Liu Z, Zhou H, et al. JAK-STAT pathway modulates the roles of iNOS and COX-2 in the cytoprotection of early phase of hydrogen peroxide preconditioning against apoptosis induced by oxidative stress[J]. Neurosci Lett,2012, 529(2):166-171.
[6]Wang SY, Hao HL, Deng K, et al. Expression levels of PTEN, FAK in multiple myeloma patients and its relationship with clinical stage and extramedullary infiltration[J]. Leuk Lymphoma, 2012, 53(6):1162-1168.
[7]Cheng ZY, Liang WT, Yang XY, et al. PTEN’s regulation of VEGF and VEGFR1 expression and its clinical significance in myeloid leukemia[J]. Med Oncol, 2012, 29(2):1084-1092.
[8]Kralovics R, Passamonti F, Buser AS, et al. A gain-of-function mutation of JAK2 in myeloproliferative disorders[J]. N Engl J Med, 2005,352(17):1779-1790.
[9]Medinger M, Skoda R, Gratwohl A, et al. Angiogenesis and vascular endothelial growth factor-/receptor expression in myeloproliferative neoplasms: correlation with clinical parameters and JAK2-V617F mutational status[J]. Br J Haematol, 2009, 146(2):150-157.
[10]Butkiewicz D, Krzeniak M, Drosik A, et al. The VEGFR2, COX-2 and MMP-2 polymorphisms are associated with clinical outcome of patients with inoperable non-small cell lung cancer[J]. Int J Cancer, 2015, 137(10):2332-2342.
[11]Hua KT, Lee WJ, Yang SF, et al. Vascular endothelial growth factor-C modulates proliferation and chemoresistance in acute myeloid leukemic cells through an endothelin-1-dependent induction of cyclooxygenase-2[J]. Biochim Biophys Acta, 2014, 1843(2):387-397.
[12]Sui W, Zhang Y, Wang Z, et al. Antitumor effect of a selective COX-2 inhibitor, celecoxib, may be attributed to angiogenesis inhibition through modulating the PTEN/PI3K/Akt/HIF-1 pathway in an H22murine hepatocarcinoma model[J]. Oncol Rep, 2014, 31(5):2252-2260.
[13]Boiocchi L, Vener C, Savi F, et al. Increased expression of vascular endothelial growth factor receptor 1 correlates with VEGF and microvessel density in Philadelphia chromosome-negative myeloproliferative neoplasms[J]. J Clin Pathol, 2011, 64(3):226-231.
[14]Boveri E, Passamonti F, Rumi E, et al. Bone marrow microvessel density in chronic myeloproliferative disorders: a study of 115 patients with clinicopathological and molecular correlations[J]. Br J Haematol, 2009, 140(2):162-168.
[15]郭慧梅,潘崚,贺建辉,等. 骨髓增殖性肿瘤患者血栓栓塞的相关因素[J]. 肿瘤防治研究, 2013, 40(10):958-960.
[16]成志勇,李士辉,杨琳,等. 干扰素α对JAK2 V617阳性的骨髓增殖性疾病的影响[J]. 实用肿瘤杂志, 2008, 23(4):318-321.
(责任编辑: 陈妙玲, 罗森)
PTEN, VEGF, COX-2 and angiogenesis in JAK2 V617F positive myeloroliferative neoplasms
CHENG Zhi-yong1, FU Jian-zhu1, 2, XU Qian1, 2, ZHAO Ya-ling1, 2, LIU Gui-min1, 2, BIAN Yong-sheng1, LIANG Li-qing1, WAN Jian-she1, ZHANG Li-jun1,2
(1DepartmentofHematology,TheFirstHospitalofBaoding,Baoding071000,China;2ChengdeMedicalCollege,Chengde067000,China.E-mail:dzczy@sohu.com)
[ABSTRACT]AIM: To investigate the expression of PTEN, VEGF and COX-2, and the relationship with angiogenesis in the bone tissues of JAK2 V617F mutation positive myeloroliferative neoplasm(MPN)patients. METHODS: JAK2 V617F positive MPN patients (n=42) were selected in the First Hospital of Baoding including 25 cases of newly diagnosed group and 17 cases of treatment group with IFN-α 2b, and 10 cases of idiopathic thrombocytopenic purpura (ITP) patients served as controls. The ratio of mutant and wild type JAK2 was detected by real-time PCR. The protein levels of p-JAK2, PTEN, VEGF and COX-2, and microvascular density (MVD) marked with CD105 in pathological tissues of bone marrow were detected by immunohistochemistry. RESULTS: The levels of p-JAK2, VEGF, COX-2 and MVD in newly diagnosed group were significantly higher than those in control group. However, the expression level of PTEN was significantly lower than that in control group. The levels of p-JAK2, VEGF, COX-2 and MVD in treatment group were significantly lower than those in newly diagnosed group, while the expression level of PTEN was significantly higher than that in newly diagnosed group. JAK2 V617F mutation burden was positively correlated with VEGF, COX-2 and MVD (P<0.05). PTEN was negatively correlated with VEGF and MVD (P<0.05). The levels of p-JAK2, VEGF, COX-2 and MVD in JAK2 V617F/JAK2 ratio≥0.5 group were significantly higher than those in JAK2 V617F/JAK2 ratio<0.5 group, but PTEN showed the contrary to the above.CONCLUSION: PTEN, VEGF, COX-2 and JAK2 V617F are involved in the pathogenesis of angiogenesis in MPN patients.
[KEY WORDS]Myeloroliferative neoplasms; JAK2 V617F; VEGF; Microvascular density; Angiogenesis
[文章编号]1000- 4718(2016)05- 0938- 05
[收稿日期]2015- 07- 10[修回日期] 2016- 01- 12
*[基金项目]河北省重点研发计划项目(No. 162777120D)
通讯作者△Tel: 0312-2096686; E-mail: dzczy@sohu.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.029
杂志网址: http://www.cjpp.net
