miRNA-7介导Bax和Bcl-2表达对人鼻咽癌CNE-1细胞凋亡的影响*
2016-06-06孙栋勋黄栋栋金巧智陈武兵蔡志毅
孙栋勋, 黄栋栋, 金巧智, 陈武兵, 蔡志毅△
(1嘉兴市第一医院,浙江 嘉兴 314000; 2台州市立医院耳鼻咽喉科,浙江 台州 318000)
miRNA-7介导Bax和Bcl-2表达对人鼻咽癌CNE-1细胞凋亡的影响*
孙栋勋1,黄栋栋1,金巧智2,陈武兵2,蔡志毅2△
(1嘉兴市第一医院,浙江 嘉兴 314000;2台州市立医院耳鼻咽喉科,浙江 台州 318000)
[摘要]目的: 研究过表达微小RNA-7(microRNA-7,miRNA-7)诱导人鼻咽癌(nasopharyngeal carcinoma,NPC)CNE-1细胞凋亡及其与Bax和Bcl-2表达之间的关联情况。方法: 体外利用脂质体Lipofectamine 2000将miRNA-7模拟物转染到人鼻咽癌CNE-1细胞中;采用real-time PCR法检测转染后各实验组细胞中miRNA-7的相对表达情况;CCK-8法检测各组细胞活力的改变;在荧光显微镜下利用Hoechst 33258荧光染色法观察转染后细胞的凋亡;real-time PCR法检测Bax和Bcl-2的mRNA表达水平;Western blot法检测Bax和Bcl-2蛋白表达水平。结果: Real-time PCR结果表明,转染miRNA-7模拟物的CNE-1细胞中其miRNA-7的相对表达水平明显高于无关序列组和空白对照组(P<0.01);转染miRNA-7模拟物后,CNE-1细胞的活力明显下降(P<0.01);Hoechst 33258染色检测可发现典型的凋亡细胞核形态学变化;real-time PCR及Western blot结果显示,转染miRNA-7模拟物的CNE-1细胞中Bax的mRNA及蛋白显著上调(P<0.01),而Bcl-2的mRNA及蛋白则显著下调(P<0.01)。结论: 过表达miRNA-7可以通过调节Bax/Bcl-2之间的比例关系来抑制鼻咽癌CNE-1细胞的恶性生长,并促进细胞凋亡。
[关键词]微小RNA-7; Bax; Bcl-2; 鼻咽癌; 细胞凋亡
鼻咽癌(nasopharyngeal carcinoma,NPC)为我国南方高发的一种头颈部恶性肿瘤,现已知NPC不仅与化学致癌物及EB病毒等因素有关,且是一种多基因多阶段侵袭性疾病,有一定的遗传倾向,这可能和鼻咽癌中癌基因的激活与抑癌基因的失活所引起的细胞抗凋亡有关。
微小RNA(microRNA,miRNA)是新近发现的又一类高度保守的非编码小RNA分子,其在基因转录后的表达调控方面起着至关重要的作用[1]。miRNA主要介导与靶基因mRNA的3’-非翻译区(3’-untranslated region,3’-UTR)的完全或不完全配对来导致靶基因mRNA的降解或翻译抑制来调控细胞增殖、凋亡及分化等生物学行为,进而发挥类似癌基因或抑癌基因的作用[2]。近年来研究发现,miRNA的异常表达与鼻咽癌的发生发展密切相关,如miRNA-17-92和miRNA-155在鼻咽癌中明显的高表达,而miRNA-143和miRNA-145则表达下调[3]。但是关于鼻咽癌中miRNA的研究仍主要集中在鼻咽癌内以及EB病毒自身合成miRNA表达谱的建立,而对于鼻咽癌中miRNA精细调控的研究仍处于初级阶段,鼻咽癌组织中异常表达miRNA的确切调控机制以及miRNA与鼻咽癌组织中靶基因特异性结合位点和机制都有待进一步的深入研究。
miRNA-7是近期发现的在某些肿瘤中具有抑癌作用的微小RNA,这些肿瘤包括胃癌[4]、乳腺癌[5]和肝癌[6]等。本课题组既往研究发现,miRNA-7在体外可以显著抑制低分化鼻咽癌5-8F细胞的恶性增殖活动[7],本研究拟通过miRNA基因转染技术来打破凋亡相关基因Bax/Bcl-2之间的平衡关系,借以探讨miRNA-7在体外对人鼻咽癌CNE-1细胞抗凋亡作用的相关影响机制,并探索寻找鼻咽癌新的miRNA活性特异性治疗靶点的可行性。
材料和方法
1实验材料
人高分化鼻咽癌CNE-1细胞株(中国科学院上海生命科学研究院细胞资源中心)。RPMI-1640培养基、OPTI-MEM I培养基、胎牛血清和胰蛋白酶(Gibco);PBS缓冲液(Thermo);CCK-8试剂盒(Bryotime);总RNA抽提试剂TRIzol、转染试剂Lipofectamine 2000(Lipo 2000)及miRNA第一链合成试剂盒(Invitrogen);cDNA第一链合成试剂盒和RealMasterMix(SYBR Green)荧光定量PCR试剂盒(Tiangen);兔抗人GAPDH、Bax、Bcl-2单克隆 I 抗和辣根过氧化物酶标记的羊抗兔 II 抗(Bioworld)。miRNA-7模拟物及阴性对照(negtive control,NC)序列由广州锐博生物合成。
2主要方法
2.1细胞培养与转染及转染效率的检测CNE-1细胞接种于含有10%胎牛血清的RPMI-1640培养基中,放置于37 ℃、5% CO2的恒温恒湿培养箱中培养。实验共分为3组:miRNA-7组;NC组;空白对照 (mock)组。将CNE-1细胞以每孔3×105接种到6孔板中,每孔2.5×103接种到96孔板中,培养24 h后更换新鲜培养基,并按操作说明以等量OPTI-MEM I无血清培养基分别稀释适当量的miRNA-7/NC与Lipo 2000,轻轻混匀后室温静置5 min,再将两者轻轻混匀于室温下共孵育15~20 min,加入6孔板中继续培养。如若转染带荧光的Cy3-miRNA-7或Cy3-NC时,所有实验操作均需避光,并以锡箔纸包被6孔板放置于培养箱中培养,转染24 h后用PBS冲洗,于荧光显微镜下观察大致转染效率并拍照。
2.2Real-time PCR检测转染后细胞中miRNA-7的相对表达情况各组CNE-1细胞经转染处理48 h后,提取细胞总RNA,紫外分光度计下测A260/A280比值处于1.8~2.1之间的RNA即符合纯度要求。配制miRNA逆转录液合成cDNA,并稀释10倍待用,配制 real-time PCR反应体系,每个样本设3个复孔。PCR反应步骤为95 ℃ 10 min;95 ℃ 15 s,60 ℃ 1 min,共40个循环,并以U6作为内参照。记录各孔Ct值,取各孔平均值作为最终结果,并采用2-ΔΔCt法进行分析。miRNA-7的上游引物序列为5’-AAA-AAGAACACGTGGAAGGATAG-3’,下游引物序列为5’-CCGCCTAACGTACCGCGAATTT-3’。U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGAATTTGCGT-3’。
2.3CCK-8法检测转染后的细胞活力取96孔板按上述转染法处理各组CNE-1细胞,于空白孔中加无细胞的完全培养基(每个实验组取4个复孔),培养48 h后向每孔中加入10 μL CCK-8试剂,混匀后放置于培养箱中培养1~2 h,测450 nm波长下每孔的吸光度(A)值。
2.4Hoechst 33258荧光染色法检测各组细胞凋亡情况将处于对数生长期的CNE-1细胞以每孔3×105个接种于放有盖玻片(多聚赖氨酸包被)的6孔板内,待24 h后分别转染,经转染24 h后,吸去培养基,PBS轻洗2次,每孔加4%多聚甲醛1 mL,于4 ℃固定10 min,从6孔板中取出玻片,吸水纸吸去多余固定液,避光条件下每个玻片滴加Hoechst 33258染液100 μL,室温下孵育10 min,吸水纸吸去多余染液,荧光显微镜下观察、摄像。每个浓度设3个复孔。在荧光显微镜下观察。
2.5Real-time PCR检测Bax和Bcl-2 mRNA的表达情况抽提各组CNE-1细胞总RNA,配制逆转录反应液合成cDNA后,采用SYBR Green荧光染料法配制PCR反应体系,每组设置3个复孔。PCR反应步骤:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,68 ℃ 1 min,共设置40个循环。反应以GAPDH作为内参照。记录各孔Ct值,取3孔平均值作为最终结果,并采用2-ΔΔCt法进行分析。GAPDH的上游引物序列为5’- CAT CAGCAATGCCTCCTGCAC-3’,下游引物序列为5’-TGAGTCCTTCCACGATACCAAAGTT-3’; Bax的上游引物序列为5’-ATGGAGCTGCAGAGGATTCG-3’,下游引物序列为5’-AATGTCCAGCCCATGATGGT-3’;Bcl-2的上游引物序列为5’-GACTTCGCCGAGATGTCCAG-3’,下游引物序列为5’-CGGTGCTTGGCAATTAGTGG-3’。
2.6Western blot检测Bax和Bcl-2蛋白表达情况于6孔板中转染各组CNE-1细胞72 h后,胰酶消化收集细胞,PBS洗涤1次后加入200 μL 1×SDS loading buffer,反复吹打搅拌至细胞充分裂解,95 ℃~100 ℃煮沸10 min,10 000 r/min离心10 min,收集上清液作为样本蛋白。按顺序加样,电泳分离,湿转法将蛋白转移至PVDF膜上,5%脱脂奶粉4℃封闭1.5 h,TBST充分洗膜,加特异性 I 抗(GAPDH,1∶10 000稀释;Bax和Bcl-2均1∶1 000稀释),放置于4 ℃孵育过夜,加入 II抗(1∶10 000稀释)室温孵育1.5 h,TBST充分洗膜,加入ECL发光液2 min后于ImageQuant LAS 4000 Mini凝胶成像仪中自动曝光,并分析各条带灰度值,计算各条带组与内参照GAPDH灰度的相对比值。重复3次实验取平均值。
3统计学处理
实验结果采用SPSS 19.0进行分析,所有计量资料结果均以均数±标准差(mean±SD)表明,多个样本均数之间采用单因素方差分析(one-way ANOVA)进行检验,组间两两比较采用最小显著性差异法(LSD法)进行分析,所有统计结果均以P<0.05为差异有统计学意义。
结果
1细胞转染情况
如图1所示,用带有Cy3荧光蛋白的Cy3-miRNA-7或 Cy3-NC转染人鼻咽癌CNE-1细胞24 h后,于荧光显微镜下拍照并观察大致转染效率,观察到转染效率在90%左右。
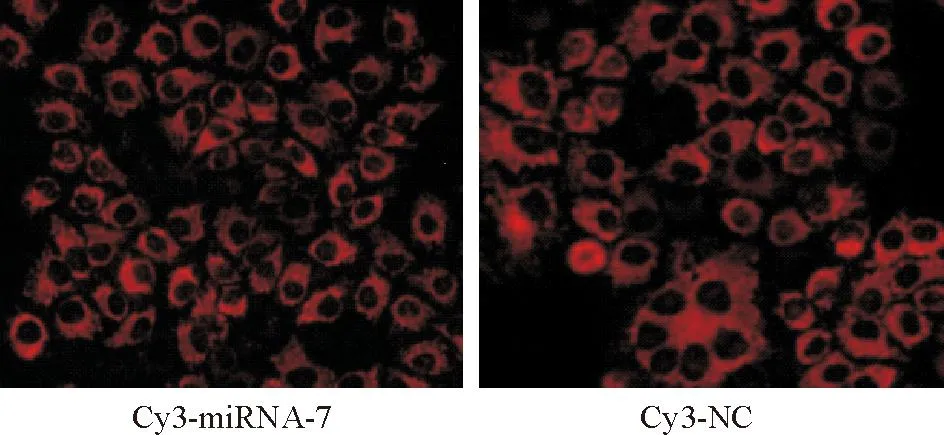
Figure 1.The expression of Cy3 fluorescin in human nasopharyngeal carcinoma CNE-1 cells 24 h after transfection (×100).
图1鼻咽癌CNE-1细胞转染24 h后荧光显微镜下Cy3荧光蛋白的表达情况
2miRNA-7在CNE-1细胞中的表达情况
miRNA-7在miRNA-7组、NC组及mock组中相对于U6的表达量分别为136.00±1.28、1.06±0.03和1.12±0.02,显示转染后miRNA-7组miRNA-7的表达量相对NC 组及Mock组呈明显上调趋势(P<0.01),NC组和Mock组之间则差异不明显,见图2。
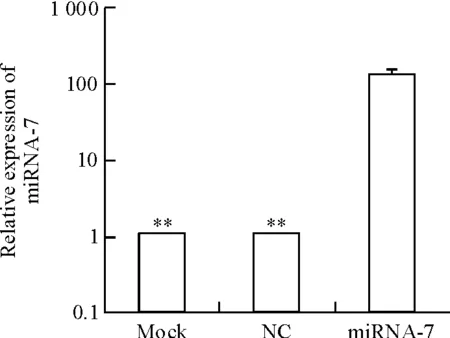
Figure 2.The expression of miRNA-7 in human nasopharyngeal carcinoma CNE-1 cells after transfection with miRNA-7 mimics. Mean±SD. n=3.**P<0.01 vs miRNA-7.
图2转染后人鼻咽癌CNE-1细胞中miRNA-7的相对表达情况
3miRNA-7抑制CNE-1细胞活力
CNE-1细胞经转染miRNA-7/NC处理48 h后,miRNA-7组的A值明显小于NC组和mock组,差异有统计学显著性(P<0.01),而NC组和mock组之间相比则差异无统计学显著性,见图3。
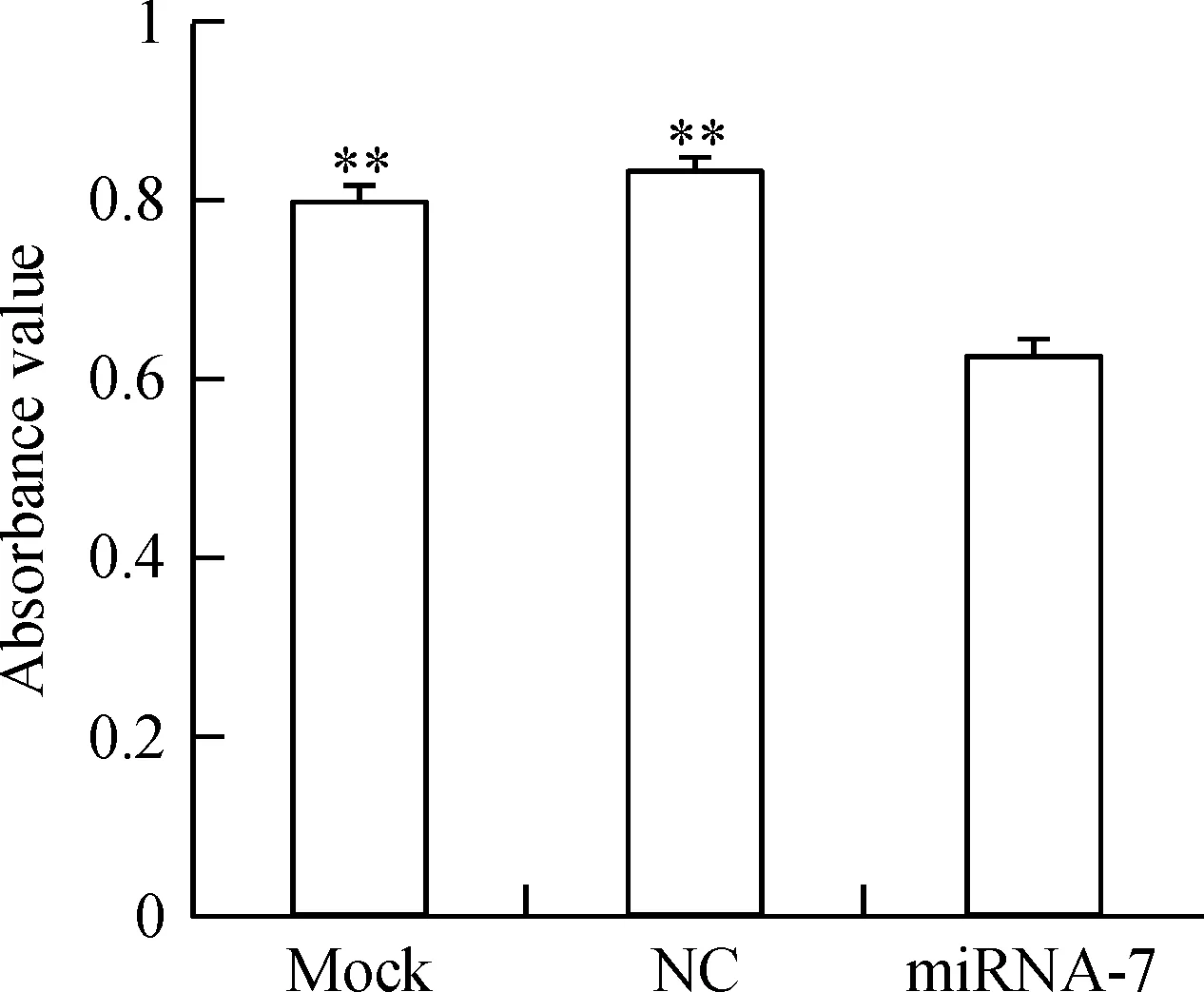
Figure 3. The activity of human nasopharyngeal carcinoma CNE-1 cells 48 h after transfection with miRNA-7 mimics was detected by CCK-8 assay.Mean±SD. n=3.**P<0.01 vs miRNA-7.
图3CCK-8法检测转染miRNA-7 48 h后各组细胞活力的变化
4miRNA-7促进CNE-1细胞凋亡形成的情况
如图4所示,NC和mock组鼻咽癌CNE-1细胞经Hoechst 33258染色后可见细胞核大小较均一,呈圆形或椭圆形,染色质分布均匀,紫外光下呈淡蓝色荧光;而miRNA-7组细胞可见染色质凝聚且分布不均匀,呈颗粒团状分布,部分细胞核缩小,有的核碎裂形成多个球形颗粒,出现较多的凋亡细胞,表现为亮蓝色的核固缩和核碎裂呈分叶状。NC组和mock组则无明显细胞核破坏现象。
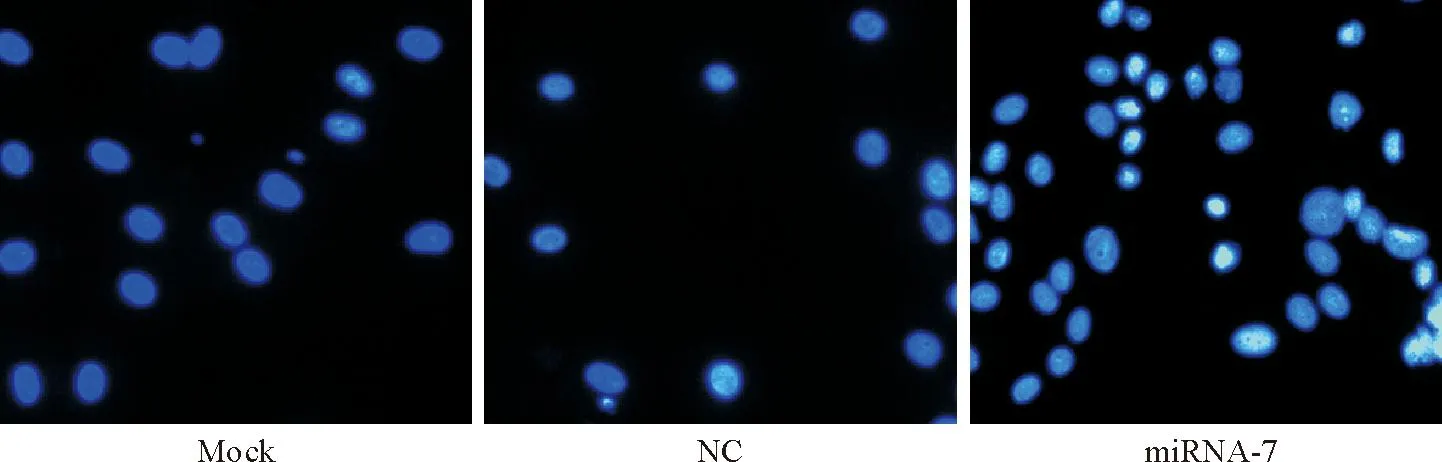
Figure 4. Nuclear morphological changes observed by Hoechst staining 24 h after transfection with miRNA-7 mimics or negative control (×400).
图4Hoechst染色检测各组细胞转染24 h后的核形态变化
5miRNA-7对Bax/Bcl-2 mRNA表达的影响
miRNA-7组和NC组Bax的mRNA表达量相对于mock组分别为1.36±0.03、1.07±0.02,而Bcl-2的 mRNA表达量则分别为0.75±0.02、0.94±0.01,miRNA-7组CNE-1细胞中Bax的mRNA表达量与NC组和mock组相比均明显上调,差异具有统计学显著性(P<0.01),而Bcl-2的mRNA表达量与NC组和mock组相比均明显下调,差异具有统计学显著性(P<0.01)。NC组和mock组Bax和Bcl-2 mRNA表达量之间的差异无统计学显著性,见图5。
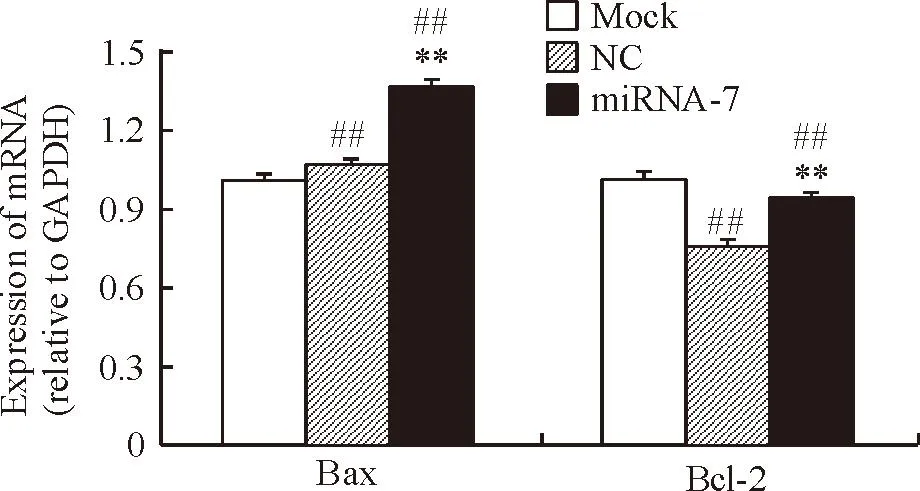
Figure 5. The effect of miRNA-7 transfection on the mRNA expression of Bax/Bcl-2 in human nasopharyngeal carcinoma CNE-1 cells. Mean±SD. n=3.**P<0.01 vs NC;##P<0.01vsmock.
图5miRNA-7对人鼻咽癌CNE-1细胞Bax/Bcl-2 mRNA表达的影响
6miRNA-7对Bax/Bcl-2蛋白表达的影响
miRNA-7组、NC组和mock组Bax蛋白相对内参照的表达量分别为0.38±0.02、0.20±0.02和0.17±0.01,Bcl-2蛋白相对内参照的表达量则分别为0.19±0.01、0.41±0.02和0.45±0.02,提示miRNA-7组CNE-1细胞中的Bax蛋白表达量与NC组和mock组相比均明显上调,差异具有统计学显著性(P<0.01),而Bcl-2的蛋白表达量与NC组和mock组相比则均明显下调,差异具有统计学显著性(P<0.01)。NC组和mock组的Bax和Bcl-2蛋白表达量之间的差异无统计学显著性,见图6。
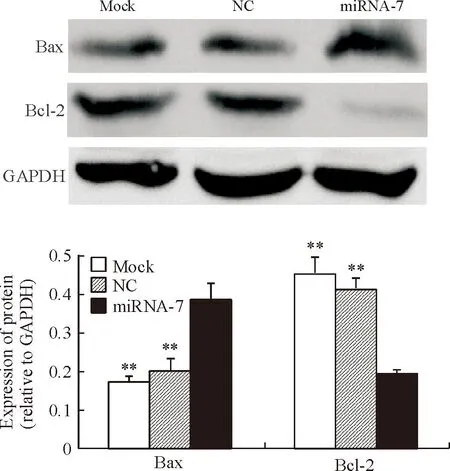
Figure 6. The effect of miRNA-7 transfection on the protein expression of Bax/Bcl-2 in human nasopharyngeal carcinoma CNE-1 cells. Mean±SD. n=3.**P<0.01 vs miRNA-7.
图6miRNA-7转染对鼻咽癌CNE-1细胞对Bax/Bcl-2蛋白表达量的影响
讨论
miRNA是一类长度约19~25个寡核苷酸序列的非编码小RNA,在真核细胞增殖、凋亡等多个生物学活动中发挥着类似癌基因或抑癌基因的作用。miRNA 可以形成复杂的网络调控系统来调控多种mRNA,且存在一定的细胞特异性。人类细胞中仅存在几百个miRNA,且高度保守并具有时序性,而其具体作用机制目前仍不清楚。
研究发现,miR-187*在人结肠癌细胞株中表达下调,而上调miR-187*表达量可显著抑制结肠癌细胞增殖活性,并使结肠癌细胞周期停滞[8]。而miRNA-125a、miRNA-10、miRNA-155等均被研究发现与肿瘤的形成和发展相关。本研究针对的miRNA-7是新近发现的众多miRNA 中的一种,其抑制肿瘤增殖、促进肿瘤细胞凋亡的相关机制已在某些肿瘤中被证实。在研究宫颈癌时发现,miRNA-7可以通过下调XIAP的表达来抑制癌细胞的增殖活力,并促进癌细胞发生凋亡[9]。此外在胃癌、乳腺癌及肝癌中miRNA-7 均可发挥一定的抑癌作用[4-6]。
在鼻咽癌CNE-1细胞中miRNA-7是否可以抑制肿瘤细胞的恶性增殖并促进细胞凋亡过程的发生呢?本研究通过体外转染技术将miRNA-7模拟物导入鼻咽癌CNE-1细胞中进行研究。荧光显微镜观察结果表明鼻咽癌CNE-1细胞的转染效率在90%左右,而real-time PCR结果提示转染后miRNA-7的表达量的确上调了近百倍余,表明转染后miRNA-7在细胞内可呈现过表达状态,这为miRNA-7在短期内发挥其强效生物学活性作用提供了有利支持。转染48 h后,利用CCK-8法检测各组细胞活力,结果显示转染miRNA-7组的鼻咽癌CNE-1细胞活力与NC组和Mock组相比明显受抑制,这表明过表达的miRNA-7可以在体外显著抑制鼻咽癌CNE-1细胞的活力。
Hanahan等[10]研究发现,凋亡与肿瘤的发生发展密切相关。本研究采用Hoechst 33258染色法对转染后的细胞进行观察分析,结果提示转染miRNA-7组的细胞核在荧光显微镜下可看到较多的典型细胞凋亡特征:细胞核固缩,呈致密浓染,核破碎,呈大小不等、形态不规则的碎片状,而NC组和Mock组的细胞核在荧光下呈淡蓝色荧光,大小呈圆形或椭圆形,染色质分布均一,未出现明显的细胞凋亡特征。这表明体外过表达miRNA-7可以显著促进鼻咽癌CNE-1细胞凋亡过程的发生和进展。Bax及Bcl-2作为细胞内最重要的凋亡调控点之一,两者的相对比例是诱导细胞凋亡过程发生的关键因素[11]。因此,为进一步探索miRNA-7促鼻咽癌CNE-1细胞发生的相关机制,本研究应用real-time PCR和Western blot法来分别检测转染后Bax和Bcl-2 mRNA及蛋白的表达变化,结果显示转染后,miRNA-7组CNE-1细胞中Bax mRNA及蛋白与NC组和mock组相比均显著上调,而Bcl-2 mRNA及蛋白则显著下调。这表明体外过表达miRNA-7可能通过调节Bcl-2和Bax直接的平衡关系,使Bax上调处于优势地位,并使Bcl-2下调处于劣势地位,进而打破CNE-1细胞内线粒体结构和功能的稳定性,使鼻咽癌CNE-1细胞的凋亡过程加速进展,最终引发肿瘤细胞凋亡坏死。
综上所述,体外过表达miRNA-7可以显著抑制鼻咽癌CNE-1细胞的生长,促进细胞凋亡坏死,其作用机制可能与miRNA-7调节Bcl-2/Bax直接的平衡比例关系有关。
[参考文献]
[1]Stefani G, Slack FJ. Small non-coding RNAs in animal development[J]. Nat Rev Mol Cell Biol, 2008, 9(3):219-230.
[2]Melo SA, Kalluri R. Molecular pathways: microRNAs as cancer therapeutics[J]. Clin Cancer Res, 2012, 18(16):4234-4239.
[3]Chen HC, Chen GH, Chen YH, et al. MicroRNA deregulation and pathway alterations in nasopharyngeal carcinoma[J]. Br J Cancer, 2009, 100(6):1002-1011.
[4]Zhao X, Dou W, He L, et al.MicroRNA-7 functions as an anti-metastatic microRNA in gastric cancer by targeting insulin-like growth factor-1 receptor[J]. Oncogene, 2013, 32(11):1363-1372.
[5]Yu N, Huangyang P, Yang X, et al. MicroRNA-7 suppresses the invasive potential of breast cancer cells and sensitizes cells to DNA damages by targeting histone methyltransferase SET8[J]. J Biol Chem, 2013, 288(27):19633-19642.
[6]Fang Y, Xue JL, Shen Q, et al. MicroRNA-7 inhibits tumor growth and metastasis by targeting the phosphoinositide 3-kinase/Akt pathway in hepatocellular carcinoma[J]. Hepatology, 2012, 55(6):1852-1862.
[7]孙栋勋,黄栋栋,金巧智,等. miRNA-7通过EGFR/PI3K/Akt通路抑制鼻咽癌5-8F细胞增殖[J]. 中国病理生理杂志, 2014, 30(10):1807-1812.
[8]张丽静,刘博,赵增仁,等. 上调miR-187*表达对人结肠癌细胞株增殖活性的影响[J]. 中国病理生理杂志, 2013, 29(11):1946-1951.
[9]Grozinsky-Glasberg S, Franchi G, Teng M, et al. Octreotide and the mTOR inhibitor RAD001 (everolimus) block proliferation and interact with the Akt-mTOR-p70S6K pathway in a neuro-endocrine tumour cell line[J]. Neuroendocrinology,2008, 87(3):168-181.
[10]Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674.
[11]Tomasin R, Gomes-Marcondes MC. Oral administration ofAloeveraand honey reduces Walker tumour growth by decreasing cell proliferation and increasing apoptosis in tumour tissue[J]. Phytother Res, 2011, 25(4):619-623.
(责任编辑: 卢萍, 罗森)
miRNA-7-mediated Bax/Bcl-2 expression promotes apoptosis of human nasopharyngeal carcinoma CNE-1 cells
SUN Dong-xun1, HUANG Dong-dong1, JIN Qiao-zhi2, CHEN Wu-bing2, CAI Zhi-yi2
(1TheFirstHospitalofJiaxing,Jiaxing314000,China;2DepartmentofOtolaryngology,TaizhouMunicipalHospital,Taizhou318000,China.E-mail:caizy008@tom.com)
[ABSTRACT]AIM: To investigate the relationship of microRNA-7 (miRNA-7) over-expression and Bax/Bcl-2 expression in human nasopharyngeal carcinoma CNE-1 cells.METHODS: The CNE-1 cells were transfected with miRNA-7 mimics using Lipofectamine 2000. The expression of miRNA-7 was detected by real-time PCR. CCK-8 assay and Hoechst 33258 staining were used to detect the cell activity and apoptosis. The expression of Bax/Bcl-2 at mRNA and protein levels was determined by real-time PCR and Western blot. RESULTS: The expression of miRNA-7 was increased significantly in the CNE-1 cells compared with negative control group and mock group (P<0.01). The activity of CNE-1 cells were extremely decreased after tansfected with miRNA-7 mimics (P<0.01). The typical apoptotic nuclear morphological changes were observed in the CNE-1 cells under the fluorescence microscope with Hoechst 33258 staining. The expression of Bax at mRNA and protein levels was significantly increased compared with the other 2 groups (P<0.01), while the Bcl-2 expression at mRNA and protein levels was significantly down-regulated (P<0.01).CONCLUSION: Over-expression of miRNA-7 significantly inhibits the growth and promotes the apoptosis of nasopharyngeal carcinoma CNE-1 cells by increasing the expression of Bax and down-regulating Bcl-2.
[KEY WORDS]MicroRNA-7; Bax; Bcl-2; Nasopharyngeal carcinoma; Apoptosis
[文章编号]1000- 4718(2016)05- 0933- 05
[收稿日期]2015- 03- 20[修回日期] 2016- 03- 21
*[基金项目]浙江省医药卫生科技项目(No. 2013KYB293)
通讯作者△Tel: 0576-88858023; E-mail: caizy008@tom.com
[中图分类号]R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.028
杂志网址: http://www.cjpp.net
