脂肪源性血管基质成分对皮肤光老化的影响*
2016-06-06王婧薷陈苑雯李升红张志丹谢光辉刘宏伟
王婧薷, 陈苑雯, 李 朦, 李升红, 廖 选, 张志丹, 谢光辉, 刘宏伟△
(暨南大学 1附属第一医院整形外科, 2生命科学技术学院再生医学教育部重点实验室,广东 广州 510632)
脂肪源性血管基质成分对皮肤光老化的影响*
王婧薷1,2,陈苑雯1,2,李朦1,2,李升红1,廖选1,张志丹1,谢光辉1,刘宏伟1,2△
(暨南大学1附属第一医院整形外科,2生命科学技术学院再生医学教育部重点实验室,广东 广州 510632)
[摘要]目的: 观察人脂肪源性血管基质成分 (stromal vascular fractions, SVF) 对中波紫外线(ultraviolet B, UVB) 诱导的裸大鼠皮肤光老化的影响。方法: 6周龄裸大鼠随机分为正常对照组及实验组,实验组持续UVB照射8周建立皮肤光老化模型并随机分为模型组,以及SVF低剂量 (low-dose, LD)、中剂量(middle-dose, MD) 和高剂量 (high-dose, HD) (100 μL悬液中的细胞数分别为104、105和106) 治疗组;采用酶消化法提取健康女性脂肪组织中的SVF,分别取低、中、高剂量的SVF悬液注射于裸大鼠背部皮下;模型组注射相同剂量的生理盐水,正常对照组不做任何处理;7 d后取材,观察注射部位表皮厚度及结构的改变;28 d后取材观察注射部位真皮厚度及结构的改变。结果: SVF治疗7 d后,中、高剂量治疗组裸大鼠皮肤较实验对照组表皮层厚度减小、角质层比例下降、基底层处于异常增殖状态的细胞核减少(P<0.05)。治疗28 d后,中剂量及高剂量治疗组I型胶原蛋白mRNA相对表达量增加,III型胶原蛋白及基质金属蛋白酶-3 (matrix metalloproteinases-3, MMP-3) mRNA相对表达量下降(P<0.05),高剂量治疗组皮肤真皮层厚度增加(P<0.05)。结论: SVF具有抗皮肤光老化的潜能,有潜在的临床应用价值。
[关键词]血管基质成分; 脂肪源性干细胞; 光老化
皮肤作为人体最大的器官,其衰老是机体衰老最直观的表现形式。皮肤老化是一个复杂的生物学过程,受内源性(遗传、心理等)及外源性因素的影响[1]。在这些因素的共同作用下,皮肤的结构、功能及外观均发生了改变。
日光中所含的紫外线(ultra violet, UV)照射(光老化)是外源性皮肤老化的关键因素,其中中波紫外线(ultra violet B, UVB) 被认为对皮肤皱纹的产生起关键作用[2]。长期接触UV的皮肤表现为粗糙、皱纹深乱、失去弹性,而胶原纤维作为人体皮肤的主要结构蛋白,是维持皮肤张力及饱满充盈的基础。在成年人皮肤中,I型胶原约占皮肤胶原含量的80%,III型胶原约占10%~15%,日光照射可影响I型胶原蛋白的形成,使幼稚的III型胶原含量相对增加,最终导致成熟的胶原束减少,造成皮肤的老化、松弛[3]。UV照射还可刺激真皮炎症反应,激活血管周围的炎性递质及细胞因子,导致溶解酶的产生,从而缓慢溶解真皮成分[4],细胞外基质持续或反复的蛋白酶解是皮肤光老化过程的基本特质之一,细胞外基质合成与降解失衡造成真皮不完全修复也是皮肤皱纹形成的重要原因[5],其中基质金属蛋白酶(matrix metalloproteinases, MMPs)家族的协同作用对细胞外基质的降解起了重要作用,又以基质金属蛋白酶-1(matrix metalloproteinase-1, MMP-1)及基质金属蛋白酶-3(matrix metalloproteinase-3, MMP-3)最为主要。光老化的组织学改变除了表现在真皮层外,同样存在表皮的改变,包括角化过度、表皮层的不规则增厚或萎缩、基底层细胞的异常增殖等[4]。
细胞治疗是现有医学领域的前沿治疗方式,干细胞用于创面愈合及肿瘤等的治疗已得到研究及应用,而将其用于抗衰老的研究仍然有限。2001年,Zuk等[6]在抽脂术所获得的脂肪组织中证实存在一群间充质来源的成体干细胞——脂肪源性干细胞(adipose-derived stem cells,ADSCs)后,已有相关文献证实ADSCs可通过旁分泌和自分泌作用促进成纤维细胞增殖、分泌及迁移,同时促进血管再生以参与皮肤组织损伤的修复和结构重建[7-10],以往的研究也已提出ADSCs可通过抗氧化、激活成纤维细胞,促进其分泌胶原蛋白等途径改善老化的皮肤[11-12]。血管基质成分(stromal vascular fractions,SVF)是一组含丰富ADSCs的混合细胞群,ADSCs的含量在20%~30%[13],同时还含有血管内皮细胞、脂肪细胞、周细胞等多种细胞成分,而现少有文献对SVF对光老化皮肤的影响进行报道。本课题组通过UVB诱导裸大鼠皮肤光老化模型,将SVF皮下注射用于皮肤光老化的治疗,观察SVF对光老化皮肤的影响。
材料和方法
1一般资料
脂肪组织(来源于暨南大学附属第一医院整形外科抽脂的健康年轻女性6人,年龄在28~34岁,已获得病人的知情同意);裸大鼠[雌性,15只,6周龄,体重100 g±5 g,由北京维通利华实验动物有限公司提供,许可证号为SCXK(京)202012-0001]。
2主要方法
2.1SVF的提取利用脂肪抽吸技术抽取健康成年女性大腿或腹部皮下脂肪组织,去除纤维结缔组织成分,置于离心管内,用PBS缓冲液清洗2~3次,加入等体积1% I型胶原酶,37 ℃环境振荡消化30 min,300×g离心10 min,加入完全培养基(DMEM + 10%FBS + 1%双抗)终止消化,使用200目筛网过滤后300×g离心10 min,所得沉淀即为SVF[14]。运用流式细胞术鉴定SVF中ADSCs含量,鉴定表面标志物,包括CD105、CD59、CD44、CD45、CD34、CD29和HLA-DR。
2.2SVF中ADSCs的体外培养前述方法提取SVF后,采用完全培养基重悬SVF,接种于细胞培养瓶内,此为原代细胞(P0),于5% CO2培养箱内培养,每3 d换液,待细胞长至80%~90%融合时,按1∶3的比例进行传代。取P3代细胞进行流式细胞术鉴定及成脂、成骨和成软骨诱导。
2.3动物分组及裸大鼠皮肤光老化模型建立15只6周龄裸大鼠饲养于暨南大学实验动物管理中心,在SPF环境内适应性饲养1周,随机分为正常对照组、模型组、SVF低剂量治疗组、SVF中剂量治疗组及SVF高剂量治疗组。除正常对照组外,其余实验组采用自制UVB照射灯箱(UVB灯管波长290~320 nm,15 W,2只,灯箱高度50 cm)照射,裸大鼠可在灯箱内自由活动。照射方式[15]:第1周60 mJ/cm2,第2周120 mJ/cm2,第3周180 mJ /cm2,第4~8周240 mJ/cm2,每周5次,共8周,总照射剂量为7.8 J/cm2。
2.4注射方式的选取取SD大鼠3只,背部脱毛处理,1 mL注射器皮下注射美蓝溶液100 μL,观察美蓝溶液的扩散范围并做测量。
2.5细胞注射注射前3 d停止UVB辐照,根据方法2.4中注射方式及剂量的探索,使用10%水合氯醛麻醉裸大鼠后于其背部皮肤皮下注射100 μL SVF。根据相关文献报道[9-10],各组细胞含量分别为:SVF低剂量(low-dose, LD)组:104;中剂量(middle-dose, MD)组:105;高剂量组(high-dose, HD)组:106。模型组和正常对照组注射等剂量生理盐水。分别于注射后7 d及28 d后使用皮肤取样器钻取6 mm直径组织,4%多聚甲醛固定用于制作石蜡切片。28d后处死所有动物,取剩余皮肤组织冻存于液氮罐内备用。
2.6HE染色皮肤样品于4%多聚甲醛固定48 h,脱水透明后进行石蜡包埋,蜡块连续切片(4 μm),黏附于多聚赖氨酸处理过的玻片上。取各组石蜡切片二甲苯脱蜡、梯度乙醇水化,苏木精染液及0.5%伊红溶液染色,梯度乙醇脱水后中性树胶封片。倒置相差显微镜下拍照,ImageJ软件测量真表皮厚度。
2.7Real-time PCR测定I型胶原蛋白、Ⅲ型胶原蛋白及MMP-3 mRNA相对表达水平取保存在液氮中的皮肤组织50 mg,提取样本皮肤组织的总RNA,并使用1%凝胶电泳检测所提取总RNA的质量,测定浓度并定量后采用逆转录试剂盒(Toyobo)完成逆转录。取逆转录后cDNA使用SYBR Green I嵌合荧光法进行PCR检测。引物设计:内参照β-actin上游引物为5’-GAGTACAACCTTCTTGCAGCTC-3’, 下游引物为5’-CATACCCACCATCACACCCTG-3’,扩增长度198 bp;collagenⅠ上游引物为5’-GATGGACTCAACGGTCTCCC-3’,下游引物为5’-CGGCCACCATCTTGAGACTT-3’,扩增长度143 bp;collagenⅢ上游引物为5’-CTGAAGGGCAGGGAACAACT-3’,下游引物为5’-ATCCCGAGTCGCAGACACATA-3’,扩增长度270 bp;MMP-3上游引物为F:5’-CAGGCATTGGCACAAAGGTG-3’,下游引物为5’-CTGAAACACACGACGCCTTC-3’,扩增长度174 bp。数据采用2-ΔΔCt法计算。
2.8免疫组化取7 d的皮肤样本石蜡切片,二甲苯脱蜡、梯度乙醇水化,置于柠檬酸钠缓冲液(pH 6.0)中,移入微波炉进行微波抗原修复10 min;自然冷却至室温后0.3% Triton X-100室温孵育15 min;3% H2O2浸泡20 min去除内源性过氧化氢酶;滴加山羊血清封闭液,室温封闭20 min,滴加兔抗大鼠Ki67多克隆Ⅰ抗抗体工作液(Abcam,1∶100稀释),4 ℃冰箱过夜;第2天取出PBS浸洗后滴加山羊抗兔IgG抗体,37 ℃孵育30 min,DAB显色剂显色;苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察,细胞核呈棕黄色为阳性染色;每张切片随机选取10个高倍镜(×400)视野,测定每个视野下阳性细胞的阳性率。
3统计学处理
应用SPSS 13.0统计软件分析,计量资料用均数±标准差(mean±SD)表示,各组数据采用完全随机设计资料的方差分析,以P<0.05为差异有统计学意义。
结果
1SVF流式细胞仪标记鉴定
正常人脂肪组织提取SVF所含ADSCs百分比为25.79%±5.70%。
2SVF中所含ADSCs体外培养的形态学观察及鉴定
原代培养的ADSCs在贴壁后充分伸展,呈长梭形,单个或集落样生长。流式细胞仪标记表面标记物显示CD29、CD59、CD44和CD105阳性表达,阳性率分别为86.13%、97.14%、99.56%和66.95%;CD34、CD45和HLA-DR阴性表达,表达率分别为5.36%、2.70%和3.01%。取P3代细胞成脂诱导后油红O染色,在显微镜下可见油滴状脂肪组织;经成骨诱导后茜素红染色,可见聚成团的骨组织被染成红色;经成软骨诱导后阿新蓝染色,可在显微镜下观察到成块状的软骨组织被染成浅蓝色。说明本实验组所获得细胞为ADSCs,见图1。
3皮下注射美蓝溶液的扩散范围
大鼠皮下注射100 μL美蓝溶液后可见注射液向周边组织扩散,呈直径约1.5 cm大小类圆形。
4经SVF治疗后裸大鼠皮肤表皮厚度及角质层的改变
HE染色可见,经UVB照射后皮肤表皮层全层明显增厚,且角质层在表皮中所占比例明显增加,经SVF治疗后,前述指标均有改变。经统计学分析,治疗后7 d,中、高剂量组表皮厚度较对照组减小(P<0.05),表皮角质层比例降低(P<0.05),说明中、高剂量的SVF可减少光老化皮肤表皮层厚度及角质层所占的比例,见图2。
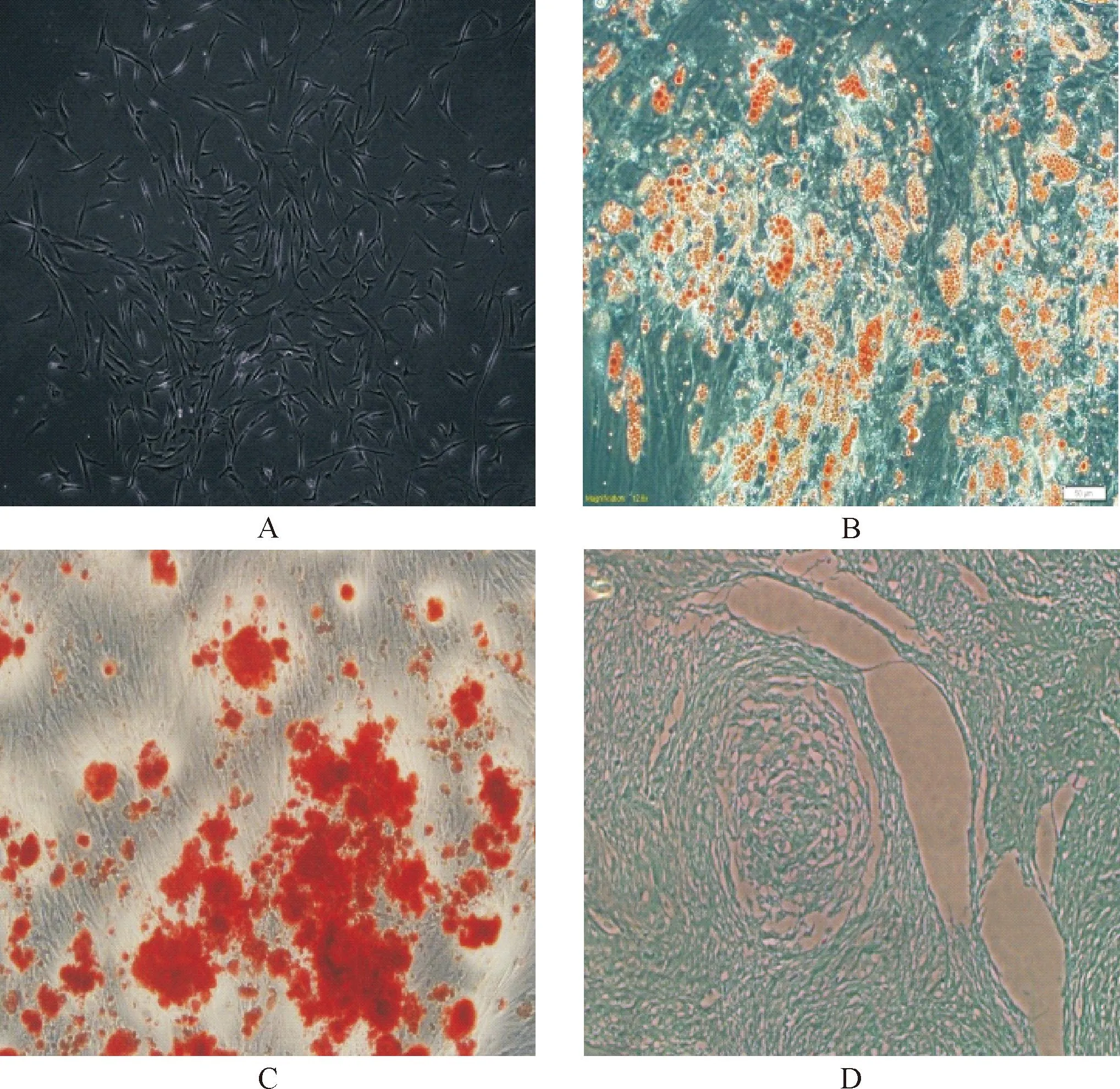
Figure 1.Multilineage differentiation potential of adipose-derived stem cells (ADSCs)(×100). A: ADSCs in vitro; B: Oil Red O staining; C: Alizarin red staining; D: Alcian blue staining.
图1脂肪源性干细胞多分化潜能鉴定
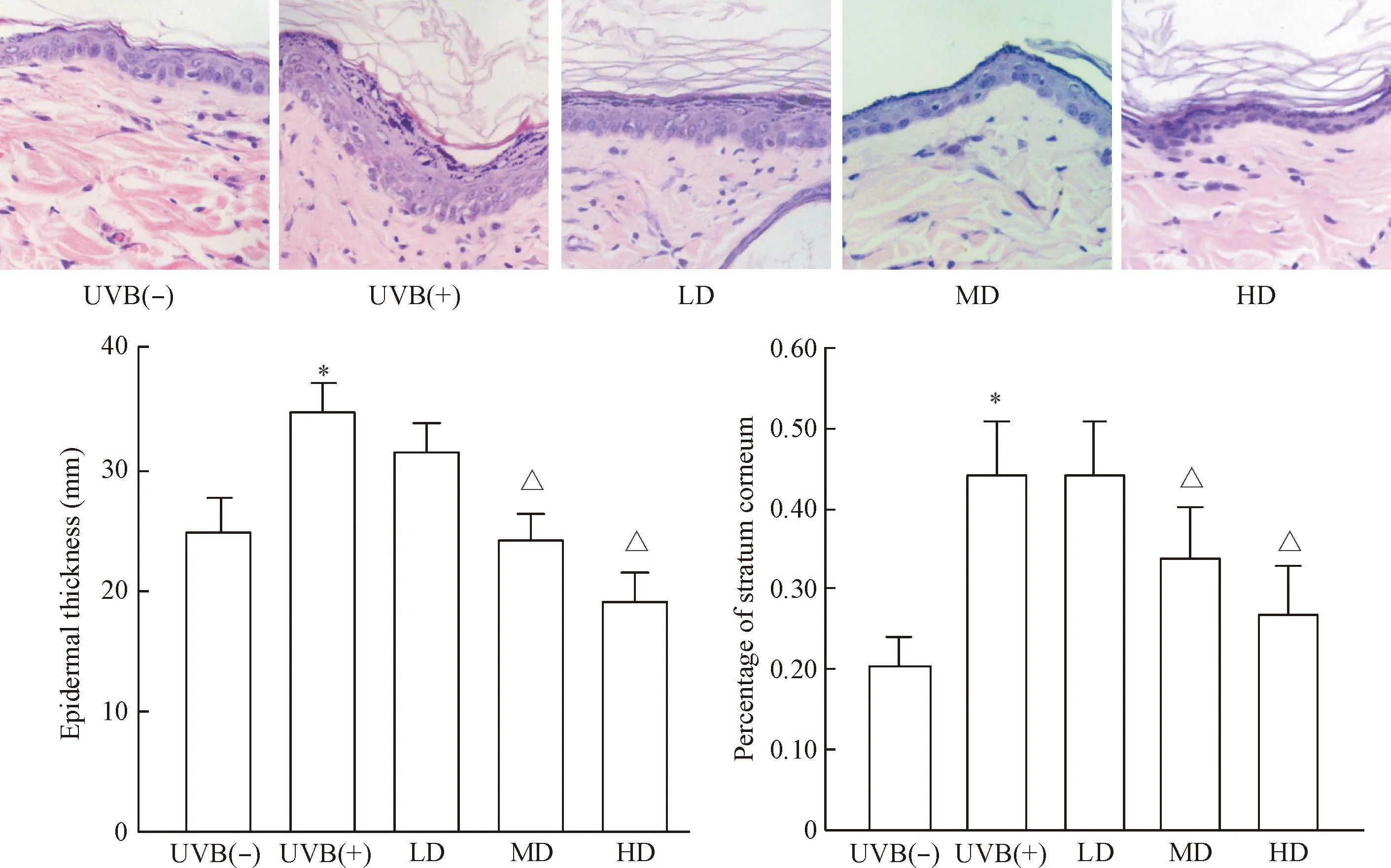
Figure 2.HE staining showed the changes of epidermal thickness of nude rats exposed to UVB 7 d after SVF treatment (×400).Mean±SD. n=6.*P<0.05 vs UVB(-) group;△P<0.05 vs UVB(+) group.
图2HE染色显示UVB诱导皮肤光老化裸大鼠经SVF治疗7 d后表皮的变化
5表皮基底层细胞核增殖情况分析
UVB照射后,表皮基底细胞层处于增殖状态的细胞核明显增多,基底层细胞排列紊乱,经SVF治疗后,可见各组基底层细胞处于增殖状态的细胞核明显减少。治疗7 d后,SVF各剂量组表皮基底层处于增殖状态的细胞核均有减少(P<0.05),说明各剂量组SVF可有效抑制UVB照射引起的基底层细胞的异常增殖,见图3。
6经SVF治疗后真皮厚度的改变
治疗7 d后各剂量组真皮厚度均无明显改变,此部分阴性数据未给出。HE染色可见,经UVB照射后皮肤真皮层变薄,治疗28 d后SVF高剂量治疗组真皮厚度增加(P<0.05),说明高剂量的SVF可增加光老化皮肤真皮厚度,见图4。
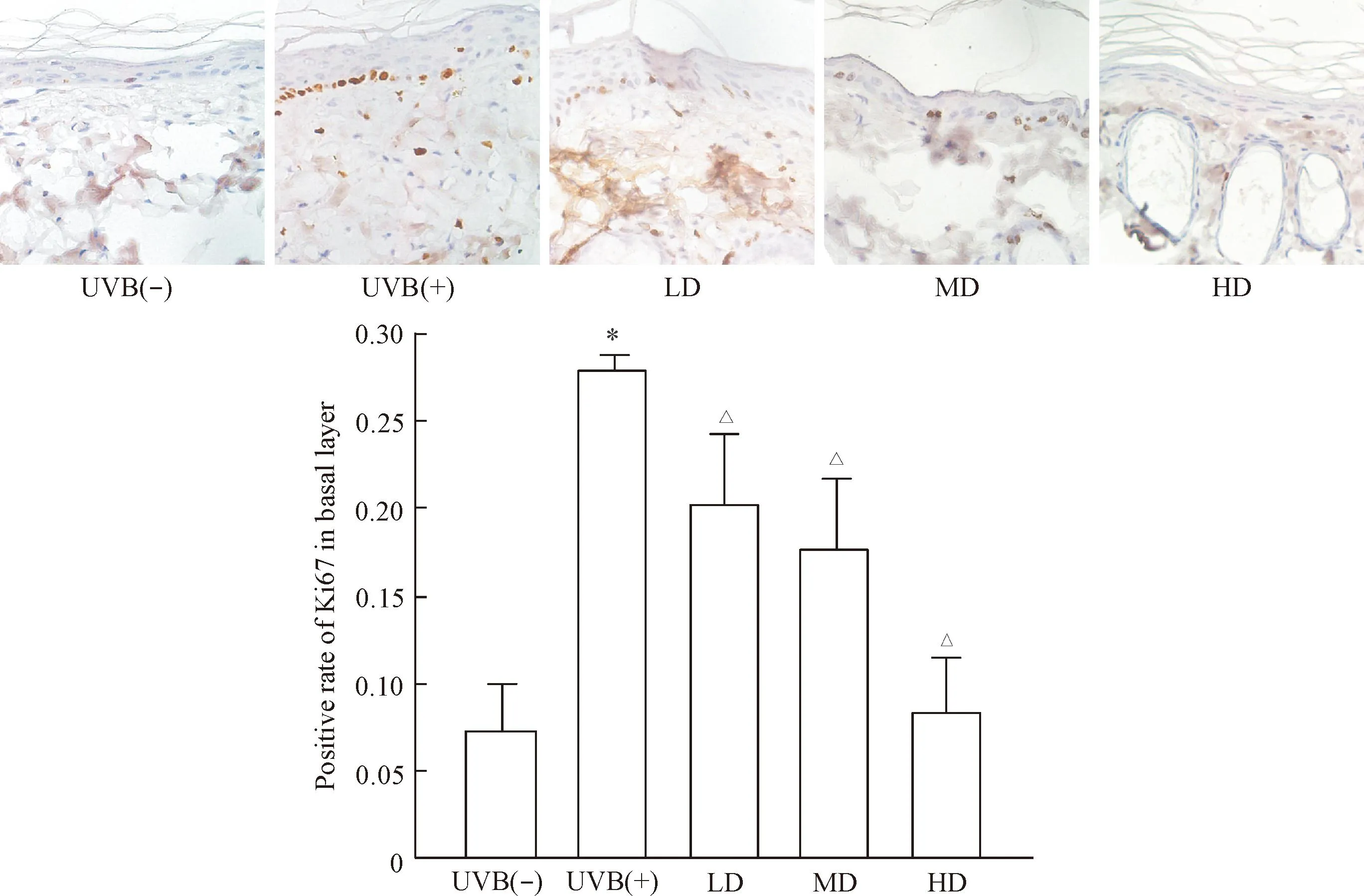
Figure 3.Ki67 immunostaining showed the proliferation of basal cells of nude rats exposed to UVB and 7 d after SVF treatment (×400). Mean±SD. n=6.*P<0.05 vs UVB(-) group;△P<0.05 vs UVB(+) group.
图3Ki67免疫组织化学染色显示SVF对UVB诱导皮肤光老化裸大鼠表皮基底层细胞核增殖能力的影响
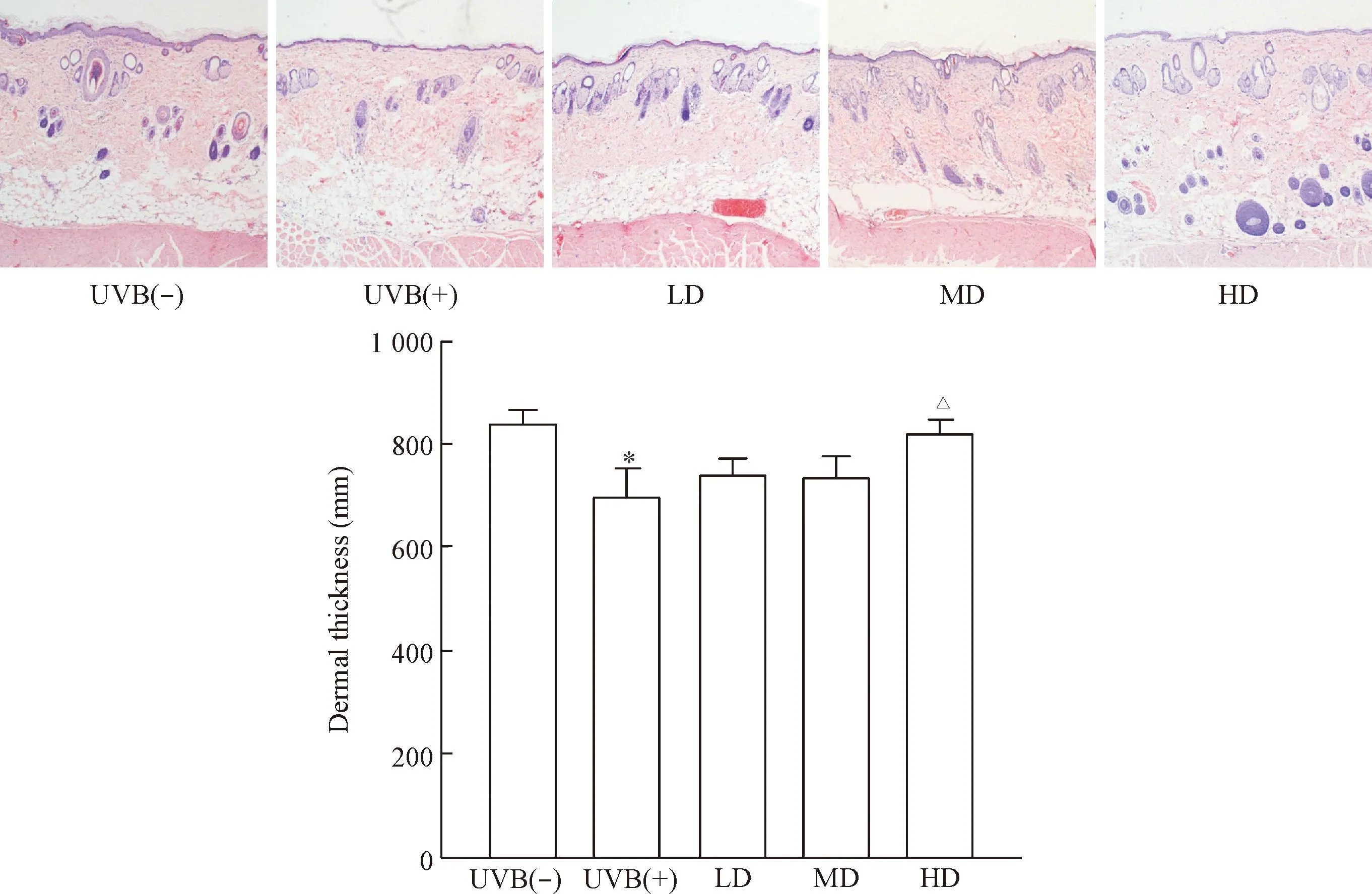
Figure 4.HE staining showed the changes of dermal thickness of nude rats exposed to UVB 28 d after SVF treatment (×40). Mean±SD. n=6.*P<0.05 vs UVB(-) group;△P<0.05 vs UVB(+) group.
图4HE染色显示UVB诱导皮肤光老化裸大鼠经SVF治疗28 d后真皮层的变化
7真皮内I型胶原蛋白、III型胶原蛋白及MMP-3 mRNA相对表达量的改变
治疗7 d后各剂量组I、III型胶原蛋白及MMP-3 mRNA相对表达量无明显改变,此部分阴性数据未给出。治疗28 d后,SVF各治疗组真皮内I型胶原蛋白浓度增加,III型胶原蛋白浓度下降,中、高剂量组胶原蛋白mRNA相对表达量改变有统计学差异(P<0.05);参与胶原蛋白降解的MMP-3 mRNA相对表达量减少,仅高剂量组有统计学意义(P<0.05),说明中、高剂量的SVF可上调I型胶原蛋白mRNA相对表达量,下调III型胶原蛋白mRNA的表达,高剂量的SVF可下调MMP-3 mRNA的表达,见图5~7。
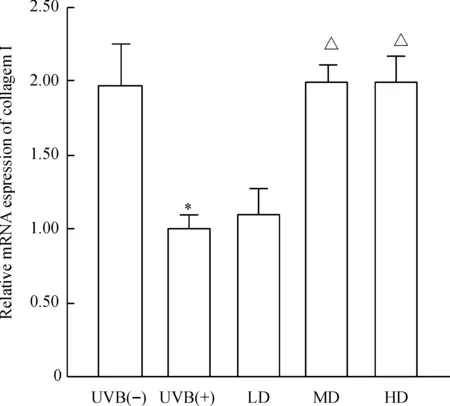
Figure 5.Real-time PCR showed the relative mRNA expression of collagen I of nude rats exposed to UVB 28 d after SVF treatment. Mean±SD. n=6.*P<0.05 vs UVB(-) group;△P<0.05 vs UVB(+) group.
图5Real-time PCR测定UVB诱导皮肤光老化裸大鼠经SVF治疗后28 d皮肤I型胶原蛋白mRNA的相对表达量
讨论
细胞治疗作为一种全新的治疗方式,已经成为现代医学发展的重要方向。干细胞可通过不断的分化及自我修复达到组织再生与修复的目的,胚胎干细胞曾被认为是最好的干细胞来源,然而胚胎干细胞在应用中存在的伦理问题及其潜在的致癌可能阻碍了它的临床应用。成体干细胞源于发育过程完成之后,同时又具有分化潜能而越来越受到关注。近年来,基于SVF用于促进伤口愈合、组织修复、外周性血管疾病等的相关报道日益增多[16-17],而少有其对皮肤光老化影响的报道。SVF广泛存在于皮下脂肪组织中,通过简单的脂肪抽吸手术即可大量获得,病人承受的痛苦小,临床可实现即取即用;同时其利用过程无外源性物质的接触,规避了细胞治疗中可能存在的生物安全性问题,降低了感染的风险。经我们的实验发现,SVF能有效改善光老化引起的皮肤表皮层及表皮角质层增厚,基底层细胞核异常增殖,真皮层变薄等老化现象,具有抗皮肤光老化的潜能。
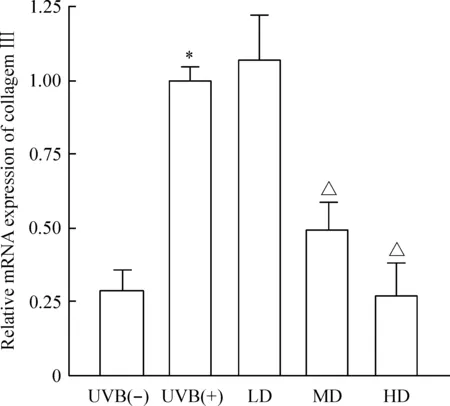
Figure 6.Real-time PCR showed the relative mRNA expression of collagen III of nude rats exposed to UVB 28 d after SVF treatment. Mean±SD. n=6.*P<0.05 vs UVB(-) group;△P<0.05 vs UVB(+) group.
图6Real-time PCR测定UVB诱导皮肤光老化裸大鼠经SVF治疗后28 d皮肤III型胶原蛋白mRNA的相对表达量
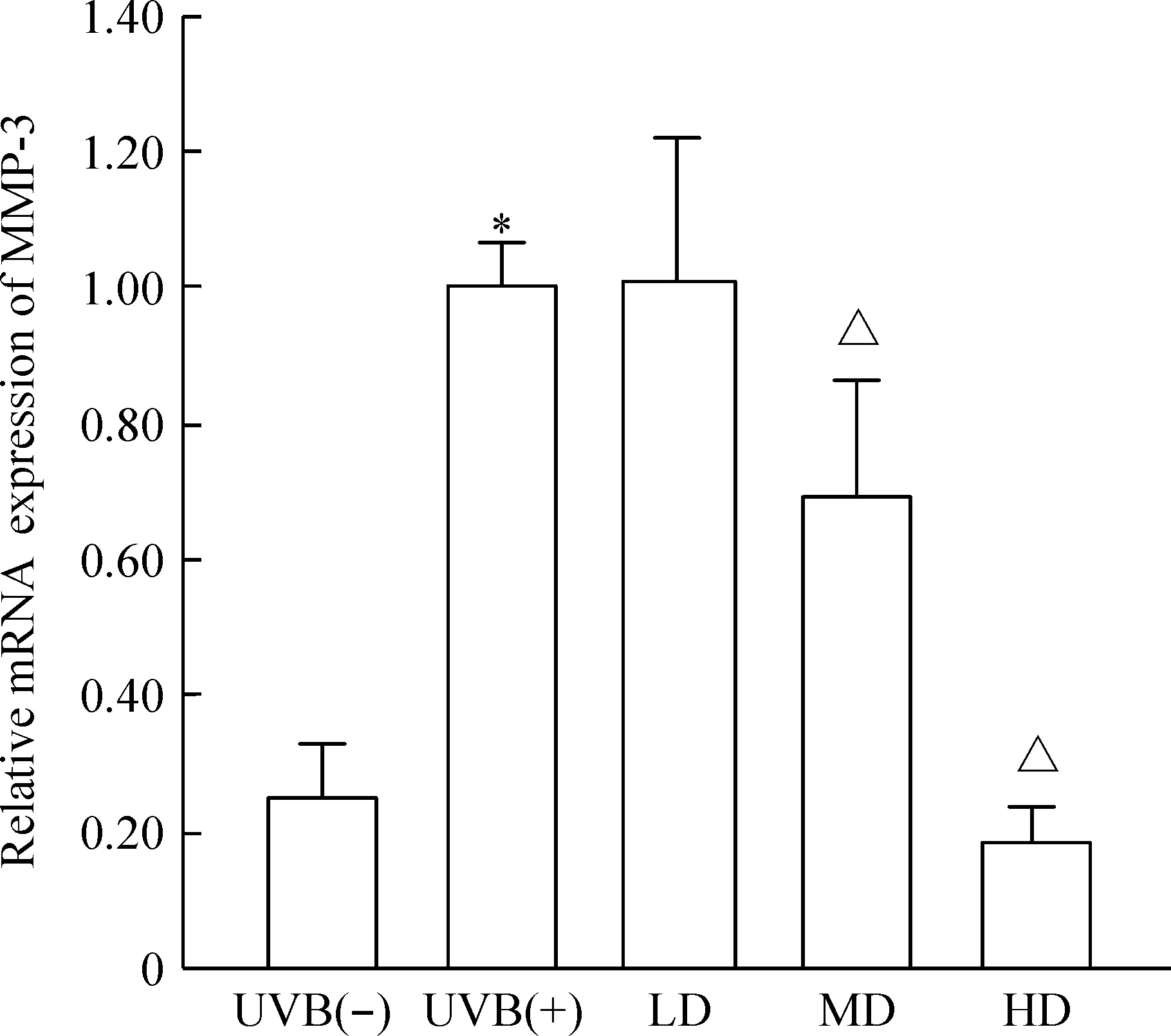
Figure 7.Real-time PCR showed the relative mRNA expression of MMP-3 of nude rats exposed to UVB 28 d after SVF treatment. Mean±SD. n=6.*P<0.05 vs UVB(-) group;△P<0.05 vs UVB(+) group.
图7Real-time PCR测定UVB诱导皮肤光老化裸大鼠经SVF治疗后28 d皮肤MMP-3 mRNA的相对表达量
正常皮肤表皮更新一次大约需要28 d,但在发生异物入侵和角质层遭到破坏时,基底细胞分裂变得旺盛,加快更新的速度,藉以排除异物和修复;在皮肤受到化学(有机溶剂等)或物理(UVB等)刺激时,可引起表皮增生及异常角化[18],出现角质层的异常增厚。在我们的实验中,UVB照射后的裸大鼠表皮组织明显增厚,这一现象同时发生在表皮的生发层与角质层中,且角质层细胞所占比例明显增加;同时可见UVB照射后表皮基底层细胞排列紊乱,部分细胞核形态发生改变,UV诱导的角质形成细胞的DNA损伤在没有被修复的情况下可致细胞异常增殖[19-20]。UV辐射诱导表皮角质形成细胞增殖途径是细胞对抗凋亡的适应性过程,Ki67是一种增进细胞周期调节蛋白,对DNA合成的调节起重要作用[22]。在SVF及皮下注射后,表皮基底层处于增殖状态的细胞明显减少,这一效果在SVF达到105、106细胞(100μL)时非常明显,其处于增殖期的细胞核基本与正常皮肤组织相同,这说明SVF对表皮抗UV损伤具有重要的调节作用,但其作用机制仍需进一步探讨。我们认为这可能通过2种途径对抗UV引起的表皮损伤从而改善增厚的表皮组织:(1)有效抑制基底层细胞的异常过度增殖,从而有效抑制表皮细胞的过度角化;(2)通过调节作用,加速表皮组织细胞的角化及更新的速度,促进表皮细胞更新,使表皮组织重新恢复平衡状态。
皮肤光老化的改善与创面愈合都是皮肤的修复过程,其机制存在着一定的共性。已有研究报道成体干细胞通过分泌细胞因子促进成纤维细胞的增殖及新生血管的形成,促进肉芽组织的生长及上皮化,从而达到促进创面愈合的目的[7-8]。在我们的实验中观察到SVF皮下注射可增加裸大鼠真皮厚度,促进真皮中I型胶原蛋白mRNA表达,抑制III型胶原蛋白mRNA的表达,胶原蛋白占人体真皮蛋白含量的约90%,其中主要为I型胶原蛋白(85%~95%)及III型胶原蛋白(10%~15%)[2],随着年龄的增加,在身体同一部位皮肤I型胶原蛋白含量减少,III胶原比例增加,这一表现在UVB暴露区更加明显[21-22],胶原蛋白含量的减少及不同成分胶原蛋白比例的改变,使皮肤变得松弛,塌陷,从而形成皱纹[1,23]。中、高剂量组的SVF能有效改善真皮组织中I/III型胶原蛋白的比例,使其更加接近年轻、健康的皮肤组织。ADSCs为SVF的主要细胞成分,已有文献报道证实ADSCs可有效增加真皮层厚度及胶原蛋白含量,从而改善了皮肤表面的皱纹[1,18],其亦可通过促进刺激成纤维细胞分泌胶原蛋白修复真皮组织[9,11,13]。MMPs是一个含锌的蛋白酶家族,MMPs通过降解细胞外基质引起组织损伤从而导致皱纹的形成[24]。过量的UV照射可以增加角质细胞、成纤维细胞、炎症细胞等对MMPs的分泌,MMP-1、MMP-3和MMP-9可被UV照射诱导分泌,对与皮肤质量密切相关的I型胶原蛋白,MMP-1启动胶原纤维断裂程序,MMP-3则进一步将其降解[25],真皮组织中MMP-3含量的多少直接影响了胶原蛋白的降解效率。我们的实验中观察到SVF皮下注射有效减少真皮组织中MMP-3 mRNA的相对表达量,这一作用可能是通过减缓胶原蛋白的降解速率,改善胶原合成与降解的失平衡状态,从而增加胶原蛋白含量以改善老化的皮肤。
综上所述,我们此次的研究通过观察真、表皮厚度、结构,真皮胶原蛋白及MMP-3 mRNA的相对表达量,表皮基底层细胞核增殖能力的变化,在表观学、组织学及mRNA表达方面证实了SVF改善皮肤光老化的潜能,为SVF在改善皮肤光老化临床转化应用提供理论依据。
[参考文献]
[1]Ganceviciene R, Liakou AI, Theodoridis A, et al. Skin anti-aging strategies[J]. Dermatoendocrinol, 2012, 4 (3):308-319.
[2]居永芳. 皮肤老化机制的研究进展[J]. 中国麻风皮肤病杂志, 2006, 22(2):143-146.
[3]刘玮. 皮肤光老化[J]. 临床皮肤科杂志, 2003, 32 (7):424-426.
[4]冯燕艳, 普雄明. 皮肤自然衰老及光老化[J]. 国外医学:皮肤性病学分册, 2004, 30(6):354-356.
[5]Fisher GJ, Wang ZQ, Datta SC, et al. Pathophysiology of premature skin aging induced by uhraviolet light[J]. N Engl J Med, 1997, 337(20):1419-1428.
[6]Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J]. Tissue Eng, 2001, 7(2):211-218.
[7]Rehman J, Traktuev D, Li J, et al. Secretion of angioge-nic and antiapoptotic factors by human adipose stromal cells[J]. Circulation, 2004, 109(10):1292-1298.
[8]Kim WS, Park BS, Sung JH. The wound-healing and antioxidant effects of adipose-derived stem cells[J]. Expert Opin Biol Ther, 2009, 9(7):879-887.
[9]Kim BH, Son WC, Yim CO, et al. Anti-wrinkle effects of adipose tissue-derived mesenchymal stem cells in a UV-irradiated hairless mouse model[J]. Tissue Eng Regen Med, 2010, 7(5):583-591.
[10]Kim WS, Park BS, Park SH, et al. Anti-wrinkle effect of adipose-derived stem cell: activation of dermal fibroblast by secretory factors[J]. J Dermatol Sci, 2009, 53 (2):96-102.
[11]Kim WS, Park BS, Sung JH. Protective role of adipose-derived stem cells and their soluble factors in photo-aging[J]. Arch Dermatol Res, 2009, 301(5):329-336.
[12]Kim WS, Park SH, Ahn SJ, et al. Whitening effect of adipose-derived stem cells a critical role of TGF-beta 1[J]. Biol Pharm Bull, 2008, 31 (4):606-610.
[13]Park BS, Jang KA, Sung JH, et al. Adipose-derived stem cells and their secretory factors as a promising therapy for skin aging[J]. Dermatol Surg, 2008,34 (10):1323-1326.
[14]Alharbi Z, Opländer C, Almakadi S, et al. Conventional vs. micro-fat harvesting: how fat harvesting technique affects tissue-engineering approaches using adipose tissue-derived stem/stromal cells[J]. J Plast Reconstr Aesthet Surg, 2013, 66(9):1271-1278.
[15]Bissett DL, Hannon DP, Orr TV. An animal model of solar-aged skin: Histological 7 and physical 7 and visible changes in UV-irradiated hairless mouse skin[J]. Photochem Photobiol, 1987, 46(3):367-378.
[16]Klumpers DD, Mooney DJ, Smit TH. From skeletal development to tissue engineering: lessons from the micromass assay[J]. Tissue Eng Part B Rev, 2015, 21 (5):427-437.
[17]Zhou L, Xia J, Qiu X, et al. In vitro evaluation of endothelial progenitor cells from adipose tissue as potential angiogenic cell sources for bladder angiogenesis[J]. PLoS One, 2015,10(2):e0117644.
[18]潘敏洪, 周晓军, 姜少军. 皮肤角质层及其损伤的研究进展[J]. 医学研究报, 2006, 19 (11):1036-1039.
[19]Karmer E, Herman O, Frand J, et al. Ki67 as a biologic marker of basal cell carcinoma: a retrospective study[J]. Isr Med Assoc J, 2014, 16(4):229-232.
[20]Ichihasi M, Ueda M, Bidiyanto A, et al. UV-induced skin damage[J]. Toxicology, 2003, 189(1-2):21-39.
[21]石钰, 李利, 王曦. 老化皮肤的胶原与弹性组织变化研究[J]. 中国美容医学, 2007, 16(6):727-730.
[22]Schwartz E, Cruickshank FA, Christensen CC, et al. Collagen alterations in chronically sun-damaged human skin[J]. Photochem Photobiol, 1993, 58(6):841-844.
[23]Kim JH, Jung M, Kim HS, et al. Adipose-derived stem cells as a new therapeutic modality for ageing skin[J]. Exp Dermatol, 2011, 20(5):383-387.
[24]Kim HH, Lee MJ, Lee SR, et al. Augmentation of UV-induced skin wrinkling by infrared irradiation in hairless mice[J]. Mech Ageing Dev, 2005, 126(11):1170-1177.
[25]郑锦芬, 陆春, 赖维. 基质金属蛋白酶与皮肤光老化[J]. 中华医学美学美容杂志, 2012, 18(1):75-77.
(责任编辑: 林白霜, 罗森)
Anti-aging effect of stromal vascular fractions in photoaging skin
WANG Jing-ru1, 2, CHEN Yuan-wen1, 2, LI Meng1, 2, LI Sheng-hong1, LIAO Xuan1, ZHANG Zhi-dan1, XIE Guang-hui1, LIU Hong-wei1, 2
(1DepartmentofOrthopedics,TheFirstAffiliatedHospital,2KeyLaboratoryofMinistryofEducationforRegenerativeMedicine,CollegeofLifeScienceandTechnology,JinanUniversity,Guangzhou510632,China.E-mail:liuhongwei0521@hotmail.com)
[ABSTRACT]AIM: To investigate the anti-aging effect of the stromal vascular fractions (SVF) injection in photo-aging skin of nude rats. METHODS: Six-week-old nude rats were divided into control group and photoaging group. The nude rats in photoaging group were continuously irradiated with ultraviolet B (UVB) for 8 weeks to build the photoaging skin model, and were randomly divided into placebo group, and low-dose (LD), middle-dose (MD) and high-dose (HD) SVF treatment groups. The human SVF was obtained by trypsin digestion from the adipose tissue in healthy females, and was subcutaneously injected into the back skin of photoaging nude rats in LD, MD and HD SVF treatment groups (104,105 and 106 cells in 100 μL suspension, respectively). The animals in photoaging skin model group were treated with placebo. Control group did not have any intervention. The changes in the thickness of epidermis and histology after 7 d and the thickness of the dermis and histology after 28 d were examined. RESULTS: The thickness of the epidermis was thinner in MD and HD SVF treatment groups than that in photoaging skin model group after 7 d (P<0.05). The percentage of stratum corneum and the abnormal proliferation of the epidermal basal cell layer were reduced (P<0.05). After 28 d, MD and HD SVF treatment groups showed that the content of collagen I was higher than that in photoaging skin model group (P<0.05), and the contents of collagen III and MMP3 were decreased (P<0.05). The dermis in HD group was thicker than that in photoaging skin model group (P<0.05).CONCLUSION: SVF may have anti-aging potential in photoaging skin and also has clinical application value.
[KEY WORDS]Stromal vascular fractions; Adipose-derived stem cells; Photoaging
[文章编号]1000- 4718(2016)05- 0892- 08
[收稿日期]2015- 11- 30[修回日期] 2016- 02- 15
*[基金项目]国家重点基础研究发展规划资助项目(No.2005CB522603);国家自然科学基金资助项目(No.81272100; No.81372065);广州市科技计划(No.201300000091; No.2015080225);2014年广州市花都区科技计划(No.HD14CXY001);暨南大学青年基金资助项目(No.21614310)
通讯作者△Tel: 020-38688163; E-mail: liuhongwei0521@hotmail.com
[中图分类号]R758.1; R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.021
杂志网址: http://www.cjpp.net
