葛根素预处理上调内皮型一氧化氮合酶的表达减轻人脐静脉内皮细胞缺氧/复氧损伤*
2016-06-06陆德琴
黄 华, 丁 菁, 粟 凤, 张 倩, 陆德琴
(贵州医科大学病理生理教研室,贵州 贵阳 550025)
葛根素预处理上调内皮型一氧化氮合酶的表达减轻人脐静脉内皮细胞缺氧/复氧损伤*
黄华,丁菁,粟凤,张倩,陆德琴△
(贵州医科大学病理生理教研室,贵州 贵阳 550025)
[摘要]目的: 探讨葛根素(puerarin,PUE)预处理对缺氧/复氧(hypoxia reoxygenation,H/R)损伤的人脐静脉内皮细胞(HUVECs)的保护作用。方法: HUVECs随机分为正常对照(control)组、H/R组、单纯PUE组和PUE+H/R组(1.0×10-3mol/L PUE预处理24 h后进行H/R)。采用Western blot方法检测内皮型一氧化氮合酶(eNOS)蛋白的表达,化学比色法检测组成型一氧化氮合酶(cNOS)的活性,TUNEL法检测细胞凋亡。此外,在PUE预处理前使用ERK蛋白激酶抑制剂U0126(1.0×10-5mol/L)或PI3K/Akt蛋白激酶抑制剂LY294002(5.0×10-5mol/L)处理细胞1 h,再进行H/R。结果: 与control组相比,H/R组的eNOS蛋白表达水平降低(P<0.05),PUE预处理上调eNOS蛋白的表达水平(P<0.05),该上调作用均可被U0126及LY294002抑制(P<0.05);与control组相比,H/R组的cNOS活力下降(P<0.05),PUE预处理组的cNOS活力增加(P<0.05);与control组相比,H/R组细胞凋亡指数显著增大(P<0.01),PUE预处理组的细胞凋亡指数减小(P<0.01)。结论: H/R可使HUVECs受损伤,eNOS蛋白表达及活性降低,细胞凋亡增加。PUE预处理可通过ERK1/2信号通路和PI3K/Akt信号通路上调HUVECs的eNOS蛋白表达,增强eNOS活性,减少细胞凋亡,发挥内皮细胞保护作用。
[关键词]葛根素; 人脐静脉内皮细胞; 缺氧/复氧; 内皮型一氧化氮合酶
缺血-再灌注损伤(ischemia-reperfusion injury,IRI)广泛存在于严重创伤与缺血性疾病治疗后。研究发现血管内皮细胞的功能障碍和结构损伤是IRI早期的病理改变和始动因素,在IRI发生、发展的过程中起着重要的作用。生理情况下血管内皮细胞分泌的一氧化氮(nitric oxide,NO)在调节血管舒缩、凝血和纤溶,以及防止氧自由基损伤等方面起着重要作用。一氧化氮合酶(nitric oxide synthase,NOS)是生成NO的关键限速酶,血管系统中的NO主要来源于内皮型NOS(endothelial NOS,eNOS)。已公认eNOS/NO功能受损是内皮细胞功能障碍的一个重要表现,因此eNOS/NO常作为反映血管内皮细胞功能的重要指标之一[1]。研究发现葛根素(puerarin,PUE)具有扩张冠状动脉、抗缺血再灌注损伤、改善血液流变学等心血管保护等作用[2]。然而目前有关PUE对内皮细胞IRI时eNOS功能的影响报道较少。本研究使用人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs),建立体外培养细胞H/R损伤模型模拟细胞IRI,探讨PUE预处理减轻内皮细胞H/R损伤的保护机制。
材料和方法
1实验试剂及仪器
HUVECs由贵州医科大学曾柱教授惠赠;胎牛血清(fetal bovine serum,FBS)、无酚红高糖DMEM培养基(Gibco);低糖DMEM培养基、高糖DMEM培养基、0.25%胰蛋白酶、青-链霉素(HyClone);葛根素注射液(成都天台山制药有限公司);NOS活性(分型)测定试剂盒(南京建成生物工程研究所);PVDF蛋白杂交膜(Millipore);ECL增强化学发光试剂盒、BCA蛋白定量试剂盒(Thermo);TUNEL凋亡检测试剂盒(武汉博士德生物公司);细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)抑制剂U0126、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B, PI3K/Akt)抑制剂LY294002(Sigma);兔抗鼠eNOS抗体、兔抗鼠β-tubulin抗体及辣根过氧化酶标记的山羊抗兔 Ⅱ 抗(Santa Cruz);兔抗人 Ⅷ 因子相关抗原抗体、兔抗人CD34抗体(北京博奥森生物公司);SABC法检测试剂盒(北京中杉金桥公司);BX41显微镜(OLYMPUS)。
2主要方法
2.1HUVECs细胞的培养HUVECs接种于25 cm2培养瓶中,用含10% FBS的高糖DMEM培养基于37 ℃、5% CO2的培养箱中培养,每48 h换液 1 次,当细胞生长接近于80%~90%时,用0.25%的胰蛋白酶消化细胞,传代。实验用传10代以内的细胞。
2.2细胞鉴定细胞爬片后,放入 6 孔板中培养。待细胞生长至50%时,用无血清培养基静止12h后,PBS洗涤3次,经4%多聚甲醛固定后,用兔抗人Ⅷ因子相关抗原抗体和兔抗人CD34抗体作为Ⅰ抗,按1∶100比例稀释,SABC法进行免疫细胞化学染色。PBS孵育作为阴性对照。镜下胞质内出现棕黄色颗粒者为阳性细胞。200倍显微镜下随机取5个视野,计算阳性细胞率(%)=阳性细胞数/细胞总数×100%。
2.3缺氧/复氧(hypoxia/reoxygenation,H/R)损伤细胞模型制备参照文献[3],将含体积分数为99.99%的高纯氮气经过滤后通入无FBS的低糖DMEM培养基内,调节气体流速为6~8 L/min,通气2 min,后将上述低糖培养基加入培养瓶内,再向培养瓶内充氮气,流速为6~8 L/min,时间5 min。旋紧培养瓶瓶盖,封口胶密封瓶口,放入37 ℃孵箱中分别缺氧培养2 h(H2)、4 h(H4)和8 h(H8)。缺氧培养结束后,所有细胞更换含10% FBS的高糖DMEM培养基后,继续在常氧条件下(37℃、5% CO2)复氧培养4 h(R4)。
2.4实验分组待HUVECs生长融合达70%~80%左右时,使用无FBS的高糖DMEM培养基静止12 h。(1)缺氧/复氧和PUE预处理实验:HUVECs随机分为control组、H2/R4组、H4/R4组和H8/R4组,在预处理实验中,根据文献[4-5]报道的具有明显内皮细胞保护作用的PUE剂量,control组和H/R各组均预先用终浓度1.0×10-3mol/L的PUE预处理24 h。(2)特异性蛋白激酶抑制剂实验:取H4/R4组进行实验,抑制剂组在PUE预处理前先使用ERK1/2抑制剂U0126(终浓度1.0×10-5mol/L)或PI3K/Akt抑制剂LY294002(终浓度5.0×10-5mol/L)预处理1 h,并分别设立抑制剂单纯用药和溶媒对照。细胞随机分为control组、H4/R4组、PUE组、PUE+H4/R4组、U0126+PUE+H4/R4、U0126+PUE组、U0126组、LY294002+PUE+H4/R4组、LY294002+PUE组、LY294002组和溶媒对照DMSO组。
2.5Western blot检测蛋白水平分别收集各组细胞,加入蛋白裂解液,4 ℃裂解,离心后取上清,BCA法测定蛋白浓度,余蛋白变性后用SDS-PAGE分离,转移至PVDF膜上,5%脱脂牛奶常温封闭1 h,TBST洗膜10 min×3次,按相应 Ⅰ 抗比例稀释(eNOS 1∶750,β-tubulin 1∶4 000),4℃孵育过夜。次日TBST洗膜后,加入 Ⅱ 抗(1∶5 000),常温孵育1 h,TBST洗膜,ECL显影曝光。凝胶成像系统采集图片并分析灰度值,以β-tubulin为内参照,结果以目的条带和β-tubulin条带积分吸光度比值表示,以正常对照组积分吸光度值为100%。以上结果至少重复3 批独立实验,每批重复检测3次。
2.6化学比色法检测HUVECs 组成型NOS(constitutive NOS, cNOS)活性各组在实验观察时点结束时,按试剂盒说明书操作收集、处理细胞、检测cNOS活性,即使用0.25%胰蛋白酶消化细胞,含10% FBS的高糖DMEM培养基终止消化,重悬,1 000 r/min离心5 min,得到细胞沉淀。加入PBS洗涤细胞,1 000 r/min离心6 min,弃上清,重复洗涤2次。在细胞沉淀中加入300 μL的PBS,混匀,超声粉碎细胞,取上清进行蛋白浓度测定和cNOS检测。所有检测均复3孔。
2.7TUNEL法检测细胞凋亡细胞爬片后,放入25 cm2玻璃培养瓶中培养。细胞生长至40%~50%,用无血清培养基静止12 h,PUE预处理及H/R培养方法如前所述。实验结束时取出玻片,按照TUNEL试剂盒(POD法)说明书的操作步骤进行细胞凋亡的检测。经DAB显色和苏木素复染、脱水封片后,显微镜下观察染色情况。镜下细胞核出现棕黄色颗粒判定为阳性细胞。显微镜下(×200)随机取5个视野,计算细胞凋亡指数%=阳性细胞数/细胞总数×100%。
3统计学处理
采用SPSS 17.0统计软件进行分析,计量资料数据以均数±标准差(mean±SD)表示。多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),方差齐性者两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
结果
1细胞鉴定结果
免疫组织化学染色结果显示,在培养的HUVECs细胞质内出现大量棕黄色颗粒,Ⅷ因子相关抗原和CD34表达阳性,阴性对照未见胞质内出现棕黄色颗粒,见图1。计算阳性细胞率为100%。
2PUE预处理上调eNOS蛋白表达
如图2所示,缺氧2 h、4 h和8 h后复氧4 h(H2/R4、H4/R4和H8/R4),随着缺氧时间的延长,各组细胞eNOS蛋白表达水平与control组相比逐渐降低(P<0.05);单纯PUE预处理组eNOS蛋白表达水平明显增高(P<0.05),PUE+H/R各组eNOS蛋白表达水平均高于同时点H/R组(P<0.05)。

Figure 1.The expression of factor VIII-related antigen and CD34 in HUVECs (SABC,×200). A: negative control; B: the positive expression of factor VIII-related antigen; C: negative control; D: the positive expression of CD34.
图1Ⅷ因子相关抗原和CD34在HUVECs细胞中的表达

Figure 2.The protein expression of eNOS in the HUVECs treated with H/R and/or PUE. Mean±SD. n=9.▲P<0.05 vs control group;#P<0.05 vs H2/R4 group;△P<0.05 vs H4/R4 group;*P<0.05 vs H8/R4 group;☆P<0.05 vs PUE group.
图2H/R与PUE预处理各组eNOS蛋白表达
3PUE预处理增加cNOS活性
如图3所示,与control组相比较,随着缺氧时间延长,H/R各组细胞cNOS活性逐渐降低(P<0.05),与同时点H/R组比较,应用PUE预处理后各组cNOS活性明显增加(P<0.05)。

Figure 3.The changes of cNOS activity in each group. Mean±SD. n=3.▲P<0.05 vs control group;#P<0.05 vs H2/R4 group;△P<0.05 vs H4/R4 group;*P<0.05 vs H8/R4 group;☆P<0.05 vs PUE group.
图3各组cNOS活性的变化
4PUE预处理减少HUVECs细胞凋亡
Control组及PUE组细胞生长良好,仅偶见细胞凋亡发生。H4/R4组细胞凋亡指数明显高于control组(P<0.01);经PUE预处理后,细胞凋亡指数明显降低 (P<0.01),见图4、5。

Figure 4.The apoptosis of HUVECs (TUNEL, ×200). A: negative control group; B: control group; C: H4/R4 group; D: PUE group; E: PUE+H4/R4 group.
图4HUVECs细胞凋亡情况5UO126及LY294002抑制PUE预处理上调的eNOS蛋白表达
如图6所示,与control组相比,H4/R4组eNOS蛋白表达水平降低(P<0.05),单纯PUE预处理组和PUE+H4/R4组eNOS蛋白表达水平显著增加(P<0.05);与H4/R4组相比,PUE组和PUE+H4/R4组eNOS蛋白表达水平明显增加(P<0.05);与单纯PUE预处理组比较,U0126+PUE+H4/R4组、U0126+PUE组、LY294002+PUE+H4/R4组和LY294002+PUE组eNOS蛋白表达水平降低(P<0.05);与PUE+H4/R4组比较,U0126+PUE+H4/R4组、U0126+PUE组、LY294002+PUE+H4/R4组和LY294002+PUE组eNOS蛋白表达水平降低(P<0.05);与control组相比,U0126组、LY294002组和DMSO组eNOS蛋白表达水平的差异无统计学显著性。
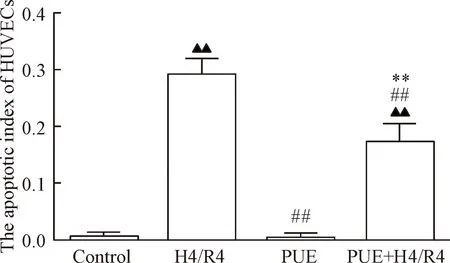
Figure 5.The apoptotic index of HUVECs in each group. Mean±SD. n=5.▲▲P<0.01 vs control group;##P<0.01 vs H4/R4 group;**P<0.01 vs PUE group.
图5各组HUVECs细胞凋亡指数
讨论
当IRI发生时,血管内皮细胞的功能异常发生时间早于实质细胞的损伤,且内皮细胞受损可引起血栓和粥样斑块形成、血管痉挛,进一步使实质细胞的损伤加剧,因此有效保护血管内皮细胞是预防和治疗IRI损伤的关键。本实验使用的HUVECs经鉴定为高纯度内皮细胞,因此可用于模拟血管内皮在H/R损伤时结构和功能的改变。

Figure 6.U0126 and LY294002 inhibited the protein expression of eNOS up-regulated by PUE pretreatment. Mean±SD. n=9.▲P<0.05 vs control group;△P<0.05 vs H4/R4 group;#P<0.05 vs PUE group;*P<0.05 vs PUE+H4/R4 group.
图6U0126及LY294002抑制PUE预处理上调的eNOS蛋白表达

PUE是从豆科植物葛根提取的一种异黄酮成分,是葛根的主要活性成分。近些年研究表明PUE可上调大鼠心肌缺血模型心肌细胞eNOS 蛋白的表达和增加NO的产生[8-9]。本研究采用文献[4-5]报道的具有明显内皮细胞保护作用的PUE剂量1.0×10-3mol/L对HUVECs进行预处理,结果显示,与同时点的H/R组比较,PUE预处理各组使eNOS蛋白表达明显增加,cNOS活性明显增强。
那么PUE是通过哪些细胞内信号转导通路来上调eNOS蛋白表达及其活性呢?研究发现细胞内多条信号通路如蛋白激酶A[10]、PI3K/Akt[11]、ERK1/2[12]等均可以使eNOS蛋白表达增加,而PUE可以通过激活蛋白激酶ERK1/2[13]、PI3K/Akt[14]等信号通路发挥生物学作用。因此本研究在PUE预处理的基础上分别加用了ERK1/2特异性抑制剂U0126和PI3K/Akt特异性抑制剂LY294002,以观察在H/R过程中PUE是否通过这2条信号通路发挥内皮细胞保护作用。结果发现,无论在正常培养条件下还是H/R培养条件下,PUE上调eNOS蛋白表达的作用均被抑制。提示PUE上调内皮细胞eNOS 蛋白表达可由ERK1/2信号通路及PI3K/Akt信号通路介导。
本实验发现HUVECs细胞在H/R后细胞凋亡指数较control组明显增高。这主要是由于在H/R过程中,细胞膜脂质过氧化反应增强,使细胞内大量氧自由基生成,且细胞抗氧化酶的活性降低,致使内皮细胞发生凋亡[15]。而研究发现PUE可以通过清除氧自由基、增加抗氧化酶活性从而发挥抗氧化保护作用[16]。本研究观察到,与H/R组比较,PUE预处理后细胞凋亡指数显著降低。
综上所述,H/R后内皮细胞eNOS蛋白表达明显下降及活性显著减弱、细胞发生凋亡,PUE预处理可通过激活ERK1/2和PI3K/Akt信号通路,使eNOS的蛋白表达上调及活性增强,减少细胞凋亡,从而发挥内皮保护作用。
[参考文献]
[1]杨春华,林水金,杨映波,等. NO在血管内皮细胞损伤中的标志作用[J]. 中华急诊医学杂志, 1999, 8(3):160-161.
[2]韩春妍. 葛根素治疗相关疾病的研究[J]. 实用药物与临床, 2012, 3(3):178-180.
[3]宋振举,杨光田,陆德琴,等. 缺氧与复氧对脑动脉内皮细胞一氧化氮合酶Ⅲ表达的影响[J]. 中国危重病急救医学, 2003, 15(9):535-537.
[4]王春玲, 傅攀峰, 李宏伟,等. 葛根素对血管内皮细胞DNA损伤的保护作用[J]. 中国微循环, 2004, 8(6):361-364.
[5]刘青. 葛根素调节支架内狭窄炎症反应的机制研究[D]. 北京中医药大学, 2007.
[6]Chen C, Jiang J, Lü JM, et al. Resistin decreases expression of endothelial nitric oxide synthase through oxidative stress in human coronary artery endothelial cells[J]. Am J Physiol Heart Circ Physiol, 2010, 299(1):H193-H201.
[7]张倩,丁菁,陆德琴,等. 依普利酮对高盐诱导的高血压大鼠主动脉内皮型一氧化氮合酶表达及活性的影响[J]. 中国病理生理杂志, 2015, 31(9):1606-1610.
[8]温葭,陈士林,Filly Cheung,等. 葛根素对心肌细胞一氧化氮影响的研究[J]. 中国心血管病研究杂志, 2006, 4(10):777-779.
[9]Zhang SY, Chen G, Wei PF, et al. The effect of puerarin on serum nitric oxide concentration and myocardial eNOS expression in rats with myocardial infarction[J]. J Asian Nat Prod Res, 2008, 10(3-4):323-328.
[10]Si H, Yu J, Jiang H, et al. Phytoestrogen genistein up-regulates endothelial nitric oxide synthase expression via activation of cAMP-responsive element-binding protein in human aortic endothelial cells[J]. Endocrinology, 2012, 26(7):3190-3198.
[11]Sun N, Wang H, Wang L. Vaspin alleviates dysfunction of endothelial progenitor cells induced by high glucose via PI3K/Akt/eNOS pathway[J]. Int J Clin Exp Pathol, 2015, 8(1):482-489.
[12]Mata-Greenwood E, Liao WX, Zheng J, et al. Differential activation of multiple signalling pathways dictates eNOS upregulation by FGF2 but not VEGF in placental artery endothelial cells[J]. Placenta, 2008, 29(8):708-717.
[13]唐哲明, 梁国荣. 葛根素通过ERK1/2信号通路促进内皮细胞增殖[J]. 四川生理科学杂志, 2012, 34(2):55-57.
[14]马亚飞,刘新伟,乔欣,等. 葛根素通过PI3K/Akt途径对大鼠缺血再灌注心肌细胞凋亡的抑制[J]. 中国老年学杂志, 2010, 30(8):1077-1079.
[15]徐慧,文薏,谭虹. 卡托普利晚期预处理对人内皮细胞缺氧复氧损伤保护作用机制的研究[J]. 中国心血管病研究, 2013, 11(4):296-299.
[16]高培国,强辉,凌鸣. 葛根素对过氧化氢诱导的血管内皮细胞损伤的保护作用[J]. 西安交通大学学报:医学版, 2012, 33(2):245-248.
(责任编辑: 陈妙玲, 罗森)
Puerarin pretreatment protects human umbilical vein endothelial cells against hypoxia/reoxygenation injury via increasing protein expression of endothelial nitric oxide synthase
HUANG Hua, DING Jing, SU Feng, ZHANG Qian, LU De-qin
(Department of Pathophysiology, Guizhou Medical University, Guiyang 550025, China. E-mail: dqlu91@hotmail.com)
[ABSTRACT]AIM: To investigate the protective effects of puerarin (PUE) pretreatment on hypoxia/reoxygenation (H/R) injury in human umbilical vein endothelial cells (HUVECs), as well as its possible mechanism and the signal transduction pathways involved. METHODS: HUVECs were randomly divided into normal control group, H/R group, PUE pretreatment group and PUE+H/R group (1.0×10-3mol/L, PUE pretreated the cells for 24 h before H/R). The protein expression of endothelial nitric oxide synthase (eNOS) was measured by Western blot. The activity of constitutive NOS (cNOS) was determined via chemical colorimetric methods. Apoptosis of HUVECs was detected by TUNEL assay. In addition, the cells were treated with ERK inhibitor U0126 (1.0×10-5mol/L) or PKB/Akt inhibitor LY294002 (5.0×10-5mol/L) for 1 h before PUE pretreatment, and then H/R was performed.RESULTS: Compared with control group, H/R decreased the protein expression of eNOS (P<0.05), and PUE pretreatment up-regulated it (P<0.05). This effect of PUE was inhibited by U0126 or LY294002 (P<0.05). Compared with control group, the activity of cNOS decreased in H/R group (P<0.05), while it increased after PUE pretreatment (P<0.05). Compared with control group, the apoptotic index significantly increased in H/R group (P<0.01). PUE pretreatment reduced the apoptotic index (P<0.01). CONCLUSION: H/R decreases the protein expression and enzyme activity of eNOS in HUVECs, and induces apoptosis of HUVECs. PUE pretreatment up-regulates the protein expression and enzyme activity of eNOS, and reduces the apoptosis of HUVECs with H/R injury. The protective effect of PUE might be through increasing eNOS protein expression via ERK1/2 and PKB/Akt signaling pathways.
[KEY WORDS]Puerarin; Human umbilical vein endothelial cells; Hypoxia/reoxygenation; Endothelial nitric oxi-de synthase
[文章编号]1000- 4718(2016)05- 0857- 06
[收稿日期]2015- 11- 20[修回日期] 2016- 01- 28
*[基金项目]国家自然科学基金资助项目(No.31460267);贵州省社会发展攻关项目 [黔科合 SY 字(2013)3019号]
通讯作者△Tel: 0851-88416116; E-mail: dqlu91@hotmail.com
[中图分类号]R363
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.05.015
杂志网址: http://www.cjpp.net
